Способ получения этилового эфира 6,7-дифтор-1,4-дигидро-4- оксо-3-хинолинкарбоновой кислоты
Иллюстрации
Показать всеРеферат
СОЮЗ СОВЕТСКИХ социАлистических
РЕСПУБЛИК (st)s С 07 D 215/233
ГОСУДАРСТВЕННЫЙ КОМИТЕТ
ПО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМ
ПРИ ГКНТ СССР
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ (21) 4925266/04 (22) 11.03.91 (46) 07.01.93. Бюл. ¹ 1 (71) Институт химии. Башкирского научного центра Уральского отделения AH СССР, Институт органической химии им, Н,Д,Зелинского и Уральский политехнический институт им, С.М,Кирова (72) У,М.Джемилев, Г.А.Толстиков, О,M.Нефедов, O,Н,Чупахин, В.Н.Чарушин, С.М.Навашин, B,А.Докичев, С.З.Султанов, В.А,Груздев и B,Н.Зверев (56) 1. Европейский патент ¹ 0000203, кл, С 07 D 215/233, 1980.
2. Европейский патент ¹ 230053, кл, С
07 D 215/233, 1981.
Изобретение относится к органической химии, конкретно к способу получения этиловогЬ эфира 6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбсновой кислоты, который находит широкое применение в качестве полупродукта в синтезе клинически важных и высокоэффективных антибактериальных препаратов — производных фторированных хинолинов (норфлоксацина, перфлоксацина, ципрофлоксацина, дифлоксацина и других). По уровню активности и спектру антибактериального действия производные этого класса антибиотиков превосходят широко применяемые в настоящее время химиотерапевтические средства, в том числе существующие пероральные антибиотики и цефалоспорины третьего поколения, Известен способ получения этилового эфира 6,7-дифтор-1.4-дигидро-4-оксо-3-хи„„БЦ ÄÄ 1786028 А1 (54) СПОСОБ ПОЛУЧЕНИЯ ЭТИЛОВОГО
ЭФИРА 6,7-ДИФТОР-1,4-ДИГИДРО-4-ОКСО-3-ХИНОЛИНКАРБОНОВОЙ КИСЛОТЫ (57) Использование: в качестве полупродукта в синтезе антибактериальных препаратов. Сущность изобретения: продукт— этиловый эфир 6,7-дифтор-1,4-дигидро-4оксо-3-хинолинкарбоновой кислоты. БФ
С12Н9ГчРгОз, т.пл. 305 — 306 С. Реагент. диэтиловый эфир 3,4-дифторанилинометиленмалоновой кислоты, Внутримолекулярная циклизация, тем-ра 210 — 254 С, в среде парафинов. Выход 98%, 1 табл. нолинкарбоновой кислоты, осуществляемый путем внутримолекулярной циклизации диэтилового эфира
3,4-дифторанилинометиленмалоновой кислоты в растворе даутерма А при 240-250 С
0 Ъ в течение 1 ч (11. О"
Недостатками этого способа являются: . ()
Плохая воспроизводимость метода син- ) теза целевого продукта, связанная с тем, что Q() при высоких температурах (240-250 С) диэтиловый эфир 3,4-дифторанилинометиленмалоновой кислоты взаимодействует в ходе реакции с дифенилом или дифениловым эфиром, которые являются составляющими компонентами даутерма А, давая соответствующие продукты конденсации.
Образующиеся побочные продукты сильно затрудняют выделение целевого продукта, снижают его чистоту, что вызыва1786028 р © СО С Н5 м
СОуС Нь
О
ZiO- Þ4
ПАРАФИНЫ
H - 98 la
ОО) с01с н5
СО С Н5
55 ет необходимость дополнительной очистки этилового эфира 6,7-дифтор-1,4-дигидро-4оксо-3-хинолинкарбоновой кислоты путем перекристаллизации из диметилформамида. 5
Относительно низкий выход целевого продукта. Во всех опытах не удалось воспроизвести выходы целевого продукта.
Необходимость предварительной ректификации даутерма А, так как при хране- 10 нии в нем образуются побочные вещества, наличие которых приводит к снижению выхода целевого продукта.
Достаточно высокйе токсичность и канцерогенность даутерма А по сравнению с 15 насыщенными углеводородами — парафинами.
Известен, принятый за прототип, способ получения этилового эфира 6,7-дифтор1,4-дигидро-4-оксо-З-хинолинкарбоновой 20 кислоты в результате внутримолекулярной циклизации диэтилового эфира 3,4-дифторанилинометиленмалоновой кислоты при
250 С в среде дифенилового эфира в течение 50 мин (2j: 25
О
В У " 3o днфениАОВыиг
Зфир l
Н 25 /о.Выход целевого продукта составляет
25% в расчете на исходный 3,4-дифторанилин, Диэтиловый эфир 3,4-дифторанилинометиленмалоновой кислоты получают взаимодействием 3,4-дифторанилина с этохсиметиленмалонатом и применяют в дальйейшем без дополнительной очистки.
К недостаткам этого процесса относятся:
Низкий выход целевого продукта (Я%)
Плохая воспроизводимость известного метода синтеза, так.как в условиях конденсации диэтйловый эфир 3,4-дифторанилинометиленмалоновой кислоты образует побочные арилкетоны: O CQCgHg+ (0 0-QO — э ® СО С Н
1Ч
„СО,С,Н, со
$avs
Указанные примеси затрудняют выделение целевого продукта, что требует проведения дополнительной очистки последнего путем перекристаллизации из диметилформамида.
Необходимость предварительной очистки дифенилового эфира, так как образующиеся в нем при хранении примеси способствуют снижению выхода этилового эфира 6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты.
Относительно высокие токсичность и канцерогенность дифенилового эфира по сравнению с насыщенными углеводородами — парафинами.
Цель изобретения — повышение выхода целевого продукта, его чистоты, а также создание более экологически безопасного и технологического процесса синтеза этилового эфира 6,7-дифтор-1,4-дигидро-4-оксо3-хинолинкарбоновой кислоты.
Цель достигается предлагаемым способом синтеза этилового эфира 6,7-дифтор1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты, заключающимся в том, что получение целевого продукта осуществляют путем внутримолекулярной циклизации диэтилового эфира 3,4-дифторанилинометиленмалоновой кислоты в растворе насыщенных алканов (c12 — c18) при концентрации исходных мономеров 0,167 — 1,1 моль/л и температуре реакции 210 — 254 С. Выход целевого продукта достигает примерно 98%, Отличительной особенностью изобретения является применение насыщенных алканов в качестве растворителя и проведение процесса при концентрации исходного субстрата 0,167 — 1,1 моль/л. Этот факт не является очевидным, так как заранее трудно предположить образование целевого продукта по предложенной схеме в одну стадию, В данном случае нельзя было исключить возможность протекания процесса электрофильного замещения в ароматическом кольце анилина с участием молекулы насыщенного углеводорода, что характерно для производных бензола.
Считалось, что дифениловый эфир — наиболее оптимальная среда для синтеза хи1786028 нолонов по данной схеме и это не вызывало никаких сомнений.
Наилучшие результаты по синтезу этилового эфира 6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты получены 5 при температуре 210-254 С и концентрациях диэтилового эфира 3,4-дифторанилинометиленмалоновой кислоты .0,167 вЂ,1 моль/л, При граничных значениях концентрации исходных мономеров и температуры 10 выход целевого продукта значительно снижается (примеры 11 — 13, 25), К достоинствам предлагаемого метода относятся:
Высокий выход целевого продукта 15 (98/).
Возможность неоднократного применения растворителя без его дополнительной очистки.
Высокая чистота этилового эфира 6,7- 20 дифтор-1,4-дигидро-4-окси-3-хинолинкарбоновой кислоты, позволяющая использовать его в дальнейших превращениях без дополнительной очистки путем перекристаллизации. 25
Насыщенные углеводороды являются малотоксичными, доступными и стабильными соединениями, промышленное производство которых нала>кено в нашей стране, . Насыщенные углеводороды обладают 30 низкой токсичностью по сравнению с дифенилом или дифенилоксидом, исполь,"ующимися в качестве растворителей.
Применение парафинов в качестве растворителей позволило полностью исклю- 35 чить образование побочных продуктов в ходе конденсации.
Насыщенные углеводороды (Cn-С18) или их смеси имеют низкую температуру плавления, в обычных условиях — жидкости 40 и поэтому технологичны в работе.
Применение парафинов различной структуры в качестве растворителей облегчает соблюдение температурного режима процесса. 45
Способ поясняется следующими примерами, Пример .1. В круглодонную колбу, снабженную воздушным холодильником, загружают 5 г (16,7 ммол ь) диэтилового эфи- 50 ра 4,4-дифторанилинометиленмалоновой кислоты и 45 мл додекана.
Реакционную массу нагревают до кипения (216 С) и выдерживают при данной температуре в течение 40 мин, Колбу охлаждают до комнатной температуры, выпавшие кристаллы этилового эфира 6,7-дифтор-1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты отфильтровывают и промывают несколько раз хлористым метиленом или хлороформом, Выделяют 4,06 г этилового эфира 6,7дифтор-1,4-ди гидро-4-оксо-3-хинолинкарбоновой кислоты, Выход - 96/, т,пл. 305—
306 С.,ИК-спектр (v, см ): 820, 1100, 1195, 1300, 1395, 1505, 1625, 1695, 2800 — 3030.
3045 — 3300. Спектр ПМР (д, м.д,); 1,52 т (ЗН, СНз, J = 7 Гц); 2,15 с (1Н, N-Н); 4,64 кв (2Н, СН2, J = 7 Гц); 8,03 — 8,60 м (2Н, CH); 9,47 с (1Н, =CH), Найдено, 7: С 57,20, 56,97; Н 3,47, 3,45;
N 5,39, 5,38.
С12Н9К Н20з
Вычислено, /,: С 56,92; Н 3,58; N 5,53.
Пример ы 2-25 приведены в таблице.
Индивидуальность и чистоту целевого продукта контролировали методом газохро-, матографического анализа, определением температуры плавления и сравнением с заведомо полученным препаратом по известной методике.
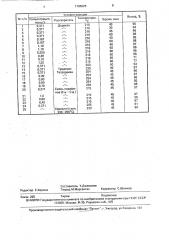
В таблице приведены результаты изучения влияния концентрации исходных мономеров, температуры и продолжительности реакции на выход этилового эфира 6,7-дифто р-1,4-ди гидро-4-оксо-3-хинолинка рбоновой кислоты.
Формула изобретения
Способ получения этилового эфира 6,7дифтор-1,4-дигидро-4-оксо-3-хиналинкарбоновой кислоты путем внутримолекулярной циклизации диэтилового эфира 3,4-дифторанилинометиленмалоновой кислоты в среде растворителя при повышенной температуре, отличающийся тем, что, с целью повышения выхода целевого продукта и улучшения технологии процесса, последний ведут в среде насыщенных алканов
С 2-С э или их смесей при температуре 210254 С и концентрации диэтилового эфира
3,4-дифторанилинометиленмалоновой кислоты 0,167 — 1,1 моль/л.
1786028
Условия еак ии
Выход, М пlп
Температура, OC
Концентрация, Растворитель моль/л
Время, мин
Додекан
Тридекан
Тетрадекан
II
Смесь парафинов (С14 — С18 ) 215
230
97
96
97
61
1,0
0,80
0,40
0,371,21
22
23
24
45 I °
° 1
Керосин (т.кип.
230-250 С
Составитель У.Джемилев
Техред M. Моргентал Корректор С. Ш ек ма р
Редактор Е.Хорина
Заказ 225 Тираж Подписное
ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР
113035, Москва, Ж-35, Раушская наб., 4/5
Производственно-издательский комбинат "Патент", r. Ужгород, ул.Гагарина, 101
3
5
8
11
12
13
14
16
17
18
19
0,371
0,371
0,371
0,371
0,167
0,167
1,10
1,10
0,300
0,40
0,10
1,20
0,371
0,371
0,371
0,40
0,80
0,90
0,70
0,371
216
216
216
216
216
216
216
216
216
216
216
254
254
254
254
254
215
96
94
96
96
98
97
98
96
71
77
53
97
96
97
96
98