Способ получения замещенных производных индола, бензофурана или бензотиофена
Иллюстрации
Показать всеРеферат
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
ГОСУДАРСТВЕННЫЙ КОМИТЕТ
ПО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМ
ПРИ ГКНТ СССР
ОПИСАНИЕ ИЗОБРЕТЕНИ
К ПАТЕНТУ
ы5 оя
)Г- R
Х мулы
1 (21) 4742832/04 (22) 29,12;89 (31) 293522 (32) 05.01,89 (33) US (46) 28.02.93, Бюл. N 8 (71) E.È.Äþïoí де Немур энд Компани (US) (72) Даглес Гай Бэтт (US) (56) Патент США N 4737519, кл. С 07 C 69/94, 1988. (54) СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ
ПРОИЗВОДНЫХ ИНДОЛА, БЕНЗОФУРАНА ЙЛИ БЕНЗОТИОФЕНА
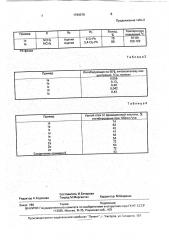
: (57) Использование: в качестве веществ, обладающих активностью ингибировать 5-липоксигеназу. Сущность изобретения: продукт: замещенные производных индола, бензофурана или бензотиазола общей форИзобретение относится к получению замещенных производных индола, бензофурана или бензотиофена общей формулы оц, ) ъ, X где Х вЂ” кислород или сера;
Йг Водород;
Вз — фен ил, или Х вЂ” NR<, где В) — C>-C4-алкил или бензил;
Вг — водород или группа С(=О)К4, где R4 — C> — С4-ал к ил, йз — З-пиридил, 3,4-метилендиоксифенил, 2-тиенил, или фенил, незамещенный
5U 1799379 АЗ (s))s С 07 О 209/30, 307/08, 333/56 где Х вЂ” кислород или сера; Ег —; йз — фенил; или X — группа NR), где В) — C) — С4алкил или бензил; Йг —:водород или группа
С (=0) R4,.ãäå R4 — C> — С4-алкил; йз — 3-пиридил, 3,4-метилендиоксифенил, 2-тиенил, или фенил, незамещенный или замещенный
С>-С4-алкилом, С>-С4-.àëêîêñèãðóïïoé, моно- или дигалоидом или ди (низший) алкиламиногруппой. Реагент 1; соединение общей формулы где Х вЂ” кислород, сера или группа NR<, где
R1 имеет указанйые значения. Реагент г: альдегид общей формульг ЯЗСНО, где Яз имеет указанные значения, Условия реакции в присутствии основания с последующим подкислением протонной кислотой. 4 табл,. Д или замещенный С1 —.C4-алкилом, С)-С4-ал 0 коксигруппой, моно- или ди-С1 — С4-алкиламиногруп пой, обладающих активностью ингибировать 5липоксигеназу.
О
Целью изобретения является разработка, на основе известных методов, способа получения новых соединений индольного, ( бензофуранового или бензотиофенового ряда, обладающих ценным фармакологическим свойством.
Изобретение иллюстрируется следующими примерами..
Пример 1, 1-метил-4-гидрокси-6-фени1метилиндол (Х = МСНз, Вг = Н. Вз = фенил) 1799379
10 нюю поверхность ушной раковины мыши, 15 Испытуемое вещество растворяют в ацетоне и наносят на ушную раковину непосред20
В табл.4 указаны активности отдельных
25 веществ этого изобретения при испытании в отеке уха от арахидоновой кислоты.
Формула изобретения
Способ получения замещенных производных индола, бензофурана или бензотио30 фена общей формулы 2
R, X
35 где Х вЂ” кислород или сера;
Я2 водород;
Яз — фенил, или Х вЂ” группа MR>, где Я1 — C>-C4-алкил или бензил;
40 Rz — водород или группа C(=0)R4, где R4 — С1-С4-алкил;.
R3 — З-пйридил., 3,4-метилендиокСифенил, 2-тиенил или .фенил, не замещенный или замещенный С1 — C4-алкилом, C> — С4-ал45 коксигруппой, моно- или ди-С вЂ” С4-алкиламиногруппой, отличающийся тем, что.соединение общей формулы О
10
Раствор 1-метил-4-оксо-4,5,6,7-тетрагидроиндола (9,8 r, 0,066 моль) и бензальдегида (7,0 г, 0,066 моль) в трет-бутаноле (250 мл) обрабатывают трет-бутилатом калия (14,7 г, 0,13 моль) и нагревают до кипения с 5 обратным холодильником. Спустя 18 ч, смесь охлаждают до. комнатной температуры и подкисляют 1-нормальной соляной кислотой. Наибольшую часть трет-бутанола удаляют при пониженнрм давлении, и остаток экстрагируют дихлорметаном, Органическую фазу сушат над сульфатом магния, фиЛьтруЮт и концентрируют при пониженном давлении, Маслянистый остаток подвергают флэш-хроматографии с 20% этилацетатом в гексане, чтобы получить твердое светло-желтое вещество (9,3 г, 59%). Этот продукт перекристаллизовали из . смеси гексан/1-хлорбутан, чтобы получить белые иглы с т.пл. 75-77 С, Аналогично получены соединения, указанные в табл,1, Пример 2. 1-метил-4-ацетокси-5-фенилметилиндол (X = ЙСНз, Яг = СОСНз, Rj =
=фен ил).
Раствор 1-метил-4-Окси-5-фенилметилиндола (4,25 г, 0,018 моль) в 40 мл пиридина обрабатывают при 0"С уксусным ангидридом(2,74 r, 0,027 моль). Смесь нагреваютдо комнатной температуры и перемешивают
18 4. После разбавления этилацетатом, пиридин удаляют путем промывки 1-нормальной соляной кислотой до тех пор пока промывная вода не станет кислой. Затем органическую фазу сушат нэд сульфатом магния, фильтруют и концентрируют при пониженном давлении. Образовавшееся масло подвергают флэш-хро иатогр афии с
20 этилацетата в гексане, получая с количественнйм выходом вязкое масло, которое медленное затвердевает. При перекристаллизации из смеси 1-хлорбутан/гексан получают целевой продукт в виде белых игл (2,9 г,58%) с т.пл, 56 — 58 С.
Аналогично были получены соединения, указанные в табл.2.
Полученные соединения I ингибируют
5-липоксигеназу в системе испытания вне организма с использованием клеток базофильной лейкемии (РВЫ) крыс в качестве источника фермента.
Жидкость над осадком после центрифугирования (10000xg) гомогенизированных клеток RBI- выдерживают с испытуемым веществом в фосфатном буфере с рН 7 в течение 5 мин, Меченую изотопом 14С арахидоновую кислоту добавляют, чтобы иницийровать реакцию, которую продолжают в течение 2 мин при 37 С. Реакцию прерывают замораживанием в суспензии сухого льда и этанола, и продукты 5-липоксигеназы отделяют от субстрата на колонках с силикагелем. Количества образовавшихся индивидуальных продуктов липоксигеназы определяют и рассчитывают процент ингибирования, В табл.3 показаны значения ингибирующей активности некоторых веществ изобретения в отношении 5-липоксигеназы.
Было найдено, что соединения! ингибируют отек, вызванный эрахидоновой кислотой. Арахидоновую кислоту (1 мг) в виде ацетонового раствора наносят на внутренственно перед вводом арахидоновой кислоты. Через 1 ч после. ввода из уха удаляют диски диаметром 6 мм с помощью пробойника биопсии, и определяется их вес
Результаты представлены в виде процентного ингибирования припухания, которое происходит в отсутствие испытуемого вещества.
Х где Х вЂ” кислород, сера или группа NR>, где
R> имеет указанные значения, подвергают взаимодействию в растворе в присутствии основания с альдегидом общей формулы
RgCHO, где Яз имеет указанные значения, 1799379 где Яз имеет указанные значения, или, в случае необходимости, ацилированием ангидридом общей формулы (R4C0)z0, 15 где Rp имеет указанные значения, с последующим подкислением и выделением полученного при этом соединения общей формул ы Ои
cd
Таблица1
OH Х
Выход, Пример
Температура плавления,оС
Фенил
Фенил
Фенил
Фенил
4-СнзОРй
3,4-(С НзО)2-P h
3,4-(ОСН20)-Рh
3-йиридйл
4-СНз-Ph
4-F-Ph
4-CI-Ph
3,4-Clz-Ph
4-(СНз)2 N-Ph
2-тиенил
2-(С2Н5О)-Ph
2-С1-Ph
Ph-фенил
@" 2
Х
Таблица2
Пример
Температура плавления,оС
Выход, la
Ib
1с
Id
le
If
Ig
Ih
Ii
Ц
Ik !
Ь
Im
In
Io !
la
Ib
le
Ы
te
Н
Ig
В
li
Ц
И
II
ИСНз
0
NCHzPh
ИСНз .ИСНз
ИСНз
ИСНз
ИСНз
Иснз
ИСНз
ИСНз
ИСНз
И-Снз
NCH3
ИСНз
ИСНз
ИСНз
ИСНз.
ИСНз
ИСНз
ИСНз
ИСНз
ИСН2снз
ИСНз
ИСНз
ИСНз
ИСНз
ИСНз
Ацетил
Ацетил
Ацетил
Ацетил
Ацетил
Ацетил
Ацетил
Пропионил
Ацетил
Ацетил
Ацетил
Ацетил
Ацетил
Фенил
2-тиенил
4-СНзО-Ph
3,4-(СНзО)2-Ph
4-СНз-Ph,4-(OCHz0)-РЙ
Фенил
Фенил
2-(СзН50)-Р4
4-/(Снз)2 N1-Ph
2-СНЪ
3-пиридил
4-F.-Pp
59
19
74
66
66
36
38
33
56
54
58
32
64
88
62
66
89
94
31
97
73
76-77
82-83
84-86
112-113
101-103
117-119
133-135
201-203
104-106
95-96
146-148
123-125 .
103-105
Масло
93-95
76-78
56-58
84-86
Масло
92-94
Масло
112-113 . 90-92
69-71
96-97
112-113
84-86
87-89
91-93
1799379
Продолжение табл.2
Ph-фенил
Таблица3
Таблица4
Составитель И. бочарова
Редактор А,Ходакова Техред M.Ìîðråíòàë Корректор М.Шароши
Заказ 789 Тираж Подписное
ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР
113035, Москва, Ж-35, Раушская нa6Ä 4/5
Производственно-издательский комбинат "Патент", г, Ужгород, ул.Гагарина, 101