Способ пробоподготовки для атомно-спектрального анализа меди высокой чистоты
Иллюстрации
Показать всеРеферат
Способ анализа меди высокой чистоты заключается в том, что процесс электролиза проводят из солянокислого раствора, содержащего органическую добавку ди-2-этилгексилдитиофосфорной кислоты в количестве 0,25±0,05 г/л. 7 табл.
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (я)5 G 01 N 21/72
ГОСУДАРСТВЕННОЕ ПАТЕНТНОЕ
ВЕДОМСТВО СССР (ГОСПАТЕНТ СССР) ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
О
О (л)
Ы 4 (21) 4925329/25 (22) 04.04.91 (46) 07.03.93. Бюл. М 9 (71) Государственный научно-исследовательский и проектно-конструкторский институт гидрометаллургии цветных металлов
"Гидроцветмет" (72) Л.Н.Шабанова, Э.Н,Гильберт и Н,И.Сен (56) ГОСТ 27981.1 — 88. Медь высокой чистоты. Методы атомно-спектрального анализа, с.6 — 24.
ГОСТ 27981.1-88. Медь высокой чистоты. Методы атомно-спектрального анализа, с.24-35.
Изобретение относится к аналитической химии, а именно к способам пробоподготовки. Оно может быть использовано в металлургической промышленности для контроля химического состава катодной меДИ.
Цель изобретения — расширение числа определяемых примесей в меди за счет улучшения селективности электрохимического выделения меди из раствора, вскрытия образца и сокращения длительности определения.
Поставленная цель достигается тем, что в предлагаемом способе электрохимическое выделение меди проводят из солянокислого раствора вскрытия образца меди с органической добавкой ди-2-этилгексилдитиофосфорной кислоты (Д2ЭГДТФК) в концентрации 0,25+.0,05 г/л при комнатной температуре.
Эксперименты выполняли на солянокислых (3MHCI) растворах вскрытия стандартных образцов меди высокой чистоты (ГСО, ОСО), содержащих органическую добавку — 0,25й0,05 г/л Д2ЭГДТФК и введен» .Ы 1800327 А1 (54) СПОСОБ ПРОБОПОДГОТОВКИ ДЛЯ
АТОМНΠ— СПЕКТРАЛЬНОГО АНАЛИЗА
МЕДИ ВЫСОКОЙ ЧИСТОТЫ (57) Способ анализа меди высокой чистоты заключается в том, что процесс электролиза проводят из соля нокислого раствора, содержащего органическую добавку ди-2-этилгексилдитиофосфорной кислоты в количестве
0,25 0,05 г/л, 7 табл. ные микропримеси As, Se, Те, Pb, Cd, Со, Ni, Fe, Si, Sb, Zn, Sn,Bi, Mn, Cr, Mg с заданными концентрациями в интервале 0,2 — 20 мг/л.
Электроосаждение меди проводили с использованием графитового анода и титанового катода при напряжении 4 0,2 В в течение 1 ч при комнатной температуре, При повышении температуры до 50 С происходит незначительное изменение электроосаждения меди (ускорение), при этом не происходит улучшения резул ьтатов анализа (табл.2). В качестве рабочей выбрана комнатная температура раствора вскрытия образца (в процессе электролиза происходит небольшой саморазогрев). Выбор оптимального времени электролитического осаждения меди (1 ч) обоснован в табл,3, Выбор соляной кислоты в качестве среды обусловлен возможностью интенсификации процесса электроосаждения меди из раствора вскрытия образца, Проводить электролитическое осаждение меди в азотнокислой среде в присутствии органической добавки Д2ЭГДТФК не представляется возможным из-за окисления последней.
1800327
Применение графитового и титанового электродов обусловлено их доступностью, дешевизной, отсутствием на электродах процессов, приводящих к образованию взвесей или осадков в растворе.
Добавка Д2ЭГДТФК к солянокислому раствору вскрытия образца меди высокой чистоты приводит к сдвигу потенциала электроосаждения и повышению селективности электроосаждения меди в область меньших значений, Величина сдвига катодной поляризации при концентрации Д2ЭГДТФК
0,25» 0,05 г/л составляет 100»-15 мВ. При концентрации меди в растворе вскрытия 20 г/л осаждение меди при комнатной температуре до остаточной концентрации 2 г/л достигается за 1 ч.
При этом в рафинате количественно остаются следующие примеси; Bi, Fe, Cd, Со, Si, Sn, Pb, Сг, Zn, Mg, Mn, Ni u As и на 50
Se,Те, Sb, По-видимому Д2ЭГДТФК при электролизе меди действует подобно известным выравнивающим и блескообразующим добавкам, применяемым в гальваностегии, в результате чего на катоде формируется мелкокристаллический осадок меди, который частично захватывает лишь некоторые примеси. Малый захват примесей связан, вероятно, с блокированием Д2ЭГДТФК активных центров на поверхности осадка с одной стороны и уменьшение захвата раствора межкристаллитными границами, с другой. Подтверждением такого действия служит сдвиг катодного потенциала, при котором происходит процесс электроосаждения меди, в отрицательную область, причем оптимальный сдвиг потенциала, равный
100»+ 0,15 мВ, обеспечивается концентрацией добавки Д2Э ГДТФ К 0,25»-0,05 г/л. Добавка Д2ЭГДТФК меньшей концентрации, например 0,15" 0,05 г/л, обеспечивает сдвиг потенциала восстановления меди лишь на
30»- 10 мВ, При этом почти полностью соосаждаются с медью Se, Sb, Fe, частично Bi, а увеличение концентрации добавки до
0,40» 0,10 г/л приводит к сдвигу потенциала не более чем на 140 мВ без существенного улучшения эффективности процесса (табл,4). Таким образом, в качестве оптимальной концентрации была установлена концентрация Д2ЭГДТФК 0,25»-0,05 г/л, Совокупность вышеперечисленных приемов, а именно, использование солянокислых растворов с органической добавкой
Д2ЭГДТФК в количестве 0,25»-0,05 г/л, графитового анода и титанового катода обеспечивает 10-кратное снижение концентрации меди в растворе за 1 ч, рафинат содержит
55 следующие примеси: Bi, Fe, Cd, Со, Si, Pb, Sn, Cr, Sb, Zn, Mn, Mg, Se, Те, Ni и As, которые далее могут быть определены АЭ с
ИСП и АА методами.
В табл.4 приведены данные, подтверждающие селективность выделения меди из раствора вскрытия образца и количественные характеристики по определяемым примесям. Воспроизводимость результатов характеризуется значениями относительного стандартного отклонения в диапазоне Sr
= 0,05 — 0,15.
Для сравнения нами было проведено электрохимическое осаждение меди из солянокислых растворов вскрытия без органической добавки.
Полученные результаты показали, что без Д2ЭГДТФК процесс выделения меди, обеспечивающий 10-кратное снижение концентрации меди (с 20 до 2 г/л) достигается за 1,7ч, ухудшается селективность процесса — почти полностью соосаждаются с медью примеси Se, Fe, Sb, и на 50 Те и В!(табл.5).
Пример 1. Анализ стандартных образцов меди на аттестованные примеси.
Навеску стандартного образца меди (ГСО М 214, ¹ 215) массой 2,000 г промывают разбавленной соляной кислотой (1:10) и дважды деионизованной водой, растворяют в 20 мл концентрированной соляной кислоты при добавлении 337, -ной перекиси водорода порциями по 3 — 4 мл. После растворения навески избыток перекиси водорода удаляют нагреванием раствора. Раствор охлаждают, прибавляют 15 мл соляной кислоты и 25 мг Д2ЭГДТФК, доводят водой до объема 100 мл. Далее раствор переносят в электролизную ячейку, помещают в нее графитовый и титановый электроды, проводят электроосаждение меди в течение часа при напряжении 4+0,2 В при комнатной температуре.
Полученный после электролиза рафинат анализируют на содержание микропримесей методами АЭ с ИСП и АА, Результаты анализа приведены в табл.6.
Пример 2. Анализ стандартных образцов меди на неаттестованные примеси.
Навеску стандартного образца меди М
214 массой 2,000 г промывают разбавленной соляной кислотой и растворяют в соляной кислоте с добавлением HzO как в примере 1.
После охлаждения раствора прибавляют 15 мл концентрированной соляной кислоты, вводят микропримеси Cd, Со, Se и Те с заданными концентрациями, значительно (не менее чем в 10 раз) превышающими содержание этих элементов в стандартном образце, 25 мг Д2ЭГДТФК, доводят водой
1800327 осаждение меди из раствора вскрытия образца без нагрева последнего. раствор до 100 мл, перемешивают. Раствор переносят в . электролизную ячейку и проводят электролиз как в примере 1.
Полученный рафинат анализируют на содержание кадмия, кобальта, селена и теллура АЭ методом с ИСП, Результаты анализа приведены в табл.7.
Таким образом, по сравнению с прототипом описанный метод обеспечивает более селективное выделение меди из раствора вскрытия меди, что позволяет проводить одновременное определение 16 микропримесей. Время электроосаждения меди сокращается с 1,5 — 2 по варианту прототипа до 1 ч.
Предлагаемый метод позволяет отказаться от дорогостоящих платиновых электродов и проводить электрохимическое
Формула изобретения
Способ пробоподготовки для атомно-спектрального анализа меди высокой чистоты, включающий электролитическое выделение меди из кислотного рас10 твора, отличающийся тем, что, с целью расширения числа определяемых примесей в меди за счет улучшения селективности выделения и сокращения длительности способа, электролиз про15 водят из солянокислого раствора, содержащего органическую добавку ди-2-этилгексилдитиофосфорной кислоты в концентрации 0,25 0,05 г/л.
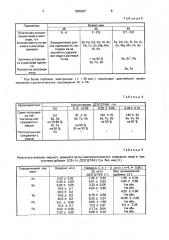
Таблица 1
Способ
Характеристики и е лагаемый известный
Fe, Cd, Со, Mg, Mn, As, Ni, Pb, Sb, Сг,Zn,Те, P
Азотная кислота
1:10
1,5-2
Состав раствора после электролиза меди
Среда
Сетчатые платиновые
70 -90
Не используется
Таблица 2
Время электролитического выделения меди, ч
Электроды
Температура раствора, С
Органическая добавка
Fe, Cd, Со, Mg, Mn, As, Ni, Pb, Sb, Cr, Zn, Те, Se, Bi, Si, $п, Соляная кислота
1:4
Анод - графит
Катод - титан
Без дополнительного нагрева раствора
Д2ЭГД ТФК
0,25 0,05 г/л
1800327
ТаблицаЗ
* При более глубоком электролизе (т > 60 мин ) происходят дальнейший захват примесей и дополнительное соосаждение Bi u Pb .
Таблица 4
Таблица 5
Результаты анализа медного рафината после электролитического отделения меди в присутствии добавки 0,25 г/л Д2ЭГДТФК(1) и без нее(2) 10
1800327
Продолжение таблицы 5.
Найдено, С+ t . S, мг/л п=4, f= 0,95
Введено, мг/л
Определяемый элемент
25 мг/л
2ЭГ ТФК 1 без органической оба вки 2
Sb
Bi
Со
Si
$п
Мп
М9
Таблица 6
Результаты анализа стамдартнык образцов меди, мас.2
0п редел. элемент б
Si Fe Zn Mn
Ni Cr
РЬ
0,00807 0 00189
0,00820 0,00195
0,000436
ГСО меди Аттестат
0,00250 0,00282 0,00293 0,00288 0,00079 0,00187
0,00282 0,00282 0,00290 0,00278 0,00083 О, 00180
0,00632 0,00222 0>00181
0,00602 0,00230 0,00180
Н 214 Найдено
Со меди Аттестат
У 215 Найдено
0,000429
0,00143 0,00134 0,00114 0,00104 0,00194 0,000935 0,00676 0,00111
0,00146 0,00126 0,00118 0,00097 0,00197 0,000950 0,00683 0,00119
0,00376 0,000842 О ° 000753 О ° 000397
0,00370 О, 000880 0,00080 0,000400 ри расчете содервания сурьмы в меди был использован поправочный коэФФициент R 2 (см.сноску табл.7) Табл и ца 7
Результаты анализа стандартного образца меди ¹ 214 на содержание неаттестованных примесей методом введено-найдено
* Результаты определения селена и теллура в пробе приведены с учетом поправочного коэффициента К равного соответственно 2,2 и 3,0. Так как указанные примеси частично соосаждаются с медью, экспериментально были рассчитаны поправочные коэффициенты для расчета результатов определения Sb, Se и Те при n = 8, f= 0,95 и различных содержаниях указанных примесей в растворе.
5,00 + 0,05
5,00 + 0,05
2,00 + 0,02
500 + 005
2,00 1- 0,02
5,00 + 0,05
2,00 0,02
5,00 + 0,05
2,00 0,02
5,00 + 0,05
500 + 0,05
10,0 0,1
2,00 - 0,02
500 + 005
2,00+ 0,02
5,00 0,05
2,00 0,02
500 + 005
2,00 1- 0,02
5,00 0,05
2,45 0,20
5,44 «+ 0,48
2 21 1- 023
5,20 + 0,050
2,24 + 0,32
5,50 0,53
2,21 0,29
5,40 = - 0,56
2,15 1- 0 21
5,30 "= 0,60
4,80 1- 0,22
97й 14
2,08 + 0,21
1,97 1- 0,11
5,00 + 0,22
2,32 0,34
5,40 - 0,53
1,96 + 0,16
5 111- 0,16
1,65 + 0,26
3,28 + 0,50
1 65 1- 048
4,71 - 0,74
2,10 + 0,26
505 059
1,95 + 016
4,90 + 0,57
1,71 + 0,39
4,75 1- 0,78
3,40 0,98
94 и 22
2,05 + 0,36
5,15+ 0,70
1,95 + 0,19
4,70 = - 0,62
2,00 + 0,17
505 1- 0,40
2,00 1- 0,24
4,75 + 0,88