Способ моделирования аллергических состояний у экспериментальных животных
Иллюстрации
Показать всеРеферат
Использование: экспериментальная зллергология, в частности способы моделирования аллергических состояний у экспериментальных животных. Сущность изобретения: экспериментальным животным вводят модельный аллерген в присутствии адьюванта, в качестве которого используют кватернизированные сополимеры П-цетил и П-этилполи-4-винилпиридиний бромидов М.М.200000-220000 в дозе от 5 до 50 мг/кг массы животного. Способ прост в исполнении, позволяет эффективно моделировать аллергические состояния у экспериментальных животных.
СОЮЭ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
IsI)s G 09 В 23/28
ГОСУДАРСТВЕННОЕ ПАТЕНТНОЕ
ВЕДОМСТВО СССР (ГОСПАТЕНТ СССР)
ОПИСАНИЕ ИЗОБРЕТЕНИЯ/". :!":::",:, ;,,
АВТОРСКОМУ СВИДЕТЕЛ ЬСТВУ (21) 4929149/14
2) 17.04.91
46) 23.03.93. Бюл, N. 11
1) Институт иммунологии (72) А.Н.Попов, А.А.Бабахин, B.Â.Ãîí÷àðoâ, М.И,Мустафаев и И,С,Гущин (56) lrIf. Archs. Allergy. Appl, lmmunol. 1983, 72, рр, 199 — 205.
4) СПОСОБ МОДЕЛИРОВАНИЯ АЛЛЕРИЧЕСКИХ СОСТОЯНИЙ У ЭКСПЕРИМЕН1AJlbHblX ЖИВОТНЫХ где+СН-СН)„, — 6 - !0% (СН-0Н) „-80-85%
NOare
СгНь
-(СН - СН)- — 5-! м% н- н н — сн н — сн)р—
6 bá (" Н5 пНзз
Изобретение относится к эксперимент льной аллергологии, в частности к способу оделирования у экспериментальных животных аллергических состояний, которые характеризуются повышенным уровнем сывороточного иммуноглобулина класса
E(lg Е).
Цель изобретения — упрощение и повыШение эффективности моделирования аллергйческих состояний у экспериментальных х ивотных, Поставленная цель достигается предлагаемым способом, который заключается в том, что экспериментальным животным вводят модельный аллерген и кватернизованные с полимеры N-цетил и N-этилполи-4-винилпиридиний-бромидов (СП) общей формулы:
„„5U„„1803928 А1 (57) Использование: экспериментальная аллергология, в частности способы моделирования аллергических состояний у экспериментальных животных. Сущность изобретения: экспериментальным животным вводят модельный аллерген в присутствии адъюванта, в качестве которого используют кватернизированные сополимеры П-цетил и П-этилполи-4-винилпиридиний бромидов М.M.200000 — 220000 в дозе от
5 до 50 мг/кг массы животного, Способ прост в исполнении, позволяет эффективно моделировать аллергические состояния узкспериментальных животных.
M@3r++
MM. 200000-220000;
ОыеНи в дозе 5 — 50 мг/кг массы животного.
Отличием способа является использование в качестве адъюванта кватернизованных сополимеров N-цетил и
N-этиполи-4-винилпиридиний бромидов вышеуказанной общей формулы в дозе 5 — 50 мг/кг массы животного, Используемые сополимеры не требуют предварительного смешивания с антигеном и действуют при одновременном с ним введении. СП различного состава и с разной степенью полимеризации получены ранее и охарактеризованы физико-химическими методами исследова00
C) СдЭ !
М Ю
1803928 ний. Известно, что они проявляют в отношении иммунокомпетентных клеток митогенные свойства. Использование их в качестве адъювантов для индукции IQE ответа неизвестно.
Для достижения цели предполагаемого изобретения необходимо вводить животным СП в дозах 5-50 мг/кг. Введение СП в дозе менее 5 мг/кг усиления продукции igЕ специфических антител не вызывает, Применение доз более 50 мг/кг не целесообразно, так как дальнейшего усиления синтеза
IgE антител не происходит.
Основой для получения СП служит поли-4винилпиридин с молекулярной массой 97 кД.
После кватернизации поли-4-винилпиридина цетилбромидом полученный продукт доалкилировали бромистым этилом.
Сополимеры представляют собой лиофильно высушенные порошки, хорошо растворимые в воде, Препараты легко дозируются путем приготовления водных растворов определенных концентраций. После полного растворения препаратов СП (4-6 ч при комнатной температуре или 15 мин при 37 С) рН их водных растворов доводят до 7,0 1Н
NaOH. Перед иммунизацией растворы СП стерилизуют фильтрацией через мембранные фильтры с размером пор 0,22 мкн, В лиофильно высушенном состоянии препараты СП хорошо хранятся и (по нашим данным) по крайней мере в течение 3 лет не теряют своей адъювантной активности, Все эти качества делают их гораздо более удобным в экспериментальном использовании по сравнению с ПАФ, МГ, личинками гельминтов или солями ртути, Выбор в качестве модельного аллергена овал ьбумина (ОА) обусловлен его способностью при введении экспериментальным животным индуцировать специфический IgE ответ и широким использованием в экспериментальной лабораторной практике. Используемая для введения доза модельного аллергена ОА традиционна для подобного моделирования IgE ответа у экспериментальных животных.
Проверка заявленного технического решения на соответствие его критерию "существенные отличия" показала, что ни в патентной ни в научной литературе не выявлено совокупности признаков, указанной в формуле изобретения.
Примеры осуществления способа.
Пример 1. Испытана способность СП индуцировать специфический IgE ответ в эксперименте на мышах (CBA х С57В1/6)Р1 массой 18 — 20 г. В каждую экспериментальную группу брали по 8 — 10 мышей, СП, содержащий 5 моль% звеньев цетилбромида
45 на>1000 мономерных звеньев винилпиридина (СП5) с молекул, массой 205 кД вводили мышам внутрибрюшинно в дозах 0,25; 0,5;
2,5; 5; 25 и 50 мг/кг массы тела. ОА также инъецировали внутрибрюшинно в дозе 0,5 мг/кг. Мышам контрольных групп инъецировали один ОА, ОА, эмульгированный в 0,2 мл ПАФ, или ОА, адсорбированный на 2,5 мг
МГ, который получали по ранее описанной методике (3), На 21 день после иммунизации мышей всех групп вторично иммунировали одним ОА в дозе 0,5 мг/кг, Влияние введения различных адъювантов на развитие специфического lgE ответа оценивали по уровню анти-ОА гомоцитотропных антител в сыворотке иммунизированных мышей.
Кровь на определенные сроки после иммунизации получали от каждой мыши индивидуально из ретробульбарного венозного сплетения, Сыворотку от сгустка форменных отделяли центрифугированием. Смешивая одинаковые объемы индивидуально полученных сывороток внутри каждой экспериментальной группы, получали пул сывороток, который затем тестировали в реакции пассивной кожной анафилаксии.
Титры IgE u IgGI гомоцитотропных антител в пуле сывороток мышей одной группы определяли по стандартной методике (7, 15, 16) на 5 беспородных крысах-самцах массой
200 — 260 r или 5 беспородных мышах-самках массой 18 — 22 г соответственно, Животным под эфирным наркозом строго внутрикожно (крысам на животе, мышам на спине) вводили микрошприцем по 30 мкл последовательных двукратных разведений пулов сывороток, приготовленных на 0,9% растворе NaCI, Разрешающую дозу ОА вводили под эфирным наркозом в хвостовую вену крысам через 24 — 48 ч (100 мкг/100 г массы в 1 мл 0,5% раствора синего Эванса), мышам через 2 ч (500 мкг в 0,2 мл 0,5% раствора синего Эванса), Через 30 мин животных под эфирным наркозом декапитировали и учитывали результаты реакции пассивной кожной анафилаксии на внутренней стороне кожи живота или спины соответственно. За титр гомоцитотропных анти-ОА антител в тестируемом пуле сывороток принимали последнее из его разведений, дающее прокрашивание участков кожи в местах внутрикожных инъекций размером не менее 5 мм в диаметре. Результаты выражали в логарифмах по основанию 2 величин, обратных титрам гомоцитотропных антител в реакции пассивной кожной анафилаксии, и брали среднее арифметическое значение, полученных на 5 животных. При статическом анализе достоверности различий в титрах гомоцитотропных антител между
1803928 группами использовались эмпирическим лах сывороток крови мышей как описано в примере 2, Результаты определения титров специфичных Ig E антител у мышей разных групп представлены в табл.3, Представленные данные свидетельствуют, что использованный в качестве адъюванта СП эффективно стимулирует продукцию специфичных IgE антител даже при раздельном введении с модельным аллергеном, Приведенные примеры демонстрируют, что предлагаемые СП имеют преимущества по сравнению с другими адъювантами, используемыми в экспериментальной практике для индукции Ig E ответа. СП не токсичны, удобны в работе, действуют даже при раздельном введении с модельным аллергеном. При этом денатурации модельного аллергена не происходит. Все эти факторы делают предлагаемые СП более простыми и эффективными адъювантами для индукции аллергических состояний у экспериментальных животных.
Формула изобретения
Способ моделирования аллергических состояний у экспериментальных животных путем введения аллергена и адъюванта, о тл ича ю щи йся тем,что, с цельюупрощения и повышения эффективности способа, в качестве адъюванта используют кватернизованные сополимеры N-цетил и N-атил поли-4-винилпиридинийбромидов с общей структурной формулой: правилом, предложенным рядом исследователей (16). Различие считали достоверным при разнице величин более чем на 3 шага разведения и тогда, когда разница в 2 шага воспроизводилась минимум в 3 независимых экспериментах, В табл, 1 представлены результаты определения уровня анти-ОА ig Е ответа, индуцированного у мышей внутрибрюшинным
10 введением ОА вместе с различными адъювантами.
Как свидетельствует из таблицы введение мышам совместно с модельными аллергеном СП в зависимой от дозы степени
15 индуцирует у мышей достоверное повышение сывороточного уровня специфичных к овальбумину lg Е антител. Эффект введения
СП в дозах 5-50 мг/кг массы на уровень первичного IgE ответа сопоставим с действием других адъювантов: ПАФ и МГ, Пример 2. Испытана способность СП различного состава индуцировать специфический IgE ответ в эксперименте на мышах (СБА х С57В1/6)F> массой 18 — 20 г. Использованы СП, содержащие 5, 7 и 14 моль,(, звеньев цетилбромида (СП5, СП7 и СП14, соответственно). СП в разных дозах вводили вместе с модельным аллергеном ОА
25 внутрибрюшинно. Использованные при первичной иммунизации мышей дозы СП, ()А и результаты определения уровня анти
ОА (9Е антител представлены в табл,2, Результаты, представленные в таблице
2, свидетельствуют, что CI разного состава также способны усиливать продукцию IgE антител. Интересен тот факт, что при введении очень больших доз модельного аллергена (50 мг/кг), не способствующих развитию
IgE ответа, совместное введение СП14 способствует продукции анти-ОА IgE антител.
Пример 3. Оценка влияния эффективности различных способов введения СП на его способность индуцировать продукцию !
9Е антител. Мышей(СВА х C57B1/6)Рз мас30
" ((,H-ОН СН-СНЦ СН-СН),—
d bb.. (" Н5 (IsH)> где+ОН-СН) „, — 8 — Iog (CH-СН) и 80 85Я сой 18 — 20 г иммунизировали ОА в дозе 50 мкг/мышь. Вслед за инъекцией антигена одной группе мышей внутрибрюшинно вводили 0,2 мл СП в дозе 5 мгlкг, а другой— такую же инъекцию СП делали подкожно в загривок. В контрольных группах вслед за инъекцией ОА мышам внутрибрюшинно или подкожно вводили физиологический раствор NaCI. 0,2 мл эмульсии ПАФ или 0,2 мл, Ko3re
СгН, ЕСН -СН)- — 5-1Ц/
K®are
4Нзз содержащие 2,5 мг МГ. На 21 день после
55 иммунизации мышей вторично иммунизировали одним ОА в дозе 0,5 мгlкг. Эффективность того или иного способа введения
СП оценивали по титрам анти-ОА IgЕ гомо- мол.м.200000 — 220000sдозеот5до50мг/кг цитотропных антител, определяемых в пу- массы животного.
1803928
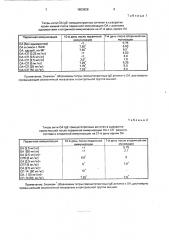
Таблица 1
Титры анти-ОА Ig E гомоцитотропных антител в сыворотке крови мышей после первичной иммунизации ОА с разными адъювантами и вторичной иммунизации на 21-й день одним ОА
Примечание. Значком обозначены титры гомоцитотропных IgE антител к ОА. достоверно превышающие аналогичный показатель в контрольной группе мышей.
Таблица 2
Титры анти-ОА IgE гомоцитотропных антител в сыворотке крови мышей после первичной иммунизации ОА с СП разного состава и вторичной иммунизации на 21-й день одним ОА
Примечание, Значком * обозначены титры гомоцитотропных Ig Е антител к ОА, достоверно превышающие аналогичный показатель в контрольной группе мышей, 10
1803928
Таблица 3
Титры анти-ОА Ig E гомоцитотропных антител в сыворотке крови мышей иммунизированных первично ОА и после различных способов введения СП и вторично на 21-й день одним ОА
Составитель И. Гущин
Техред М.Моргентал Корректор Н, Ревская
Редактор T. Козлова
Заказ 1058 Тираж Подписное
ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР
113035, Москва, Ж-35, Раушская наб„4/5
Производственно-издательский комбинат "Патент", г. Ужгород, ул.Гагарина, 101
Примечание. Значком * обозначены титры гомоцитотропных lg E антител к ОА, достоверно превышающие аналогичный показатель в контрольной группе мышей.