Бромгидраты 6-(n @ -бензилоксикарбонил)аргиниламинонафталин- 1-сульфамидов в качестве субстратов для флуоресцентного анализа пептидаз
Иллюстрации
Показать всеРеферат
Использование: в качестве субстратов для флуоресцентного анализа пептидаз. Сущность изобретения: бромгидраты 6- (Na -бензилоксикарбонил)аргиниламинонафталин-1-сульфамиде в формулы: 1-RiR2NS02 (нафталинумНАгд М01 -Z) НВг, где , R2 линейный или разветвленный (Ct-C) алкил, CsHn, циклогексил, бензил, или , С2И5, или NRiR2 гексаметилен, пиперидин, морфолин, Z- бензилоксикарбонил. Реагент 1: бромгидрат 6-(N а-бензилоксикарбонил)аргинил. Реагент -2: соответствующий аминонафталин сульфамид. Условия реакции: в среде сухого пиридина и толуола. 3 табл.
союз соВетских социАлистических
РЕСПУБЛИК (я)5 С 07 С 311/38
К ПАТЕHTY
ГОСУДАРСТВЕННОЕ ПАТЕНТНОЕ
ВЕДОМСТВО СССР (ГОСПАТЕНТ CCCP) (21) 4931982/04 (22) 19,03.91 (46) 30,03.93. Бюл. М 12 (71) Институт биохимии Литовской АН (72) С,Ю.Бутенас, А.И.Палайма, Р,С,Битаутайте и 3.А.Талайкито (73) Институт биохимии Литовской АН (56) Ьиоорганическая химия, 1989, т. 15, N 4,с,444. (54) БРОМГИДРАТЫ 6-(й -БЕНЗИЛОКСИКАРБОНИЛ)АР ГИНИЛАМИ НОНАФТАЛИН-1-СУЛЬФАМИДОВ В КАЧЕСТВЕ СУБСТРАТОВ ДЛЯ cDJlYOPECLIEHTHOÃÎ АНАЛИЗА ПЕПТИДАЗ
Изобретение относится к химии аминонафталинсульфокислот, а именно к новь1м бромгидратам 6-(N -бензилоксикарбонил)аргиниламинонафталин-1-сульфамидов общей формуль1 1
q+yNHAe (N -z) нв;
®2 1 2 где R<=H; Йг=СНз, СгНБ, СзНт, i-СзНт, C4Hg, i-C4Hg, t-C4Hg, СБН,, СН2- О или В1=Й2=СНз, СФ5, или ЙВЯ2= Й н ) > б о в качестве субстратов дпя флуоресцентного анализа пептидаз.
Цепь изобретения — повышение эффективности субстратов, применяемых дпя флуоресцентного анализа пептидаз.
„„5Ц„„1806133 АЗ (57} Использование: в качестве субстратов для флуоресцентного анализа пептидаэ.
Сущность изобретения; бромгидраты 6(N -бензилоксикарбонил)аргинипамино- нафталин-1-сульфамидов формулы;
1-R>RzNSO2 (нафталин)-NHArg-(N -Z) HHr, Q где R<=H, Rz = линейный или"разветвленный (C>-С4) алкип, СБН1, циклогексил, бенэил, или R1=R2=CHa, С2НБ, или NR
6-(й -бензилоксикарбонил)аргинил. Реа° а гент 2: соответствующий аминонафталин сульфамид, Условия реакции: в среде сухого пиридина и толуопа. 3 табл, Цель достигается синтезом бромгидратов 6-(N -бензилоксикарбонил)-аргиниламинонафталин-1-с льфамидов, которые имеют детектируемые группы, обладающие более высокой интенсивностью флуоресценции. Крометого, предложенные субстраты получа1отся более простым путем, чем О
5-(тоэил глицил-пролил-аргинил)аминонафтапинсульфамиды. Синтез соединений и их (р, поименение в качестве субстратов дпя опре- () деления пептидаз иллюстрируется примерами, (7.
Пример 1, Бромгидрат 6-(N -бензипоксикарбонил)аргиниламинонафталин-1диэтил суп ьфамида.
3;89 г (0,01 моль) бромгидрата (N -бензипоксикарбонил)аргинина и 2,78 r (0,01 моль) 6-аминонафталин-1-диэтиленсульфамида растворяют в 15 мл сухого пиридина, добавляют 30 мл сухого толуола. Толуол отгоняют при пониженном давлении, реакционную смесь охлаждают до -20 С и
1806133
30
55 добавляют раствор 2,68 r (0,013 моль) дициклогексилкарбодиимида в 6 мл сухого пиридина. Реакционную смесь выдерживают при -20 С 30 мин, при +4 С вЂ” 1 ч и при
+20 С вЂ” 20 ч. Отфильтровывают мочевину, отгоняют пиридин при, пониженном давлении, остаток растворяют в смеси хлороформ-пропанол 3:1, Этот раствор .промывают 15 мл воды, 15 мл насыщенного .водного р-ра NaCf, содержащего 1 мл конц .
HCl, 15 мл 2%-ного водного аммиака и 15 мл воды. Органический слой отделяют, высушивают над безводным Иа2304, растворитепи отгоняют и остаток растирают с сухим толуолом. Продукт отфильтровывают, промывают сухим толуолом, сухим диэтиловым эфиром и перекристаллизовывают из пропанола. Гlолучают 5,64 г(выход 84%) целевого продукта с т.пл. 104-112 С, 1а1п
12,8 (c 1; СНзОН); Rr=0,72 (бутанол-уксусная кислота-вода 4:1.2) (БУВ 412), Найдено, %: С 51,63; Н 5,85; N 12,76; В г
1 1,88; S 4,58
СзвНз7КвВгЯО
Вычислено, %: С 51.77; Н 5,74; И 12,94;
В r 12,30, S 4,94.
СзвНзтйвВгЯО.
ПМР-спектр (д, м.д., ДМСО): 0,94 (СНз), 3,20 (CHz).
Аналогично получают остальные соединения. Их физико-химические свойства и риведены в табл,1.
Для доказательства преимущества новых субстратов определены относительные интенсивности фпуоресценции и спектр поглощения детектируемых групп.
Пример 2, а) Определение относительной интенсивности флуоресценции 6аминонафталин- f äиэтилсульфамида (Детектируемая группа соединения (12) формулы 1), Растворяют 0,004945 г 6-аминонафталин-1-диэтипсульфамида в 10 мл 95%-ного этилового спирта. 0,23 мп этого раствора разбавляют t0 мл фосфатного буфера с 4 рН=7,0 (0,067 M) и снимают спектр флуоресценции на спектрофлуориметре "Hitachi
MPF-4" (Япония) в относительном режиме регистрации при чувствительности "3" в кювете с толщиной слоя 1 см, Длина волны возбуждения ß îçá.=357 нм, ширина щели возбуждения 10 нм, эмиссии -4 нм, Концентрация измеряемого раствора c=4,0705 10
-5 моль/л, оптическая плотность при длине волны возбуждения 0,080. Полоса эмиссии имеет максимум при 1 ф,.=477 нм, высота полосы (J) — -92 мм. Относительную интенсивность флуоресценции рассчитывают по формуле
Is= А.
1 с 10 где А — соотношение максимальной и использованной чувствительности прибора.
Для 6-аминонафталин-1-диэтилсульфамида получают:
1s „= 753.
92 100
4,0705 10 10 3
Аналогично измерены спектры флуоресценции остальных 6-аминозамещенных, а также известных 5-аминозамещенных нафталинсульфамидов. б) Спектры поглощения 6-аминонафталин-1-супьфамидов в фосфатном буфере измерены на спектрофотометре "Specord
M-40" (ГД Р). E — молекулярный коэффициент поглощения, моль, л см ).
Данные относительной интенсивности флуоресц .Иции и спектры поглощения приведены в табл.2.
Из табл.2 видно, что относительные интенсивности флуоресценции детектируемых групп новых субстратов составляют (410-860), в то же время у аналогов они колеблются в интервале (9-26).
Использование новых соединений в качестве субстратов для флуоресцентного анализа пептидаз иллюстрируется примером 3.
Пример 3. Гидропиз бромгидрата
6-(N -бензилоксикарбонил)-аргиниламиноа нафталин-1-диэтилсульфамида (12) тромбином.
К 1,8 мл 1 мкМ раствора бромгидрата 6-(Ка -бензилоксикарбонил)аргиниламинонафталин-1-диэтилсульфамида в 0,02 М трис-HCt буфере, рН 7,4 0,15 М NaCt, помещенного в кювету флуориметра и термостатированного при 25 С, добавляет 200 мкп
1 мкМ раствора бычьего тромбина в том же буфере. Наблюдают рост флуоресценции, фиксируя время, в.течение которого в растворе образуется 0,1 мкМ концентрация 6аминонафталин-1-диэтипсульфамида, т,е, время 10%-ного гидролиза субстрата (12), которое равное 165 мин.
Аналогично проводят гидролиз других субстратов. Для этого используют следующие пептидазы: 1) Тромбин (Lundblad, R.l .
et аl Methods Enzymot., 1976, v. 45, р. 156), 2) плазмин (Kabi Vf torum, Stoct:holm, Явебеп)б
3) фактор Xa (Krfchnasvvamy, S, et а(. J, В1о1, Chem., 1987, v. 262, р. 3291), 4) АПС (активированный протеин С) (Kiscet; W, et а1.
Methods Enzymof„1I981, к 80. р. 320), 5) 1806133!
1!
I
2 1 а(Э (1 о !
Р(1
S () 1
М\ 1
» . !!
«!
I (л л л
Ф СЧ л л
С(С3
Ch O
Р1 М м л л
° м л л
С3 О сО м м
М (1
0O а
° ф
« л
00 м
М Р( м
С(00 л в
Ф
X ( м м м м
Ch Ch л в
СО м м
Р1 С !
О О «л л л л а (! С(Р1 М М м м м л л
CO м м
\ о в в a a
-З С(-З
СЧ СЧ С 4
\С а
СЧ СЧ С4,, о л О
С4
О 1 1Р(СЧ
Р1 л а
С
:4 СЧ
С(03
СЧ СЧ с(л л
С4 СЧ С1 tlat
С4 СЧ
Ch л м
С4 м
О(СЧ
% в, л
3 о \
СЧ СЧ б
С4 СЧ и
С4 СЧ
О л
СЧ м
С 4
С(СЧ л л
° Ф
С4
»» м
С3 3С3
СЧ СЧ л л
a a с4 C4
Р 00
«0 мъ м л л е 40 Ю в л л
СЧ Р4 М
« « л 00
0 м л
1О а
СЧ С(Ch СО
«С
Я л
СЧ
00 С Р"! О
a. л
СЧ 1СЧ
3С3 Л б м м
О
С 4 ./
CO
0 м
СО л
СЧ (.Ф м
4 б .Ф м м м л а л м л а в 3 3 О
О Ю ch
С(Ch 00
С33 СЧ СЧ
00 л
3 л
Ch
С4
Ъ СЧ л л л
Ch
01 СО Ч СЧ
Ch СЧ л л а
Ch»CO Ch
:Ч СЧ о л
0.3
Ch
СЧ о с1 л. л а
О О
00 Ch
СЧ СЧ О у
° л С Г
Ф
01 0
СЧ С(% л.СС
СЧ л л л сЧ а л в
I °
0 М
\.г
CO СО (СЧ СЧ СЧ л л 00 л л
»
1 .ф
«
СЧ С4
) ( а л
Ф 00
«3 л
Ф «Ф
СЧ СЧ м с3 «л л а
C4 - СЧ
» 0 б
«
С0 СО 00
Ф 3
С 4 СЧ СЧ О О а л
СЧ ч .Ф
00 СО 3Ф
СЧ C4
СЧ а
СЧ
Ф л
«
С4 м л
Ф
Ch
1С
СЧ
СО м
О\
»4
О О
СЧ С 4
С(СО
СЧ СЧ « О 00
Ю Е О
С(О и о ч
1 С(Ch O
С(и
Р\
О 1 л о ю
00 Л о ю о о о
00 00 СО о. о о
СЧ
00 00 л о о
1 о о О а»
1 О м л л б Ф а .+ о О л и л л eel
0 л 00
С( х х х л1 111 д
u u u
° л сл сп х х
-а
u u
° «u
Ь3
С! И (С( х и
1 ((0 &
Я
X О I ((1
Х
1 х
S Э хН
Э C-.
"Т L о О
3 L
9,R ф 1-!
Оа О (- х, X
S О, Ы c(."
X S
I»
Э 03
X «Э а. л
Э Ц
>) а
11
Cl а
C»I
I
I
1
I (1
1
1 !
1
1
I
I
I 1
1 1
1 1
1 3
1 3
I 1
l 1
1 2 1 (CI. I
l Э
О 1
1 Р) I (S 1
I 1 1
1 О 1
I е»
I
I ! 1
1
I
1
1
t .I
1
1 г ! Ъ
I Л: о
1 (. 1 .
4 (= о т
Ы,1
2; 1 т
С4 I
О l >
m. 1 ! ! ш
1 а
1 Е
I X
1 (у ! (1 Э
I X ! Х
1 Э
1 2Г о с
I L о
1
I (I Т 1
1, I
l 1 I (3 !!
3. «71 а
I Э 3 — — -1
1 X 1
О 1
1 (13 I .1
I X (1!
1 I Z 1
С «
1 1
1 1
I 1 I
Ч(1 3 (-«
1 1
I 0 1 а!
Э LI
3 X I о (1 C0 I 1
1 S I Х
1 1 1 1 ! О I C« I ! «1 (I 1
«
I I ! 1 ! (1 (3 I
Ь3
1 FCI 1
1 1
1 I
11
I 1
I 1
1 I
1 л I
I CCI I
1 (I 3
I 1 л х х х х х х х х
1806133
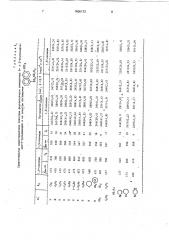
Таблица 3
Время (мин) 103-ного гидролиза соединений формулы I различными протеазами
О р Н41.g(N-Z) НВГ
502МР,1Д
Протеазы
120 2520
34 3040
15 2510
660 . 1810
270 !540
Н
30
220 3120
50 2220 1260 4810
34
28 1460
17
200 3160
1280 14510
33
Н
45
43 1930
2520 7240
30
55
Н
Н С О 17
12 270 19 510
200 1 160 2110 13240
1080 2110 3120 13410
Н
СНз
СН и ь
NR) Йу
Сд115
6540 13360
6640 13!70
3340 13300
360 1760
813 !420
171 1710
20
76
3Е
Все протеазц получены из Вермонтского университета (ClJA) Редактор Т.Егорова
Заказ 962 Тираж Подписное ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР
113035, Москва, )К-35, Раушская наб., 4/5
Производственно-издательский комбинаT "Патент", г. Ужгород, ул.Гагарина, 101
СИЗ
С,Н
СЗН7 " 3 7
С1Н9
1 С4НЯ
""Ñ4ll9
С Н !
Тромбин Фактор АПС Плазмин Уроки- TAll
Ха наза
8 550
17 2470
° 45 1310
12 510
12 1040
Составитель P.Ïoøêåíå
Техред М.Моргентал Корректор M.ÀHäðóøåíêo