Штамм гибридных культивируемых клеток mus мusсulus l., используемый для получения моноклональных антител к м @ зависимой днказе хроматина печени крыс
Иллюстрации
Показать всеРеферат
Использование: биотехнология, молекулярная энзимология. Сущность изобретения: получение штамма гибридных культивируемых клеток Mus musculus L., продуцирующего моноклональные антитела (МКА) к Мп -зависимой ДНКазе хроматина печени крысы. Штамм получают гидридизацией спленоцитов мышей линии Balb/c и клеток миеломы NS/1 - Ад 4.1. Титр МКА в культуральной жидкости, определенный с помощью иммуноферментного анализа, составляет 1:8, в асцитной - 1:10 .МКА связывают Мп2+-зависимую ДНКазу, при этом они способны ингибировать нуклеазную активность данного фермента. 2 табл.
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
ГОСУДАРСТВЕННОЕ ПАТЕНТНОЕ
ВЕДОМСТВО СССР (ГОСПАТЕНТ СССР) ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ (21) 4926897/13 (22) 09,04.91 (46) 15,04.93. Бюл. М 14 (71) Казанский государственный университет им, В.И.Ульянова-Ленина (72) М,M.Áåëîâà, Л,Я.Махмутова, Е.Ю,Котляр, Г.А.Шапиро, Ф.M.Õàìàäå и В,Г,Винтер (54) ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК MUS MUSCULUS („ИСПОЛ Ь- .
ЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ
МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К Мп -ЗАВИСИМОЙ ДНКазе ХРОМАТИНА ПЕЧЕНИ
КРЫС (57) Использование: биотехнология, молекуИзобретение относится к биотехнологии и может быть использовано в молекулярной энзимологии, а также для получения гомогенных препаратов Мп -зависимой
2+
ДНКазы, хроматина печени крыс методом аффинной хроматографии, Штамм гибридных культивируемых клеток Mus musculus L. получают следующим образом.
В качестве доноров иммунных селезенок используют 8-12-недельных мышей линии Balb/с. Мышей иммунизируют внутрибрюшинно и подкожно нейтральной
Мп -зависимой ДНКазой хроматина пече2+ ни крыс с удельной активностью 600 ед/мг.
3а три дня до гибридизации животным вводят высокоочищенный препарат фермента с удельной активностью 2358 ед/мг. Культуру клеток миеломы мыши NS/1-Ag.4.1,. у,которой потеряна способность к синтезу собственных иммуноглобулинов, получают из
„„. Ж„„1808872 А1 лярная энзимология. Сущность изобретения: получение штамма гибридных культивируемыхых клеток Mu s mu sculu s продуцирующего моноклональные антитела (MKA) к Мп -зависимой ДНКазе хромэтина печени крысы, Штамм получают гидридизацией спленоцитов мышей линии Balb/c u клеток миеломы NS/1 — Ag 4.1, Титр MKA в культуральной жидкости, определенный с помощью иммуноферментного анализа, составляет 1:8, в асцитной — 1:10 . МКА связы5 вают Мп -зависимую ДНКазу, при этом они способны ингибировать нуклеазную активность данного фермента, 2 табл. коллекции институ i а Цитологии А. СССР, - Клетки культивируют на "полноценной" среде следующего сос1ава: 1 литр исходной а среды RPNi — 1640, 2 г йаНСОЗ, 110 мг (р пирувата натрия, 15% нативной эмбриональной телячьей сыворотки, 2 мМ L-глугамина, 10 мМ НЕРЕ$, 50 мг гентамицина, 10
ММР-меркаптоэтанола, 5 10 ед/мл инсулина. Клетки. в течение трех недель выращивают на "полноценной" среде в присутствии
20 мкг/мл 8-азагуанина для освобождения ет предшествующих ревертвнтсв. 3а три дня до гибридизации клетки переводят на д
"полноценную" среду без 8-азагуанина. Для гибридизации монослой миеломных клеток, находящихся в логарифмической фазе роста, смывают "полноценной" средой без сыворотки. Подсчет клеток ведут в камере
Горяева. Количество жизнеспособных клеток определяют при окрашивании 0,5%-ным раствором трипанового синего. Слияние
1808872 клеток миеломы с иммунными спленоцитами проводят по методу Келера и Милстейна с помощью полиэтиленгликоля, Селезенку иммунизированного животного промывают
2-3 раза "полноценной" средой без сыворотки и переносят в стеклянный гомогенизатор, Тремя осторожными давительными движениями получают суспензию клеток.
После оседания крупных частиц собирают полученную суспензию клеток и смешивают с миеломными в соотношении 2 10 спле7 ноцитов и 1 10 миеломных. Клетки осаж7 дают центрифугированием в течение 10 минут при 800 g. Затем по каплям добавляют 2 мл 50%-ного раствора полиэтиленгликоля (молекулярная масса 1540), приготовленного на "полноценной" среде, но без сыворотки и НЕРЕЯ. После мягкого перемешивания в течение минуты, приливают "полноценную" среду(50 мл) и центрифугируют 10 минут .при 800 g. Полученный осадок заливают "полноценной" средбй.
Суспенэию клеток оставляют на 12 часов в термостате. Затем "полноценную" среду заменяют на селективную среду HAT — "полноценную" среду, содержащую 10 мол/л гипоксантина, 1,6 10 мол/л тимидина, 4 10 мол/л аминоптерина — и раскапывают в 96-луночные панели с питающим слоем, из перитонеальных макрофагов мыши. Клетки выращивают в 5%-ной атмосфере СО2 при 37 С. На 14-ый день появляются первые колонии гибридом, супернатант этих лунок исследуют на присутствие моноклональныx антител путем иммуноферментного анализа.
Далее путем клонирования осуществляют выделение стабильных клонов гибридных клеток, Клетки из тех лунок, супернатант которых дает положительный результат в ИФА, используют для клонирования и реклонирования. Для этого клетки, находящиеся в середине логарифмической фазы роста, разводят свежей "полноценной" средой и рассевают в новую панель иэ расчета 1 клетка на лунку. Предварительно в эти панели рассевают питающие клетки. Клонирование проводят трехкратно, так, чо 60% клонов дают положительный ответ при исследовании методом ИФА. Клоны, дающие положительный результат в ИФА и ингибирующие активность ДНКазы в системе In vitro, выращивают в сосудах Карреля.
Полученный штамм обозначают 4Е, он хранится в Специализированной коллекции перевиваемых соматических клеток позвоночных Института цитологии АН СССР под номером 530Д и характеризуется следующими признаками.
Культуральные признаки, Среда RPMI — 1640 с 10% телячьей эмб5 риональной сыворотки, 2 мМ L-глутамина, 50 г/л гентамицина, 10 MM 2-меркаптоэтанола, 5 10 ед/мл инсулина. Клетки вырэ-з щивают при 37 С в 5%-ной атмосфере СО2 на стеклянной или пластиковой культуральной посуде. Посевная доза 5 10 кл/M/1.
Пассажи проводят каждые 2-3 дня с кратностью рассева 1;5. Для получения асцитной жидкости 5-7 10 клеток вводят перитониб ально мышам Bali/с, сенсибилизированным пристаном. Опухоль развивается через
7-10 дней.
Криоконсервирование.
Клетки штамма ресуспендируют в среде
RPNI с 45% эмбриональной телячьей сыворотки в присутствии 10% ДМСО, оазливают в пластиковые ампулы по 4-6 10 клеток в 1 мл, Размораживание.
Быстро при 37 С клетки разводят в 10
25 мл полноценной среды и осаждают, ресуспендируют в 5 мл той же среды и переносят в культуральный флакон. Выживамость после размораживания более составляет более 30%.
Контаминация, Бактерии и грибы sк;ультуре не обнаружены при длительном наблюдении и посевах на питательные среды.
Характеристика полезного продукта.
Моноклональные антитела связывают
2+
Мп -зависимую ДНКазу, при этом они способны ингибировать нуклеазную активность данного фермента. Титр МКА в культуральной жидкости, определенный с
40 помощью ИФА, составляет 1:8, в асцитной жидкости — 1. 10, 5
Пример 1, Для определения специфического взаимодействия моноклональ + ных антител с Мп -зависимой ДНКазой
45 проводят определение нуклеэзной активно2+ сти Мп -зависимой ДНКазы в присутствии антител, Нуклеазную активность определяют спектрофотометрически. В работе используют реакционную смесь следующего состава (общий объем 200 мкл);100 мкг денатурированной нагреванием ДНК из тимуса теленка, 20 MM трис HCI буфера рН 7,2, 25 мМ Mn . Bo все пробы добавляют по 20
2+ мкл препарата ДНКазы, инкубированной в
55 течение 30 минут при 37 С с моноклональными антителами. Контролем служат пробы, где фермент инкубируют без антител. Затем реакционную смесь с ферментом инкчбируют при 37 С в течение часа. Реакцию оста1808872
40
55 навливают добавлением 3,8 мл 3% НС10 на холоду. Осадок кислотнонерастворимых продуктов удаляют через 15 мин центрифугированием при 7000 g в течение 15 мин. В надосадочной жидкости прирост кислоторастворимых продуктов определяют на спектрофотометре по поглощению при 260 нм. 3а единицу активности фермента принимают изменение оптической плотности /E26o/ реакционной смеси за 1 ч инкубации в пересчете на 1 мл ферментного препарата (ед/мл).
Удельную активность определяют как отношение числа единиц активности ферментного препарата на количество мг белка (ед/мг).
Активность фермента, инкубированного без антител, принимают за 100, а активность фермента, ин куби рова нного в и рисутстви и антител, пересчитывают в пропорции;
100 — активность фермента без антител (Е26о)
Х% — активность фермента с антителами (Е26о)
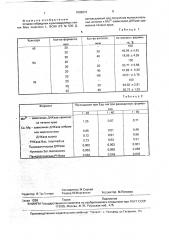
Полученные результаты представлены в табл.1, Для того, чтобы исключить возможность ошибки эксперимента при разведении фермента вследствие внесения в реакционную смесь дополнительного объема жидкости в виде антител, ставят следующие опыты: вместо исследуемых антител в реакционную смесь вносят антитела клонов 5А и 1В, которые дают положительный ответ в ИФА при взаимодействии с ферментатом. Полученные данные тоже представлены в табл.1, Таким образом, результаты полученных исследований показывают, что только клон
4Е является продуцентом антител. которые способны ингибировать активность фермента на 80%. Клоны 5А и 1В, которые дают высокий положительный ответ в ИФА, не способны ингибировать активность изучаемого фермента на 80%, даже при увеличении количества вносимых антител. По литературным данным большего процента ингибирования активности ферментов иммуноглобулинами достигнуть невозможно. Таким образом, из полученных гибридом только клон 4Е отвечает поставленным требованиям — максимальной способностью ингибировать активность
Мп -зависимой ДНКаэы.
Пример 2. Полученные моноклональные антитела используют для изучения иммунохимических свойств нуклеаз (эволюционная биохимия ферментов), В работе.используют ферменты различных эволюционных груп; Мп -зависимую ДНКаэу хроматина печени крыс с удельной активностью2358ед/мг; Са, Mg-зависимуюДНКазу ядер эмбрионов морского ежа с удельной активностью 1278 ед/мг; ДНКазу из ядер эмбрионов вьна с удельной активностью
416 ед/мг; панкреатическую ДНКазу с удельной активностью 4200 ед/мг по Кунитцу; панкреатическую РНКазу с удельной активностью 40 ед/мг по Кунитцу, а также бактериальные нуклеазы. РНКазу
Вас,intermedlus с удельной активностью
12000 ед/мг, и нуклеазу Бег marcescens c удельной активностью 1,5-2,0 10 едlмг.
Для изучения взаимодействия моноклональных антител с различными ферментами применяют метод твердофазного ИФА, т,к. он обладает высокой чувствительностью и позволяет в одинаковых условиях провести анализ сотни проб, В качестве антигена в панель вносят ферменты в различных разведениях, а в качестве антител используют фракции моноклональных антител клона 4Е в разведении 1:2000 (концентрация антител
1,1 мкг/мл).
Моноклональные антитела разводят на
1/-ном БСА в буфере, содержащем 0,01 M трис-HCI, 0,15 М NaCI. 10 М ЭДТА, поскольку при разведении беэ БСА активность. антител резко снижается.
Результаты исследований представлены в табл,2, Как видно иэ таблицы, моноклональные антитела к Мп -зависимой ДНКазе хрома2+ тина печени крыс связываются с этим ферментом; Са, Mg-зависимой ДНКазой ядер эмбрионов морского ежа, нуклеазой эмбрионов вьюна и РНКазой Вас11Ьз intermedius, но не связываются с панкреатической
ДНКазой, нуклеазой Ser.marcescens и панкреатической РНКазой, На основании полученных данных можно сделать вывод о наличии сходных антигенных детерминант у трех из семи исследованных ферментов.
Способность моноклональных антител распознавать ферменты с высокой степенью специфичности используется для решения ряда проблем молекулярной генетики и эволюционной. биохимии, Интересно отметить, что в 60 случаев детальное изучение ферментов с помощью моноклональных антител показало, что последние существуют в мультимолекулярной форме. Можно предположить что изучаемый авторами фермент Мп -зависимая
ДН Каза хроматина печени крыс существует в такой форме, Но этот вопрос еще подлежит дальнейшему изучению. Используя моноклональные антитела, можно проводить исследования в эволюционном плане, следя за появлением и изменением содержания изучаемого антигена в клетке при развитии организма или клеточном цикле, наблюдая за миграцией антигена e,ïðåäåëàõ клетки и всего организма.
1808872
Ф о р м у л а и з о б р е т е н и я используемый для получения моноклональ2+
Штамм гибридных культивируемых кле- ных антител к Мп -зависимой ДНКазе хроток Mus musculus L. ВСКК (П) N 530 Д, матинэ печени крыс.
Таблица 1
Таблица 2
Составитель M.Ñåðîâà
Редактор B.Тр ., бченко Техред M,Моргентал Корректор M.Ïåòðîâà
Заказ 1258 Тираж Подписное
ВНИЙПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР
113035, Москва, Ж-35, Раушская наб., 4/5
Производственно-издательский комбинат "Патент", г. Ужгород, ул.Гагарина, 10