Способ выделения птеринового кофермента ферментной системы необратимого окислительного дезаминирования l-глютамата
Иллюстрации
Показать всеРеферат
Использование: в биохимии и энзимологии. Сущность изобретения: способ выделения птеринового кофермента ферментной системы необратимого окислительного деззминирования L-глютамата. Семена злаковых и бобовых растений экстрагируют водой при массо-обьемном соотношении 1:1-10, гомогенат центрифугируют, очищают гель-хроматографией на заряженном ионообменнике типа QAE-сефадекс или адсорбционной хроматографией на окиси алюминия. 9 фиг.
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
ГОСУДАРСТВЕННОЕ ПАТЕНТНОЕ
ВЕДОМСТВО СССР (ГОСПАТЕНТ СССР) ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ (21) 4789209/04 (22) 05,02.90 (46) 23.04.93. Бюл. М 15 (71) Институт молекулярной биологии и биохимии им. M.À.Àéòõîäèíà (72) M.Ê.Ãèëüìàíîâ, Г,А.Шалахметова и
Е,А.M иронов (56) Диксон М., Уэбб Э, Ферменты. т, 1, кл.
1ll Выделение ферментов 1982. — M.: Мир, с, 45 — 81. (54) СПОСОБ ВЫДЕЛЕНИЯ ПТЕРИНОВОГО КОФЕРМЕНТА ФЕРМЕНТНОЙ СИСТЕИзобретение относится к способу выделения нового биологически активного соединения — птеринового кофермента ферментной системы необратимого окислительного дезаминирования L-глютамата, который может найти применение в знзимологии и биохимии, Поставленная цель достигается опись|ваемым способом выделения птеринового кофермента ферментной системы необратимого окислительного дезаминирования L-глютамата, заключающийся в том, что семена злаковых и бобовых растений зкстрагируют водой при весообъемном соотношении 1:1-10, гомогенат центрифугируют, очищают гель-хроматографией на декстрановых гелях с последующей ионообменной хроматографией на заряженном ионообменнике типа
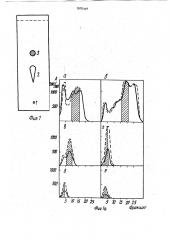
QAE-сефадексе или адсорбционной хроматографией на окиси алюминия, На фиг, 1а — изображена последовательная гель-хроматографическая очистка фак° тора на: а — сефадексе G-50: б — сефадексе
G-15; в, r — молселекте 6-10; д, е — сефадексе 6-10. (Адсорбция при 280 нм — сплошная.,.Я2 181038у А1 (я)ю С 12 N 9/00, G 01 N 7/20
МЫ НЕОБРАТИМОГО ОКИСЛИТЕЛЬНОГО
ДЕЗАМИНИРОВАНИЯ L-ГЛК)ТАМАТА (57) Использование: в биохимии и энзимологии. Сущность изобретения: способ выделения птеринового кофермента ферментной системы необратимого окислительного дезаминирования L-глютамата. Семена злаковых и бобовых растений экстрагируют водой при массо-обьемном соотношении 1;1-10, гомогенат центрифугируют, очищают гель-хроматографией на заряженном ионообменнике типа ОАЕ-сефадекс или адсорбционной хроматографией на окиси алюминия. 9 фиг. линия, при 260 нм — пунктирная линия; фракции, содержа:цие фактор — заштрихованы); на фиг. 1 — тонкослойная хроматография гидролизованного фактора в системе растворителей: бутанол-уксусная кислота-вода (4:1:1), здесь 1 — старт, 2— аминокислотный компонент, 3 — флюоресцирующий комйонент; на фиг; 2 — спектр флюоресценции фактора: 1 — спектр возбуждения; 2 — спектр эмиссии; фиг. 3 — И К-спектр фактора: на фиг. 4 — дифференциальный спектр фактора; на фиг. 5 — тонкослойная хроматография фактора и птериновых соединений, окисленных перманганатом калия:
1 — 6-птерин карбоновая кислота, 2 — зритроптерин, 3 — фактор (в системе растворите-, лей: А — пропанол-аммиак (2:1), Б бутанол-уксусная кислота-вода (4:1:1); на фиг. 6 — тонкослойная хроматография фактора (пятно 2) и эритроптерина (пятна 1, 3), окисленных перманганатом калия (в системах растворителей: А — пропанол-аммиак (2;1), Б — бутанол-уксусная кислота-вода (4;1:1); на фиг, 7 — полерография неокислен1810389 ного эритроптерина; на фиг, 8 — полярография неокисленного кофермента; на фиг. 9— полярография кофермента и эритроптерина, окисленных перманганатом калия в щелочных условиях. 5
Пример 1. 50 г зерна пшеницы сорта
Саратовская 29 растирают в дистиллированной воде в соотношении 1:1 (масса семян к объему дист. воды) — выход кофермента в таком соотношении составля- 10 ет 10, при экстракции зерна пшеницы в соотношении 1:5, выход кофермента — 95 ; экстракция семян в дистиллированной воде в соотношении 1:10 — выход кофермента составляет 15 . Затем гомогенат центрифу- 15 гируют при ускорении силы тяжести, равной 1000 g, выход кофермента составляет
15 ; при ускорении силы тяжести, равной
8000 g, выход кофермента составляет 75 ; а при ускорении силы тяжести, равной 20
10000 g, выход кофермента составляет 95 .
В дальнейшем надосадочную жидкость подвергают гель-хроматографии на колонке с сефадексом G — 50, Как показано на фиг. 1а, фракции содержащие коферментную активность, заштрихованы. Следующим этапом очистки кофермента явилась ступенчатая хроматография на анионообменнике QAEсефадексе А-50, фракции содержащие кофермент объединяют и выпаривают досуха. 30
На последней стадии очистки кофермента используют адсорбционную хроматографию, на щелочной окиси алюминия.
Для работы используют колонку размером
1,2 х 5 см, уравновешенную бидистиллятом. 35
Не связавшиеся с сорбентом вещества сначала элюируют бидистиллированной водой, а затем кофермент элюируют с колонки 0,5 н раствором аммиака. Фракции, содержащие кофермент, обьединяют и выпаривают 40 на вакуумно-роторном испарителе.
Аналогичным образом, как описано в примере 1, выделяют кофермент из элаковых растений (овес; ячмень) и бобовых (сои, гороха, люпина). Выход кофермента зави- 45 сит от взятого соотношения веса растительного материала к объему дист. воды (примеры приводятся ниже).
Пример 2. Выделение кофермента из овса. 50
Соотношение массы к объему 1:I 1:5 1:10
Выход кофермента, 10 90 20
Пример 3. Выделение кофермента из ячменя, 55
Соотношение массы к объему 1:1 1:5 1;10
Выход кофермента, 20 98 40
Пример 4. Выделение кофермента иэ люпина, Соотношение массы к объему 1:1 1:5 1:10
Выход кофермента, 10 87 18
Пример 5. Выделение кофермента из гороха.
Соотношение массы к объему 1:1 1:5 1. 10
Выход кофермента, 7 80 10
Пример 6, Выделение кофермента иэ сои, Соотношение массы к объему 1;1 1:5 1:10
Выход кофермента, 9 85 8
Физико-химические свойства кофермента. Для того, чтобы полностью исключить сомнения о белковой природе кофермента были испытаны каждая аминокислота, из содержащихся в коферменте, в отдельности и в сумме. Ни по отдельности, ни в сумме они не оказывали активирующего действия на "кофермент-чувствительный" фермент. Была проведена тонкослойная хроматография в системе растворителей: бутанол-уксусная кислота-вода (4:1:1) гидролизованного в соляной кислоте кофермента.
Хроматограмма была проявлена нингидрином. Как видно из фиг. 1, на хроматограмме имеются два пятна, одно из которых проявляется нингидрином; а другое — нет. Эти пятная были выделены и испытаны на коферментную активность, Как мы и предполагали, активацию "кофермент-чувствительного" фермента проявляло пятно, не окрашиваемое нингидрином, т.е. вещество неаминокислотной и небелковой природы, При освещении хроматограммы ультрафиолетом наблюдалась интенсивная флюоресценция активного компонента кофермента, Для этого с хроматограммы было выделено флюоресцирующее пятно неаминокислотной природы элюированием бидистиллятом и был снят спектр флюоресценции.
Спектр флюоресценции активного кофермента приведен на рис. 2. Как видно из рисунка, активный компонент кофермента имеет лишь один пик поглощения с максимумом длины волны 330 нм и симметричный ему пик возбуждения с максимумом — 450 нм.
Симметричность пиков свидетельствует о том, что препарат кофермента не загрязнен другими флюоресцирующими веществами.
Так как по спектру флюоресценции невозможно делать выводы о природе активного компонента кофермента, необходимо было провести комплексное его изучение. Был снят спектр ИК-спектр на спектрофотометре "Спекорд" 75 ИР, Из фиг,3, видны выраженные пики в областях 1585. 1395, 1305, 1090, 1045 см . При сравнительном анализе известных стандартных соединений, приве1810389 денных в центре по спектроскопии Института органической химии С0 АН СССР (r.
Новосибирск) было обнаружено некоторое сходство его co спектром 2-амина-4-гидрокси-7-птеридина.
Были изучены ультрафиолетовые и дифференциальные ультрафиолетовые спектры, Кофермент, элюированный с щелочной окиси алюминия анализировали в щелочной (1), кислой (2) и нейтральной (3) среде. На рисунке 4 показан дифференциальный спектр (4) щелочного раствора кофермента (1) относительно кислого (2). Дифференциальный спектр кофермента с максимумом поглощения при 360 нм указывает на его птериновую природу, На основании полученных данных сделан вывод о том, что выделенный из зерна пшеницы коферент, участвующий в реакции окислительного дезаминирования глютамата, относится к классу птериновых соединений, Для того, чтобы определить к каким производным птеринов относится выделенный коферент, было проведено в щелочных.условиях перманганатное окисление кофермента, Для этого используют активный компонент кофермента после тонкослойной хроматографии. Окисление проводят в 0,1 н NaOH в присутствии 0,1 н КМп04, Затем эту смесь прогревают при 100 С на водяной бане в течение 30 минут, После этого добавляют этанол и полученный коричневый осадок отфильтровывают и фильтрат используют для дальнейшей работы, Окисленный препарат кофермента разделяют тонкослойной хроматографией на широкопористых пластинках
"Силуфол" в двух системах растворителей:1) пропанол-аммиак 17; (2:1), 2) бутанол-уксусная кислота-вода (4:1:1). Данный хроматографического анализа щелочного окисления кофермента приведены на рисунке 5. Как видно из рисунка, на хроматограмме имеется пятно, продукт щелочного окисления кофермента в системе: бутанол-уксусная кислота-вода (R 0,23 0,02); пропанол-аммиак 1% (Rt=0,4 0,03).
Данный способ идентификации позволяет провести достоверное разделение и идентификацию соединения, относящихся к
6- и 7-производным птеринам, Для этого параллельно с анализируемым продуктом шелочного окисления кофермента были разделены продукты щелочного окисления синтетических маркеров; 6-птерин карбоновой
5 кислоты, ксантоптерина, 7-метил птерина и
7 производного птерина — эритроптерина.
Как видно из рисунка 6 продукт окисления кофермента имеет одинаковую подвижность с продуктом окисления эритроптери10 на. Это свидетельствует о том, что кофермент относится к 7-замещенным птеринам и по всей вероятности, продукты щелочного окисления кофермента и эритроптерина идентичны и этим продуктом
15 является ксантоптерин-7-карбоновая кислота о а. н и N î КМпО>
| g О,!нища
20 > и ы сн -с-соон н g ц N соон
Данные полярографического анализа кофермента, продукта щелочного окисления кофермента перманганатом калия, 25 эритроптерина, продукта щелочного окисления эритроптерина перманганатом калия (ксантоптерина-7-карбоновая кислота) представлены на рисунках 7 — 9. Как видно из рисунков 7 и 8, поля рографические характе30 ристики неокисленного кофермента и неокисленного эритроптерина не совпадают, хотя после щелочного окисления их лерманганатом калия они имеют идентичные полярографические характеристики, На этом
35 основании сделан вывод, что кофермент, хотя и близок по свойствам к эритроптерину, отличается от него и является 7-замещенным птериновым соединением, 40 Формула изобретения
Способ выделения птеринового кофермента ферментной системы необратимого окислительного дезаминирования L-гпе емата, отл и ча ю щи и с я тем, что семена
45 злаковых или бобовых растений зкстрагируют водой при массообъемном соотношении
1:1-10, гомогенат центрифугируют и очищают гель-хроматографией на декстрановых гелях с последующей ионообменной хрома50 тографией на заряженном ионообменнике типа QAE-сефадексе или адсорбционной хроматографией на окиси алюминия, 1810:м9 l/l
10_#_
ХЮЮФУ5
4Ьг./а 4puwud
1810389
520 560 4Ю ЙУ ФЮ
Ялики Йлны rw фару
1810389
1810389
1810389