Гидроксоантимониты редкоземельных элементов или таллия (iii) и способ их получения
Иллюстрации
Показать всеРеферат
Использование: новые соединения для электронной промышленности; производство резистивных материалов. Сущность изобретения: водный раствор соли редкоземельного элемента контактируют с раствором антимонита калия в 2 к. гидроксиде калия при молярном соотношении 1:1. Осадок отделяют, промывают, сушат. Получается новое химическое соединение - гидроксоантимонит РЗЭ формулы HO-Sfcr04 Ме-ОН, ,...-... ., где Me- La. Sm. Nd, Ib, Gd, Dy, Ho, Er, Tl. 2 с.п, ф-лы, 1 ил., З табл.
„„ДЦ„„1813718 А1
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (5!)5 С 01 F 17/00, С 01 G 15100
ГОСУДАРСТВЕННОЕ ПАТЕНТНОЕ
ВЕДОМСТВО СССР (ГОСПАТЕНТ СССР)
ОПИСАНИЕ ИЗОБРЕТЕНИЯ и- Вммлчс
Ц р
),1 «. "Ф ДЯ . -,;- .;; « влмт y:, К .АВТОРСКОМУ СВИДЕТЕЛЬСТВУ мв
° мт мм Изобретение относится к новым хими-. бавляют 26,3 г (0,1 моль) антимонита калия. Ф ческим соединейиям, а именно гидроксоан-... Содержимое перемешивают до полного тимонитам РЗЭ и таллия (1И), которые могут: растворения антимонита калия. Затем прМ-. быть использованы в электронной промыш- ливаат водный раствор, содержащий 44,4 г ленности при производстве резистивных .. — (0,1 моль) нитрата самария и перемеШив®от . материалов, для приготовления катализато- 5-10 мин. Выпавший осадок п®реиосят нэ ров на их основе. -::: .. . :: .фильтр, промывают 200 мл дистиллироаэн- . 6д
Цель изобретения — создание новых со- . ной воды и сушат на воздухе. с, " единений — гидроксоантимонитов РЗЭ и . Выход 33,7 r(90®). таллия (ill), которые могут быть испол ьзова- Полученный продукт поданным химиче- ©ф ны в качестве составляющего продукта при ского анализа (Sb 34,28, Зв 42,027ь, КзО получении реаистивнмх материалов. 10,1 )прелставляетсоооавнтимонитсамаПредложенные соединенйя получают рия ЯаЯЬОз . 2Н20, . путем смешения раствора антимонита ка-: Целесообразностьвыбранныхпараметлия в 2 н. растворе гидроксида калия с рас- ровйроцессаобосновыааетсярезультатами твором соли соответствующего элемента проведенныхисследований,которыеприве(преимущественно нитратом) при малярном дены в табл.1. соотношении компонентов 1:1 с последую- Из табл.1 видно, что изменение молярщим отделением, промывкой и сушкой про- ного отношения компонентов в сторону как дукта, уменьшения, так и увеличения не позволяет
Пример 1, .В реакционный сосуд получить однофазный гидроксоантимонит помещают 200 мл 2 н. раствора КОН и при1 (21) 4864932/26 (22) 10.09.90 (46) 07.05.93. Бюл. hb 17 (71) Всесоюзный. научно-исследовательский институт реактивов и химически чистых материалов для электронной техники (72) Н,Млйалеха, В.П.Карлов, Г;Н.бутузов и
Н.Г. Кисель (56) Насонова С;Н. и др. Получение и неко-. торйе свойства стибитов РЗЭ.
)Курнал неорганической химии, 1973; в.
8, с. 2068-2071. (54) ГИДРОКСОАНТИМОНИТЫ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ ИЛИ ТАЛЛИЯ (И1) .
И СПОСОБ ИХ ПОЛУЧЕНИЯ
2 (57) Использование: новые соединения для, электронной прамйшленйости, производство резистивных материзлоав Сущность изобретения водный раствор соли редкоземельного элемент® контри e раствором аитимонита калия а 2 н. гидроксиде калия при молярном соотнойвним
1:1. Осадок отдещиот, проймет, сушат, Получается новое химическое соединение— гидроксоантимонит РЗЭ формулы нО-Ьь а-он, где Me-(.а. Sm, Nd,!Ь,ad, Оу, Но, Ег, Tl.
2 с.п. ф-лы, 1 ил., 3 табл.
181371 8 как индивидуальный продукт (примеры 4 и
5).
Использование раствора гидроксида калия с концентрацией менее 2 н. не только удлиняет процесс за счет увеличения времени растворения антимонита калия в КОН, но и не позволяет в конечном итоге получить продукт в чистом виде (пример 2).
Повышение концентрации гидроксида каля выше 2 н. нецелесообразно, так как ведет к ненужному его перерасходу и удлинению времени отмывки продукта от избытка щелочи, выход гидроксоантимонита при этом остается неизменным (пример 3), Увеличение времени взаимодействия компонентов не привело к увеличению выхода продукта, следовательно также нецелесообразно (пример 6).
Аналогичным способом получены другие гидроксоантимониты РЗЭ и таллия (lll) (табл,2.).
Индивидуальность и строение полученных соединений доказаны с помощью комплекса методов физико-химического анализа.
Данные химического анализа гидроксоантимонитов РЗЭ и таллия (III) приведены в табл.2. Содержание сурьмы определяли.титрованием 0,1 н. раствором бромата калия, предварительно растворяя навеску соли в
10 мл НС! (1:1); РЗЭ и таллий (III) определяли трилонометрически; наличие воды определяли термогравиметрически, высушиванием навески до постоянной массы при 600 С в атмосфере аргона, Результаты химического анализа показали, что полученные соединения имеют одно и то же отношение
Ме:Sb и могут быть представлены валовой формулой Ме$ЬОз пН20, где n. = 2.
Воздушно-сухие антимониты оказались рентгеноаморфны, прокаленные при 640660 С в атмосфере аргона — переходят в безводные антимониты, рентгенофазовый анализ которых показал, что эти соединения имеют структуру типа флюорита с а = 5,52—
5,34 А, что согласуется с литературными данными. Прокаленные на воздухе антимо-. ниты переходят в соответствующие антимонйтЫ, что йодтвердили данные химического анализа и рентгенофазовых исследований.
Для установления природы синтезированных соединений и получения информации о состоянии воды был использован
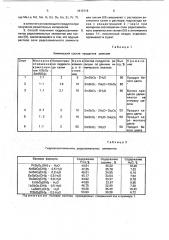
-метод ИК-спектроскопии (UR-20, в таблетках с КВг). На чертеже представлены ИКспектры гидроксоантимонитов РЗЭ и таллия (III). На ИК-спектре воздушно-сухого антимонита самария {кривая I) помимо полос поглощения с максимумом (1640, 3350 см ). обусловленных деформационными колебаниями молекул воды, полосы поглощения, относящейся к валентным колебаниям
Sb-О при 580 см, и полосы поглощения, относящейся к валентным колебаниям Me-Q с максимумом 450 см, отмечены полосы поглощения с максимумом (1100, 1400 см ), наличие которых следует объяснить присутствием в соединении гидроксильных групп.
Отсутствие этих максимумов на ИК-спектре предварительно нагретого до 900 С в атмосфере аргона антимонита самария (кривая 3) подтверждает, что зти полосы поглощения обусловлены колебаниями связей Sb-ОН и ОН, так при нагревании группы
ОН удаляются в виде молекул воды.
Данные термогравиметрического анализа подтвердили индивидуальность пол5
15 твердых растворов, Из табл.3 видно, что используемые при этом cooTBBTcTBóþùèå антимониты обладают менее выраженными резистивными
CBOACTB3MN.
Формула изобретения
1. Гидроксоантимониты редкоземельных элементов или таллия (И1) общей форму50
55 ученных соединений, так как . их термограммы отличались от термограмм ис20 ходных соединений. Все термограммы имели по одному энда- и экзоэффекту.
Эндоэффект с максимумом при 140-160 С связан с удалением гигроскопической воды, а экзозффект при 480-520 С- с окислением
25 сурьмы (ill) в сурьму (/).
Таким образом, на основании полученных результатов можно считать установленным, что полученные соединения являются гидроксоантимонитами РЗЭ и таллия (III) и
30 могут быть представлены формулой
МеЯЬО2(ОН) . пН20, где п 1, Установлена возможность использования полученных гидроксоантимонитов в резистивных материалах на основе оксида
35 олова {И).
Измерения величины электросопротивления порошкообразных образцов показали, что синтезированные гидроксоантимониты
РЗЭ не являются диэлектриками и обладают
40 определенной величиной проводимости(д =
-б -7
=110 10 Омсм). Введениедобавки гидро- . ксоантимонита редкоземельного элемента или таллия к диоксиду олова обеспечивает резкое снижение электросопротивления, 45 что, видимо, обусловлено образованием
1813718 или таллия (И!) смешивают с раствором антимонита калия в растворе гидроксида калия с концентрацией 2 г-экв/л при молярном соотношении соли редкоземель5 ного элемента или таллия (III) и антимонита калия 1:1, полученный осадок отделяют, промывают и сушат. где Ме1 à, Nd, Sm, Ib, Gd, 0y, Но, Ег, Pr, Tl, в качестве составляющего продукта при получении резистивных материалов.
2. Способ получения гидроксоантимонитов редкоземельных элементов или таллия (III), заключающийся в том, что водный раствор соли редкоземельного элемента
Таблица 1
Химический состав продуктов реакции
Концентрация гидроксида калия
П ри мечание
Опыт
Состав продуктов ре- Вых акции по данным хи- од,$ мического анализа
B ремя взаимодействия. мин
Продукт белого цвета
ЯтЯЬО3 . 2НгО
1,9
ЯеЯЬОз . 2HgO+ КЯЬО2 80
ЯглЯЬОз 2HzO
2,1
ЯтЯЬОз 2HzO+ ЯЬ20з 50
ЯГЛЯЬОз . 2Hz0+ Smz03 50
2:1
10
ЯгпЯЬО3 2Н20
Таблица 2
Гидроксоантимониты редкоземельных элементов
Содержание
Н20, Содержание с ьмы, Валовая формула
Содержание
РЗЗ, PrSbO2 (ОН) г Н20
NdSb0g(OH)z 0,5 Н20
GdSbO2(OHjz 0,2НрО .ОуЯЬОт(ОН)г 0,5 Н20
НОЯЬ02(ОН)2 0,8 HzO
ЕГЯЬ02(ОН)2 Н20 ! bSbOz (ОН)2 0,5 Н20 . LaSbOz (OH)2 Н20
TISbOz ОН 0,5 Н2О р и м е ч а н и е .Условия синтеза приведенных соединений как в примере 1.
Молярное отношение компонентов КЯЬО2
:Sm NO3 3
40,51
42,25
45,01
45,17
44,92
44,80
46,75
40,26
50,93
35,22
35,78
34,95
33,94
33,27
32,67
32,99
35,40
30,38
Время процесса удлинняется на отмывку щелочи
Продукт серого цвета
Продукт серо- желтого цвета
Продукт беЛОГО S873
10,40
7,92
6,16
7,52
8,78
9,65
7,30
10,43
6,72
1813718
& 100см fg
)jhHHh. волны
Корректор С.Лисина
Техред M,Ìîðгентал
Редактор
Заказ 1809 Тираж Подписное
ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР
113035, Москва, Ж-35, Раушская наб., 4/5
Производственно-издательский комбинат "Патент", г, Ужгород, ул.Гагарина, 101
Данные по электросопротивлению порошков оксида олова (lY),ëåãèðîâàííûõ соединениями $Ь(!П) и Sb(Y) с Р 3 Э В(Зп02)==5000кОм см