Способ определения гидроксида, карбоната и бензоата натрия в водном растворе
Иллюстрации
Показать всеРеферат
Использование: аналитическая химия. Сущность изобретения: одну пробу анализируемого вещества титруют соля ной кислотой в присутствии хлорида бария, вторую пробу титруют соляной кислотой в среде метанола, или этанола, или пропанола и воды , взятых в объемном соотношении спирта и воды, равном 1.0:(0,4-1,0). 2 табл. СО с
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (sr)s 6 01 N 31/16
ГОСУДАРСТВЕННОЕ ПАТЕНТНОЕ
ВЕДОМСТВО СССР (ГOCflATEHT СССР) ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ПАТЕНТУ (21) 4920269/04 (22) 19.03.91 (46) 23,05.93. Бюл. М 19 (71) Нижнекамское производственное объединение "Нижнекамскнефтехим" (72) Л.Я.Гатиятуллина, Т.И.Ахметова и
Э.И.Галлямова (73) Нижнекамское производственное объединение "Нижнекамскнефтехим" (56) Алексеев В.Н. Количественный анализ, M,: Химия, 1972, с. 300 — 302.
Эшворт М.P.Ô. Титриметрические методы анализа органических соединений.—
IVl.: Химия, 1968, с. 250-373.
Барандес В.З, и др. Комплексонометрический метод определения карбоната натрия в регенерированном растворе гидроокиси натрия. Кокс и химия, 1968, М 7, с, 39.
Изобретение относится к аналитической химии, а именно к способу количественного определения гидроксида, бензоата и карбоната натрия в растворе щелочи с узла нейтрализации эпоксидата производства стирола и окиси пропилена.
Цель изобретения — разработка упрощенного способа раздельного определения гидроксида, карбоната и бензоата натрия в водном растворе.
Указанная цель достигается благодаря тому, что одну пробу анализируемого вещества титруют соляной кислотой в присутствии хлорида бария, вторую пробу титруют соляной кислотой в среде метанола или этанола или изопропанола и воды, взятых в объемном соотношении спирта и воды, равном 1,0:(0,4 — 1,0), „„5U„„1817850 АЗ (54) СПОСОБ ОПРЕДЕЛЕНИЯ ГИДРОКСИДА, КАРБОНАТА И БЕНЗОАТА НАТРИЯ В
ВОДНОМ РАСТВОРЕ (57) Использование: аналитическая химия.
Сущность изобретения: одну пробу анализируемого вещества титруютсоляной кислотой в присутствии хлорида бария, вторую пробу титруют соляной кислотой в среде метанола, или этанола, или пропанола и воды, взятых в объемном соотношении спирта и воды, равном 1,0:(0,4-1,0). 2 табл.
Указанный способ обеспечивает возможность раздельного определения гидрохлорида, карбоната и бензоата натрия в их ОО смеси при аналитическом контроле процесса нейтрализации эпоксидата производства стирала и окиси пропилена. СО
Изобретение осуществляется следую- Ц щим образом.
Пример 1. Т и т р о в а н и е 1, В ячейку для потенциометрического титрования вносят 0,2 — 1,0 г исследуемой пробы, содержащей 2,0-0,02 мас. соединений натрия, Сд приливают 25 см метилового, этилового или изопропилового спирта и такое количество дистиллированной воды, чтобы общий объем воды в ячейке составил 10 см (спирт;вода =- 1:0,4) содержимое ячейки титруют спиртовым раствором соляной кисло1817850 ты с молярной концентрацией эквивалента с (HCI) = 0,05-0,1 моль/дм до получения двух скачков потенциалов. Титрант приливают порциями по 0,1 см, значения потенциалов записывают после приливания каждой порции титранта.
Т и т р о в а н и е 2. В ячейку для титрования вносят 0,2-1,0 г исследуемой пробы, 10 см водного раствора хлорида бария с малярной концентрацией эквивалента (с 1/2
ВаС!2)=1,0моль/дм, перемешивают, приливают 25 см дистиллированной воды и титруют раствором соляной кислоты до получения первого скачка потенциалов, который соответствует концу титрования гидроксида натрия.
Массовую долю гидроксида натрия (Х1), карбоната натрия (Х2) и бензоата натрия (Хз) рассчитывают по формулам
Уа С К 40 (1)
10 ° mz
Y> — Уз m>/mz С К 2 53
Xz—
10 m< (2)
Хз—
t0 mq (3) где Xi, Х2, Хз — массовые доли гидроксида натрия, карбоната натрия и бензоата натрия, соответственно,мас. ;
У1, Уг — объемы раствора соляной кислоты, соответствующие первому и второму скачку потенциалов при первом титровании (в отсутствии хлорида бария), соответственно, см;
Уз — объем раствора соляной кислоты, соответствующий скачку потенциалов в области -230/+20 мВ при втором титровании (в присутствии хлорида бария), см;
С вЂ” малярная концентрация эквивалента соляной кислоты, моль/дм;
m> — навеска пробы, взятая на первое титрование, r; т2 — навеска пробы, взятая на второе титрование, г;
К вЂ” поправочный коэффициент к концентрации раствора соляной кислоты;
40, 53, 144 — эквивалентная масса гидроксида натрия, карбоната натрия и бензоата натрия, соответственно, г;
2, 10 — коэффициенты пересчета.
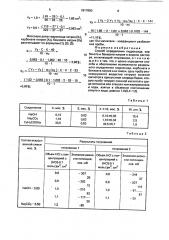
Метрологические характеристики методики определения гидроксида, карбоната и бензоата натрия в промывном растворе производства СОП с поз. H-373 при n = 4 и р-0,95 приведены втабл, 1.
5
20 !
Заявляемый способ содержит часть условий титрования известного способа апределения гидроксида и карбоната натрия, которая заключается в проведении титрования одной из двух порций пробы в присутствии хлорида бария (4). Однако это титрование в сочетании с титрованием другой порции пробы в водной среде не позволяет определять бензоат натрия.
Пример 2, Анализируют искусственную смесь, состоящую из 3,80 ) NaOH, 0,50% NazCOa и 11,0 g CgHsCOONa заявляемым способом.
Т и т р о в а н и е 1. Пробу предварительно разбавляют в 10 раз дистиллированной водой. В ячейкудля титрования вносят 1 см разбавленной пробы, приливают 25 см этилового спирта и добавляют 9 см дистиллированной воды, перемешивают содержимое ячейки и титруют спиртовым раствором соляной кислоты с молярной концентрацией эквивалента с (HCi) = 0,1 моль/дм до получения двух скачков потенциалов. Отмечают объемы титранта, соответствующие скачкам потенциалов (У) и Уг).
Титрование2. В ячейкудля титрования вносят 1 см разбавленной пробы, 10 см раствора хлорида бария с молярз ной концентрацией эквивалентна (с 1/2
BaCiz) = 1,0 моль/дм, перемешивают, при3 ливают 25 см дистиллированной воды и титруют раствором соляной кислоты до получения первого скачка потенциалов. Отмечают объем титранта, соответствующий скачку потенциалов (Уз).
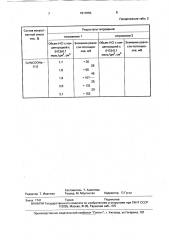
Результаты титрований представлены в табл. 2.
Обьемы соляной кислоты (Y, смз), соответствующие скачкам потенциалов, рассчитывают методом первой производной по формуле:
Y= Y +
2 ЛЕвах ЛE1 — ЛЕ2 (4) где Y — обьем раствора титранта, прилитый до начала скачка потенциалов, смз;
ЛУ вЂ” дозируемый объем титранта вблизи скачка потенциалов, см ;
Л Евах — максимальное изменение потенциала индикаторного электрода в точке эквивалентности, мВ;
Л Е1, ЬЕ2 — изменение потенциала индикаторного электрода до и после ЛЕвах соответственно, мВ.
По формуле (4) рассчитывают У1, Уъ Уа — объемы титранта, соответствующие скачкам потенциалов:
1 p+ (93 -721 01 рр з, 186 — 72 — 28 I817850
10 m>
Уз С К 40
Х
10 П12
10.т1
10 1
-0,60 ;
Таблица 1
Таблица 2 з, Yz = 1,8+ 98 — 28 — 25 - 1,85 см; у kg+ 10- 7-) О," Ору з
220 — 37 — 67
Массовую долю гидроксида натрия (Х ), карбоната натрия (Хг), бензоата натрия (Хз) рассчитывают по формулам (1). (2), (3):
0,963 0,1 1,002 40 10 3 86
10 1
Y> — т з m lmz С К 2 53
Xz—
1,02 -0,963 0,1 1,002 2 53 10
Хз—
Y2 — 2 У1+Уз m1/m2 С К 144
10 1,85 — 2 1,02 + 0,963 0,1002 144
5 10 1
11,15, где 10 в числителе — коэффициент разбавления пробы.
Формула изобретения
Способ определения гидроксида, кар10 боната и бензоата натрия в водном растворе, включающий титрование, о т л и ч а юшийся тем, что, с целью упрощения способа и обеспечения возможности раздельного определения гидроксида, карбоната и бензоата натрия в их смеси, одну пробу анализируемого вещества титруют соляной кислотой в присутствии хлорида бария, вторую пробу титруют соляной кислотой в среде метанола или этанола или изопропанола и воды, взятых в обьемном соотношении спирта и воды, равном 1,0:(0.4 — 1,0).
1817850
Продолжение табл. 2
Составитель Т. Ахметова
Техред М. Моргентал Корректор О, Густи
Редактор Т. Иванова
Производственно-издательский комбинат "Патент", г. Ужгород, ул.Гагарина. 101
Заказ 1741 Тираж Подписное
ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР
113035, Москва, Ж-35, Раушская наб., 4/5