Способ определения микроколичеств тяжелых металлов
Иллюстрации
Показать всеРеферат
Использование: аналитическая химия, а именно способы определения микроколичеств тяжелых металлов в анализируемых образцах, в том числе в природных и сточных водах, почвах и т. д., а также пищевых продуктах. Сущность изобретения: электрохимически определяют тяжелые металлы с помощью ферментного электрода на основе иммобилизованной холинэстеразы, причем используют активирующее действие на иммобилизованную холинэстеразу микроколичеств ионов Tl(l), Hg(ll), Pb(ll), Cd(ll). Чувствительность определения составляет для талия 10 моль/л, для ртути 10 моль/л, для свинца 10 9 моль/л и для кадмия 510 моль/л. Время определения 30 мин. 2 табл.
COIO3 СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (я)э G 01 N 27/48
ГОСУДАРСТВЕ1+1ОЕ ПАТЕНТНОЕ
ВЕДОМСТВО СССР (ГОСПАТЕНТ СССР) ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ (21) 4839153/25 (22) 14.06.90 (46) 23.06.93. Бюл. 1я 23 (71) Казанский государственный университет им. В. И. Ульянова-Ленина (72) Э. П. Медянцева, С, С. Бабкина, Г. К. Будников. И. Л. Федорова и М. Г. Вертлиб (56) Долманова И. Ф. и др. Кинетическое определение микроколичеств ртути с использованием фермента пероксидаэы,—
ЖАХ, 1979, М 8, т, 34, с. 1644 — 1647, Аналитическая химия ртути; Серия
"Аналитическая химия элементов". М., Наука, 1984, с. 228.
Полянский Н, Г. Свинец: Аналитическая химия элементов M.: Наука, 1986. с. 375.
Бабкина С. С. и др, Вольтамперометрическое изучение влияния ионов металлов нэ каталитическую активность иммобилизованной холинэстераэы" Тез докл. III Bcec. конф. по электрохимическим методам анализа, Томск, 1989, 47. с.
Авторское свидетельство СССР
ЬВ 1296913, кл. G 01 N 27/30, 1987.
Браунштейн А. В, Ферменты. — М,: Наука, 1964, с. 207.
Изобретение относится к области аналитической химии, а именно к способам определения микроколичеств тяжелых металлов в анализируемых образцах, в том числе в природных и сточных водах, почвах и т. д.. т,е. в обьектах окружающей среды, а также в пищевых и сельскохозяйственных продуктах.
Целью изобретения является увеличение чувствительности определения ионов
Tl(I) в области концентраций от 1 10 до 1х х10 моль/л, Hg(ll) от 5 10 до 1 10
„, ЯЦ„„1822971 А1 (54) СПОСОБ ОПРЕДЕЛЕНИЯ МИКРОКОЛИЧЕСТВ ТЯЖЕЛЫХ МЕТАЛЛОВ (57) Использование: аналитическая химия, а именно способы определения микроколичеств тяжелых металлов в анализируемых образцах, в том числе в природных и сточных водах, почвах и т. д., а также пищевых продуктах, Сущность изобретения: э ектрохимически определяют тяжелые металлы с помощью ферментного электрода на основе иммобилиэованной холинэстеразы, причем используют эктивирующее действие на иммобилиэованную холинэстеразу микроколичеств ионов Tl(I), Hg(II), Pb(ll), Cd(II).
ЧувствительносТь определения составляет для талия 1О моль/л, для ртути 10
-1 моль/л, для саиица10 моль/л и для кадмия
5 10 моль/л. Время определения 30 мин. 2 табл. моль/л, Pb(ll) от 1 10 до 1 10 моль/л и
Cd(ll) от 1. 10 до 5 10 моль/л, т.е. воэможность определять эти ионы в области концентраций от 1 10 до 1 10 моль/л.
-12
Поставленная цель достигается путем электрохимического определения данных тяжелых металлов в указанном интервале концентраций с помощью ферментного электрода на основе иммобилизоеэнной холинэстераэы, причем используется не ингибирующее, а активирующее действие на иммобилизованную холинэстераэу микро1822911 количеств ионов TI(l), Hg(ll). Pb(ll) и Cd(ll). что выражается в увеличении высоты катодного пика при потенциале -0.55 В по срав- нению с контрольным опытом в отсутствие ионов тяжелых металлов. На вольт-амперог- 5 раммах БТХИ на ферментном электроде наблюдается пик при потенциале -0,55 В относительно нас.к.э., причем высота вго . зависит от активности биосенсорной части ферментного электрода, которая, в свою очередь, зависит от присутствия в растворе ингибиторов или активаторов ХЭ. При введении в исследуемый раствор ионов ряда тяжель(х металлов в области концентраций
1 10 -1 10" моль/л для Tl(l), 5 10 -Iх 15 х10 моль/л для Hg II), 1 10 — 1 10Я моль/л для Pb(ll), 1. 10 5 10 моль/л для
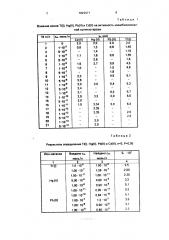
Cd(ll) соответственно ток в пике при потенциале -0,55 В возрастает по сравнению с контрольным опытом в отсутствие ионов ме- 20 таллов, т.е. наблюдается активация иммобилизованной ХЭ (табл. 1). В этих условиях образуется, по-видимому, тройной фермент-металл-субстрат комплекс. в котором металлу приписывается роль "мостика", связывающего фермент с субстратом и удерживающего таким образом субстрат около активного центра фермента, Укаэанные выше области концентраций являются оптимальными. В табл. 1 приводятся ре- З0 зультаты, позволяющие обосновать оптимальный интервал определяемых концентраций, При более высоких концентрациях ионов тяжелых металлов имеет место их ингибирующее действие на З5 иммобилизованную ХЭ (см. табл, 1), при этом наблюдается уменьшение высоты пика при потенциале — 0,55 В, например, позиции
3. 4 в табл. 1 по сравнению с контрольным опытом (позиция 1 в табл. 1). При концент- 40 рациях ионов указанных металлов ниже оптимальных, они не влияют на каталитическую активность ХЭ, что приводит к отсутствию изменения высоты катодного тика при потенциале -0,55 В (см. табл. 45
1), например, позиции 14 и 15 для Cd(ll), 20 и 21 для Hg(ll) и т.д. В указанных оптимальных интервалах концентраций высота пика зависит от концентрации ионов тяжелых металлов в ячейке (см. табл. 1).
Способ определения осуществляется следующим образом.
Ферментный электрод погружают в исследуемый раствор, содержащий ионы определяемых металлов, выдерживают 15»
2 мин, промывают водой и переносят в электролитическую ячейку с боратным буферным раствором и раствором субстратабутирилтиохолин иодида. Раствор термостатируют при 25+0,2 С, продувают током водорода или аргона и регистрируют вольтамперограмму в интервале потенциалов от -0,1 до 0,8 В. Минимальный объем анализируемого раствора 4-5 мл, Измеряют увеличение высоты катодного тика по сравнению с контрольным опытом в отсутствие ионов исследуемых металлов.
Существенными отличиями способа является использование активирующего действия на ИХЭ ионов таллин, свинца, ртути и кадмия в определенном интервале концентраций, что позволяет значительно повысить чувствительность определения.
Нижняя граница определяемых концентраций для таллия составляет 10 моль/л, для ртути 10 моль/л, для свинца 10 9 моль/л
5 10 моль/л кадмия.
Изобретение осуществляется следующим образом, П р и ч е р 1, Построение градуировочного графика для определения микроколичеств ионов ртути.
Ферментный электрод помещают в стандартный раствор, содержащий ионы ртути (И) на 15 мин, Для этого к объему от 4,5 до 5 мл бидистиллированной воды приливают от 1 мкл (маленькие объемы отмеряли микрошприцем на 10 мкл) до 0,5 мл стандартного раствора соли металла соответствующей концентрации. Затем ферментный электрод промывают водой и помещают в электролитическую ячейку с нас. к, э„содержащую 0,5 мл стандартного раствора БТХИ с концентрацией 0,006 г!мл и 4,5 мл боратного буферного раствора с рН
9,05. Удаляют кислород продуванием в течение 15 мин (время достижения равновесия реакции гидролиза должно быть постоянным во всех определениях) аргоном или электролитически генерированным водородом, Снимают вольтамперограммы в интервале потенциалов от -0,1 до -0,8 В при скорости наложения потенциала 1 В/с при непрерывном режиме поляризации с треугольной разверткой потенциала. Измеряют высоту катодного пика при потенциале0,55 В. Строят градуировочную прямую, выражающую зависимость высоты катодного пика от отрицательного десятичного логарифма концентрации иона металла.
Определение неизвестной концентрации ртути (! 1).
Ферментный электрод помещают в Нсс ледуемый раствор соли ртути (1!) на 15 2 мин.
Затем ферментный электрод промывают водой и помещают в электролитическую ячейку с нас. к. э., содержащую 0,5 мл стандартного раствора БТХИ с концентрацией
1822971
0.006 гlмл и 4,5 мл боратного буферного раствора с рН 9,05 Все дальнейшие операции проводят как описано выше. По высоте пика при потенциале -0,55 В и градуировочному графику определяют концентрацию ионов ртути (II). Градуировочный график для определения микроколичеств ионов ртути (II) в области концентраций (1 10 -1 10 )
-5, -12 моль/л описывается следующим уравнением: У=(0,114-0,02)x+(2.12+0,02), r=0,9988, В табл. 2 приведены результаты определения ртути (11) предлагаемым способом, Пример 2. Построение градуировочного графика и определение неизвестной концентрации ионов тяжелых металлов (таллия).
Ферментный электрод помещают s стандартный раствор соли таллия (1) на
15 + 2 мин. Все дальнейшие операции проводят аналогично примеру 1, Неизвестную концентрацию ионов таллия находят по аналогичному градуировочному графику, который описывается ураенеаием: у-(0,30Ю03)х 4304Ю,111, г=0,9981 в области концентраций от 1 10 до 1 10 моль/л. Результаты определения
-11 ионов таллия (1) также представлены в табл. 2.
Пример 3. Построение градуировочного графика и определение неизвестной концентрации ионов свинца и кадмия.
Ферментмый электрод помещают в стандартный раствор соли свинца (11) или кадмия (11) на 15 мин, затем промывают водой и помещают в электролитическую ячейку. Состав раствора в ячейке и все дальнейшие операции аналогично примеру 1, Неизвестную концентрацию ионов свинца (1 1) находят по градуировочному графику, который описывается уравнением: у-(0,85»
":0,02)х-(1,43 0,2т), г=0,9994 в области концентраций (1 10 — l .10 ) моль/л. Градуировочный график для определения содержания ионов кадмия имеет следующий вид: у=-(0,68 -0,07)х — (2,4 -0,5). 0,9896 в интервале(1 10 -5 109) моль/л. Результаты определения данных ионов металлов представлены в табл. 2.
Определение предлагаемым cnorîéoì ионов TI(l), Hg(ll), Pb(ll) и Cd(ll) возможно в присутствии следующих ионов. Bl(III) до концентрации 1 10 моль/л. Cu(ll) до концентрации 1 10 моль/л, Nlll) до концент-4 рации 2 10 моль/л, Zn(II) и Fe(lll) до концент,>ации 1 . 10 моль/л. поскольку
-з перечисленные металлы не оказывают активирующего действия на иммобилизованную холинэстеразу и не изменяют высоту катодного пика при потенциале — 0,55 В. В их присутствии наблюдается пик, соответствующий исходной активности ХЭ.
В присутствии же ионов этих металлов в концентрациях выше указанных значений, они оказывают мешающее влияние вследствие ингибирования иммобилиэованной холинэстервэы. Предлагаемый способ определения позволяет значительно снизить нижнюю границу определяемых содержаний ионов тяжелых металлов по сравннеию с известными способами определений до 10 моль/л для Tl (1), 10 моль/л до Hg(ll) и 10 моль/л для Pb(ll) и
Сд(11).
Формула изобретения
Способ определения микроколичеств тяжелых металлов, заключающийся в иммобилизации холинэстеразы в пленку из нитрата целлюлозы, использовании пленки в качестве сенсорной части ферментного да гчика, выдерживании ферментного датчика в исследуемом растворе с последующей промывкой его водой, внесении в электрохимическую ячейку с раствором субстрата холинэстеразы бутирилтиохолин йодида, регистрации вольтамперограмм в интервале потенциалов от-0,1 до-0,8 В и измерении величины катодного пика при потенциале—
0,55 В, отличающийся тем, что, с целью увеличения чувствительности определения ионов таллин, ртути, свинца и кадмия, электрод в исследуемом растворе выдерживают в течение (15 +U) мин, а концентрацию металлов определяют по увеличению высоты пика, обусловленного активирующим действием ионов металлов на иммобилизованную холинэстеразу.
1822971
Таблица 1
8лияние ионов Tl(l), Hg(ll), Pb(ll) и Cd(ll) на активность иммобилиэованной холинэстеразы
Таблица 2
Результаты определения Tl(l), Hg(ll), РЬ(И) и Cd(ll), n-5, P-0,95
1822971
Продолжение табл. 2
Составитель Э. Медянцева
Техред М. Моргентая Корректор А. Мотыль
Редактор Т. Шагова
Производственно-издательский комбинат "Патент, г. Ужгород, ул.Гагарина, 101
Заказ 2178 Тираж Подписное
ВНИИПИ Государственного комитета flo изобретениям k открытиям при ГКНТ СССР
113035, Москва, Ж 35, Раушская наб., 4/5