Способ определения трипсиноподобной активности плазмы крови
Иллюстрации
Показать всеРеферат
Использование: в области медицинской биохимии. Сущность изобретения: трипсиноподобную активность плазмы крови определяют путем спектрофотометрического измерения начальной скорости гидролиза плазмой N -карбобензокси-диглицил-L-ap- гинил-паранитроанилида в среде, содержащей 0,05-0,15 М NaCl и дополнительно 0,05 М трис-Н CI. Способ позволяет ускорить анализ и повысить его чувствительность за счет спектррфотометрической регистрации начальной скорости реакции и использования N а-карбобензокси-диглицил-1 -аргинил-паранитроанилида в качестве субстрата. 3 табл.
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (si)s 6 01 N 33/48
ГОСУДАРСТВЕННОЕ ПАТЕНТНОЕ
ВЕДОМСТВО СССР (ГОСПАТЕНТ СССР) ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ (21) 4879819/14 (22) 02.11.90 (46).07.08.93. Бюл. М 29 (71) Минский государственный медицинский институт и Институт биоорганической химии АН БССР (72) В.М.Моин, О.Г.Березкина, Г,А.Лобачева, В. П,Голубович, Л.И. Кирнарский, С.В.Егорова, Л.В.Николайчик, В.В.Николайчик, Е.И.Сорочинская и А.О.Смирнов (56) Биохимические методы исследования в клинике. Справочник, М.: Медицина, 1969, с,206 †2. (54) СПОСОБ ОПРЕДЕЛЕНИЯ ТРИПСИНОПОДОБНОЙ АКТИВНОСТИ ПЛАЗМЫ КРОВИ
Изобретение относится к области биологии и медицины, в частности к ферментологии, и предназначено для определения активности трипсиноподобных (сериновых) протеиназ в плазме крови и других биологических жидкостях. Изобретение может быть использовано также для оценки эффективности лечебных мероприятий по борьбе с гиперпротеаземией (например, гемосорбции с применением селективных антипротеаэных сорбентов).
Цель изобретения — ускорение и повышение чувствительности способа, Указанная цель реализуется использованием в анализе трипсиноподобной активности плазмы хромогенного пептидного субстрата, содержащего, как и в прототипе, амидную связь аргинил-пара-нитроанилид, Для повышения чувствительности метода в отличие от прототипа субстрат содержит 2 Глициновых остатка в Pz и Рэ п . Ы< > 1 832195 A l (57) Использование: в области медицинской биохимии. Сущность изобретения: трипсиноподобную активность плазмы крови определяют путем спектрофотометрического измерения начальной скорости гидролиза плазмой N а-карбобенэокси-диглицил-L-аргинил-паранитроанилида в среде, содержащей 0,05 — 0,15 М NaCl и дополнительно 0,05
М трис-Н С1. Способ позволяет ускорить анализ и повысить его чувствительность эа счет спектрофотометрической регистрации начальной скорости реакции и использования
N -карбобензокси-диглицил-L-аргинил-паа ранитроанилида в качестве субстрата, 3 табл. положениях. Проведение фермент-субстратной реакции в среде трис-буфера, содержащей хлорид натрия в концентрации
0,05 — 0,15М, не только обеспечивает оптимальную скорость реакции фермент-субстрат, но также устраняет помутнение исследуемых образцов.
Таким образом, заявляемый способ отличается от прототипа использованным субстратом (N -карбобензокси-диглицил-L-apа гинил-пара-нитроанилид), присутствием хлорида натрия в концентрации 0,05-15М, измерением ферментативной активности в режиме регистрации начальной скорости реакции по приросту оптической плотности при длинах волн 405-410 нм.
Пример 1. Проведено определение диапазона ионной силы инкубационной среды, оптимальной для гидролиза протеинаэами плазмы хромогенного субстрата по заявленному способу. Изменение ионной
1832195 силы осуществлялось добавлением различных концентраций хлорида натрия в 0,05 М трис-HCI буфер с постоянным значением рН
8,2. Анализирован пул плазмы больных(таблица 1).
Таким образом, оптимальной концентрацией хлорида натрия в инкубационной среде, обеспечивающей максимальную скорость реакции 0,05 M трис-HCI буфера, рН
8,2, является концентрация в диапазоне 0,50,15 М. В отсутствии хлорида натрия в инкубационной среде наблюдается ее помутнение. Об этом свидетельствует прирост оптической плотности, не обусловленной собственно ферментативной активностью (Е Й составляет 0,0012, что искажает результаты анализа).
П р.и м е р 2. Заявленным способом проведено исследование скорости гидролиза протеинаэами плазмы хромогенного субстрата (N -карбобенэокси-диглицил-(=эра гинил-пара-нитроанилид — трифторацетат) в конечной его концентрации в инкубационной среде 2х10 М. Результаты анализа различных количеств плазмы суммированы в табл.2. Использован пуя плазмы больных.
Представленные данные свидетельствуют о прямолинейном характере зависимости скорости гидролиза субстрата в заявленной концентрации от количества плазмы в инкубационной среде, Пример 3. Проведено сравнительное исследование трипсиноподобной активности плазмы крови заявленным способом и прототипом, Результаты этого эксперимента суммированы в табл.3, Иэ представленных данных следует, что чувствительность заявленного способа почти на порядок выше таковой способа прототипа (X SX для прототипа и заявленного способа соответственно 0,96 + 1.14 и
7,53 + 1,91).
Продолжительность анализа трипсиноподобной активности плазмы крови по заявленному способу составляет 10-15 мин, что в 6-9 раз быстрее, чем по способу-прототипу (60-90 мин).
Пример 4. Проведено определение точности анализа трипсиноподобной активности плазмы, выполненных по прототипу и заявленному способу, Установленные коэффициенты вариации (Y ) соответственно равны 13,9 и 1,2ь, что свидетельствует о более высокой точности заявленного способа. Прямая фотометрическая регистрация
39
55 начальной скорости реакции, как известно из ферментологии, является наиболее точным способом измерения ферментативной активности. В этой связи заявляемый способ в сравнении с прототипом является более точным.
Пример. В термостатируемую кювету спектрофотометра вносят 2,6 мл 0,05 M трис-HCI буфера, рН 8,2 содержащего хлорид натрия 0,1 М (0,5-0,15 М). Затем вносят
0,2 мл плазмы, полученной центрифугированием крови, стабилизированной 3,8 раствором цитрата натрия (обьемное соотношение крови и цитрата 9:1). Смесь преинкубирует 5 минут. Реакцию начинают добавлением в кювету 0,2 мл рабочего раствора субстрата. Последний готовят перед опытом разведением в 5 раэ вышеуказанным буфером 1,5 х 10 М раствора N -карбобензокси-диглицил-DL-аргинил-пара-нитроанилида (трифторацетат) в диметилформамиде. Конечная концентрация субстрата в инкубационной среде 2 х 10 М, Начальную скорость реакции регистрируют при длине волны 410 нм. Ферментативную активность рассчитывают в нмоль х мин мл плазмы, используя для вычислений данные линейного участка кинетической кривой, по формуле:
Е410нм х 3
1мин
1нин
0,0088 х 0,2 — E4)o» х 1704,5, где Еа1О» — прирост оптической плот1мин ности за 1 мин при длине волны 410 нм; 3— объем инкубационной смеси в мл; 0,2 — объем анализируемой плазмы в мл, 0,0088— коэффициент микромолярной экстинции пара-нитроанилина при длине волны 410 нм.
Формула изобретения
Способ определения трипсиноподобной активности плазмы крови, включающий инкубацию исследуемого образца в среде, содержащей синтетический субстрат, с последующим спектрофотометрическим измерением скорости освобождения и-нитроанилина из субстрата, о т л и ч à ю щ и йс я тем, что, с целью ускорения и повышения чувствительности способа, в качестве субстрата используют N -карбобенэоксидиглицил-L-аргинил-паранитроанилид, инкубацию поводят в среде, содержащей
0,05-0,15 М NaCI и дополнительно 0,05 М трис-НС! с последующей регистрацией начальной скорости освобождения и-нитроанилина.
1832195
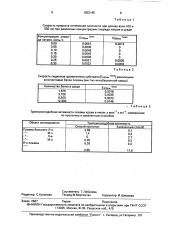
Таблица 1
Скорость прироста оптической плотности при длинах волн 410 и
550 нм при различных концентрациях хлорида натрия в среде
Таблица 2
Скорость гидролиза хромогенного субстрата (Е41онм " ) различными количествами белка плазмы (мкгlмл инкубационной среды) Таблица 3
Трипсиноподобная активность плазмы крови в нмоль х мин х мл, измеренная по прототипу и заявленным способом
Составитель Г.Лобачева
Техред М.Моргентал Корректор И.Шмакова
Редактор С.Кулакова
Производственно-издательский комбинат "Патент", г. Ужгород, ул.Гагарина, 101
Заказ 2607 Тираж Подписное
ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР
113035. Москва, Ж-35. Раушская наб., 4/5