Способ получения @ , @ -ненасыщенных кислот
Иллюстрации
Показать всеРеферат
Использование: в органической химии в качестве реагентов. Сущность изобретения: продукт- /, у -ненасыщенные кислоты. Реагент 1: эллиловые спирты. Реагент 2: оксид углерода. Условия реакции: хлорид четвертичного ониевого катиона ф-лы: А+ (Ri, Ra, Ra, ), где А - азот или фосфор, Ri-R4 - низший алкил или фенил, температура 50- 150°С, давление 10-250 атм. 5 табл.
СОЮЗ СОВЕТСКИХ
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК (я)5 С 07 С 57/13, 51/12
ГОСУДАРСТВЕННЫЙ КОМИТЕТ
ПО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМ
ПРИ ГКНТ СССР
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ПАТЕНТУ (21) 4743670/04 (22) 25.04.90 (31) 8906019 (32) 28.04.89 (33) FR (46) 23,08.93. Бюл. М 31 (71) Рон-Пуленк Шими (FR) (72) Филипп Дени, Жан Женк и Робер Перрон (FR) (56) Патент США ЬЬ 4585594, кл. С 07 С
51/14, 1986.
Предметом изобретения является способ получения P, y -ненасыщенных кислот.
Известен способ карбонилирования вторичных или третичных аллиловых алканолов в присутствии галогенидов палладия, дополненных фосфином, в случае необходимости в избытке, при температуре 50-150 С и повышенном давлении.
Хотя избирательность реакции может показаться высокой, активность каталитической системы мала, о чем одновременно свидетельствуют большая продолжительность реакции и проведение ее при очень высоком давлении.
Цель изобретения — сокращение продолжительности процесса — достигается способом получения P, y -ненасыщенных кислот путем взаимодействия соответствующего аллилового спирта с оксидом углерода в присутствии nannaдиевого
Ы2, 1836325А3 (54) СПОСОБ ПОЛУЧЕНИЯ /3, у -НЕНАСЫЩЕННЫХ КИСЛОТ (57) Использование: в органической химии в качестве реагентов. Сущность изобретения: продукт- p, y -ненасыщенные кислоты. Реагент 1: аллиловые спирты. Реагент 2: оксид углерода. Условия реакции: хлорид четвертичного ониевого катиона ф-лы: А (Я1, Rz, йз, R4), где А — азот или фосфор, R>-R4— низший алкил или фенил, температура 50150 С, давление 10 — 250 атм. 5 табл, катализатора в жидкой фазе при повышенной температуре и давлении, отличительной особенностью которого является то, что в качестве аллилового спирта используют 2бутен-1,4-диол, 1-бутен-3,4-диол, 2-циклогексен-1-ол, З-фенил-2-пропен-1-ол, 3-метил-1-бутен-3-ол, 2-метил-1-пропен-3ол, 2-бутен-1-on или собственно аллиловый спирт и процесс ведут в присутствии четвертичного ониевого хлорида элемента V Б группы, выбранного из азота или фосфора, который тетракоординирован с атомами углерода, причем четвертичный ониевый катион соответствует формуле A R>RzRzR4, где
R>-R4 — низший алкил или фенил, при температуре 50-150 С и давлении 10-250 атм.
В качестве палладиевого катализатора могут быть использованы металлический палладий, нанесенный при необходимости на подложку (уголь, гидроокись алюминия или двуокись кремния), PdClz, Pd(OAc)z.
1836325
РВщРдС)з(Во-н-бутил), соли или л -аллиловые палладиевые комплексные соединения, анион которых, координированный с катионом Pd, выбирают среди следующих анионов: карбоксилаты, например формиат, ацетат, пропионат, бензоат, ацетилацетонат, галогениды, например Cl и Br, предпочтительно С! .
Количество используемого катализатора зависит от требуемой производительности, расхода катализатора и других условий реакции.
Хорошие результаты могут быть получены при концентрации палладия в реакционной среде 10 — 1, предпочтительно 2 .10 — 5 10 моль/л.
Благоприятное действие четвертичного ониевого хлорида проявляется при молярном отношении ониевый катион/палладий порядка 0,5, оно может составлять 1-50, и больше. Фактически, четвертичный ониевый хлорид может использоваться в относительно большом количестве и играть роль дополнительного растворителя реакционной среды.
Вместе с оксидом углерода могут присутствовать такие инертные газы, как азот, аргон, диоксид углерода.
Реакцию обычно проводят в присутствии растворителей или разбавителей, таких как ароматические углеводороды, сложные эфиры, кетоны, нитрилы, диметилсульфоксид или амиды карбоновых кислот.
Наличие воды, даже в относительно большом количестве (порядка 10 моль на 1 моль субстрата), не вредит реакции и может оказывать в определенных условиях благоприятное действие на избирательность и даже на активность.
В некоторых случаях может оказаться желательным присутствие низшего алканола, Действительно, хотя такой спирт не может рассматриваться в качестве инертного в условиях реакции, он может выступать в роли сореагента для этерификации образовавшейся Р, у -кислоты, что облегчает выделение продукта в виде сложного эфира. В этом случае образовавшийся сложный эфир может быть гидролизован известным способом в кислоту.
Этот вариант может представлять особый интерес, когда в качестве аллилового спирта используется бутендиол, а в качестве алканола — метанол или этанол, в этом случае, молярное отношение алканол/диол может достигать примерно 10.
Преимущественно реакцию проводят в
N-метилпирролидоне.
Ф
10
Концентрация аллилового спирта может изменяться в широких пределах.
В конце реакции или в конце какой-то стадии процесса рекуперируют заданную кислоту известным споСобом, например экстракцией.
Пример ы 1 — 8. В предварительно продутый аргоном автоклав из нержавеющей стали типа Hasteiloy В2 объемом 125 см загружают 4,4 r (50 ммоль) 2-бутен-1,4з диола, 1 мг-атом палладия в аиде PdClz, 5 r (17 ммоль) РВщО и 25 мл ацетонитрила.
Автоклав герметично закрывают, поме15 щаютв печь с перемешиванием, подают под давлением оксид углерода и нагревают до
100 С, затем доводят давление до 125 бар, После 6 ч реакции автоклав охлаждают и дегазируют.
20 Реакционную массу разбавляют до 100 мл растворителем.
Аликвотную часть этерифицируют метанолом, затем анализируют газовой хроматографией, Конверсия 100 .
Продукты реакции содержат смесь 3- и
2-гексеновых кислот, в которой основной является 3-гексеновая кислота (смесь ЬЬ 1), . смесь валериановой, 2-метилбутановой, 3пентеновой, 2-пентеновой и 4-пентеновой кислот, в которой основной является 3-пентеновая кислота (смесь М 2), смесь этилянтарной, метилглутаровой и адипиновой кислот, в которой основной является метил35 глутаровая кислота (смесь М 3), и пентадиеновую кислоту (ПДК).
Полученные результаты представлены в табл. 1.
П ри меры 9-11. Как в примере 1, в
40 автоклав подают 2-бутен-1,4-диол, часть которого заменяют эквивалентным объемом растворителя. Общий объем поддерживается постоянным и равным 30 мл. Полученные результаты указаны в табл. 2.
45 П ри м е р ы 12 и 13, Повторяют пример
1, но используя эквивалентное количество палладия в виде Pd(OAc)z или Рд(бВА)2.
За 6 ч реакции получают 24 или 32
50 еси
Пример ы 14 и 15. Воспроизводят пример 1, используя в качестве растворителя эквивалентный обьем диметилсульфоксида или диметилформамида. 3а 6 ч реакции
55 получают 70 или 50 смеси М 1.
Пример 16. Воспроизводят пример 5, заменив PdCb эквивалентным количеством палладия в виде Pd(dBA)z. За 21 ч реакции получают 85 смеси М 1.
I 836325
Пример ы 17 и 18. Воспроизводят пример 5, используя 0.5 или 0,12 r чистого палладия е виде РбС!2.
Выход смеси М 1 75",(, в первом случае наблюдается через 1,5 ч, а во втором через
12 ч.
Пример 19. Воспроизводят пример 5. используя эквивалентное количество 1-бутен-3,4-диола. Выход смеси М 1 80, Пример 20. Повторяют пример 5, заменяя PdCI2 эквивалентным количеством палладия на угле (3 PdSPS на С).
Через 1 ч выход смеси N. 1 44,.
Пример 21. Воспроизводят пример 5, заменяя PdCI2 эквивалентным количеством
РВи4РбС!з и PBu4CI эквивалентным обьемом N-метилпирролидона, через 15 мин выход смеси М 1 45 .
Пример ы 22 — 26. Проводят серию испытаний, аналогичных примеру 5, заменяя N-метилпирролидон одинаковым объемом смеси (N-метилпирропидона с водой или метанолом).
Результаты испытаний указаны в табл.
3.
П р и м е б ы 27-37. Проводят серию испытаний аналогично примеру 1, используя в качестве растворителя ацетонитрил (примеры 27-31) либо N-метилпирролидон (примеры 32-37), при различных температурах и давлении оксида углерода.
Полученные результаты приведены в табл, 4, Пример 38. Проводят опыт аналогичным образом, загружая в автоклав 50 ммопь аллилового спирта, 37,5 мл этилбензола, 0,25 мг-атом палладия в виде PdCIz и 2,5 ммоль PBu4CI.
Температура 80 С, давление 200 бар.
Охлаждают и дегазируют автоклав после 6 ч реакции.
Конверсия аллилового спирта 100, реакционная смесь содержит алпипвинилацетат (60 . определено по соотношению двойного числа молей обнаруженного еинилацетата и числа молей загруженного аллилового спирта) и 3-бутеновую кислоту(30 (, по загруженному аллилоеому спирту). Оценку осуществляют по разнице между, с одной стороны, общим количеством метилового эфира, определенным посредством газовой хроматографии после этерификации, и, с другой стороны, количеством метилового эфира; полученного в результате разложения аллилеинилацетата, По данным газовой хроматографии смесь содержит 20 аллилвинилацетата и 507(, З-метилбутеноата, 5
Пример 39. Воспроизводя пример
39, вводя эквивалентное количество паппадия в виде комплексного соединения
РбС!2(РРЬз)2 и заменяя PBu4CI эквивалентным количеством SnCI2 2Нр0.
Конверсия аллилового спирта 15 j,, содержание аплилвинилацетата в сырой смеси 16 .
После этерификации смесь содержит
8 аллилвинилацетата и 6"-,ь 3-метилбутеноата.
Пример 40. Аналогично загружают в автоклав 40 ммоль аллилового спирта, 25 мл
N-метилпирролидона, 1 ммоль РбС!2 и 17 ммопь РВ04С!.
Температура 100 С, давление 120 бар.
После 30 мин реакции (продолжительность абсорбции) конверсия аллилового спирта 100, аллилвинилацетат в сырой смеси отсутствует.
После этерификации смесь содержит
62 3-метипбутеноата.
Пример 41. Воспроизводят пример
40, добавляя к загрузке 100 ммоль воды.
Продолжительность реакции 40 мин.
Конверсия аллилового спирта 100, сырая смесь содержит 2 алпилвинилацетата.
После этерификации аплилвинилацетат в смеси не обнаружен, она содержит 100
3-метил бутеноата.
Пример 42. Воспроизводят пример
40, заменяя PdCI2 эквивалентным количеством комплексного соединения PdС!2(РРЬз), а PBu4CI 100 ммопями SnClz 2Н20. Время реакции 4 ч.
Конверсия аллилового спирта 10, сырая смесь содержит 27; аллилвинипацетата, После этерификации аллилвинилацетат в смеси отсутствует, содержание 3-метилбутеноата 5 .
Пример ы 43-47, В автоклав загружают 50 ммоль спирта, 1 мг-атом паллэдия в виде РбС!, 17 ммоль PBu4CI и 25 мл N-метилпирролидона.
Температура 100 С. давление оксида углерода 120 бар.
Сырую реакционную смесь анализируют методом газовой хроматографии и затем этерифицируют метанолом, Количество ненасыщенной Р, у -кислоты определяют газавой хроматографией соответствующих метилов ых эфиров.
Таким образом, предлагаемый способ позволяет сократить продолжительность процесса до 1-3 ч против 10-15 ч е известном способе при использовании более низкого давления.
1836325
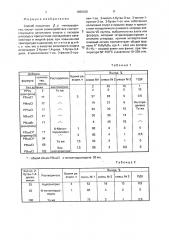
Таблица 1
* — общий объем PBu4C| и метилпирролидона 30 мл.
Таблица 2
Формула изобретения
Способ получения P, y -ненасыщенных кислот путем взаимодействия соответствующего аллилового спирта с оксидом углерода в присутствии палладиевого катализатора в жидкой фазе при повышенной температуре и давлении, о т л и ч а ю щ и йс я тем, что в качестве аллилового спирта используют 2-бутен-1,4-диол, 1-бутен-3,4диол, 2-циклогексен-1-ол, 3-фенил-2-пропен-1-ол, 3-метил-1-бутен-3-ол, 2-метил-1пропен-З-on, 2-бутен-1-ол или собственно аллиловый спирт и процесс ведут в присутствии четвертичного ониевого хлорида элемента ЧБ группы, выбранного из азота или фосфора, который тетракоординирован с атомами углерода, причем четвертичный ониевый катион соответствует общей формуле А R>RzRzR4, где А — азот или фосфор;
R>-R4 — низший алкил или фенил, при температуре 50-150 С и давлении 10-250 атм.
1836325
Таблица 3
Таблица 4
Таблица 5