Способ получения диоксида хлора
Иллюстрации
Показать всеРеферат
Двуокись хлора получают путем электролиза в катодном отделении электролизера с использованием пористого катода. Катодное отделение отделено от анодного отделения катионообменной мембраной. Хлорат натрия вступает во взаимодействие с ионами водорода и хлоридными ионами в катодном отделении, а двуокись хлора отводят из катодных отделений. Хлор, полученный в качестве побочного продукта двуокиси хлора, восстанавливают на катоде для получения хлоридных ионов для реакции , в то время как полученные в результате электролиза ионы водорода перемещаются через мембрану из анодного отделения в катодное отделение с целью получения ионов водорода для реакции. 1 ил.
союз соВетских социАлистических
РЕСПУБЛИК (5l)5 С 25 В 1/26
ГОСУДАРСТВЕННОЕ ПАТЕНТНОЕ
ВЕДОМСТВО СССР (ГОСПАТЕНТ СССР) ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ПАТЕНТУ (21) 4613178/26 (22) 26.12.88 (46) 23.08.93. Бюл, N 31 (31) 558945 (32).16.02.88 (33) СА (71) Теннеко Канада Инк. (СА) (72) Марек Липштайн (Р1.), Джеймсд Мак
Джилвери и Збигнев Твардовски (СА) (56) Фиошин M,Я. и др. Электросинтез окислителей и восстановителей., Л.: Химия, 1981, с. 70, (54) СПОСОБ ПОЛУЧЕНИЯ ДИОКСИДА
ХЛОРА (57) Двуокись хлора получают путем электролиза в катодном отделении электролизеИзобретение относится к получению двуокиси хлора, по существу, в чистом виде, то есть, практически не содержащей хлора.
Двуокись хлора широко используют в качестве отбеливающего химического сое-. динения, и известно его получение восстановлением хлората натрия в кислотной водной реакционной среде, Реакция, .с помощью которой получают двуокись хлора, представлена уравнением:
С!Оз + С! +2H ---CIO2 + 1/2С!2+ Н О
Как правило, поэтому хлор образуется .совместно с двуокисью хлора.
Целью изобретения является повышение чистоты получаемого продукта.
В соответствии с настоящим изобретением, предусматривается электролиз, который осуществляют в катодном отделении
„„Ы3 „„l 836493 АЗ ра с использованием пористого катода. Катодное отделение отделено от анодного отделения катионообменной мембраной.
Хлорат натрия вступает во взаимодействие с ионами водорода и хлоридными ионами в катодном отделении, а двуокись хлора отводят из катодных отделений. Хлор, полученный в качестве побочного продукта двуокиси хлора, восстанавливают на катоде для получения хлоридных ионов для реакции, в то время как полученные в результате электролиза ионы водорода перемещаются через мембрану из анодного отделения в катодное отделение с целью получения ионов водорода для реакции. 1 ил. электролизера, разделенного катионообменной мембраной, в котором электролитически восстанавливают совместно 90 полученный хлор и в котором расположен (Д . пористый катод. Ионы хлората, как правило 0с, в виде водного раствора хлората натрия, ф вводят в катодное отделение, в котором находятся ионы водорода и ионы хлорида.
Ионы хлората восстанавливают с помощью ионов водорода и ионов хлорида в катодном отделении для получения двуокиси хлора, которую отводят из квтодного отдвявния, в (ду
I то время как подводят электрический ток для восстановления совместно полученного хлора до ионов хлорида. Ионы водорода образуются в результате электролиза в анодном отделении и перемещается из анодного отделения в катодное отделение.
Этим путем из хлоратного сырья с помощью
1836493 электролиза получают двуокись хлора с высокой степенью чистоты.
Двуокись хлора получают химическим образом в катодном отделении согласно уравнению: йаС(Оз+ 2Н + 2С(-О02+ 1/2C(z+ NaCI+ H20
Хлор, полученный совместно с двуокисью хлора в катодном отделении, в соответствии с этим уравнением, электролитически восстанавливают до ионов хлорида; обеспечивая выход готовой двуокиси хлора иа катодного отделения практически не содержащей хлора.
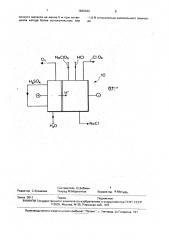
Попеременно вместе с одним молем хлорида натрия можно вводить в катодное отделение 1/2 моля хлора. В этом случае два моля Н переносятся из анодного отделения в катодное отделение для .удовлетворения потребности в ионах водорода в этом процессе, в то время как 1/2 моля хлора, вводимого в катодное отделение; и 1/2 моля хлора, полученного в качестве побочного продукта в катодном отделении, подвергаются электрохимическому восстановлению с образованием двух молей ионов хлорида, На чертеже дана схематичное изображение электролизера для получения двуокиси хлора в соответствии с одним вариантом изобретения.
Водный раствор хлората.натрия подают по трубопроводу в катодное отделениеэлектролизера, в котором помещен пористый электрод. В катодное отделение по трубопроводу также вводят кислоту, предпочтительно соляную. Водный раствор хлората натрия имеет концентрацию, достаточную для обеспечения, при наличии расхода относительно высокой концентрации хлората натрия в катодном отделении, 5-молярную, предпочтительно приблизительно 5 — 6,5 молярную. В электролизере имеется катионообменная мембрана, отделяющая катодное отделение от анодного отделения, После начальной загрузки оксикислоты в анодное отделение по трубопроводу подают воду, и ионы водорода, полученные в результате электролиза анолита, мигрируют через катионообменную мембрану в катодное отделение. Анолитный раствор серной кислоты подвергают рециркуляции. Миграция ионов водорода через катионообменную мембрану и ввод соляной кислоты по трубопроводу обеспечивают общую кислотную нормальность в катодном отделении, равную по меньшей мере приблизительно 0,01 N, предпочтительно, по меньшей мере, приблизительно 0,05 М, Кислород, полученный в:качестве побочного продукта в процессе электролиза в анодном отделении, отводят по трубопроводу из анодного отделения. В катодном отделении хлорат натрия, вступает в химическую реакцию с ионами водорода и ионами хлорида, полученными в результате электролиза ионами водорода, переносимыми через катионообменную мембрану, и ионами хлорида. полученными в результате электролиза в катодном отделении, как описано ниже, с образованием
"0 двуокиси хлора и хлора в соответствии со следующим уравнением:
NaClOa+ 2Н++ 2CI
C(Oz+ 1/2C(z+ NaCI+ Н20
Одна половина потребности в ионах во"5 дорода удовлетворяется за счет кислоты. подаваемой по трубопроводу, а остальная потребность в ионах водорода обеспечивается за счет ионов водорода, перемещаемых из анодного отделения.
20 Полученный в качестве побочного продукта хлор восстанавливают в электрохимических условиях, которые существуют в катодном отделении, избирательно по отношению к присутствующей в нем двуокиси хлора, Полученные таким путем ионы хлорида обеспечивают половину потребности в ионах хлорида для химического восстановления хлората, остальная потребность в ионах хлорида обеспечивается при этом за
30 счет подачи соляной кислоты по трубопроводу, или из другого удобного внешнего источника ионов .хлорида, такого как, например, хлорид натрия.
В зависимости от условий электролиза
35 в катодном отделении, ионы хлорида можно получить непосредственно из полученного в качестве побочного продукта хлора в результате электрохимического восстановления, в соответствии со следующим
40 уравнением;
1/2С(г + e CI
В этой последней операции образование иона хлорида результируют таким образом, чтобы избежать последующего восстановле45 ния в результате электролиза хлорида, которое приводит к значительному образованию хлора.
Подача хлората натрия по трубопроводу и. ввод ионов хлорида по трубопроводу, так
50 же как полученные электрохимически ионы хлорида обеспечивают соотношение между ионами. хлората и хлорида в катодном отделении, равное приблизительно 1;1, предпочтительно от приблизительно 2:1 до приблизительно 4:1.
Электродный потенциал, приложенный к катоду, является более положительным, чем -1 В, по сравнению с насыщенным каломельным электродом (НКЭ).
1836493
15
25
35
Электродный потенциал катода связан с потенциалом раствора. Пористый электрод характеризуется распределением потенциала своей структуры, и действительный потенциал будет зависеть от места определения и может быть более отрицательным, чем — 1
В, относительно насыщенного каломельного электрода.
В катодном отделении предпочтительно поддерживают повышеннуютемпературудля того, чтобы способствовать образованию двуокиси хлора. Как правило, используют температуру выше приблизительно 50 С, предпочтительно приблизительно 60-70 С.
Двуокись хлора, полученную в результате химической реакции, практически не содержащую хлора, отводят из катодного отделения в качестве целевого газового потока по трубопроводу, Этот поток двуокиси хлора можно использовать в дальнейшем, как описано, например, s отношении варианта, изображенного на фиг.2 ниже.
Побочный хлорид натрия из процесса химического производства двуокиси хлора удаляют из катодного отделения в виде водного раствора по трубопроводу. Этот водный раствор хлорида натрия может быть направлен в электролизер для получения хлоратов с целью электролитического пре вращения в водный раствор хлората для возврата в катодное отделение с целью образования, по меньшей мере, частично хлората натрия в трубопроводе, Материалы для изготовления таких электродов с низким перенапряжением известны. Такие электроды в основном содержат подложку, в качестве которой используется титан. цирконий, тантал или гафний, с расположенным на ней электропроводящим покрытием, в качестве которого могут служить драгоценный сплав, например, платина, сплав драгоценного металла, например, платино-иридиевый сплав; оксид металла, например, окись рутения или диоксид титана; платинат, например, платинат лития или платинат кальция; . или смеси двух или более таких материалов.
Любой из этих материалов можно использовать для получения материала, служащего для изготовления катода с низким перенапряжением.
Электролизер, в котором осуЩествляют электролизное производство двуокиси хлора в соответствии с настоящим изобретением, может иметь любую удобную конструкцию.
Как правило, электролизер разделен на аналитное и католитное отделения и ионообменной мембраной, как правило, катионообменной мембраной; с тем, чтобы промотировать перенос ионов водорода и предотвратить взаимодействие газов, полученных на аноде, обычно кислорода, с двуокисью хлора, электролитическое восстановление на катоде, Анод электролизера может быть изготовлен из любого необходимого электропроводящего материала, например, из графита или металла.
Обращаясь теперь к фиг.2, на ней можно увидеть соединение генератора двуокиси хлора, изображенного на фиг.1, с электролизером для получения хлората и хлоридобразующи м электролизе ром.
Настоящее изобретение иллюстрируется при помощи следующего примера.
Экспериментальный электролизер был выполнен в соответствии с чертежом. Электролизер представлял собой обычный электролизер среднего давления фирмы
Электроцал АБ, который был модифицирован под трехмерный электрод, образованный путем установки графитового войлока (поставляемого. Юнион Карбайд Корпорейшен) в катодное отделение. Электролиэер был разделен на анодное и катодное отделения катионообменный мембраной (НАФИОН 120), Площадь мембраны составила
1 дм, в то время как площадь катода по оценкам экспериментаторов приблизительно в 100 — 1000 раз превышала площадь мембраны. В качестве анода был использован стабильный по размерам электрод, выделяющий кислород.
Загрузка катодного отделения составила 8,626 молей хлората натрия, 2,356 молей хлорида натрия и 1,536 молей HCI, В качестве анолита использовали 6N HzS04. К катоду был приложен электродный потенциал около — 0,7 вольт по отношению к НКЭ, при плотности тока l,97 кА/м в течение периода времени, равного 4 часа, при температуре 70 С. В выходящем из катодного отделения потоке содержалось 7.659 молей . йаС!з и 3,548 молей NaCI. Отходящие газы были исследованы,.и в них содержалось
0,626 молей CION и 0,68 молей Clz.
Чистота двуокиси хлора составляла
90,2%, выход химической реакции составил
82,2 .
Формула изобретения
Способ получения диоксида хлора, включающий обработку водного раствора, содержащего смесь ионов хлората, хлорида, водорода и щелочного металла, в мембранном электролизере, отличающийся тем, что, с целью повышения чистоты получаемого продукта, процесс ведут в катодной камере электрол изера с катионообменной мембраной на пористом катоде при подаче исходной смеси в катодную камеру с концентрацией хлората ще1836493 лочного металла не менее 5 м при потен- — 1,0 В относительно каломельного электроциале катода более положительном, чем да, 10
Яв
Составитель О.Зобнин
Редактор С.Кулакова Техред М.Моргентал Корректор А.Мотыль
Заказ 3011 Тираж П,одписное
ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР
113035. Москва, Ж-35, Раушская наб., 4/5
Производственно-издательский комбинат "Патент", г. Ужгород, ул,Гагарина, 101