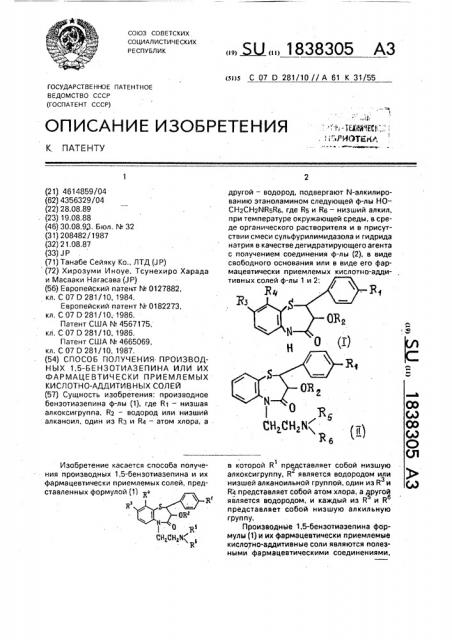
Способ получения производных 1,5-бензотиазепина или их фармацевтически приемлемых кислотно-аддитивных солей
Иллюстрации
Показать всеРеферат
союз советских
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
ГОСУДАРСТВЕННОЕ ПАТЕНТНОЕ
ВЕДОМСТВО СССР (ГОСПАТЕНТ СССР) ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К. ПАТЕ НТУ
М
®
0 р
CH@CH@N R (21) 4614859/04 (62) 4356329/04 (22) 28,08,89 (23) 19.08,88 (46) 30.08,93. Бюл. ¹ 32 (31) 208482/1987 (32) 21,08.87 (33) JP (71) Танабе Сейяку Ко., ЛТД (JP) (72) Хирозуми Иноуе, Тсунехиро Харада и Масааки Нагасава (JP) (56) Европейский патент N 0127882, кл. С 07 0 281/10, 1984.
Европейский патент N 0182273, кл, С 07 D 281/10, 1986.
Патент CLUA N. 4567175, кл, С 07 D 281/10, 1986.
Патент США ¹ 4665069, кл. С 07 0 281/10, 1987, (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 1,5-БЕНЗОТИАЗЕПИНА ИЛИ ИХ
ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ
КИСЛОТНО-АДДИТИВ Н ЫХ СОЛ ЕЙ (57) Сущность изобретения: производное бенэотиазепина ф-лы (1), где R> — низшая алкоксигруппа, R2 — водород или низший алканоил, один из Вз u Rp — атом хлора, а
Изобретение касается способа получения производных 1,5-бензотиазепина и их фармацевтически приемлемых солей, представленных формулой (1) >».... ЫÄÄ 1838305 А3 (я)з С 07 D 281/10//А 61 К 31/55 другой — водород, подвергают N-алкилированию зтаноламином следующей ф-лы НО—
СН2СН2ЙКБЯ6, где КБ и Rs — низший алкил, при температуре окружающей среды, в среде органического растворителя и в присутствии смеси сульфурилимидазола и гидрида натрия в качестве дегидратирующего агента с получением соединения ф-лы (2), в виде свободного основания или в виде его фармацевтически приемлемых кислотно-аддитивных солей ф-л в которой R представляет собой низшую алкоксигруппу, R является водородом или низшей алканоильной группой, один из R u й4 представляет собой атом хлора, а другой является водородом, и каждый иэ R u R представляет собой низшую алкильную группу.
Производные 1,5-бензотиазепина формулы (1) и их фармацевтически приемлемые кисло7но-аддитивные соли являются полезными фармацевтическими соединениями, 1338305 обладающими высокой гипотензивной активностью, церебральным и коронарным сосудорасширяющим действием, и/или активностью ангибирования агрегации тромбоцитов, и среди соединений формулы (1) соединение, в котором R представляет со2 бой атом водорода, полезно также в качестве промежуточного соединения для синтеза лекарственных средств.
S производных 1,5-бензотиазепина формулы (1) низшая алкоксигруппа и низшая алканоильная группа включают алкоксигруппу с 1 — 6 углеродными атомами и алканоильную группу с 2-6 углеродными атомами соответственно.
Известен способ получения указанных выше соединений формулы 1 с помощью
К-алкилирования соединений, представленных формуло дф 3
3 в которой R R R u R имеют значения, 1 2 3 4 указанные выше, 2-диалкиламиноэтмилгалогенидом в органическом растворителе (1, 2).
Согласно настоящему изобретению соединение формулы (1) или его фармацевтически приемлемая соль получают реакцией соединения, представленного приведенной выше формулой (II) с аминоэтанолом, представленным формулой (Н!)
z и — (."н — СН вЂ” QH уб где R" и R имеют значения, определенные для них ранее, в процессе реакции конденсации с последующим, если необходимо, превращением полученного соединением в соль обычным методом, Упомянутая реакция конденсации удобно проводится в присутствии дегидрирующего средства, В качестве дегидрирующего средства могут быть использованы, например, смесь сульфурилдиимидазола и гидрида натрия. Реакцию предпочтительно проводят в подходящем растворителе (т.е. хлороформе, дихлорэтане, дихлорметане, ацетоне, диэтилкетоне, метилэтилкетоне, этилацетате, этилпропионате, метилпропионате, диметилформамиде, диэтилформиа-е, диметилацетамиде, формилморфолине, ацетилморфолине, диоксане, тетрагидрофуране, эфире, диметоксиэтане, диглиме, то5
10 луоле. бензоле, ксилоле и так далее) при температуре от 0 С до 150 С, Соединение формулы (1), полученное таким образом, при необходимости легко переводится в фармацевтически приемлемую кислотно-аддитивную соль, например, обработкой кислотой. Примеры фармацевтически приемлемых кислотно-аддитивных солей включают неорганические кислотноаддитивные соли, такие как гидрохлорид, гидробромид, гидроиодид, перхлорат, сульфат, фосфат, и так далее; органические кислотно-аддитивные соли, такие как оксалат, малеат, фумарат, тартрат, метансульфонат и
15 так далее.
Поскольку реакция согласно настоящему изобретению не сопровождается какойлибо рацемизацией, то при использовании оптически активного соединения (II) в каче20 стве исходного материаг а можно получить соединение формулы (!) в виде оптически активного соединения.
Производные 1,5-бензотиазепина формулы (I) или их фармацевтически приемлемые кислотно-аддитивные соли согласно изобретению проявляют высокую гипотензивную активность, церебральную или коронарную сосудорасширяющую активность и/или активность ингибирования агрегации
30 тромбоцитов, как упомянуто выше, и могут использоваться для профилактики и лечения заболеваний мозга, таких как церебросаскулярное сокращение, церебральная ишемия, церебральный инфаркт и так далее, 35 или заболеваний. сердца, таких как стенокардия, инфаркт сердца и так далее. Среди соединений формулы (I) соединение, в котором R представляет собой водород, полезно также в качестве синтетического промежуточного соединения, поскольку это соединение путем ацилирования может быть превращено в соединение (I), в котором R2 является низшей алканоильной группой, 45 . Исходное соединение формулы (II), ис- . пользуемое в настоящем изобретений, может быть получено методами, описанными в (3. 4), Соединение (1) согласно изобретению и соединение (II) включают также либо два вида стереоизомеров (т.е. цис- и транс-изомеры) или четыре вида оптических изомеров (т.е. (+)-цис, (-}-цис-, (+)-транс- и (-)-транс-изомеры) и их смеси, базирующиеся на двух асимметрических углеродных атомах в молекуле.
Пример 1. После перемешивания смеси 354 мг 2-(диметиламино) -этанола и
159 мг 60 -ного гидрида натрия в 14 мл диметилформамида при комнатной темпе1838305 ратуре в течение 20 мин к смеси добавляли
787 мг сульфурилдиимидазола при -40 С и смесь перемешивали при этой температуре один час, затем добавляли 5 мл раствора 1,0 г (+)-цис-2-(4-метоксифенил)-3-ацетокси- 8хлор-2,3-дигидро-1,5-бензотиазепин-4(5H)она в диметилсульфоксиде при -40 С и после постепенного повышения температуры реакционную смесь перемешивали при комнатной температуре 20 ч. После завершения реакции добавляли метанол и хлороформ. Смесь промывали водой, сушили, с последующим удалением растворителя и остаток отделяли колоночной хроматографией. После удаления исходного лактама элюированием смесью хлороформ-этанол в отношении 20:1 элюированный маслянистый продукт превращали в малеат и перекристаллизовывали из этанола и получали
777 мг (+)-цис-2 -4(метоксифенил)-3-ацетокси -5-/2-(диметиламино)-зтил /-8-хлор -2,3дигидро-1.5-бензотиазепин-4(5Н)-она в форме соли малеиновой кислоты, Выход;
51,90, Точка пл. 158 — 160 С, Пример 2. К раствору 1,86 r (+)-цис2-(4-метоксифенил) -З-ацетокси-8-хлор-2,3. дигидро- 1,5-бензотиазепин-4(5Н)-она в 30 мл ацетона добавляли 2,4 г порошкообразного карбоната калия и 1,1 r гидрохлорида
2-(диметиламино)-этилметансульфоната и смесь перемешивали при кипячении с обратным холодильником 10 ч. После завершения реакции неорганические продукты удаляли фильтрацией, к остатку добавляли
10 -ю хлористоводородную кислоту и этилацетат и экстрагировали 10%-й хлористоводородной кислотой. Экстракт промывали водой, сушили и затем концентрировали при пониженном давлении. Остаток обращали в гидрохлорид и перекристаллизовывали из смеси ацетон-этанол. Получали 2,10 г гидрохлорида (+)-цис-2-(4-метоксифенил)3-ацетокси-5/2-(диметил-амина)- этил/-8хлор-2,3-дигидро-1,5- бензотиазепин-4(5Н)она с выходом 86,5 . Т.në, 127 — 131 С (разл.).
Пример .3. К раствору 3,36 г (+)-цис2-(4-метоксифенил) -3-окси-8-хлор-2;3-дигидро -1,5-бензотиазепин-4(5Н)-она в 50 мл диметилсульфоксида добавляли 1,35 г гидроокиси калия при охлаждении льдом и после перемешивания при комнатной температуре добавляли 3,44 гр 2-(диметиламино)-этилового эфира метансульфокислоты в форме гидрохлорида с последующим перемешиванием при комнатной температуре в течение 16 ч. После завершения реакции смесь выливали в воду со льдом и смесь экстрагировали смесью хлороформдиэтиловый эфир в отношении 1:1. Экстракт
55 промывали водой, сушили и выпаривали при пониженном давлении. Перекристаллизацией остатка (3,48 г) из смешанного растворителя атил-ацетат-гексан получали 3.06
r (+)-цис-2-(4-метоксифенил)-3-окси- 5-/2(диметиламино)-атил/-8 -хлор-2,3-дигидро1,5- бензотиазепин-4(5Н)-она, выход 75,2, т.пл. 122 — 124 С.
Пример 4. К раствору 1,68 г (+)-цис2-(4-метоксифенил)-3 -окси-8-хлор-2,3-дигидро- 1,5-бензотиазепин-4(5Н)-она в 30 мл ацетона и 0,5 мл воды добавляли 2,40 г карбоната калия и 1,09 г 2-(диметипамино)-этилового эфира метансульфокислоты в виде гидрохлорида с последующим нагреванием с обратным холодильником в течение 20 ч, После окончания реакции неорганические материалы удаляли фильтрацией и фильтрат концентрировали. К остатку добавляли
10%-ю хлористоводородную кислоту и этилацетат и органической слой экстрагировали 10%-й хлористоводородной кислотой.
Слои хлористоводородной кислоты обьединяли, подщелачивали карбонатом калия и затем экстрагировали этилацетатом. Экстракт промывали водой, сушили и выпаривали при пониженном давлении.
Перекристаллизацией остатка из смеси этипацетат-н-гексан получали 1,40 г (+)-цис-2(4- м е т о к с и ф е н и л)
3-окси-5-(2-(диметиламино)-атил)-8-хлор—
2,3-дигидро-1,5- бензотиазепин-4(5Н)-она с выходом 68,8 . Точка плавления 123—
1250С.
Пример 5. По примеру 3. но используя гидрохл орид 2-(диметилам и но)-этило вы и эфир бензолсульфокислоты вместо гидрохлорида 2-(диметиламино)-этилметансульфоната. получали гидрохлорид (+)-цис-2-(4-метоксифенил)- 3-ацетокси-5-(2(диметилами но)-этил)-8-хлор -2,3-дигидро1,5-бензотиазепин -4(5Н)-она.
Это соединение имело те же физические свойства, что и соединение по примеру 2.
Пример 6. По примеру 2, но используя гидрохлорид 2-(диметиламино)-этиловый эфир толуолсульфокислоты вместо гидрохлорида 2-(диметиламино)-этилового эфира метансул ьфокислоты получали гидрохлорид (+)-цис-2-(4-метоксифенил) -3-ацетокси-5-(2-(диметиламино)-этил)-8-хлор- -2,3-дигидро-1,5-бе н зотиазеп и н- -4(5 Н)-она.
Это соединение имело такие же физические свойства, что и соединение, полученное по примеру 2, Пример 7. По примеру 2, но используя
2-(диметиламино)-этилсульфат вместо гидрохлорида 2-(диметиламино)-этилового эфира метансульфокислоты получали (+)1838305 где Rl — низшая алкоксигруппа;
R2 — водород или низший алканоил; один иэ Вэ и R4 — водород, а другой хлор; каждый из R5 и R5 низший длкил, или их фармацевтически приемлемых кислотно-аддитивных солей, соответствующим
N-алкилированием производного 1,5-бензотиазепина общей формулы цис-2-(4-метоксифен ил)-3-ацетокси- 5-(2(диметиламино)-атил)- 8-хлор-2.3-дигидро1,5- бенэотиазепин-4(5Н)-он в форме гидрохлорида.
Это соединение имело такие же физи- 5 ческие свойства, что и соединение по примеру 2.
Пример ы 8-9. При обработке соответствующих исходных материалов способами, описанными в примерах 2-4, 10 получали следующие соединения. (8) (+)-цис-2-(4-метоксифенил)-3 -окси-5(2-(диметиламино)- атил)-9-хлор-2,3-дигидро- t,5- бензотиазепин-4(5Н)-он. НС).1/4
Н20, точка плавления 190-192 С.. 15 (9) (+)-цис-2-(4-метоксифенил)-3-ацетокси-5- (2-(диметиламино)-атил)-9-хлор- 2.3-. дигидро-1,5-бенэотиазепин-4(5H)-онгидрохлоридмоногидрат, т.пл. 140143 С. 20
Формула изобретения
Способ получения производных 1,5бензотиазепина общей формулы .
Н, где R>, Rz, Йз, R4 имеют указанные значения, в среде органического растворителя с выделением целевого продукта s виде свободно-. го основания или в виде его фарма цевтически приемлемых кислотно-аддитивных солей, о т л и " а ю шийся тем, что, с целью упрощения процесса, алкилирование осуществляют этаноламином формулы 5
НΠ— СН СНг — N
Rá где R5 u Rs имеют указанные значения, и процесс ведут в присутствии смеси сульфурилимидазола и гидрида натрия в качестве дегидратирующего агента.
25 о
©Ф4"
3б
Составитель Хирозуми Иноуе
Редактор С. Кулакова е Техред М.Моргентал Корректор Е. Папп
Заказ 2900 Тираж Подписное
ВНИИПИ Государственного комитета llo изобретениям и открытиям при ГКНТ СССР
113035, Москва, Ж-35, Раушская наб., 4/5
Производственно-издательский комбинат "Патент", г, Ужгород, ул.Гагарина, 101