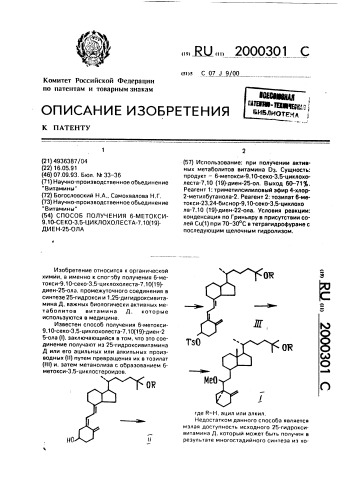
Способ получения 6-метокси-9,10-секо-3,5-циклохолеста-7, 10(19)-диен-25-ола
Иллюстрации
Показать всеРеферат
Использование: при получении активных метаболитов витамина Оз. Сущность: продукт - 6-метокси-9,10-секо-3,5-циклохолеста-7,10 (19)-диен-25-ол. Выход 60-71%. Реагент 1: триметилсилиловый эфир 4-хлор- 2-метилбутанола-2. Реагент 2: тозилат 6-метокси-23,24-биснор-9.10-секо-3,5-циклохо ла-7.10 (19)-диен-22-ола. Условия реакции: конденсация по Гриньяру в присутствии солей Си(1) при 70-30°С в тетрагидрофуране с последующим щелочным гидролизом.
(5!)5 С 07 J 9/00
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К ПАТЕНТУ
ОЯ
Т$0
0R йО
Комитет Российской Федерации по патентам и товарным знакам (21) 4936387/04 (22) 16.05.91 (46) 07.09.93. Бюл, М 33 — 36 (71) Научно-производственное объединение
"Витамины" (72) Богословский Н.А., Самохвалова Н.Г. (73) Научно-производственное объединение
"Витамины" (54) СПОСОБ ПОЛУЧЕНИЯ 6-МЕТОКСИ9,10-СЕ КО-3,5-ЦИ КЛОХОЛ Е СТА-7,10(19)ДИ Е Н-25-ОЛА
Изобретение относится к органической химии, а именно к спог бу получения 6-метокси-9.10-секо-3,5-циклохолеста-7,10(19)диен-25-ола, промежуточного соединения в синтезе 25-гидрокси и 1,25-дигидроксивитамина Д, важных биологически активных метаболитов витамина Д. которые используются в медицине.
Известен способ получения 6-метокси9,10-секо-3,5-циклохолеста-7,10(19)-диен-2
5-ола (1), заключающийся в том, что это соединение получают из 25-гидроксивитамина
Д или его ацильных или алкильных производных (II) путем превращения их в тоэилат (III) и. затем метанолиэа с образованием 6метокси-3,5-циклостероидов.,„,ЯО„„ 2000301 С (57) Использование: при получении активных метаболитов витамина 0э. Сущность: продукт — 6-метокси-9,10-секо-3,5-циклохолеста-7,10 (19)-диен-25-on. Выход 60-71 .
Реагент 1: триметилсилиловый эфир 4-хлор2-метилбутанола-2. Реагент 2; тоэилат 6-метокси-23,24-биснор-9,10-секо-3,5-циклохо ла-7,10 (19)-диен-22-ола, Условия реакции: конденсация по Гриньяру в присутствии солей Cu(1) при 70-ЗООС в тетрагидрофуране с последующим щелочным гидролизом, где R=H, ацил или алкил.
Недостатком данного способа является мэлая доступность исходного 25-гидроксивитамина Д, который может быть получен в результате многостадийного синтеза иэ хо2000301
СцНай йеО
i,Мед
Сц
Я 50 леновой кислоты с выходом 0,058 (,. Кроме того, в синтезе используются дорогие и опасные реагенты, такие как диазометан и соли серебра. Перечисленные недостатки делают такой способ получения б-метокси9, 10-секо-3,5-циклохолеста-7,10(19)-диен25-ола (I) сложным и трудоемким.
Целью изобретения является упрощение процесса получения б-метокси-9,10-секо-3.5-циклохолеста-7,10(19)-диен-25-ола (I) 1О как промежуточного продукта в синтезе 25гидрокси- и 1,25-дигидроксивитамина Д.
Указанная цель достигается созданием способа получения соединения 1, заключающегося в том, что тоэилат б-метокси-23,24- 15 биснор-9,10-секо-3,5-цикл охола-7,10(19)диен-22-ола (И) конденсируют с Гриньяровским реагентом, полученным иэ триметилсилиловых эфиров 4-хлор- или
4-бром-2-метилбутан-2-ола (V) в присутст- 20 вии солей одновалентной меди как катализатора, при температуре 70 — 30 С в зфирсодержащем растворителе и после отделения и промывки органического слоя выделяют триметилсилиловый эфир 25 б-метокси-9,10-секо-3,5-циклохолеста-7,10 (19)-диен-25-ола (Vll), который подвергают основному гидролизу в спиртовом растворе с получением целевого продукта, Ф
Т$
30 где R=H, ацип ипи элкип, В качестве основания используют гидроокиси щелочных металлов — натрия или калия, а также карбонаты или бикарбонаты этих металлов, Целевой б-метокси-9,10-секо-3,5-циклохолеста-7,10(19)-диен-25-ол (1) очищают хромэтографически нэ колонке с нейтральным или щелочным адсорбентом, выход 90 от триметилсипилового эфира о-метокси-9,10-секо-3,5-циклохолеста-7,10 (19)-диен-25-ола (Vl).
Пример 1. В трехгорлой колбе обратным холодильником растворяют 11.51 г силилового эфира 4-бром-2-метилбутанола-2 (V) в 98 мл свежеперегнэнного тетрагидрофурана. К раствору прибавляют 1,15 г магниевой стружки и при интенсивном перемешивании доводят до кипения., Реакционную массу кипятят с обратным холодильником еще 2 ч, охлаждают до 0 С и через капельную воронку с обводом и реакционную колбу пропускают интенсивный ток аргона и быстро прибавляют 2,90 г свежеприготовпенной иодистой меди, Раствор приобретает пунцово-синее окрашивание.
Реакционную массу перемешивают при 0 С в токе аргона 10 мин и затем из капельной воронки прибавляют раствор 4,62 г тозилата (IV) e 60 мл сухого бензола в течение 15 — 25 мин, поддерживая температуру в реакционной массе около 0" С. Далее реакционной массе дают нагреться до комнатной температуры (18 — 20 С) в течение 45 мин. После контроля полноты реакции (ТСХ) в реакционную массу приливают раствор 37,5 г хлористого аммония s 62,5 мп воды и перемешивают 1,5 ч, затем отделяют органический слой и промывают 3 раза по
200 мп водой, сушат сульфатом натрия.
Органический слой, содержащий триметипсилиловый эфир б-метокси-9,10-секо-3.5цикл охола-7,10(19)-диен-25-оп а (Vi) анализируют с помощью TCX и спектров
ПМР. Спектр ПМР. д в м.д.; 0.1(МезРО-25, с); 0,53 и 0,59 (Me-13. R и S, с); 0,94 (Me-21, д); 1,21 (Me-26,27 с): 3,26 и 3,32 (Me0-6, R u
S с)4,18и 4,45(H 6, Ru S д); 4,68и 4,99(Н-7.
S и R, д); 4,96 и 4,82 (С-19, 6S, уш.с, в эоимере); 5,02 и 4,88 (С-19, 6R, уш.с).
Далее раствор отфильтровывают, рэгтворитепь удаляют в вакууме, остаток растворяют в 80 мп метанола, содержащего 2 мл 40%-ного водного раствора ед от нэтра и кипятят при перемешиванни в течении 1 ч. Зкстрагируют 50 мп с леси бенэоп-зфио (1;1) и промывают 3 рэзэ по 50 мч 1>рь1 сушат нпд сульфатом натрия. Пос;е удэпения рпстворитепя в впкуу .е попу пн т 1.1(г неочищенного продук.гэ (I) Boо1 гчпа. о,,;
ЩЭЮГ На КОПОНКЕ С СО НКПГЕЧЕЧ, ОГЦ.ЧО<.;,lÍ
2000301
Составитель И. Федосеева
Техред M.Ìîðãåíòàë Корректор О. Густи
Редактор Л. Павлова
Тираж Подписное
HflO "Поиск" Роспатента
113035, Москва, Ж-35, Раушская наб.. 4/5
Заказ 3064
Производственно-издательский комбинат "Патент", r, Ужгород, ул.Гагарина. 101 ным R2COa. Вещество растворяют в 30 мл бензола, наносят на колонку, колонку промывают бензолом (200 мл). смесью бензолацетон, 99:1 (200 мл, 98:2 (200 мл); 96 4 (600 мл). Фракции, содержащие б-метокси-9,10- 5 секо-3 5-циклохолеста-7,10(19)-диен-25-ол (I), управляют в вакууме. Получают 2 13 r смолообразного продукта (1), выход 79,3 .
Спектр ПМР, д в м,д.: 0,53 и 0,59(Me13, R и S, c); 0.94 (Ме-21, д): 1,21 (Me-26,27, 10 с); 3,26 и 3,32 (Ме0-6, R и S, с); 4,18 и 4,45 (Н-6, R и S, д); 4,68 и 4,99 (Н-7, 5 и R, д); 4,96 и 4,82 (С-19, 6S, уш.с): 5 02 и 4,88 (С-19, 6R, уш.с).
Пример 2. В условиях примера 1 15 конденсируют 10,03 г силилового эфира 4хлор-2-метилбутэнол-2 (V) в 100 мл сухого диэтилового эфира и 4,60 г тозилата (IV) в присутствии 2,53 r бромистой меди как катализатора. Полученный силиловый эфир 20
5;6-метокси-9.10-секо-3,5-ци клохолеста-7, 10(19)диен-25-ол (VI) растворяют в 75 мл этанола, содержащего 1 г бикарбоната натрия, и кипятят при перемешивании в течение 3 ч. После обработки в условиях 25 примера 1 и хроматографической очистки на колонке с окисью алюминия получают
1.98 г целевого продукта (1), выход 71,18 .
Пример 3. Аналогично примеру 1, при температуре реакции 65-70 С конденсиру- 30 ют 5,75 r силилового эфира 4-бром-2-метилбутанол-2 (Ч) в 50 мл сухого диэтилового эфира и 2,31 r тоэилата (1Ч) в присутствии
1,45 г свежеприготовленной иодистой меди как катализатора. Полученный силиловый 35 эфир 6-метокси-9,10-секо-3,5-циклохолеста-7,10(19)-диен-25-ол (VI растворяют в 30 мл этанола. содержащего 0,9 мл 407,-ного водного раствора едкого натра, и выдерживают при температуре 10-15 С в течение 10 40 ч. После обработки в условиях примера 1 и хроматографической очистки на колонке с . силикагелем получают 1,64 г целевого продукта (I), выход 59,04 .
Пример 4. Аналог ично щ.имеру 1, при температуре реакции 25-30 С, конденсируют 5 r силилового эфира 4-хлор-2-метилбутанол-2 (Ч) в 48 мл свежеперегнанного тетрагидрофурана и 2,3 г тозилата (1Ч) в присутствии 1,26 г бромистой меди как катализатора. Полученный силиловый эфир
6-метокси-9,10-секо-3,5-циклохолеста-7,10 (19)-диен-25-ол (Vl) растворяют в 36 мл этанола, содержащего 0,6 г бикарбоната калия, и выдерживают при комнатной температуре в течение 6 ч. После обработки в условиях примера 1 и хроматографической очистки на колонке с окисью алюминия получают 1,59 г целевого продукта (I), выход 57,42, Таким образом, из доступного тозилатэ
6-метокси-23,24-биснор-9.10-секо-3,5-цик лохола-7.10(19)диен-22-ona (IV) в две стадии с высоким выходом синтезирован 6-метокси-9,10-секо-3,5-циклохолеста-7,10(19)дие н-25-ола (I), что значительно упрощает его получение по сравнению с известным методом.
Формула изобретения
Способ получения 6-метокси-9,10-секо3,5-циклохолестэ-7,10(19)-диен-25-ола иэ тозилпроизводного 9,10-секо-3.5-циклохола-7,10(19)-диена, о т л и ч э ю шийся тем, что используют тозилат 6-метокси-23,24,бис-нор-9,10-секо-3,5-циклохолэ-7,10(19)-д иен-22-ола, который конденсируют с Гриньяровским реагентом, полученным из триметилсилиловых эфиров 4-хлор или
4-бром-2-метилбутэн-2-ола в присутствии солей одновалентной меди при температуре
-70-30 С в эфирсодержащем растворителе с последующим гидролизом полученного триметилсилилового эфира — 6-метокси9,10-секо-3,5-циклохолеста-7,10(19)-диен25-ола основаниями, выбранными из группы NaOH, КОН, КНСОз. йаНСОз, в спиртовом растворе при 10-80 С и хроматографической очисткой на нейтральном или щелочном адсорбенте.