Патент ссср 204945
Иллюстрации
Показать всеРеферат
ОПИСАНИЕ
ИЗОБРЕТЕНИЯ
Ссмз Ссветскик
Ссциалистическик
Республик
К ПАТЕНТУ
Зависимый от №
Кл. 45l, Oi00
Заявлено 19.I.1965 (№ 938671/23-4) с присоединением заявки №
Приоритет
Опубликовано 19.II.1968. Бюллетень ¹ 22
Дата опубликования описания 5Л .1968. 1ПК л 01тт
УДК 632,951.2(088.8) Комитет по делам изобретений и открытий при Совете Министров
СССР
Авторы изобретения
Иностранцы
Такеаки Като, Кензо Иеда, Садао Хорие, Тосно Мизутани, Кеимеи Фуджимото и Иоситоси Окуно (Япония) Иностранная фирма
Сумитомо Кемикал Компани Лимитед (Япония) Заявитель
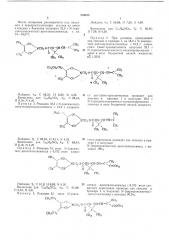
СПОСОБ ПОЛУЧЕНИЯ ИНСЕКТИЦИДНЫХ ЭФИРОВ
ХРИЗАНТЕМОВОЙ ИЛИ ПИРЕТРОВОЙ КИСЛОТЫ радикал общей формулы (3""
Данное изобретение относится к области получения новых производных хризантемовой или пиретровой кислот, позволяющих расширить ассортимент веществ, пригодных для применения в качестве действующего начала в инсектицидных препаратах.
Известен способ получения эфиров хризантемовой или пиретровой кислоты путем взаимодействия ее хлорангидрида с гидроксилсодержащим соединением в растворе органического растворителя в присутствии пиридина.
С целью расширения производных хризантемовой или пиретровой кислоты, согласно изобретению, берут гидроксилсодержащее соединение общей формулы где R> — водород, метил, этил, пропил, изопропил, где Х вЂ” метил, метокси, п — целое число от
10 0 до 2, R2 — водород, метил, этил, пропил, изопропил.
Пример l. 15,5 г Х- (оксиметил) -диметилмалеимида растворяют в смеси, состоящей из
15 50 ил безводного толуола и 12 г безводного пиридина. В этот раствор по каплям добавляют раствор 19,2 г хлористого транс-хризантемоила в 50 мл безводного толуола, реакционный сосуд герметически закрывают, и выдел
20 живают в этом состоянии в течение ночи. Выпавший в осадок солянокислый пиперидин растворяют при добавлении к реакционной смеси 30 лл воды и разделяют два образовавшихся слоя. Органический слой промывают 5%2S ной соляной кислотой, насыщенным раствором бикарбоната натрия, а затем насыщенным раствором хлористого натрия, высушивают над сульфатом натрия и очищают при пропусканпи через колонку с окисью алюминия, 204945
Найдено, %: С 66,88; Н 7,56; N 4,66.
После испарения растворителя под вакуумом и перекристаллизации остатка из смеси я-гексана с бензолом получают 22,5 г N-(хризантемоксиметил) -диметилмалеимида; т. пл.
74 — 78,5 С
Вычислено для С IJINO4, %: С бб 86;
Н 7,59; N 4,59.
П р и и е р 2. При реакции, проведенной как описано в примере 1, из 18,3 г N-(оксиметил) -метилпропилмалеимида с 19,2 г хлористого транс-хризантемои1а получают 29,1 г
10 N- (хризантемоксиметил) -метилпропилмалеи мида в виде бесцветной вязкой жидкости;
I1D 1,5025 снзсн2 и Со
Сн, î.с Сн — CH-pcH-=e С
Ф сн, со о с CV СН
Найдено, о/o.. С 68,31; Н 8,20; N 4,25.
Вычислено для СIoH>NO4, %: С 68,44;
Н 8,16; N 4,20.
Пример 3. Реакцию 18,3 г N-(оксиметил)метилизопропилмалеимида с 19,2 г хлористо15 го цис-транс-хризантемоила проводят как описано в примере 1 и получают 28,3 г
N- (хризантемоксиметил) -метилизопропилма леимида в виде бесцветной вязкой жидкости
Ня / - CH..СО 3!
„ 1... О С,;П; — СН Сн=с! " !1 "Г !
С э ©О
СНя Сна
Найдено, %: С 68 49; Н 8,11; N 4,22.
Вычислено для CIoÍ27NO4, o/o. С 68,44;
Н 8,16; N 420.
Пример 4. Реакцию 0,1 лоль N-(оксиметил)-диметилмалеимида с 0,102 моль хлористого пиретроила проводят как описано в примере 1 и получают
N-(пиретроксиметил) -диметилмалеимид с выходом 86o/о
СНз
СО. .-:-;. - -С СН- С г СООСБз
0 (СН> СБз
Н айдено, %: С 61,8; Н 6,83; N 4,16. метил) - диметилмалеимида с 0,102 моль хлоВычислено для С,,ВН ЗNOo, %: С 61,88: ристого перитроила проводят как описано в
H 6,64; N 4,01. примере 1, и получают N-(пиретроксиметил)Пример 5. Реакцию 0,1 моль N-(окси- -диэтилмалеимид с выходом 90,3%
СНЗСН2 ,. ) э 11 1 " --1,1С;-,э, „.. СЦ-I"„H СН=
О НдС11г з
СН
204945
Найдено, о о: С 63,58; Н 7,33; N 3,84.
Вычислено для С2 Н27М06, %: С 63,64;
Н 7,21; N 3,71.
Пример 6. Реакцию 0,1 моль N-(оксимеФ
|1
Cv-, -Xm,.о С Сн — сн Сн=С .C0i ll i i — C00CX, С сн сн
Найдено, о о: С 66,18; Н 5,94; N 3,55, Вычислено для CggHggNOg, %: С 66,49;
Н 5,83; N 3,52.
Пример 7. Реакцию 0,1 моль N - (оксиметил) -1-этил-2-фенилмалеимида с 0,102 моль
СО / СБ, о С СН-СН.СН =С
С- ) i, / CH о К,, CHç CCHHç
Найдено, о о: С 72,33; Н 7,21; N 3,70.
Вычислено для С зH»NO4, %: С 7242;
Н 7,13; N 3,67.
Пример 8. Реакцию 0,1 моль К - (оксиметил) - 1 - метил-2-(паратолил)-малеимида с — со Й4 мсн,. о С CH-CH.Сн=С со--, - g сн, о с.
СНЗ снЗ
Найдено, о о: С 72,48; Н 7,11; N 3,81.
Вычислено для С2;Н,NO<, %: С 72,42;
Н 713; N 367.
О
-Сн,оН
С/ 9
И о
Способ получения инсектицидных эфиров хризантемовой или пиретровой кислоты путем взаимодействия гидроксилсодержащего соединения с хлорангидридом хризантемовой или ппретровой кислоты в растворе органического растворителя в присутствии пиридина, отличаюи1ийся тем, что, с целью получения продуктов, пригодных для применения в качестве действующего начала инсектицидных препаратов, в качестве гидроксилсодержащего соединения берут вещества общей формулы где R> — водород, пил, радикал общей
<, Предмет изобретения
6 тил) - фенилмалеимида с 0,102 моль хлористого пиретроила проводят как описано в примере 1 и получают N-(пиретроксиметил)-фенилмалеимид с выходом 85%; п 1,5660. хлористого хризантемоила проводят как опи10 сано в примере 1 и получают N-(хризантемоксиметил) -1-этил-2-фенилмалепмид с выходом 90%; т. пл. 98 — 100 С
0,1 моль ангидрида хризантемовой кислоты проводят как описано в примере 1 и получают
N - (хризантемоксиметил) - 1 - метил-2-(паратолил) - малеимид с выходом 83%; т. пл.
82 — 85 С метил, этил, пропил, изопроформулы где Х вЂ” метил, метокси, п — целое число от
0 до 2;
R — водород, метил, этил, пропил, изопропил.