Средство для лечения отравлений фосфорорганическими отравляющими веществами
Иллюстрации
Показать всеНастоящее изобретение может найти применение в медицине для экстренного лечения острых отравлений фосфорорганическими отравляющими веществами, обладающими нервно-паралитическим действием. Предлагается применение 15% водного раствора 1-метил-5-[2’-(бензилдиметиламмонио)этил]карбамоилпиридиний-2-альдоксима дихлорида, существенно превосходящего по лечебной эффективности применяемый в отечественной медицинской практике 15% раствор дипироксима (ТМБ-4, тримедоксима бромид). 3 табл.
Реферат
Настоящее изобретение может найти применение в медицине для экстренного лечения острых отравлений фосфорорганическими отравляющими веществами, обладающими нервно-паралитическим действием (ФОВ НПД), в частности зарином, зоманом и веществом типа Vx. Подобные отравления возможны в ходе уничтожения запасов химического оружия, осуществляемого в соответствии с “Конвенцией о запрещении разработки, производства, накопления и применения химического оружия и его уничтожении”, ратифицированной в РФ 05.12.97 г., а также при террористических атаках (известный случай отравления зарином в Токийском метро).
В настоящее время для лечения отравлений ФОВ НПД предназначены инъекционные лекарственные формы препаратов из группы оксимов - реактиваторов холинэстеразы (ХЭ). Хорошо известны и нашли практическое применение четвертичные и бисчетвертичные производные пиридинальдоксимов: 2-ПАМ хлорид (пралидоксим хлорид) (Iа) и 2-ПАМ метансульфонат (Р2S) (Iб), обидоксим (токсогонин, LuH6) (II), дипироксим (ТМБ-4, тримедоксима бромид) (III) [A.P.Gray. Design and Structure-Activity Relationships of Antidotes to Organophosphorus Anticholinesterase Agents. Drug Metabolism Reviews, 15 (3), 557-589 (1984)]. Они выпускаются в виде готовых водных растворов в автоинъекторах, щприц-тюбиках или в ампулированной форме [М.Д.Машковский. Лекарственные средства, т.1, 201-203. Изд. 14, М., 2000 г. I.Ricordel, J.Meunier. Armes chimiques: antidotes. Apercu sur les moyens actuel, perspectives. Ann. Pharm. Fr., 58 (1), 5-12 (2000)].
Как правило, реактиваторы холинэстеразы применяются в сочетании с препаратами из группы холиноблокаторов (атропин, бензактизин и др.), что значительно повышает эффективность лечения и позволяет снизить дозы обоих препаратов [А.Р.Gray. Design and Structure-Activity Relationships of Antidotes to Organophosphorus Anticholinesterase Agents. Drug Metabolism Reviews, 15 (3), 557-589 (1984); М.Д.Машковский. Лекарственные средства. T.1, 201-203. Изд. 14, М., 2000 г.]. Однако возможно также индивидуальное применение реактиваторов.
Из перечисленных выше реактиваторов ХЭ обидоксим и дипироксим примерно равноэффективны, 2-ПАМ менее активен.
В отечественной медицинской практике используется дипироксим в виде 15 % водного раствора в ампулах [М.Д.Машковский. Лекарственные средства, т.1, 201-203. Изд. 14, М., 2000 г.]. Несмотря на определенные преимущества перед 2-ПАМ, дипироксим (как и обидоксим) все же недостаточно эффективен. К тому же производные 4-пиридинальдоксима, к которым относятся дипироксим и обидоксим, образуют в процессе реактивации ХЭ, протекающей при лечении, относительно стойкие фосфорилированные оксимы, обладающие собственной высокой токсичностью [F.Worek et al., Seventh international Symposium on protection against. GB warfare agents. Stockholm, Sweden, 15-19. June. 2001, p.55]. Это свойство в меньшей степени присуще производным 2-пиридинальдоксима.
Основной задачей настоящего изобретения является создание нового лекарственного средства для экстренного лечения острых отравлений ФОВ НПД, обладающего существенно более высокой лечебной эффективностью по сравнению с существующими средствами. Создание такого средства позволит также расширить ассортимент практически используемых реактиваторов ХЭ.
В настоящее время в Российской Федерации реактиваторы холинэстеразы не производятся и не закупаются по импорту [Регистр лекарственных средств России - Энциклопедия лекарств. Выпуск 10. ООО “РЛС-2003”, стр. 68, 293, 331, 844, 1052]. Производство 15 % раствора дипироксима на “Ай Си Эн Октябрь” прекращено из-за отсутствия сырья-субстанции дипироксима, ранее производившейся в Латвии [Регистр лекарственных средств России. М., 1993, стр. 382]. Описанные в справочнике М.Д.Машковского (т.1, стр. 201-203) инъекционные формы других оксимов (аллоксим, изонитрозин и диэтиксим) по лечебной эффективности значительно уступают дипироксиму.
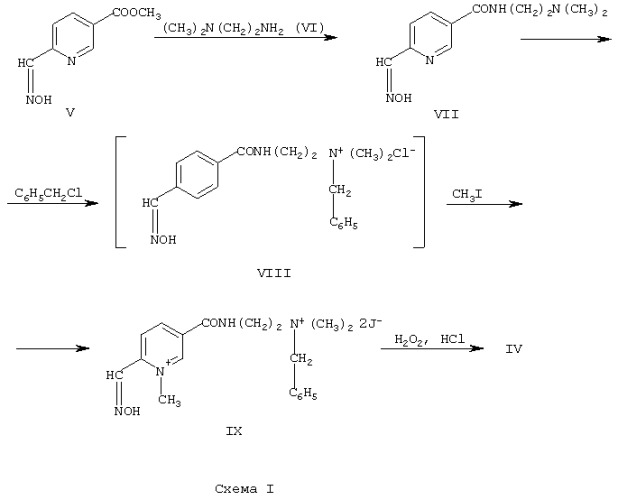
Для решения поставленной задачи предлагается использовать 15 % водный раствор производного 2-пиридинальдоксима - 1-метил-5-[2’-(бензилдиметиламмонио)-этил]-карбамоилпиридиний-2-альдоксима дихлорида (IV):
Синтез оксима (IV) осуществляется по химической схеме I.
Стадия I. Получение 5-[2’-(диметиламино)этил]-карбамоилпиридин-2-альдоксима (VI).
В колбу вместимостью 1 л, снабженную мешалкой и обратным холодильником с затвором, препятствующим контакту реакционной массы с углекислым газом воздуха, загружают 27,8 г (0,315 моль) N,N-диметил-аминоэтилендиамина (VI) и 54,0 г (0,3 моль) 5-метоксикарбонилпиридин-2-альдоксима (V) (Лантвоев В.И., Сомин И.Н. и др. “Способ получения 5-алкоксикарбонилпиридин-2-альдоксимов”. Авт. свид. №1301829, Бюл. изобр. №13, 1987 ). Массу разогревают до 60°С, перемешивают до полной гомогенизации и выдерживают при заданной температуре в течение 60 часов без перемешивания. К закристаллизовавшейся после выдержки массе добавляют по 400 мл этилового спирта и ацетона, перемешивают при кипении до полного растворения. После охлаждения до 0 - +5°C выпавший продукт отфильтровывают, промывают смесью спирта с ацетоном (1:1, 2×70 мл) и сушат при 60°С до постоянной массы.
Выход оксимоамида (VII) 57 г (80,5 %); температура плавления 180-182°С. Найдено (%): С 55,78; Н 6,90; N 23,6. С11Н16О2. Вычислено (%): С 55,91; Н 6,84; N 23,70. Спектр ПМР (ДМСО d6; δ, м.д.): 2,27 с (6Н, N(CH3)2); 3,3-3,7 м (4Н; -СН2-СН2-); 7,94; 8,3; 8,95 (3Н пиридинового ядра); 8,19 с (1Н; CH=N); 8,5 (1Н; CONH). УФ спектр, λmax; нм: в 0,01 н. NaOH 310; в 0,01 н. НСl 255; 290.
Стадия II. Получение 1-метил-5-[2’-(диметилбензиламмонио)этил]-карбамоилпиридиний-2-альдоксима дийодида (IX).
В колбу вместимостью 1 л помещают 59,0 г (0,25 моль) оксимоамида (VII), 115 мл диметилформамида, 34,6 г (0,27 моль) свежеперегнанного хлористого бензила, нагревают массу до 60°С, выдерживают в течение 5 часов. Затем к реакционной массе прикапывают 107 г (0,74 моль) йодистого метила и оставляют в герметично закрытой колбе на 24 часа при 60°С. После завершения выдержки массу охлаждают до комнатной температуры, приливают 225 мл ацетона, перемешивают 1 час, охлаждают до 0 - +5°С и выдерживают при этой температуре в течение суток. Выпавший дийодид отфильтровывают, промывают холодным ацетоном (2×50 мл) и сушат при 60°С до постоянной массы. Получают 136 г (90 %) технического дийодида; содержание основного вещества 98,5 %; температура плавления 188 -189°С.
Стадия III. Получение 1-метил-5-[2’-(диметилбензиламмонио)этил]-карбамоилпиридиний-2-альдоксима дихлорида (IV).
В колбу вместимостью 1 л, снабженную эффективной мешалкой, термометром и капельной воронкой, загружают 800 мл воды, 300 мг трилона Б и 61 г (59,6 г в пересчете на 100 %; 0,1 моль) дийодида (IX). Массу при перемешивании нагревают до 40-45°С и выдерживают до полного ратворения. Затем в колбу последовательно приливают 15 мл толуола, 14 мл (0,157 моль) 35 % соляной кислоты и 13 мл (0,128 моль) 30 % перекиси водорода. После слива реагентов массу выдерживают в течение 1 часа при 40-45°С, охлаждают до 10-20°С и выдерживают еще 2 часа. Водный раствор декантируют от выделившегося комплекса и фильтруют. Фильтрат помещают в колбу, прибавляют к нему 3 г нейтрального активированного угля и перемешивают в течение часа при комнатной температуре. Уголь отфильтровывают, растворитель удаляют в вакуумном ротационном испарителе при температуре 45-50°С. Остаток кристаллизуют из 125 мл этилового спирта. Выпавший белый кристаллический продукт отфильтровывают и сушат при 60°С до постоянной массы. Выход оксима (IV) 26,6 г (64 %); температура плавления 199-201°С (с разложением). Найдено (%): Сl 17,0. Вычислено (%): Сl 17,2. Спектр ПМР (ДМСО (d6; δ, м.д.): 13,5 с (1Н; ОН); 10,5 т (1Н; NH⊕); 8,7 с (1Н; =СН); 9,8 с; 9,0 д; 8,5 д (3Н пиридинового ядра); 7,5-7,6 м (5Н; С6Н5); 4,7 с (2Н; СН2-С6H5); 4,4 с (3Н; >N⊕-СН3); 3,9 т; 3,6 т (4Н; -СН2-СН2-); 3,1 с (6Н; N⊕(CH3)2). УФ спектр, λmax; нм: в 0,01 н. NaOH 356.
Готовая лекарственная форма предлагаемого средства представляет собой 15 % водный раствор оксима IV, содержащий вспомогательные вещества, которые обеспечивают стабильность раствора. Наиболее важным фактором стабильности является поддержание в процессе хранения оптимального интервала рН в пределах от 2,4 до 3,4. Раствор оксима IV, предназначенный для инъекций, может выпускаться в ампульной форме, шприц-тюбиках или в однокамерном автоинъекторе. Для получения стерильной лекарственной формы раствор оксима IV следует подвергнуть мембранной фильтрации в асептических условиях с разливом в ампулы, шприц-тюбики или автоинъекторы в атмосфере инертного газа.
Изготовленный таким образом 15 % раствор оксима IV сравнивали по токсичности, лечебной эффективности и терапевтическому индексу с промышленным образцом 15 % раствора дипироксима (см. табл. 1-3). В табл. 1, 2 приведены токсичность и сравнительные данные по лечебной эффективности индивидуальных реактиваторов III и IV, в табл. 3 - при сочетании указанных реактиваторов с холиноблокатором - циклозилом [М.Д. Машковский. Лекарственные средства, т.1, стр. 213. Изд. 14, М., 2000 г.].
| Таблица 1Токсичность (ЛД50), лечебные дозы (ЕД95) и терапевтический индекс (ТИ) дипироксима (III), 2-ПАМ-хлорида (Iа) и оксима IV, определенные на крысах | |||
| Оксим | ЛД50 мг/кг | ЕД95 МГ/КГ | ТИ |
| Дипироксим | 192±12 | 30 | 6,4 |
| Оксим IV | 297±44 | 2,5 | 11,9 |
| 2-ПАМ-хлорид | 315±32 | 40 | 7,9 |
| Примечание. 1. Величины средней летальной дозы (ЛД50) определены при внутримышечном введении водного раствора оксима. 2. ЕД95 - доза оксима, обеспечивающая выживание 95 % животных, отравленных смертельной дозой (1 ЛД99) зарина (при внутримышечном введении яда и реактива-тора). 3. ТИ = ЛД50/ЕД95. | |||
| Таблица 2Сравнительная лечебная эффективность индивидуальных оксимов III и IV для кошек, отравленных веществом Vx. | |||
| Оксим | Доза оксима мг/кг | Выживаемость в % | |
| Дипироксим | 15 | 20 | |
| Оксим IV | 15 | 60 | |
| контроль | 0 | 0 | |
| Примечание. Данные получены на 10 животных при внутримышечной затравке веществом Vx в дозе 5 мкг/кг. Оксим вводили внутримышечно через 20 минут после яда. |
| Таблица 3Комбинированное лечебное применение дипироксима и оксима IV с холиноблокатором циклозилом (0,2 мг/кг) у крыс, отравленных ФОБ НПД | ||||||
| Оксим | Vx (2 ЛД50) | Зоман (1 ЛД99) | Зарин (1 ЛД99) | |||
| ЕД95 МГ/КГ | ТИ | ЕД95 мг/кг | ТИ | ЕД95 МГ/КГ | ТИ | |
| Дипироксим | 0,50 | 384 | 20,0 | 9,6 | 1,25 | 153 |
| Оксим IV | 0,05 | 5940 | 2,5 | 118 | 0,10 | 2970 |
| Примечание. Внутримышечная затравка ядом. Одновременное внутримышечное введение реактиватора и холиноблокатора (в одном шприце) через 20 минут после затравки. |
Приведенные результаты, полученные на крысах, (таблицы 1, 3) свидетельствуют: как при индивидуальном, так и при комбинированном применении обоих оксимов дипироксим значительно уступает по лечебной эффективности оксиму IV. Лечебные дозы последнего примерно в 10 раз ниже, чем у дипироксима. Так как оксим IV примерно в 1,5 раза менее токсичен, чем дипироксим (табл. 1), соответствующие терапевтические индексы оксима IV превосходят эти величины у дипироксима более чем в 10 раз.
Данные, полученные на кошках, (табл. 2) подтверждают превосходство оксима IV: при равных лечебных дозах обоих препаратов процент выживаемости животных отличается в три раза в пользу оксима IV.
Средство для лечения отравлений фосфорорганическими отравляющими веществами, содержащее реактиватор холинэстеразы из группы бисчетвертичных производных пиридинальдоксимов, отличающееся тем, что в качестве реактиватора холинэстеразы используют 1-метил-5-[2’-(бензилдиметиламмонио)этил]карбамоилпиридиний-2-альдоксима дихлорид в виде 15%-ного водного раствора.