Способ получения 1,3-оксатиоланового нуклеозида, способ получения производного 1,3-оксатиоланил-5-она
Иллюстрации
Показать всеОписывается способ получения 1,3-оксатиолановых нуклеозидов или способ получения производных 1,3-оксатиоланил-5-она, которые включают эффективные методы образования 1,3-оксатиоланового кольца с последующей конденсацией 1,3-оксатиолана с пиримидиновым или пуриновым основанием. С использованием приведенных способов рассматриваемые соединения могут быть получены в виде отдельных энантиомеров с высокой селективностью. 2 с. и 25 з.п.ф-лы, 3 ил.
Реферат
Настоящая заявка относится к способам получения 1,3-оксатиолановых нуклеозидов и имеет приоритет в соответствии с предварительными заявками на патент США №60/096214 от 12 августа 1998 г. и 60/122841 от 3 марта 1999 г.
Предпосылки создания изобретения
Способность различных синтетических нуклеозидов, таких как AZT, D4T, DDI и DDC, ингибировать репликацию ВИЧ in vitro и in vivo привело исследователей в конце 1980-х годов к разработке и испытанию нуклеозидов, в которых атом углерода в 3’-положении замещен гетероатомом. Норбек с соавт. (Norbeck et аl.) раскрыли, что (±)-1-[цис-(2,4)-2-(гидроксиметил)-4-диоксоланил]тимин (обозначаемый как (±)-диоксолан-Т) проявляет умеренную активность против ВИЧ (со значением ЭК50 на АТН8 клетках в 20 мкМ) и является нетоксичным для неинфицированных контрольных клеток в концентрации 200 мкМ (Tetrahedron Letters 30 (46), 6246, (1998)). В публикации по заявке на Европейский патент №337713 и в патенте США №5041449, принадлежащем БиоХемфарма Инк. (BioChemPharma, Inc.), раскрываются рацемические 2-замещенные-4-замещенные-1,3-диоксоланы, которые проявляют противовирусную активность. В опубликованных РСТ заявках US 91/09124 и US 93/08044 раскрываются выделенные β-D-1,3-диоксоланиловые нуклеозиды, применяемые для лечения ВИЧ-инфекции. В документе WO 94/09793 раскрывается использование выделенных β-D-1,3-диоксоланиловых нуклеозидов, применяемых для лечения HBV (вирус гепатита В) инфекции.
Публикация РСТ US 95/11464 раскрывает применимость (-)-(2S,4S)-1-(2-гидроксиметил-1,3-диоксолан-4-ил) цитозина в лечении опухолей и других процессов аномальной клеточной пролиферации.
В патенте США №5047407 и в публикации по заявке на Европейский патент №0382526, также принадлежащей БиоХемфарма, Инк (BioChemPharma, Inc.), показано, что множество рацемических 2-замещенных-5-замещенных-1,3-оксатиоксолановых нуклеозидов обладают противовирусной активностью и конкретно указывается, что рацемическая смесь 2-гидроксиметил-5-(цитозин-1-ил)-1,3-оксатиоксолана (обозначаемая ниже как ВСН-189) обладает примерно той же активностью против ВИЧ, что и AZT, но характеризуется меньшей токсичностью. (-)-Энантиомер ВСН-189 (патент США №5539116, принадлежащий Лиотта с соавт.. (Liotta et al) ), известный как 3ТС, в настоящее время коммерчески доступен и применяется для лечения ВИЧ у человека в Соединенных Штатах. См. также ЕР 513200 В1.
Было также раскрыто, что цис-2-гидроксиметил-5-(5-фторцитозин-1-ил)-1,3-оксотиолан (FTC) проявляет мощную активность в отношении ВИЧ. (См. Schinazi et al., "Selective Inhibition of Human Immunodeficiency Viruses by Racemates and Enantiomers of cis-5-Fluoro-1-[2-(Hydroxymethyl)-1,3-Oxathiolane-5-yl]Cytosine", Antimicrobial Agents and Chemotherapy, November 1992, page 2423-2431. А также патенты США №5814639, 5914331, 5210085 и патент США 5204466, а также WO 91/11186 и WO 92/14743.)
В связи с коммерческой важностью 1,3-оксатиолановых нуклеозидов в патентах и научной литературе описано множество способов их получения. При разработке способа их получения должны приниматься во внимание три ключевых аспекта их синтеза. Во-первых, реакционная схема должна предусматривать эффективный путь создания кольцевой структуры 1,3-оксатиолана, предпочтительно с наличием замещающих групп в соответствующих положениях для использования в последующих реакциях. Во-вторых, схема реакции должна предусматривать эффективные возможности конденсации 1,3-оксатиоланового кольца с защищенным соответствующим образом основанием, которое в случае 3ТС представляет собой цитозин, а в случае FTC представляет собой 5-фторцитозин. В-третьих, такая реакция должна быть стереоселективной, то есть обеспечивать образование нужного энантиомера. Заместители на хиральных углеродах (конкретном пуриновом или пиримидиновом основании) (обозначаемые как С5 заместитель)) и на СН2ОН (обозначаемые как С2 заместитель) в 1,3-оксатиолановых нуклеозидах могут находиться либо в цис-положении (на той же самой стороне), либо в транс-положении (на противоположных сторонах) по отношению к плоскости оксатиолановой кольцевой системы. При этом и цис-, и транс-рацематы включают два оптических изомера. Исходя из этого, каждое соединение имеет четыре индивидуальных оптических изомера. Четыре оптических изомера изображаются следующими конфигурациями (при ориентации оксатиолановой группы в горизонтальной плоскости, так что -S-СН2-группа находится сзади): (1) цис-конфигурация (обозначаемая также как β-конфигурация) - в том случае, когда обе группы находятся “сверху”, и этот вариант представляет собой встречающуюся в природе L-конфигурацию; (2) цис-конфигурация, когда обе группы находятся “снизу”, и это представляет собой не встречающуюся в природе β-цис-конфигурацию; (3) транс-конфигурация (также обозначаемая как α-конфигурация), когда С2 заместитель находится “сверху” и С5 заместитель “снизу”; и (4) трансконфигурация, когда С2 заместитель находится “снизу” и С5 заместитель находится “сверху”. Два цис-энантиомера вместе обозначаются как рацемическая смесь β-энантиомера, а два транс-энантиомера вместе обозначаются как рацемическая смесь α-энантиомеров. В целом, разделение пары рацемических цис-оптических изомеров от пары рацемических транс-оптических изомеров является хорошо разработанной стандартной процедурой. Значительно труднее разделить или каким-то образом выделить индивидуальные энантиомеры в цис-конфигурации. Для 3ТС и FTC желательная стереохимическая конфигурация представляет собой β-L-изомер.
Пути получения 1,3-оксатиоланового кольца
Ниже дана пронумерованная схема 1,3-оксатиоланового кольца:
Краус с соавт. (Kraus et al., "Synthesis of New 2,5-Disubstituted 1,3-Oxathiolanes. Intermediates in Nucleoside Chemistry", Synthesis, pages 1046-1048 (1991)) описывают проблемы, возникающие при проведении реакции альдегида глиоксилата или гликолевой кислоты с меркаптоуксусной кислотой в толуоле в присутствии п-толуолсульфоновой кислоты. Краус отмечает, что для успешности указанной реакции необходимо, чтобы гликолевое производное, находящееся в форме гидрата, было превращено в свободный альдегид при азеотропном удалении воды с толуолом перед проведением циклоконденсации. После этого для восстановления лактоновой группы и группы карбоновой кислоты используют различные каталитические восстановители. При этом восстановление с использованием боргидрида натрия не привело к желаемым результатам, тогда как применение боранметилсульфидного комплекса (БМС) приводит к восстановлению только фрагмента карбоновой кислоты. При повышении температуры или при использовании большого избытка БМС происходящее раскрытие кольца ведет к получению полимерного материала. Восстановление 2-карбокси-1,3-оксатиолан-5-она с помощью гидрида бис(2-метоксиэтокси) алюминия-натрия в толуоле дает смесь продуктов. Гидрид трибутилолова не приводит к нужному восстановлению. И, наконец, при проведении восстановления на защищенных лактонах также не удалось выделить целевое соединение, независимо от условий восстановительного катализа.
В связи с наличием указанных трудностей Краус с соавт. предложили реакцию, которая включает проведение циклоконденсации безводных глиоксилатов с диэтилацеталем 2-меркаптоацетальдегида при температуре кипения с обратным холодильником в толуоле с получением производных 5-этокси-1,3-оксатиолана, которые далее могут быть восстановлены с помощью БМС до соответствующего 2-гидроксиметил-1,3-оксатиолана с 50% выходом, и который после бензоилирования дает смесь цис- и транс-2-бензоилоксиметил-5-этокси-1,3-оксатиолана. Указанный способ описан также в патенте США №5047407.
В патенте США №5248776 раскрывается способ получения энантиомерно чистых β-L-1,3-оксатиолановых нуклеозидов из 1,6-тиоангидро-L-гулозы.
В патенте США №5204466 раскрывается способ получения 1,3-оксатиоланового кольца реакцией меркаптоуксусной кислоты (тиогликолевой кислоты) с гликолевым альдегидом с образованием 2-(R-окси)-метил-5-оксо-1,3-оксатиолана.
Патент США №5466806 описывает способ получения 2-гидроксиметил-5-гидрокси-1,3-оксатиолана посредством реакции димера меркаптоацетальдегида с соединением формулы RwOCH2CHO в нейтральных или щелочных условиях, где Rw обозначает защитную группу гидроксила. (См. также Mclntosh et al., "2-Mercaptoaldehyde dimers and 2,5-dihydrothiophenes from 1,2-oxathiolan-5-ones,"Can. J. Chem. Vol.61, 1872-1875 (1983).)
Белло с соавт. (Belleau et al.) раскрывают способ получения 1,3-диоксоланового нуклеозида посредством окислительного разложения L-аскорбиновой кислоты (Belleau et al., "Oxidative Degradation of L-ascorbic Acid Acetals to 2’, 3’-Dideoxy-3’-Oxaribofuranosides. Synthesis of Enantiomerically Pure 2’,3’-Dideoxy-3’-Oxacytidine Stereoisomers as Potential Antiviral Agents", Tetrahedron Letters, vol.33, №46, 6949-6952 (1992)).
В патенте США №5204466 раскрывается получение 1,3-оксатиоланового кольца посредством озонолиза аллилового простого или сложного эфира формулы CH2=CHCH2OR, где R обозначает защитную группу, с образованием гликолевого альдегида формулы OHCCH2OR, и при добавлении тиогликолевой кислоты к гликолевому альдегиду с образованием лактона формулы 2-(R-окси)-метил-5-оксо-1,3-оксатиолан.
Пути конденсации 1,3-оксатиолана с защищенным основанием
В патенте США №5204466 раскрывается способ конденсации 1,3-оксатиолана с защищенным пиримидиновым основанием при использовании хлорида олова в качестве кислоты Льюиса, причем этот способ обеспечивает практически полную β-стереоселективность (см. также Choi et al., "In Situ Complexation Directs the Stereochemistry of N-Glycosylation in the Synthesis of Oxathiolanyl and Dioxolanyl Nucleoside Analogues," J. Am Chem. Soc. 1991, 213, 9377-9379). Использование хлорида олова приводит к получению в ходе реакции нежелательных остатков и побочных продуктов, которые трудно удалить.
Множество патентов США раскрывают способ получения 1,3-оксатиолановых нуклеозидов через реакцию конденсации 1,3-оксатиоланового интермедиата, который включает хиральный эфир во 2-м положении кольца с защищенным основанием в присутствии кремнийсодержащей кислоты Льюиса. Сложный эфир, находящийся во 2-м положении, далее восстанавливают до соответствующей гидроксиметильной группы, что дает готовый продукт. См. патенты США №5663320; 5864164: 5693787; 5696254; 5744596 и 5756706.
В патенте США №5763606 раскрывается способ получения преимущественно цис-2-карбоновой или тиокарбоновой кислоты 1,3-оксатиолановых нуклеозидов, который включает конденсацию целевого предварительно силилированного пуринового или пиримидинового основания с бициклическим интермедиатом в присутствии кислоты Льюиса.
Патент США №5272151 описывает способ получения 1,3-диоксолановых нуклеозидов, которые включают взаимодействие 2-О-защищенного-5-О-ацилированного-1,3-диоксолана с защищенным по кислороду или азоту пуриновым или пиримидиновым основанием в присутствии титанового катализатора.
Чои с соавт. (Choi et al., "In Situ Complexation Directs the Stereochemistry of N-Glycosylation in the Synthesis of Oxathiolanyl and Dioxolanyl Nucleoside Analogues," J. Am Chem. Soc. 1991, 213, 9377-9379) показали, что в случае использования HgCl2, Et2AlCl или TiCl2(O-изопропил)2 не происходит связывания 1,3-оксатиолана с защищенным пиримидиновым основанием (см. примечание 2). Чои также указал, что взаимодействие между аномерными ацетатами 1,3-оксатиолана с силилированным цитозином и практически любой обычно применяемой кислотой Льюиса, отличной от хлорида олова, приводит к образованию неразделяемых смесей N-гликозилированных аномеров.
В патенте США №5922867 раскрывается способ получения диоксоланового нуклеозида, который включает гликозилирование пуринового или пиримидинового основания с использованием 2-защищенного-оксиметил-4-галоген-1,3-диоксолана.
Пути получения 1,3-оксатиоланового нуклеозида в желательной стереоконфигурации
В патенте США №5728575 заявляется способ получения 3ТС и FTC энзиматической реакцией 5’-ацил-защищенного рацемического нуклеозида с использованием эстеразы из печени свиньи, липазы из поджелудочной железы свиньи или субтилизина. В патенте США №5539116 заявляется продукт ЗТС, получаемый в результате разделения продукта по способу патента ‘575.
В патенте США №5827727 (Liotta) заявляется способ получения 3ТС и FTC реакцией стереоселективного дезаминирования с использованием цитидиндезаминазы.
В патенте США №5892025 (Liotta et al.) заявляется способ разделения конденсации энантиомеров цис-FTC при пропускании цис-FTC через колонку с хиральным ацетилированным β-циклодекстрином.
В патенте США №5663320 заявляется способ получения хирального 1,3-оксатиоланового интермедиата, который включает разделение рацемического интермедиата на основе методики, основанной на использовании хиральных свойств.
В связи с важностью 1,3-оксатиолановых нуклеозидов для лечения заболеваний, вызванных вирусом иммунодефицита человека и вирусом гепатита В, настоящее изобретение ставит своей целью разработку способов получения 1,3-оксатиолановых нуклеозидов, которые могут использоваться в производственном масштабе.
Краткое описание сущности изобретения
Предлагаются способы получения 1,3-оксатиолановых нуклеозидов, которые включают эффективные методы образования 1,3-оксатиоланового кольца с последующей конденсацией 1,3-оксатиолана с пиримидиновым или пуриновым основанием. С использованием приведенных в описании способов указанное соединение может быть получено в виде изолированного энантиомера.
Было показано, что 2-[R1С(О)OCH2]-1,3-оксатиоланил-5-он может быть получен с высоким выходом при непосредственном взаимодействии ацеталя формулы (R1O)2CHR, где R обозначает -(СН2-О-С(О)R1 и R1 обозначает алкил, арил, гетероарил, гетероциклический радикал, алкарил, алкилгетероарил или алкилгетероциклический радикал, или аралкил, с меркаптоуксусной кислотой в органическом растворителе, например в ацетонитриле, в присутствии кислоты Льюиса или протонной кислоты в органическом растворителе с минимальным количеством воды. В альтернативном варианте может использоваться предшественник альдегида (ОН)2СНR или (R1O) (OH)CHR. Ацеталь может также использоваться в виде смеси полуацеталя, мономера ацеталя или его продуктов с более высокой степенью конденсации. При взаимодействии меркаптоуксусной кислоты непосредственно с ацеталем количество побочных продуктов снижается, что в свою очередь повышает чистоту продукта и выход указанного исходного материала. Ацеталь получают обычным способом, например при взаимодействии диэфира спирта с н-бутирилхлоридом.
(R1O)2CHR может быть получен любым подходящим способом, в частности, например, либо (i) реакцией соединения формулы ОН-СН2-С=С-СН2-ОН с RC(O)Cl с образованием RC(O)OCH2C(H)=C(H)OC(О)R, который озонируют или каким-либо другим способом расщепляют с получением целевого соединения, либо (ii) при восстановлении (R1O)2CHC(О)Н с образованием (R1O)2CHCH2OH, который далее взаимодействует с ClC(O)R с образованием целевого соединения.
Альтернативно НС(О)СН2ОС(О)R1 взаимодействует с меркаптоуксусной кислотой с образованием целевого 1,3-оксатиоланового кольца. НС(О)СН2OС(О)R1 может быть получен с помощью любого приемлемого способа, например, способов А и В, приведенных на фиг.2.
5-(O-защищенная группа)-2-защищенный гидроксиметил-1,3-оксатиолан или его 5-ацетилокси производное могут быть конденсированы с соответствующим силилированным пиримидиновым или пуриновым основанием, включая цитозин или 5- фторцитозин, с использованием кислоты Льюиса, такой как хлорид олова, (Сl)3Тi. (изопропоксид), триметилсилилтрифлат, триметилсилилиодид или другая кислота Льюиса, которая известна своей способностью катализировать конденсацию, включая те кислоты Льюиса, которые были описаны в патентах США №5663320; 5864164; 5693787; 5696254; 5744596 и 5756706, с получением соответствующего нуклеозида с высокой β-селективностью. Было обнаружено, что (Сl)3Тi(изопропоксид) может применяться в качестве катализатора для конденсации 1,3-оксатиолана с защищенным основанием, тогда как ранее сообщалось, что в случае защищенного пиримидинового основания и 1,3-оксатиолана не происходит конденсации при использовании HgCl2, Et2AlCl или ТiСl2(O-изопропил)2.
В альтернативном варианте осуществления изобретения гликолевая кислота используется вместо меркаптоуксусной кислоты в присутствии кислоты Льюиса с образованием соответствующего 1,3-диоксолана, который может быть конденсирован с пуриновым или пиримидиновым основанием с образованием 1,3-диоксоланового нуклеозида. Предпочтительно проводить циклоконденсацию ацеталя (или альдегида) с гликолевой кислотой в присутствии кислоты Льюиса, такой как диэтилэтерат трифторида бора, а не протонной кислоты, такой как п-толуолсульфоновая кислота.
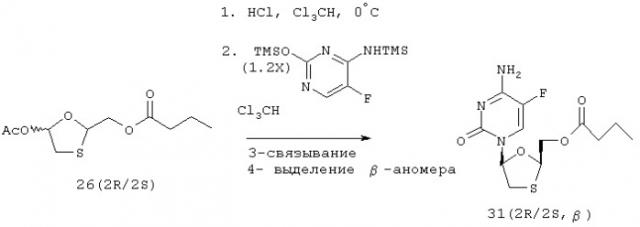
Было также показано, что 1,3-оксатиолановый нуклеозид может быть получен посредством: (i) образования 5-галоген-2-защищенного-оксиметил-1,3-оксатиолана, и (ii) взаимодействия 5-галоген-2-защищенного-оксиметил-1,3-оксатиолана с защищенным пуриновым или пиримидиновым основанием при низкой температуре, предпочтительно ниже 25 градусов Цельсия и более предпочтительно ниже 10 градусов Цельсия. Было обнаружено, что реакция конденсации может быть эффективно проведена и без использования кислоты Льюиса. В предпочтительном варианте реализации изобретения галогеновый заместитель в 5 положении оксатиолана представляет собой хлор. В типичном варианте реакция приводит к образованию смеси β- и α-аномеров, которые должны быть разделены. В типичном случае β-аномер образуется в избытке относительно α-аномера. Разделение β- и α-аномеров может быть осуществлено любым известным способом, включая фракционную кристаллизацию, хроматографию (ахиральную или хиральную) или получение и разделение диастереомерных производных. В одном варианте реализации изобретения рацемический 5-ацилированный-2-защищенный-оксиметил-1,3-оксатиолан хлорируют при низкой температуре (например, при температуре 0 градусов Цельсия), затем конденсируют с защищенным основанием, таким как 5-фторцитозин или цитозин, с получением смеси диастереомеров (в типичном случае при значительном избытке β-соединения). В другом варианте реализации изобретения хиральный 5-ацилированный-2-защищенный-оксиметил-1,3-оксатиолан хлорируют и затем используют в реакции взаимодействия с защищенным основанием. Может использоваться любой 5-ацилированный-2-защищенный-оксиметил-1,3-оксатиолан, который обеспечивает получение желательного продукта. Неограничивающие примеры соответствующих ацильных групп включают, не ограничиваясь ими, ацетат, пропионат, бутират, бензоат, п-метоксибензоат и п-(т-бутил)-бензоат. Реакция галогенирования может быть проведена в любом приемлемом органическом растворителе, включая толуол, хлороформ, уксусную кислоту, тетрагидрофуран, диэтиловый эфир, бензол и др. На коэффициент соотношения аномеров α к β, достигаемый в реакции конденсации, может оказывать влияние растворитель, выбранный для использования в данной реакции. При этом любой специалист может путем подбора выбрать тот органический растворитель, который обеспечивает оптимальный выход желательного продукта.
Краткое описание фигур
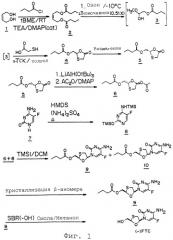
Фиг.1 представляет собой иллюстрацию одного из способов получения 1,3-оксатиоланового нуклеозида согласно изобретению, который включает получение 2-[R1C(О)ОСН2]-1,3-оксатиоланил-5-она посредством взаимодействия ацеталя формулы (R1O)2CHR, где R обозначает -(СН2-О-С(О)R1), с меркаптоуксусной кислотой.
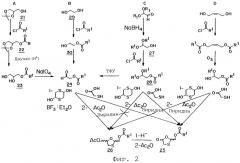
Фиг.2 представляет собой схематическую иллюстрацию четырех альтернативных способов (A-D) образования 1,3-оксатиоланового кольца согласно изобретению.
Фиг.3 представляет собой схематическую иллюстрацию получения энантиомеров 1,3-оксатиоланового нуклеозида с использованием процедуры разделения до и после связывания.
Подробное описание изобретения
Предлагается способ получения 1,3-оксатиолановых нуклеозидов, которые включают эффективные способы образования 1,3-оксатиоланового кольца и последующую реакцию конденсации 1,3-оксатиолана с пиримидиновым или пуриновым основанием.
Было показано, что 2-[R1C(О)OCH2O]-1,3-оксатиоланил-5-он может быть получен с высоким выходом при непосредственном взаимодействии ацеталя формулы (алкилО)2CHR, где R обозначает -(СН2-О-С(О)R1), и R1 обозначает алкил, арил, гетероарил, алкарил, алкгетероарил или аралкил с меркаптоуксусной кислотой в присутствии кислоты Льюиса или протонной кислоты в органическом растворителе с минимальным количеством воды. Ацеталь может использоваться в виде смеси полуацеталя, мономера ацеталя или его продукта конденсации. При непосредственном взаимодействии меркаптоуксусной кислоты с ацеталем количество побочных продуктов снижается, что, в свою очередь, повышает чистоту продукта и выход исходного материала.
5-(O-защищающая группа)-2-защищенный гидроксиметил-1,3-оксатиолан или его 5-ацетилокси производное могут быть подвергнуты конденсации с защищенным силилсодержащим пиримидиновым или пуриновым основанием, включая цитозин или 5-фторцитозин, с использованием кислоты Льюиса, такой как хлорид олова, (Сl)3Тi(изопропоксид), триметилсилилтрифлат, триметилсилилиодид или другая кислота Льюиса, катализирующая реакцию конденсации, включая те кислоты Льюиса, которые были описаны в патентах США №5663320; 5864164; 5693787; 5696254; 5744596 и 5756706, с получением соответствующего нуклеозида с высокой β-селективностью. Было обнаружено, что (Сl)3Ti(изопропоксид) может применяться в качестве катализатора для конденсации 1,3-оксатиолана с защищенным основанием, несмотря на имевшиеся сообщения о том, что 1,3-оксатиолан с защищенным пиримидиновым основанием не конденсируется в присутствии HgCl2, Et2AlCl или TiCl2(O-изопропил)2.
В альтернативном варианте реализации изобретения меркаптоуксусную кислоту используют вместо гликолевой кислоты с образованием соответствующего 1,3-диоксолана, который может быть конденсирован с пуриновым или пиримидиновым основанием с образованием 1,3-диоксоланового нуклеозида. Предпочтительно реакцию циклоконденсации ацеталя (или альдегида) с гликолевой кислотой проводят в присутствии кислоты Льюиса, такой как диэтилэтерат трифторида бора, а не протонной кислоты, такой как п-толуолсульфоновая кислота.
Было также показано, что 1,3-оксатиолановый нуклеозид может быть получен посредством: (i) образования 5-ацилированного-2-защищенного-оксиметил-1,3-оксатиолана и (ii) взаимодействия 5-галоген-2-защищенного-оксиметил-1,3-оксатиолана с защищенным пуриновым или пиримидиновым основанием при низкой температуре, предпочтительно ниже 25 градусов Цельсия и более предпочтительно ниже 10 градусов Цельсия. Было обнаружено, что реакция конденсации может быть эффективно проведена без использования кислоты Льюиса. В предпочтительном варианте реализации изобретения галогеновый заместитель в 5-м положении оксатиолана представляет собой хлор. В типичном случае реакция приводит к образованию смеси β- и α-аномеров, которые должны быть разделены. В типичном случае β-аномер образуется в избытке относительно α-аномера. Разделение β- и α-аномеров может быть осуществлено любым известным способом, включая фракционную кристаллизацию, хроматографию (ахиральную или хиральную) или получение и разделение диастереомерных производных. В одном варианте реализации изобретения рацемический 5-ацилированный-2-защищенный-оксиметил-1,3-оксатиолан хлорируют при низкой температуре (например, при температуре 0 градусов Цельсия) и затем конденсируют с защищенным основанием, таким как 5-фторцитозин или цитозин, с получением смеси диастереомеров (в типичном случае при значительном избытке β-соединения). В другом варианте реализации изобретения хиральный 5-ацилированный-2-защищенный-оксиметил-1,3-оксатиолан хлорируют и затем используют в реакции взаимодействия с защищенным основанием. Может использоваться любой 5-ацилированный-2-защищенный-оксиметил-1,3-оксатиолан, который обеспечивает получение целевого продукта. Неограничивающие примеры соответствующих ацильных групп включают, не ограничиваясь ими, ацетат, пропионат, бутират, бензоат, п-метоксибензоат и п-(т-бутил)-бензоат. Реакция галогенирования может быть проведена в любом приемлемом органическом растворителе, включая толуол, хлороформ, уксусную кислоту, тетрагидрофуран, диэтиловый эфир, бензол и др. На коэффициент соотношения аномеров α к β, достигаемый в реакции конденсации, может оказывать влияние вид растворителя, выбранного для использования в данной реакции. При этом любой специалист в данной области может методом подбора выбрать тот органический растворитель, который обеспечивает оптимальный выход желательного продукта.
Выбранный 5-ацилированный-2-защищенный-оксиметил-1,3-оксатиолан может быть галогенирован, например, до получения 5-хлор, 5-бром или 5-йод производного с использованием известных методов.
Хиральные стационарные фазы для проведения хиральной хроматографии описаны во множестве работ, включая, например, работу Стради с соавт. (Stradi et al. Analytical Enantioseparations, Polysaccharides and their Derivatives as Chiral Stationary Phases. Perkin Elmer, 1992).
Вместо 5-ацильной группы может использоваться любая другая удаляемая группа, которая может быть замещена и заменена галогеном и предпочтительно хлоридом. Такие примеры включают алкокси, алкоксикарбонил, амидо, азидо и изоцианато.
I. Определения
В контексте настоящего описания термин “выделенный энантиомер” относится к нуклеозидной композиции, которая включает по меньшей мере примерно от 95% до 100% или более предпочтительно свыше 97% чистого энантиомера указанного нуклеозида.
Термин “пуриновое или пиримидиновое основание” включает, не ограничиваясь приведенным списком, 6-алкилпурин и N6-алкилпурины, N6-ацилпурины, N6-бензилпурин, 6-галогенпурин, N6-ацетиленовый пурин, N6-ацилпурин, N6-гидроксиалкилпурин, 6-тиоалкилпурин, N2-алкилпурины, N4-алкилпиримидины, N4-ацилпиримидины, 4-галогенпиримидины, N4-ацетиленовые пиримидины, 4-амино- и N4-ацилпиримидины, 4-гидроксиалкилпиримидины, 4-тиоалкилпиримидины, тимин, цитозин, 6-азапиримидин, включая 6-азацитозин, 2- и/или 4-меркаптопиримидин, урацил, C5-aлкилпиpимидины, С5-бензилпиримидины, C5-гaлoгeнпиpимидины, С5-винилпиримидин, С5-ацетиленовый пиримидин, C5-aцилпиpимидин, С5-гидроксиалкилпурин, C5-aмидoпиpимидин, C5-циaнoпиpимидин, С5-нитропиримидин, С5-аминопиримидин, N2-aлкилпypины, N2-aлкил-6-тиопурины, 5-азацитидинил, 5-азаурацилил, триазолопиридинил, имидазолопиридинил, пирролопиримидинил и пиразолопиримидинил. Функциональные кислородные и азотные группы на основании могут быть защищены, если это необходимо или желательно. Приемлемые защитные группы хорошо известны специалистам в данной области и включают триметилсилильные, диметилгексилсилильные, т-бутилдиметилсилильные и т-бутилдифенилсилильные, тритильные, алкильные группы, а также ацильные группы, такие как ацетил и пропионил, метансульфонил и п-толуолсульфонил. Предпочтительные основания включают цитозин, 5-фторцитозин, урацил, тимин, аденин, гуанин, ксантин, 2,6-диаминопурин, 6-аминопурин, 6-хлорпурин и 2,6-дихлорпурин.
Термин “алкил” в контексте настоящего описания, если не указано иное, относится к насыщенному линейному, разветвленному или циклическому, первичному, вторичному или третичному углеводороду, в типичном случае от C1 до C18 и конкретно включает метил, этил, пропил, изопропил, бутил, изобутил, т-бутил, пентил, циклопентил, изопентил, неопентил, гексил, изогексил, циклогексил, циклогексилметил, 3-метилпентил, 2,2-диметилбутил и 2,3-диметилбутил. Алкильная группа может быть необязательно замещена одной или большим числом групп, выбранных из группы, состоящей из гидроксила, групп карбоновой кислоты или сложного эфира, амино, алкиламино, ариламино, алкокси, арилокси, нитро, циано, сульфоновой кислоты, сульфата, фосфоновой кислоты, фосфата или фосфоната, либо незащищенных, либо защищенных, если это необходимо, в соответствии с известной специалистам в данной области методикой, например, приведенной в руководстве Грина с соавт. (Green et al., "Protective Groups in Organic Synthesis", John Wiley and Sons, Second Edition, 1991), включенном в настоящее описание в качестве ссылки.
Термин “защищенный” в контексте настоящего описания, если особо не оговорено иное, относится к группе, которая добавляется к атому кислорода, азота или фосфора для предупреждения его дальнейшего взаимодействия или для других целей. Специалистам в области органического синтеза известен широкий перечень защищающих групп для кислорода и азота. Приемлемые защищающие группы описаны, например, в руководстве Грина с соавт. (Green et al., "Protective Groups in Organic Synthesis", John Wiley and Sons, Second Edition, 1991), включенном в настоящее описание в качестве ссылки.
Термин "арил" в контексте настоящего изобретения, если особо не оговорено иное, относится к фенилу, бифенилу или нафтилу и обозначает предпочтительно фенил. Арильная группа может быть необязательно замещена одной или большим числом групп, выбранных из группы, состоящей из гидроксила, амино, алкиламино, ариламино, алкокси, арилокси, нитро, циано, сульфоновой кислоты, сульфата, фосфоновой кислоты, фосфата или фосфоната, которые могут быть либо незащищенные, либо защищенные, если это необходимо, с использованием методик, известных специалистам в данной области техники и приведенной, например, в руководстве Грина с соавт. (Green et al., "Protective Groups in Organic Synthesis", John Wiley and Sons, Second Edition, 1991), включенном в настоящее описание в качестве ссылки.
Термин “алкарил”, или “алкиларил” относится к алкильной группе с арильным заместителем.
Термин “аралкил”, или “арилалкил” относится к арильной группе с алкильным заместителем.
Термин “галоген” в контексте настоящего описания включает хлор, бром, йод и фтор.
Термин “ацил” относится к группе формулы -C(O)R’, где R’ обозначает алкил, арил, алкарил, аралкил, гетероароматическую, гетероциклическую группы, алкоксиалкил, включающий метоксиметил; арилалкил, включающий бензил; арилоксиалкил, такой как феноксиметил; арил, включающий фенил, необязательно замещенный галогеном, C1-C4алкилом или C1-C4алкокси или аминокислотным остатком.
В контексте настоящего описания удаленная группа относится к функциональной группе, которую в соответствующих условиях отщепляют от молекулы, к которой она была присоединена.
Термин “гетероарил”, или “гетероциклический радикал” в контексте настоящего описания относится к циклической группе, которая включает в кольце по меньшей мере один атом серы, кислорода или азота. Неограничивающие примеры указанной группы включают фурил, пиридил, пиримидил, тиенил, изотиазолил, имидазолил, тетразолил, пиразинил, бензофуранил, бензотиофенил, хинолил, изохинолил, бензотиенил, изобензофурил, пиразолил, индолил, изоиндолил, бензимидазолил, пуринил, карбазолил, оксазолил, тиазолил, изотиазолил, 1,2,4-тиадиазолил, изоксазолил, пирролил, хиназолинил, пиридазинил, пиразинил, циннолинил, фталазинил, хиноксалинил, ксантинил, гипоксантинил и птеридинил. Функциональные кислородные и азотные группы на гетероциклическом основании могут быть защищены, если это необходимо или желательно. Подходящие защищающие группы хорошо известны специалистам в данной области и включают триметилсилил, диметилгексилсилил. Алкильная группа может быть необязательно замещена одним или большим числом групп, выбранных из группы, состоящей из гидроксила, группы карбоновой кислоты или сложного эфира, амино, алкиламино, ариламино, алкокси, арилокси, нитро, циано, сульфоновой кислоты, сульфата, фосфоновой кислоты, фосфата или фосфоната, которые могут быть либо незащищены, либо защищены, если это необходимо, в соответствии с известной специалистам данной области методикой и приведенной, например, в руководстве Грина с соавт. (Green et al., "Protective Groups in Organic Synthesis", John Wiley and Sons, Second Edition, 1991), которое включено в настоящее описание в качестве ссылки.
Термин “алкилгетероарил” относится к алкильной группе, замещенной гетероарильным заместителем.
II. Получение лактонового кольца 1,3-оксатиолана
На фиг.1 показан один путь осуществления описанного процесса. 2-бутен-1,4-диол взаимодействует с хлорангидридом карбоновой кислоты или другим эфирным предшественником с образованием 2-бутен-1,4-диолового диэфира. Выбор хлорангидрида карбоновой кислоты или другого предшественника сложного эфира определяется группой, которую желательно иметь во 2-м положении образующегося 1,3-оксатиоланового кольца. Так, например, если бутирилхлорид взаимодействует с 2-бутен-1,4-диолом, то в получаемом 2-[R1C(О)ОСН2О]-1,3-оксатиоланил-5-оне R1 будет пропилом. В другом варианте реализации изобретения хлорангидрид карбоновой кислоты или другой эфирный предшественник выбирают так, чтобы R1 был алкилом, арилом, гетероарилом, алкарилом, алкилгетероарилом или аралкилом.
На второй стадии реакции 2-бутен-1,4-диэфир расщепляют предпочтительно путем озонолиза с получением ацеталя формулы (алкилО)2CHR, в которой R обозначает (СН2-О-С(О)R1), где R1 обозначает алкил, арил, гетероарил, алкарил, алкилгетероарил или аралкил. Реакцию озонолиза в типичном случае проводят при очень низких температурах, обычно при температуре -70°С или ниже. В случае проведения реакции при более высокой температуре, например при -10°С, необходимы специальные низкотемпературные реакторы. Реакция, приводящая к образованию ацеталей, может быть проведена с использованием различных спиртовых растворителей при наличии или в отсутствие дополнительных растворителей, таких как дихлорметан. Предпочтительным спиртовым растворителем является метанол. Реакцию озонолиза чаще всего гасят диметилсульфидом, однако было показано, что применение тиомочевины позволяет получать целевой продукт с более высокой степенью чистоты.
В альтернативном варианте ацеталь формулы (алкилО)2CHR, где R обозначает (CH2OC(O)R’) и R7 обозначает алкил, арил, гетероарил, алкилгетероарил или аралкил, может быть получен при ацилировании (алкилО)2CHCH2OH галогенидом или ангидридом соответствующей кислоты в присутствии основания, такого как триэтиламин.
На ключевой стадии процесса ацеталь непосредственно взаимодействует с меркаптоуксусной кислотой в присутствии кислоты Льюиса или протонной кислоты в органическом растворителе с минимальным количеством воды. Ацеталь может быть использован в виде смеси полуацеталя, мономера ацеталя или продуктов его конденсации. При этом для использования в рамках настоящего способа приемлема любая протонная кислота или кислота Льюиса, которая приводит к получению целевого продукта. Было показано, что реакция циклоконденсации ацеталя с меркаптоуксусной кислотой приводит к эффективному образованию 1,3-оксатиолана. И наоборот, циклоконденсация альдегида с меркаптоуксусной кислотой зачастую сопряжена с рядом проблем, что сказывается на более низких выходах целевого продукта 1,3-оксатиолана, загрязненного непрореагировавшим альдегидом, а также ведет к образованию альдегидных побочных продуктов.
На следующей стадии 2-защищенный гидроксиметил-5-оксо-1,3-оксатиолан разделяют с использованием большого числа приемлемых методов, известных в технике. Заместитель во 2-м положении выбирают с учетом легкости его разделения на этой стадии. Таким заместителем может быть, например, группа, которая стереоселективно расщепляется ферментом. В патенте США №5204466 (Liotta et al.) описывается способ разделения оксатиолана путем стереоселективного ферментного гидролиза с использованием липазы из поджелудочной железы свиньи, субтилизина или эстеразы из печени свиньи. В патенте США №5663320 заявлен способ получения хирального интермедиата 1,3-оксатиолана, который включает разделение рацемического интермедиата с использованием хиральной техники. В WO 91/17159 раскрывается использование хиральных колонок с триацетатом целлюлозы или с β-циклодекстрином для разделения энантиомеров 1,3-оксатиолановых нуклеозидов.
Выделенный целевой (2R)-энантиомер 2-защищенного гидроксиметил-5-оксо-1,3-оксатиолана, который в случае 3ТС и FTC дает β-L-энантиомер, восстанавливают до соответствующего 5-O-защищенного соединения, например до 5-ацетата, с использованием восстановителя, предпочтительно три-трет-бутоксиалюмогидрида лития.
На фиг.2 показаны четыре дополнительных варианта реализации настоящего изобретения (способы A-D), применяемые для получения 1,3-оксатиоланового кольца. В ка