Антитело igg с аффинностью связывания в отношении антигенного комплекса cd3, рекомбинантные нуклеиновые кислоты, кодирующие легкую и тяжелую цепи антитела, способ получения системы, способ получения антитела, способ лечения пациента
Иллюстрации
Показать всеИзобретение относится к области генной инженерии, конкретно к новым антителам, направленным против антигенного комплекса CD3 и может быть использовано в терапевтических целях. Антитело IgG, обладает аффинностью связывания в отношении антигенного комплекса CD3, в котором тяжелая цепь содержит каркас вариабельной области человека вместе с по меньшей мере одним CDR, выбранным среди аминокислотных последовательностей SEQ ID NO 2, 4 и 6 и их соответствующих консервативно модифицированных вариантов, а легкая цепь содержит каркас вариабельной области грызуна вместе с по меньшей мере одним CDR, выбранным среди аминокислотных последовательностей SEQ ID NO 8, 10 и 12 и их соответствующих консервативно модифицированных вариантов. Антитело получают путем культивирования прокариотической или эукариотической клетки, котрансформированной вектором, содержащим рекомбинантную нуклеиновую кислоту, кодирующую легкую цепь антитела, и вектором, содержащим рекомбинантную нуклеиновую кислоту, кодирующую тяжелую цепь антитела. Антитело в эффективном количестве вводят пациенту, страдающему злокачественной опухолью или нуждающемуся в иммуносупрессии. Изобретение позволяет получить химерные антитела против CD3, способные эффективно продуцироваться эксперссионными системами про- и эукариотических клеток с повышенным выходом, 6 н. и 27 з.п. ф-лы, 5 ил.
Реферат
Настоящее изобретение относится к новым антителам, направленным против антигенного комплекса CD3, к ДНК и РНК, кодирующим продуцирование этих антител, к клеточным линиям, содержащим такие ДНК и/или РНК, способным к их продуцированию, и к способам получения антител с использованием указанных ДНК, РНК и/или клеток.
Антиген человека CD3 состоит минимум из четырех инвариантных полипептидных цепей, которые нековалентно связаны с Т-клеточными рецепторами на поверхности Т-клеток, и теперь называется, как правило, антигенным комплексом CD3. Указанный комплекс весьма глубоко вовлекается в процесс Т-клеточной активации в ответ на узнавание антигена Т-клеточными рецепторами. Все моноклональные антитела против CD3 можно использовать для повышения чувствительности Т-клеток к вторичным пролиферативным стимулам, таким как IL1 (интерлейкин-1) и IL2 (интерлейкин-2). Кроме того, некоторые моноклональные антитела против CD3 сами являются митогенными в отношении Т-клеток. Это свойство является изотипически зависимым и является результатом взаимодействия Fc-домена антитела против CD3 с рецепторами Fc на поверхности А-клеток.
Антитела против CD3 используют для воздействия на иммунологический статус посредством подавления, усиления или переориентации Т-клеточных реакций на антигены. Следовательно, они обладают значительным терапевтическим потенциалом для применения в качестве иммунодепрессивных средств у человека, например для лечения отторжения после трансплантации почечных, печеночных или сердечных аллографтов.
WO 92/06193 и равноценные ей заявки (GB 2249310A, заявки №№ЕР.91917169.4, JP 516117/91 и заявка на патент США, регистрационный номер №07/862543, содержание которых включено в настоящее описание в качестве ссылок) относятся к антиглобулиновой реакции антител против CD3 с помощью реконструирования или "гуманизации" генов вариабельной области антител и экспрессирования их в сочетании с соответствующими генами константных доменов антител человека. При этом содержание моноклональных антител, отличных от человеческих, снижается настолько, что антиглобулиновая реакция маловероятна.
WO 93/19196 и ее эквиваленты (например, Европейский патент 0586617, патент США 5585097 и заявка на патент США, регистрационный №08/478684, все включены в настоящее описание в качестве ссылок) относятся к первичной иммунизации. В них описывается применение агликозилированных гуманизированных антител против CD3 подкласса IgG, которые неожиданно сохраняют свою антиген-связывающую специфичность и иммунодепрессивные свойства и все еще не индуцируют Т-клеточный митогенез in vitro и индуцируют пониженный уровень высвобождения цитокинов in vivo, в то же время сохраняя некоторую связывающую способность в отношении Fc.
Хотя такие антитела против CD3 обладают высокой терапевтической ценностью, получить их в клеточной структуре непросто. На практике выявлено, что плохой выход антител сопровождается плохим ростом трансфицированной клеточной линии. После длительной работы в течение нескольких лет самый лучший достигнутый уровень получения антител составляет примерно 10 мкг/мл, причем клетки, экспрессирующие антитела против CD3, растут очень медленно. Кроме того, указанные клетки в системах с полыми картриджами, используемыми в крупномасштабном производстве, со временем становятся непродуктивными.
Векторная система РЕЕ12 Celltech Glutamine Synthesis, используемая при указанной выше экспрессии антител против CD3, обычно обеспечивает экспрессию других гуманизированных антител на уровне примерно 200 мкг/мл. Исходная гибридомная клеточная линия крысы (YTH 12.5) экспрессировалась в клеточной культуре на относительно нормальном уровне в 100 мкг/мл, что указывает на плохое продуцирование антител, связанное с гуманизированной формой. Оказывается, что имеются один или несколько экспрессированных гуманизированных белков, являющихся токсичными для клеток, поскольку после трансфекции клетки становятся непродуктивными быстрее, чем растут.
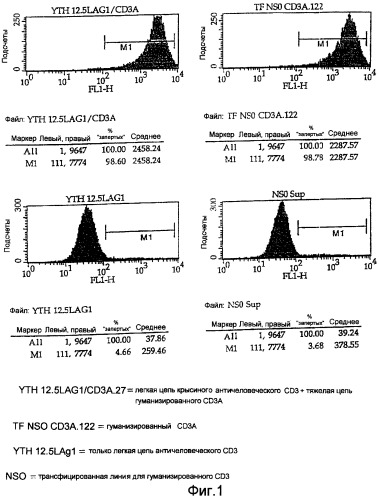
Авторы настоящего изобретения неожиданно обнаружили, что посредством получения химерной формы антител против CD3, связывания вариабельной области легкой цепи СDЗ крысы с константной областью лямбда человека и клонирования полученной формы в РЕЕ12, содержащей агликозилированную тяжелую цепь гуманизированного CD3, можно получить миелоидные клеточные линии, обеспечивающие экспрессию функциональных агликозилированных антител против CD3 в количестве 60-100 мкг на мл культуры. Посредством использования клонирования методом серийных разведении можно отобрать некоторые клоны и обеспечить еще более высокий уровень экспрессии, например порядка 120 мкг/мл, и при получении в крупном масштабе сохранить устойчивую долгоживущую культуру без неблагоприятного действия на рост клеток. Таким образом, химерные антитела настоящего изобретения показывают хорошую способность к продуцированию в отсутствие антиглобулиновой реакции, обычно связанной с антителами, полученными от крыс.
Соответственно, настоящее изобретение относится к антителу IgG, обладающему аффиностью связывания в отношении антигенного комплекса CD3, в котором тяжелая цепь содержит каркас вариабельной области вместе с по меньшей мере одним CDR, выбранным из аминокислотных последовательностей SEQ ID NO: 2, 4 и 6 и их соответствующих консервативно модифицированных вариантов, и легкая цепь содержит каркас вариабельной области вместе по меньшей мере с одним CDR, выбранным из аминокислотных последовательностей SEQ ID NO: 8, 10 и 12 и их соответствующих консервативно модифицированных вариантов, отличающемуся тем, что каркас вариабельной области тяжелой цепи соответствует последовательности, типичной для человека, а вариабельная область легкой цепи включает одну или несколько специфичных аминокислот, характерных для последовательности, типичной для грызуна.
Предпочтительно, вариабельная область легкой цепи включает достаточно аминокислот, специфичных для последовательности, типичной для грызуна, так что легкая и тяжелая цепи ассоциируются сильнее, чем в том случае, когда вариабельная область легкой цепи полностью соответствует области, типичной для человека. Удобно, чтобы вариабельная область легкой цепи полностью соответствовала области, типичной для грызуна, например последовательности крысы. С другой стороны, могут быть включены только несколько или даже одна из аминокислот, характерных для крысы.
Конкретные аминокислоты, которые в последовательности вариабельной области легкой цепи скорее являются типичными для грызуна, а не для человека, выбирают среди аминокислот, представленных в SEQ ID NO 14 в списке последовательностей, приложенном к данному описанию, причем предпочтительна последовательность каркаса вариабельной области легкой цепи, в которую включены все возможные аминокислоты, характерные для каркаса крысы, вместе с соответствующими последовательностями CDR. Так аминокислотами, характерными для каркасного вариабельного участка легкой цепи крысы, в SEQ ID NO 14 являются Gln-1, Ala-2, Val-3, Val-4, Ala-7, Asn-8, Thr-12, Leu-14, Ser-16, Lys-19, Leu-20, Leu-39, Tyr-40, Glu-41, Ser-44, Met-48, Tyr-50, Phe-75, His-79, Asn-80, Val-81, Ala-82, Ile-83, Ile-88 и Phe-90. Соответствующими аминокислотами человека в каждом случае являются Asp-1, Phe-2, Met-3, Leu-4, Pro-7, His-8, Glu-12, Pro-14, Lys-15, Ile-19, Ile-20, Gln-39, Arg-40, Pro-41, Ala-44, Val-48, Phe-50, Ser-75, Ser-79, Gly-80, Leu-81, Gln-82, Thr-83, Asp-88 и Tyr-90. Последняя последовательность человека поясняется в ЕР 0586617 В на странице 6 и в соответствующей заявке на патент США.
Удобно, когда каркас вариабельной области тяжелой цепи является типичным для человека, а вариабельная область легкой цепи является областью, типичной для грызуна, причем все вышеуказанные аминокислоты представляют SEQ ID NO 14, типичную для крысы. Однако одно или несколько из этих положений SEQ ID NO 14, но не все, могут соответствовать позициям, типичным для человека, при условии достаточности соответствия последовательности таковой грызуна, например крысы, для обеспечения устойчивого взаимодействия легкой и тяжелой цепи, по сравнению с таковым, обеспечиваемым полностью гуманизированной формой, известной из уровня техники. Это взаимодействие предпочтительно таково, что когда антитела экспрессируются в клетках РЕЕ12 с использованием указаний изготовителей (Celltech), достигается превышение уровня в 50 мкг/мл, предпочтительно - превышение уровня в 100 мкг/мл. Предпочтительно, такие клетки не должны становиться непродуктивными в значительном количестве после использования в течение нескольких недель.
Специалисты в данной области техники понимают, что такие методы как сайт-направленный мутагенез с использованием PCR позволяют получить такие различные легкие вариабельные цепи, так что все их варианты по изобретению можно получить без чрезмерных усилий и скринировать по уровню экспрессии в клетках РЕЕ12.
Аминокислотные последовательности CDR SEQ ID NO 2, 4, 6, 8, 10 и 12 соответствуют CDR (a), (b), (с), (d), (е) и (f) в WO 93/19196, и сами CDR можно также отнести к соответствующим CDR (a)-(f), показанным ниже.
Предпочтительно, каждая из тяжелой цепи и/или легкой цепи содержит все три своих соответствующих CDR SEQ ID NO 2, 4 и 6 и SEQ ID NO 8, 10 и 12.
Предпочтительно, антитела являются агликозилированными. Термин "агликозилированный" используется в своем обычном значении для указания на то, что антитела, соответствующие изобретению, не являются гликозилированными.
Термином "типичный для человека" в отношении каркасного участка обозначают каркас, который достаточно подобен каркасу антитела человека, являющемуся, по существу, неиммуногенным для человека, когда присутствует в исходном антителе. Предпочтительно, антитело изобретения с тяжелой цепью с каркасом, типичным для человека, имеет значение аффинности в отношении антигена CD3 60-140%, чаще 80-100%, от такового антитела грызуна. Характеристики гуманизированных моноклональных антител и способы их получения из моноклональных антител грызунов описаны в патенте США 5585089, включенном в настоящее описание в качестве ссылки. Сравнение вариабельной области тяжелой цепи, типичной для человека, с крысиным аналогом можно осуществить посредством сравнения SEQ ID NO 16 (крыса) с соответствующей областью, обнаруженной в N-конце SEQ ID NO 20. SEQ ID NO 15 представляет собой последовательность ДНК, кодирующей SEQ ID NO 16. Таким образом, каркасный участок, типичный для человека, может иметь, например, семь или более из числа тринадцати изменений, которые отличают последовательность N-концевых 119 аминокислот SEQ ID NO 20 от N-концевых 119 аминокислот SEQ ID NO 16. Предпочтительнее, включают все аминокислоты, типичные для человека. Эти изменения могут иметь место, например, в любом из положений 5, 18, 19, 42, 49, 75, 77, 78, 88, 93, 97, 98 и 114 указанных последовательностей.
Термином "типичный для грызуна" в отношении каркасного участка обозначает каркас, соответствующий в аминокислотной последовательности каркасу антитела грызуна, например крысы или мыши. В случае антител против CD3 удобными аминокислотами каркасного участка являются аминокислоты антитела крысы.
Другие сведения о СD3-антигенах можно найти в сообщении Первого международного рабочего совещания и конференции по дифференциации лейкоцитов человека. Сведения об антигенах и описание различных гликозилированных антител против CD3-антигена также можно найти в сообщениях рабочих совещаний и конференций такого ряда, в частности Третьего и Четвертого, опубликованных издательством Оксфордского университета. Конкретными примерами таких антител являются антитела, описанные Van Ller et al., Euro.J.Imminol., 1987, 17, 1599-1604; Alegre et al., J. Immunol., 1991, 140, 1184 и Smith et al., там же, 1986, 16, 478, причем последняя публикация относится к антителу-IgG UCHT1 и его вариантам.
Однако особый интерес в качестве основы для антител по настоящему изобретению представляют CDR, содержащиеся в антителах ОКТЗ и YTH 12.5.14.2. Антитела ОКТ3 описываются в таких публикациях, как Chatenaud et al., Transplantation, 1991, 51, 334, и New England Journal of Medicine paper, 1985, 313, 339, а также в патентах ЕР 0018795 и США 4361539. Антитела YTH 12.5.14.2 (далее называемые YTH 12.5) описываются в такие публикациях, как Clark et al., European J. Immunol., 1989, 19, 381-388, а реконструированные YTH 12.5 являются предметом ЕР 0504350 и равноценных заявке на патент США, регистрационный №08362780 и патенту США 5585097, где подробно описываются CDR, имеющиеся в указанном антителе. Заявка на патент США, регистрационный №08362780 и патенты США 5585097 и 4361539 включены в настоящее описание в качестве ссылок.
Термин "консервативно модифицированные варианты" является термином, хорошо известным в технике, показывающим варианты, содержащие изменения, по существу, не влияющие на аффинность антител и антигенов. Этот термин, по существу, имеет значение, установленное в патенте США 5380712, включенном для этого в настоящее описание в качестве ссылки.
Что касается CDR, наибольшее значение имеют CDR тяжелой цепи (а), (b) и (с). Для специалистов в этой области техники также понятно, что антитела изобретения также содержат константные домены.
CDR (а), (b) и (с) располагаются в тяжелой цепи в следующем порядке: каркасный участок антитела человека 1/(а)/каркасный участок антитела человека 2/(b)/каркасный участок антитела человека 3/(с)/каркасный участок антитела человека 4 в лидерной позиции к направлению константного домена (n-конец - С-конец), и CDR (d), (е) и (f) располагаются в легкой цепи в последовательности каркасный участок антитела грызуна 1/(d)/каркасный участок антитела грызуна 2/(е)/каркасный участок антитела грызуна 3/(f)/каркасный участок антитела грызуна 4 в лидерной позиции к направлению константного домена. Поэтому предпочтительно, что когда все три CDR присутствуют в тяжелой цепи CDR, они располагаются в последовательности (а), (b) и (с) в лидерной позиции к направлению константного домена, и CDR легкой цепи располагаются в последовательности (d), (е) и (f) в лидерной позиции к направлению константного домена. Каркасный участок антитела грызуна представляет собой предпочтительно каркасный участок антитела крысы.
Однако следует иметь в виду, что антитела по настоящему изобретению могут содержать CDR, совершенно отличающиеся от CDR, описанных выше, и что, даже когда этого не случается, возможно наличие тяжелых цепей и, особенно, легких цепей, содержащих только один или два CDR из числа CDR (a), (b) и (с) и (d), (е) и (f), соответственно. Однако, хотя присутствие всех шести указанных выше цепей в антителе по настоящему изобретению не является обязательным, чаще всего в наиболее предпочтительных антителах будут присутствовать все шесть CDR.
Следовательно, особенно предпочтительное антитело содержит тяжелую цепь, типичную для человека, с тремя CDR (а), (b) и (с), содержащими аминокислотные последовательности SEQ ID NO 2, 4 и 6 или их соответствующие консервативно модифицированные варианты, и легкую цепь, типичную для крысы, с тремя CDR (d), (е) и (f), содержащими аминокислотные последовательности SEQ ID NO 8, 10 и 12 или их соответствующие консервативно модифицированные варианты, где CDR тяжелой цепи располагаются в порядке (а), (b) и (с) в лидерном направлении к константной области, а CDR легкой цепи располагаются в порядке (d), (е) и (f) в лидерном направлении к константной области.
Предпочтительной формой первого аспекта настоящего изобретения является антитело, в частности агликозилированное, обладающее аффинностью связывания в отношении СD3-антигена человека, где константная область антитела является или образована от константной области, характерной для человека, причем в частности представляет собой константную область лямбда, присоединенную к вариабельной области легкой цепи крысы.
Одним из подходящих вариантов является наличие в антителе каркасного участка вариабельного домена легкой цепи крысы, соответствующего по аминокислотной последовательности последовательности в гибридоме YTH 12.5, т.е. SEQ ID NO 14, хотя константная область, все еще предпочтительно, будет образована от одной из константных областей человека, например будет представлять собой константную область лямбда человека. Предпочтительной аминокислотной последовательностью химерной легкой цепи крысы/человека и константной области лямбда является SEQ ID NO 18. Рекомбинантная нуклеиновая кислота, например ДНК, кодирующая YTH 12.5, содержит аминокислотную последовательность SEQ ID NO 13, в то время как ДНК, кодирующая вариабельную область легкой цепи крысы и константную область лямбда человека, содержит SEQ ID NO 17.
Некоторые последовательности каркаса вариабельного домена тяжелой цепи человека будут предпочтительны в случае пересадки предпочтительных последовательностей CDR, так как 3-мерная конформация CDR будет лучше сохраняться в таких последовательностях, и антитело будет сохранять высокий уровень аффинности в отношении антигена. Каркасы вариабельной (V) области тяжелой цепи являются, предпочтительно, каркасами, которые кодируются геном III VY26/D/J VH, типичной для человека, из гибридомной клеточной линии В-клеток 18/2 (Huminghat, Dersimonian et al., Journal of Immunology, 139, 2496-2501; WO 93/19196 и заявка на патент США, регистрационный №08/478684).
Следовательно, в предпочтительном варианте первого аспекта настоящего изобретения один или несколько предпочтительных CDR тяжелой цепи антитела крысы против CD3 присутствуют в каркасе вариабельного домена человека, имеющего приведенную далее аминокислотную последовательность, считываемую в лидерном положении к направлению константной области, причем CDR представляет CDR (a), (b) и (с), как определено выше, его консервативно модифицированный вариант или иной CDR:
SEQ ID NO 21/CDR/SEQ ID NO 22/CDR/SEQ ID NO 23/CDR/SEQ ID NO 24.
Подобным образом, один или несколько предпочтительных CDR легкой цепи антитела против CD3 крысы присутствуют в каркасе вариабельного домена грызуна, имеющего приведенную далее аминокислотную последовательность, считываемую в лидерном положении к направлению константной области, причем CDR представляет CDR (d), (е) и (f), как определено выше, его консервативно модифицированный вариант или иной CDR:
SEQ ID NO 25/CDR/SEQ ID NO 26/CDR/SEQ ID NO 27/CDR/SEQ ID NO 28.
В агликозилированном антителе, содержащем все три предпочтительных CDR легкой цепи, вариабельная область легкой цепи содержит SEQ ID NO 14.
Константные области тяжелой и легкой цепи могут иметь в основе антитела различного типа, желательные для антитела, представляющего собой антитело IgG, но, хотя они могут происходить от антител грызуна, например крысы или мыши, они предпочтительно происходят от антител человека. Как описано выше, в случае легкой цепи константная область представляет собой предпочтительно область лямбда, а в случае тяжелой цепи она предпочтительно представляет собой изотип IgG, в особенности IgG1, соответствующим образом модифицированную для осуществления агликозилирования.
В агликозилированном антителе, содержащем все три предпочтительные CDR, вариабельная область тяжелой цепи и СН1-шарнир-агликозил-СН2СН3 IgG1 человека содержит SEQ ID NO 20 и кодируется ДНК SEQ ID NO 19.
Известно, что все константные области человека изотипа IgG являются гликозилированными по аспарагиновому остатку в положении 297, что составляет часть N-гликозилирования мотива аспарагин297-Х298-серин299 или треонин299, где Х представляет собой остаток любой аминокислоты, за исключением пролина. Таким образом, антитело изобретения можно агликозилировать посредством замены аспарагина в такой константной области на другую аминокислоту, которую нельзя гликозилировать. Потенциально можно использовать любой другой аминокислотный остаток, но наиболее предпочтителен аланин. С другой стороны, гликозилирование по аспарагину297 можно предотвратить посредством изменения одного из других остатков мотива, например посредством замены остатка 298 на пролин или остатка 299 на аминокислоту, отличную от серина или треонина. Способы осуществления такого сайт-направленного мутагенеза хорошо известны специалистам в этой области техники и могут быть осуществлены, например, с использованием набора для сайт-направленного мутагенеза, такого как, например, набор, коммерчески доступный от Amersham. Пример такой процедуры также приводится здесь далее.
В технике хорошо известно, что замена одной аминокислоты в CDR на другую с подобными свойствами, например замена остатка глутаминовой кислоты на остаток аспарагиновой кислоты, не может существенно изменить свойства или структуру пептида или белка, в который произведены замена или замены.
Таким образом, агликозилированные антитела настоящего изобретения включают антитела, содержащие предпочтительные CDR, но с определенной аминокислотной последовательностью, в которой произведены такие замена или замены без изменения, по существу, аффинности связывания и специфичности CDR. С другой стороны, в последовательности аминокислотных остатков CDR можно произвести делеции, или последовательности можно нарастить по N- или С-концам, или по тем и другим, причем в то же время активность все еще сохраняется.
Предпочтительными агликозилированными антителами в соответствии с настоящим изобретением являются такие, в которых константа аффинности в отношении антигена составляет 105 моль-1 или более, например до 1012 моль-1. Лиганды с различной аффинностью могут подойти для разного применения, так что, например, в некоторых случаях подходящей может быть аффинность в 106, 107 или 108 моль-1 или более. Однако, как правило, подходящими являются антитела с аффинностью в интервале 106-108 моль-1. Обычно такие антитела также не обнаруживают какой-либо существенной аффинности связывания в отношении других антигенов. Аффинность связывания антител и специфичность антител можно проверить с помощью методов анализа, таких как описанные в разделе "Примеры" в ЕР 0586617 и в заявке на патент США, регистрационный №08/478684, и в патенте США 5585097, включенных в настоящее описание в качестве ссылок (см., например, пример 5 - Анализ изменения направленности клеток-эффекторов), или с помощью таких методов, как ELISA и другие иммуноанализы.
Антитела по настоящему изобретению являются агликозилированными IgG антителами против CD3 с конфигурацией в форме "Y", которые могут иметь две идентичные легкие и две идентичные тяжелые цепи, и, таким образом, являются двухвалентными в отношении каждого антиген-связывающего сайта с аффинностью в отношении СD3-антигена. С другой стороны, изобретение также применимо к антителам, в которых только один из фрагментов плеч антитела обладает аффинностью связывания в отношении СD3-антигена. Такие антитела могут принимать различные формы. Таким образом, другой фрагмент антитела может иметь аффинность связывания в отношении антигена иную, чем CD3, так что антитело является биспецифическим антителом, например, как описано в патенте США №4474893 (включенном в настоящее описание в качестве ссылки) и заявках на европейский патент №№87907123.1 и 87907124.9. С другой стороны, антитело может иметь только один фрагмент, проявляющий аффинность связывания, причем такое антитело называют "моновалентным".
Моновалентные антитела (или фрагменты антител) можно получить многими способами. Glenine and Stevenson (Nature, 295, 712-713 (1982)) описывают способ получения моновалентных антител посредством ферментативного расщепления. Stevenson et al. описывают другой подход к получению моноклональных антител, при котором полученные ферментативно фрагменты Fab' и Fc сшиваются химически (Anticancer Drug Design, 3, 219-230 (1989)). При таких способах полученные моновалентные антитела теряют один из своих Fab'-фрагментов. Третий способ получения моновалентных антител описан в европейском патенте №131424. При подходе, описанном в указанном патенте, форма "Y" антитела сохраняется, но только один из двух Fab'-доменов будет связываться с антигеном. Это достигается посредством введения в гибридому гена, кодирующего чужеродную легкую цепь, которая будет соединяться с тяжелой цепью антитела с образованием смеси продуктов, в которой моновалентные антитела являются одним из продуктов, представляющих интерес.
Однако предпочтительнее моноклональные агликозилированные антитела против CD3 изобретения получают следующим способом. Этот способ включает введение в подходящую экспрессирующую систему, например клеточную систему, такую, какая описана здесь далее вместе с генами, кодирующими тяжелую и легкую цепь, гена, кодирующего "укороченную" тяжелую цепь, в которой отсутствуют домен вариабельной области и первый домен константной области тяжелой цепи, причем ген утрачивает экзон для каждого из этих доменов. Это приводит к продуцированию клеточной системой смеси (а) антител, которые являются полными двухвалентными антителами, (b) фрагментов антител, состоящих только из двух укороченных тяжелых цепей (т.е. Fc-фрагмента), и (с) фрагментов антител, моновалентных для СD3-антигена, состоящих из укороченной тяжелой цепи и легкой цепи в сочетании с нормальной тяжелой цепью. Такой фрагмент антитела (с) является моновалентным, так как он имеет только один Fab'-фрагмент. Получение моновалентных антител в форме таких фрагментов посредством указанного способа предпочтительно по ряду причин. Так, полученные фрагменты антител легко очищаются от смеси антител, продуцированных клеточной системой, так как, например, их можно отделить, основываясь просто на их молекулярной массе. Такой вариант не представляется возможным по способу европейского патента №131424, где полученные моноклональные антитела имеют характеристики, схожие с характеристиками двухвалентных антител в отношении размера и внешних признаков.
Кроме того, при получении фрагментов моноклональных антител по новому способу используют условия, которые можно легче регулировать, и, таким образом, процесс не настолько произволен, как метод ферментативного расщепления и химического сшивания, при которых требуется разделять сложный продукт реакции, и дополнительным преимуществом является то, что используемая клеточная линия будет продуцировать фрагменты моноклональных антител в отсутствие необходимости процедур непрерывного синтеза, требуемых при методе ферментативного расщепления и химического сшивания.
Считается, что агликозилированные антитела по изобретению не встречаются в природе и такие агликозилированные антитела можно вообще получить синтетически многими способами. Однако наиболее удобно соответствующие генные конструкции для константных и вариабельных областей тяжелых и легких цепей, имеющихся в антителе, получать отдельно и затем встраивать в подходящую экспрессирующую систему.
Гены, кодирующие вариабельные домены лиганда нужного строения, можно получить и соответствующим образом присоединить к генам, кодирующим константные домены антитела, подвергнутые сайт-направленному мутагенезу. Такие константные гены можно получить из гибридомной кДНК или из хромосомной ДНК и подвергнуть сайт-направленному мутагенезу для получения агликозилированных константных областей. Гены, кодирующие вариабельные области, также можно получить методами синтеза генов, используемыми при идентификации содержащихся в них CDR. Подходящие клонирующие векторы для ДНК могут быть векторами разных типов.
Специалисты в этой области техники представят, что такие гены можно получить разными способами. Например, можно (i) известным способом создать ряд гибридом против СD3-антигена, (ii) получить ДНК из этих гибридом с помощью процедур, описанных в WO 92/06193 и WO 93/19196 и соответствующих им патентах США, посредством экстракции мРНК и превращения ее в кДНК с использованием PCR, (iii) скринировать эту кДНК олигонуклеотидными зондами, соответствующими по последовательности последовательностям ДНК, комплементарным CDR, (iv) секвенировать любую положительно идентифицированную гибридому и (v) реконструировать последовательность крысы методами гуманизации, описанными в вышеуказанных патентах. Для того, чтобы иметь возможность получить несколько, а предпочтительно - все шесть предпочтительных CDR, можно использовать сайт-направленный мутагенез для встраивания нужной ДНК в соответствующих местах в ДНК, кодирующую каркас.
Экспрессию таких генов через культивирование клеточной системы для продуцирования функционального CD3-лиганда наиболее удобно осуществлять посредством трансформации подходящей системы прокариотных или, в особенности, эукариотных клеток, в частности линии иммортализованных клеток млекопитающих, такой как линия клеток миеломы, например клеток миеломы крысы YB2/3.01/Аg20 (далее называемая YO), клеток миеломы NS20 или клеток яичника китайского хомячка (хотя представляет интерес также использование растительных клеток) экспрессирующими векторами, содержащими ДНК, кодирующую разные области антитела, с последующим культивированием системы трансформированных клеток, продуцирующей нужные антитела. Такие общие методы применения для получения лигандов, соответствующих настоящему изобретению, хорошо известны в технике и описаны в таких публикациях, как "Molecular Cloning", Sambrook, Fritsch and Maniatis, Cold Spring Harbor Laboratory Press, 1989 (2nd edition). Эти методы также поясняются примерами, содержащимися в WO 93/19196 и заявке на патент США, регистрационный №08/478684, включенных в настоящее описание в качестве ссылок.
Таким образом, другой аспект настоящего изобретения относится к способу получения агликозилированного IgG антитела, соответствующего первому аспекту, обладающего аффинностью связывания в отношении СD3-антигена, включающему культивирование клеток, способных экспрессировать антитела для того, чтобы осуществить их экспрессию. Третий аспект настоящего изобретения также относится к клеточной линии, непосредственно экспрессирующей агликозилированные антитела по изобретению.
Среди таких клеточных линий предпочтительными являются линии, содержащие последовательности ДНК, кодирующие предпочтительные CDR, описанные здесь ранее. Группа нуклеотидных последовательностей, кодирующих CDR (a)-(f), описанные здесь ранее, показана ниже, соответственно как (a)-(f), но следует иметь в виду, что вырождение генетического кода позволяет осуществить изменения в этих последовательностях, по-прежнему кодирующих аминокислотные последовательности CDR.
(a) SEQ ID NO 1; (b) SEQ ID NO 1; (с) SEQ ID NO 5;
(d) SEQ ID NO 7; (e) SEQ ID NO 9; (f) SEQ ID NO 11.
Такие клеточные линии будут, в частности, содержать более крупные последовательности ДНК, включающие (1) ДНК, экспрессирующую вариабельные каркасные участки тяжелой цепи человека, содержащие один или несколько CDR из числа (а), (b) и (с), и (2) ДНК, экспрессирующую вариабельные каркасные участки легкой цепи грызуна, например крысы, содержащие один или несколько CDR из числа (d), (е) и (f).
Конкретным примером такой ДНК является SEQ ID NO 19, кодирующая CDR (a), (b) и (с), локализованные в каркасе тяжелой цепи, кодированном геном VH26.D.J VH человека типа III, связанным с СH1-шарнир-агликозил-СН2СН3 IgG человека, как описано выше, и SEQ ID NO 17, кодирующая CDR (d), (е) и (f), локализованные в каркасе легкой цепи, кодированном химерным белком константной области лямбда человека YTH 12.5.
Химерные, частично гуманизированные, агликозилированные антитела, в соответствии с настоящим изобретением, имеют терапевтическую ценность, в частности при иммуносупрессии, в частности для подавления отторжения трансплантата, когда особенно желательно, чтобы иммуносупрессия была временной, а не полной, и таким образом, чтобы Т-клетки полностью не разрушались, а вместо этого оказывались нефункциональными вследствие блокады антителами комплекса антиген-CD3-TCR. Кроме того, применение агликозилированных антител против CD3 может иметь потенциал в других областях, таких как лечение злокачественных опухолей, конкретно - при конструировании биспецифических антител (для перенацеливания эффекторных клеток) или конъюгатов антитело-токсин, где эффективность лекарственного средства могла бы быть осложнена Fc-опосредованным киллингом эффекторных клеток или неспецифическим киллингом клеток, содержащих рецептор-Fc, соответственно.
Таким образом, в своем четвертом аспекте настоящее изобретение относится к способу лечения пациентов, страдающих злокачественными опухолями, в частности лимфомой, или применения в целях иммуносупрессии, например в случае угрозы отторжения трансплантата, включающему введение терапевтически эффективного количества агликозилированных антител в соответствии с первым аспектом изобретения.
Агликозилированные антитела в соответствии с первым аспектом изобретения можно включить в композиции для введения пациентам посредством введения указанных антител вместе с физиологически приемлемым разбавителем или носителем. Антитела вводят, предпочтительно, в форме композиции для инъекций вместе с таким разбавителем или носителем, который является стерильным или апирогенным. В инструкции может быть указано, что подходящая доза антител составляет примерно 1-10 мг при ежедневной инъекции, например в течение 10 суток, хотя вследствие устранения первичного эффекта дозы можно будет, при необходимости, вводить большее количество антител, например даже при 100 мг в сутки, в зависимости от индивидуальной потребности пациента. Применение в ветеринарии основывается на подобной же дозировке.
Теперь изобретение будет описано с помощью ссылки на следующие неограничивающие примеры, фигуры и список последовательностей. Другие осуществления настоящего изобретения, подпадающие под объем настоящих притязаний, будут очевидны специалисту в данной области в свете следующих разделов.
Фигуры
На Фигуре 1 показаны диаграммы FACS-анализа связывания полностью гуманизированных агликозил-СD3 (ЕР 0586617, заявка на патент США, регистрационный №08/478684 и патент США 558097) и химерных антител настоящего изобретения, в которых используется легкий вариабельный каркасный участок антитела крысы. Одна легкая цепь YTH 12.5 LAG1 не показывает нормального связывания, так как не связана с тяжелой цепью.
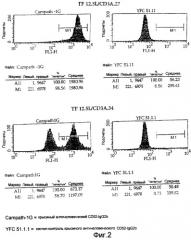
На Фигуре 2 представлены диаграммы FACS-анализа связывания двух химерных трансфектантов, полученных с использованием вектора pOXD52neo, которые, таким образом, экспрессируют СD52-антиген на своей поверхности. Диаграммы иллюстрируют применение вектора pOXD52neo как способ проверить, являются ли трансфектанты клональной популяцией. TF 12.5L/CD3A..27 имеет один пик при окрашивании CD52, показывающий, что все клетки продуцируют антитела против CD3, в то время как TF 12.5L/CD3A.34 имеет два пика, указывающих на непродуктивную популяцию клеток, не продуцирующих антитела против CD3.
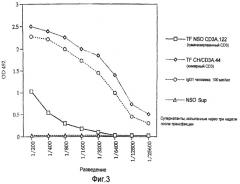
На Фигуре 3 представлены графики зависимости OD 492 от разведения при ELISA для сравнения продуцирования IgG человека как меры выхода антител в случае химерного CD3 настоящего изобретения и гуманизированного аликозил-CD3 известного уровня техники. Супернатанты CD3, испытанные через три недели после трансфекции, показывают, что клетки, содержащие ДНК, кодирующую химерное антитело настоящего изобретения, продуцируют примерно 120 мкг/мл антител, а полностью гуманизированные CD3 продуцируют менее 10 мкг/мл.
На Фигурах 4 и 5 показаны диаграммы связывания химерных антител настоящего изобретения и полностью гуманизированных CD3 с клетками Jurkat для оценки аффинности антител. Начинают с известной концентрации 100 мкг/мл, а затем разводят до 1/20 и семикратных титраций до 1/2560. Картины окрашивания показывают, что аффинность является одинаковой.
Список последовательностей
SEQ ID NO 1 представляет собой последовательность ДНК, кодирующей CDR (а).
SEQ ID NO 2 представляет собой аминокислотную последовательность CDR (a).
SEQ ID NO 3 представляет собой последовательность ДНК, кодирующей CDR (b).
SEQ ID NO 4 представляет собой аминокислотную последовательность CDR (b).
SEQ ID NO 5 представляет собой последовательность ДНК, кодирующей CDR (с).
SEQ ID NO 6 представляет собой аминокислотную последовательность CDR (с).
SEQ ID NO 7 представляет собой последовательность ДНК, кодирующей CDR (d).
SEQ ID NO 8 представляет собой аминокислотную последовательность CDR (d).
SEQ ID NO 9 представляет собой последовательность ДНК, кодирующей CDR (е).
SEQ ID NO 10 представляет собой аминокислотную последовательность CDR (е).
SEQ ID NO 11 представляет собой последовательность ДНК, кодирующей CDR (f).
SEQ ID NO 12 представляет собой аминокислотную последовательность CDR (f).
SEQ ID NO 13 представляет собой последовательность ДНК, кодирующей вариабельную область легкой цепи крысы.
SEQ ID NO 14 представляет собой аминокислотную последовательность вариабельной области легкой цепи крысы.
SEQ ID NO 15 представляет собой последовательность ДНК, кодирующей вариабельную область тяжелой цепи крысы, содержащей соответствующие CDR.
SEQ ID NO 16 представляет с