Композиция для лечения или профилактики инфекции, вызванной бактерией neisseria
Иллюстрации
Показать всеИзобретение относится к биотехнологии и может быть использовано в медицине для лечения инфекционных заболеваний. Композиция, предназначенная для лечения или профилактики инфекций, вызванных нейссерией, включает а) белок, аминокислотная последовательность которого на 65% и более идентична природному белку нейссерии одного вида (в тексте приведена первая группа аминокислотных последовательностей) и/или его фрагмент, состоящий из 10 и более аминокислот и проявляющий свойства антигена; б) второй белок, аминокислотная последовательность которого на 65% и более идентична природному белку нейссерии другого вида (в тексте приведена вторая группа аминокислотных последовательностей с четными числами) и/или его фрагмент, состоящий из 10 или более аминокислот и проявляющий свойства антигена; в частности, второй белок представляет собой NspA. Композиция дополнительно содержит адъювант. Композиция используется как лекарственное средство, так и для производства лекарственного средства. Использование изобретения позволяет повысить эффективность профилактики или лечения за счет универсальности действия композиции (вакцины). 7 з.п. ф-лы, 41 ил., 5 табл.
Реферат
Область изобретения
Данное изобретение относится к композициям, содержащим комбинации биологических молекул из бактерии Neisseria, в частности N.meningitidis и N.gonorrhoeae.
Предшествующий уровень техники
Neisseria meningitidis и Neisseria gonorrhoeae являются неподвижными, грамотрицательными диплококками, которые являются патогенными в человеке.
На основании капсульного полисахарида этого организма были идентифицированы 12 серологических групп N.meningitidis. Группа А является патогеном, наиболее часто лежащим в основе эпидемического заболевания в расположенной южнее Сахары Африке. Серологические группы В и С являются ответственными за огромное большинство случаев в Соединенных Штатах и в большинстве развитых стран. Серологические группы W135 и Y являются ответственными за остальные случаи в Соединенных Штатах и развитых странах.
Менингококковая вакцина, используемая в настоящее время, является тетравалентной полисахаридной вакциной, состоящей из серологических групп А, С, Y и W135. Однако менингококк В остается проблемой. Этот подход с использованием полисахарида не может быть использован, так как капсульный полисахарид menB является полимером α(2-8)-связанной N-ацетилнейраминовой кислоты, которая также присутствует в ткани млекопитающего. Один из подходов к menB-вакцине использует смеси белков наружной мембраны (ОМР). Для преодоления антигенной вариабельности были созданы поливалентные вакцины, содержащие до девяти различных поринов [например, Poolman JT (1992) Development of a meningococcal vaccine. Infect. Agents Dis. 4:13-28]. Дополнительными белками для использования в вакцинах белков наружной мембраны были белки ора и орс, но ни один из этих подходов не был способен преодолеть антигенную вариабельность [например, Ala’ Аldeen & Borriello (1996) The meningococcal transferrin-binding proteins 1 and 2 are both surface exposed and generate bactericidal antibodies capable of killing homologous and heterologous strains. Vaccine 14 (1):49-53].
При условии того, что менингококковое заболевание во время неэпидемических периодов у населения обычно вызывается множеством штаммов или вариантами штаммов [Russel et al. (1998) Abstracts of 11th International pathogenic Neisseria conference, page 281] вместе с частыми временными сдвигами в преобладающих штаммах, кажется вероятным, что универсальная вакцина против менингококка В потребует более одной разновидности антигена.
Описание изобретения
Белковые и нуклеотидные последовательности Neisseria описаны в следующих документах:
- WO 99/24578
- WO 99/36544
- WO 99/57280
- WO 97/28273
- WO 96/29412
- WO 95/03413
- Tettelin et al. (2000) Science 287:1809-1815
Для облегчения ссылок последовательности, описанные в этих документах, будут цитироваться в данной заявке в соответствии со следующей таблицей:
| Документ | Нумерация последовательностей в оригинале | Нумерация последовательностей в данной заявке |
| WO 99/24578 | SEQ ID NO:1-892 | SEQ ID NО:1-892 |
| WO 99/36544 | SEQ ID NO:1-90 | SEQ ID NО:893-982 |
| WO 99/57280 | SEQ ID NO:1-3020 | SEQ ID NO:983-4000 |
| WO 97/28273 | кодирующая ДНК фиг.4белок фигуры 4кодирующая ДНК фиг.9ДНК фигуры 13белок фигуры 13 | SEQ ID NО:4003SEQ ID NО:4004SEQ ID NО:4005SEQ ID NО:4006SEQ ID NО:4007 |
| WO 96/29412 | SEQ ID NO:1-26 | SEQ ID NО:4008-4033 |
| WO 95/03413 | SEQ ID NO:1-23 | SEQ ID NО:4034-4056 |
| Tettelin et al. (2000) Science 287:1809-15 | NMB0001-2160 (ДНК)NMB0001-2160(кодируемые белки) | SEQ ID NО:4057-6216SEQ ID NO:6217-8376 |
Данное изобретение представляет композиции, содержащие первую биологическую молекулу из бактерии Neisseria и вторую биологическую молекулу из бактерии Neisseria. Термин “биологическая молекула” включает белки и нуклеиновые кислоты.
Эти композиции могут также содержать дополнительные биологические молекулы, предпочтительно также из Neisseria, т.е. можно сказать, что эти композиции содержат две или более биологические молекулы (например, 3, 4, 5, 6, 7, 8 и т.д.), по меньшей мере две из которых являются молекулами бактерии Neisseria (например, 3, 4, 5, 6, 7, 8 и т.д.). Такие композиции включают в себя композиции, содержащие (i) два или более различных белков Neisseria, (ii) две или более нуклеиновых кислот Neisseria или (iii) смесь одного или нескольких белков Neisseria и одной или нескольких нуклеиновых кислот Neisseria.
В одном предпочтительном варианте первая и вторая биологические молекулы являются молекулами из различных видов Neisseria (например, одна из N.meningitidis и одна из N.gonorrhoeae), но они могут быть из одного и того же вида. Биологические молекулы в этих композициях могут быть из различных серологических групп или штаммов одного и того же вида.
Первая биологическая молекула предпочтительно выбрана из группы, состоящей из SEQ ID NO:1-8376. Более предпочтительно она выбрана из группы, состоящей из SEQ ID NO:1-4002 и/или SEQ ID NO:4057-8376. Предпочтительно она является очищенной или выделенной биологической молекулой.
Вторая биологическая молекула предпочтительно выбрана из группы, состоящей из SEQ ID NO:1-8376. Более предпочтительно она выбрана из группы, состоящей из SEQ ID NO:1-4002 и/или SEQ ID NO:4057-8376. Предпочтительно она является очищенной или выделенной биологической молекулой.
Одна или обе первая и вторая биологические молекулы могут быть биологической молекулой Neisseria, которая не описана конкретно здесь и которая может не быть идентифицированной, описанной, общедоступной биологической молекулой или очищенной до подачи данной заявки.
В частности, данное изобретение представляет композицию, содержащую одну или несколько из следующих пар первой и второй биологических молекул (перечисленных в виде SEQ ID NO: - см. в конце описания).
Таким образом, данное изобретение включает каждую из 35074500 возможных пар SEQ ID NO:1-8376 (1 и 2, 1 и 3, 1 и 4, 1 и 5...1 и 8375, 1 и 8376, 2 и 3, 2 и 4, 2 и 5...2 и 8375, 2 и 8376, 3 и 4...1000 и 1001, 1000 и 1002...1000 и 8376...8374 и 8375, 8374 и 8376, 8375 и 8376), хотя из-за их количества все они здесь полностью не перечислены.
Подробности того, как могут быть получены и использованы молекулы, имеющие последовательности SEQ ID NO:1-4056, могут быть найдены в соответствующих международных заявках, и нет необходимости повторять эти подробности в данной заявке. Сходные принципы относятся также к SEQ ID NO:4057-8376.
SEQ ID NO:1-8376 в композициях данного изобретения могут быть дополнены или заменены молекулами, содержащими последовательности, гомологичные (т.е. имеющие идентичность последовательности) относительно SEQ ID NO:1-8376. В зависимости от конкретной последовательности степень идентичности предпочтительно является более 50% (например, 65%, 80%, 90% или более) и включают мутанты или аллельные варианты. Идентичность последовательности между белками предпочтительно определяют при помощи алгоритма поиска гомологии Смита-Уотермана, обеспеченного в программе MPSRCH (Oxford Molecular), использующего поиск аффинного гэпа с параметрами штраф для открытого гэпа=12 и штраф удлинения гэпа=1.
SEQ ID NO:1-8376 в композициях данного изобретения могут дополнены или заменены молекулами, содержащими фрагменты SEQ ID NO:1-8376. Такие фрагменты должны содержать по меньшей мере n последовательных мономеров из этих молекул, и в зависимости от конкретной последовательности n равно либо (i) 7 или более для белковых молекул (например, 8, 10, 12, 14, 16, 18, 20 или более), предпочтительно, например, этот фрагмент содержит эпитоп из этой последовательности, либо (ii) 10 или более для молекул нуклеиновых кислот (например, 12, 14, 15, 18, 20, 25, 30, 35, 40 или более).
Если эта композиция содержит белок, который существует в различных растущей (возникающей) и зрелой формах, используют предпочтительно зрелую форму этого белка. Например, может быть использована зрелая форма белка NspA (SEQ ID NO:4008-4033; WO 96/29412; фигура 29), не имеющая сигнального пептида.
В случае белковых молкул SEQ ID NO:1-8376 в композициях данного изобретения могут быть дополнены или заменены антителом, которое связывается с этим белком. Это антитело может быть моноклональным или поликлональным.
В случае молекул нуклеиновых кислот SEQ ID NO:1-8376 в композициях данного изобретения могут быть дополнены или заменены нуклеиновой кислотой, которая может гибридизоваться с нуклеиновой кислотой Neisseria, предпочтительно при условиях "высокой жесткости" (например, 65°С в растворе 0,1×SSC, 0,5% ДСН).
Должно быть понятно, что любая нуклеиновая кислота в этих композициях может принимать различные формы (например, быть одноцепочечной, двухцепочечной, быть в форме векторов, зондов и т.д.). Кроме того, термин "нуклеиновая кислота" включает ДНК и РНК, а также их аналоги, такие как аналоги, содержащие модифицированные каркасы, а также пептид-нуклеиновые кислоты (ПНК) и т.д.
В некоторых вариантах эта композиция содержит молекулы из различных видов Neisseria, например одну или несколько молекул N.meningitidis и одну или несколько молекул N.gonorrhoeae. В некоторых вариантах эта композиция может содержать молекулы из различных серологических групп и/или штаммов одного и того же вида, например штаммов А и В N.meningitidis. Дополнительные варианты содержат смеси одной или нескольких молекул N.meningitidis из различных штаммов, а также одной или нескольких молекул N.gonorrhoeae.
Многие белки являются относительно консервативными в различных видах, серологических группах и штаммах N.meningitidis и N.gonorrhoeae (например, SEQ ID NO:52, 54, 58). PCT/IB00/00642 включает более подробный анализ консервативных областей в этих белках. Для гарантии максимального перекрестного узнавания и реактивности между штаммами области белков, которые являются консервативными в различных видах, серологических группах и штаммах Neisseria, могут быть использованы в композициях данного изобретения. Таким образом, данное изобретение представляет белки, которые содержат участки аминокислотной последовательности, которые являются общими в большинстве Neisseria, в частности N.meningitidis и N.gonorrhoeae. Таким образом, предпочтительно эта композиция содержит белок, содержащий фрагмент белка Neisseria (предпочтительно белок из SEQ ID NO:1-8376 или более предпочтительно SEQ ID NO:1-4002), причем указанный фрагмент состоит из n последовательных консервативных аминокислот. В зависимости от конкретного белка n равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20 или более). Этот фрагмент предпочтительно содержит антигенный или иммуногенный участок белка Neisseria. “Консервативной” аминокислотой является аминокислота, которая присутствует в конкретном белке Neisseria в по меньшей мере х% Neisseria (или, предпочтительно, в по меньшей мере х% обоих штаммов N. meningitidis и N. gonorrhoeae). Значение х может быть равно 50% или более, например 66%, 75%, 80%, 90%, 95% или даже 100% (т.е. эта аминокислота обнаруживается в рассматриваемом белке во всех Neisseria). Для определения, является ли аминокислота “консервативной” в конкретном белке Neisseria, необходимо сравнить этот аминокислотный остаток в последовательностях рассматриваемого белка из множества различных Neisseria ("ссылочной популяции"). Подходящие определения "ссылочных популяций" могут быть найдены в PCT/IB00/00642. Аминокислотные последовательности различных Neisseria могут быть легко подвергнуты сравнению при помощи компьютеров. Обычно это сравнение включает сопоставление ряда последовательностей с использованием алгоритма, например, CLUSTAL [Thompson et al. (1994) Nucleic Acids Res. 22:4673-4680; Trends Biochem. Sci (1998) 23:403-405] или предпочтительно PILEUP [часть пакета GCG Wisconsin, предпочтительно версия 9.0]. Консервативные аминокислоты легко обнаруживаются при сопоставлении множества последовательностей - в рассматриваемом аминокислотном положении большинство сопоставляемых последовательностей будут содержать конкретную аминокислоту. Консервативные аминокислоты могут быть сделаны более визуально заметными с использованием программы, такой как BOXSHADE [доступной, например, в NIH, в Интернете], PRETTYBOX [GCG Wisconsin, версия 10] или JALVIEW [доступной в EBI, в Интернете].
Таким образом, конкретные композиции в соответствии с данным изобретением включают композиции, содержащие:
- две или более биологических молекул, выбранных из SEQ ID NO:1-4002;
- одну или более биологических молекул, выбранных из SEQ ID NO:1-4002, комбинированных с одной или несколькими биологическими молекулами, выбранными из SEQ ID NO:4003-8376;
- одну или более биологических молекул, выбранных из SEQ ID NO:1-4002, комбинированных с белком NspA (как описано в WO 96/29412; см. также фигуру 29 здесь), предпочтительно в зрелой форме;
- одну или большее количество биологических молекул, выбранных из SEQ ID NO:1-8376 (предпочтительно SEQ ID NO:1-4002), объединенных с трансферринсвязывающим белком А (ТbрА) и/или В (ТbрВ), например ТbрА и ТbрВ, описанными в WO 00/25811) (или их иммуногенными фрагментами);
- один или более фрагментов белков, выбранных из SEQ ID NO:1-4002, причем этот фрагмент предпочтительно содержит участок консервативных аминокислот;
- комбинацию различных белков, причем эта комбинация как целое включает один или более белков, которые узнаются каждым штаммом в ссылочной популяции, хотя каждый индивидуальный белок в данной комбинации сам по себе не узнается каждым штаммом в ссылочной популяции, т.е. каждый член ссылочной комбинации узнает по меньшей мере один белок в данной комбинации.
Данное изобретение представляет также композиции данного изобретения для использования в качестве лекарственных средств (например, в качестве иммуногенных композиций или вакцин) или в качестве диагностических реагентов. Оно представляет также использование этих композиций для производства: (i) лекарственного средства для лечения или профилактики инфекции, вызываемой бактериями Neisseria; (ii) диагностического реагента для обнаружения присутствия бактерий Neisseria или антител, индуцированных против бактерий Neisseria; и/или (iii) реагента, который может индуцировать выработку антител против бактерий Neisseria.
Данное изобретение представляет также способ лечения пациента, предусматривающий введение этому пациенту терапевтически эффективного количества композиции в соответствии с данным изобретением.
Кроме того, данное изобретение представляет способ получения композиции в соответствии с данным изобретением, предусматривающий стадию комбинирования одной или нескольких из SEQ ID NO:1-8376 с одной или несколькими из SEQ ID NO:1-8376.
Краткое описание рисунков
Фигура 1 показывает результаты электрофореза в ДСН-ПААГ для экспрессии ORF 6, 7, 13, 65-1, 72, 73-1, 105-1, 137-1, 143-1 и 147-1. Левые дорожки показывают маркеры молекулярных масс (набор M1).
Фигура 2 показывает (А) результаты электрофореза в ДСН-ПААГ для ORF9, (В) положение иммунореактивной полосы N.meningitidis в Вестерн-блоттинге по отношению к препарату везикул наружных мембран N.meningitidis, (С) FACS-анализ.
Фигура 3 показывает результаты электрофореза в ДСН-ПААГ для экспрессии ORF 2-1, 5-1, 22-1, 132-1 и 4. Левые дорожки показывают маркеры молекулярных масс (набор M1).
Фигуры 4-28 показывают график гидрофильности (верхний), антигенный индекс (средний) и AMPHI-участки (нижний) для ORF 2, 5, 6, 7, 9, 13а, 15, 22, 23, 27, 28, 32, 65, 72, 73, 76, 79, 89, 105, 106-1, 132, 137, 138, 143 и 147.
Фигура 29 показывает вариабельность последовательности NspA из различных штаммов менингококка В. Эти последовательности могут быть использованы в качестве альтернатив NspA WO 96/29412 (SEQ ID NO:4008-4033).
Фигура 30 показывает связывание поликлонального анти-rNspA с использованием непрямой флуоресцентной проточной цитометрии с инкапсулированными и неинкапсулированными штаммами menB.
Фигура 31 показывает сходные данные для инкапсулированных штаммов 8047, CU385 и М986 (31А) и неинкапсулированных штаммов BZ232, МС58, NG3/88 и NGB165 (31В).
Фигура 32 показывает модель вторичной структуры NspA.
Фигура 33 показывает FACS-анализ неинкапсулированного штамма М7 (37А) и обработанных этанолом (для разрушения капсулы) штаммов 2996, N44776, МС58, 1000, BZ232, BZ133, NG6/88, BZ198, NG3/88, 297-0, BZ147 и BZ169 (37В) с использованием тетравалентной смеси.
Фигура 34 показывает FACS-анализ штамма М7 с использованием пентавалентной смеси при разведениях 1:400 (34А), 1:200 (34В) и 1:100 (34С).
Примеры
Пример 1. Эксперименты по экспрессии и очистке
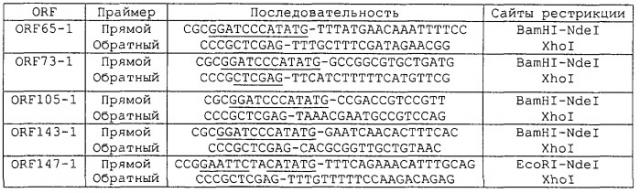
В ORF 6, 7, 13, 65-1, 72, 73-1, 105-1, 137-1, 143-1 и 147-1, описанные в WO 99/24578, экспрессировали в Е.coli и очищали, как представлено в таблице 1:
Таблица 1
| ORF | His-гибрид | GST-гибрид | Очистка | MW (кДа) |
| 6 | + | GST-гибрид | 23 | |
| 7 | + | + | GST-гибрид | 28 |
| 13 | + | GST-гибрид | 10 | |
| 65-1 | + | GST-гибрид | 32 | |
| 72 | + | His-гибрид | 13,5 | |
| 73-1 | + | GST-гибрид | 13 | |
| 105-1 | + | + | His-гибрид | 32 |
| 137-1 | + | GST-гибрид | 31 | |
| 143-1 | + | + | His-гибрид | 23,5 |
| 147-1 | - | + | His-гибрид | 32 |
Примечание: ORF73-1 экспрессировался в виде фрагмента (аминокислоты 41-161).
Протоколы, используемые для экспрессии этих десяти ORF, были по существу такими же, как описанные в WO 99/24578, с использованием векторов pGEX и рЕТ. Примеры ПЦР-праймеров, используемых для амплификации этих ORF, приведены в таблице 2:
Результаты электрофореза в ДСН-ПААГ для этих десяти экспрессированных ORF приведены на фигуре 1.
ORF-His-гибрид использовали для иммунизации мышей. Эти сыворотки использовали в анализе ELISA по существу, как описано в WO 99/24578, и они давали положительные результаты.
Следующие белки также экспрессировали и очищали (результаты не показаны):
| ORF | Экспрессия His-гибрида | Экспрессия GST-гибрида | Экспрессируемые в виде фрагмента | Положение аминокислот фрагмента |
| ORF1 (S) | - | - | - | 43-1087 |
| ORF1 (β) | не опр. | - | - | 1051-1457 |
| ORF35-1 | - | - | - | |
| ORF41 | не опр. | не опр. | - | 25-619 |
| ORF46 | - | - | - | 25-433 |
| ORF61 | не опр. | не опр. | - | 1-575 |
| ORF83-1 | - | - | - | 15-313 |
| ORF100-1 | не опр. | - | - | 21-376 |
| ORF114-1 | не опр. | - | - | 1-1423 |
| ORF124-1 | не опр. | не опр. | - | |
| ORF131-1 | не опр. | - | - | 22-135 |
Следующие ПЦР-праймеры использовали для амплификации этих ORF:
Каждый из этих ORF может быть соединен с одной или несколькими из последовательностей SEQ ID NO:1-8376.
Пример 2. Экспрессия и очистка ORF9
ORF9, описанный в WO 99/24578, клонировали в вектор рЕТ и экспрессировали в Е.coli. Очищенный гибридный белок ORF-His анализировали при помощи электрофореза в ДСН-ПААГ, как показано на фигуре 2А. Мышей иммунизировали очищенным ORF9-His и сыворотки использовали для Вестерн-блот-анализа (фигура 2В), FACS-анализа (фигура 2С) и ELISA-анализа. Используемые протоколы были по существу такими же, как приведенные в WO 99/24578.
Эти результаты подтверждают, что ORF9 является поверхностно-экспонированным белком. ORF9 пригоден для комбинирования с одной или несколькими последовательностями SEQ ID NO:1-8376.
Пример 3. Дополнительные эксперименты по экспрессии
Дополнительные эксперименты по экспрессии и очистке проводили в Е.coli для ORF 2-1, 5-1, 22-1 и 132-1, описанных в WO 99/24578, как представлено в таблице 3:
Таблица 3
| RF | His-гибрид | GST-гибрид | Очистка | MW (кДа) |
| 2-1 | + | GST-гибрид | 26 | |
| 5-1 | - | + | GST-гибрид | 33 |
| 22-1 | - | + | His-гибрид | 49 |
| 132-1 | - | + | GST-гибрид | 48 |
Протоколы, используемые для экспрессии этих четырех ORF, были по существу такими же, как описанные в WO 99/24578, с использованием векторов pGEX и рЕТ. Примеры ПЦР-праймеров, используемых для амплификации этих ORF, приведены в таблице 4:
Результаты электрофореза в ДСН-ПААГ для этих четырех экспрессированных ORF показаны на фигуре 3.
Каждый из этих ORF может быть объединен с одной или несколькими из SEQ ID NO:1-8376.
Пример 4. Экспрессия и очистка липопротеина ORF4
ORF4 описан в WO 99/24578 как содержащий липопептидную сигнальную последовательность (LPSS). Этот полноразмерный ORF амплифицировали с использованием следующих ПЦР-праймеров:
ORF4-L (прямой) CGCGGATCCCATATGAAAACCTTCTTCAAAACC
ORF4-L (обратный) CCCGCTCGAGTTATTTGGCTGCGCCTTC
Амплифицированный фрагмент ДНК клонировали в вектор рЕТ21b+ для экспрессии в виде меченого His на С-конце гибрида. Культуру логарифмической фазы роста Е.coli, содержащую pET21b-orf4-LPSS, индуцировали 1,0 мМ IPTG в течение 3 час при 30°С, собирали центрифугированием в течение 10 мин при 8000 g и ресуспендировали в ЗФР. Суспензию обрабатывали ультразвуком на льду и добавляли Тритон Х-114 до конечной концентрации 0,6% (об./об.). Этот материал инкубировали на льду в течение 20 мин, затем нагревали до разделения фаз (определяемого по высокой степени мутности). После центрифугирования в течение 10 мин при 10000 g верхнюю водную фазу отбрасывали, а лежащую ниже фазу детергента собирали без нарушения бактериального осадка. К фазе детергента добавляли 13 объемов 20 мМ гистидина, 2 мМ ЭДТА, 30 мМ NaCl (pH 5,8). Этот материал центрифугировали в течение 10 мин при 4°С и супернатант объединяли порциями при 4°С в течение 30 мин со смолой Q Sepharose Fast Flow (Pharmacia). Смесь центрифугировали, супернатант сохраняли, а смолу промывали 20 мМ гистидином, 2 мМ ЭДТА, 30 мМ NaCl (pH 5,8), Тритоном Х-100 0,3% (об./об.) и элюировали 1 М NaCl в том же самом буфере. Большая часть липопротеина Orf4 была обнаружена в супернатанте, полученном после связывания. Конечную очистку выполняли хроматографией на Hi-TrapTM Q (Pharmacia). Супернатант после связывания доводили до pH 7,0 добавлением 0,1 М НСl и наносили на колонку Hi-TrapTM Q, уравновешенную 50 мМ Трис-НСl (pH 7,0), 2 мМ ЭДТА, 0,3% Тритоном Х-100, 10 мМ NaCl. Колонку промывали 5,0 мл буфера для уравновешивания и элюировали градиентом NaCl от 10 мМ до 1 М. Элюировали две электрофоретически отличающиеся формы белка. Одну в промывочном растворе, а другую в градиенте NaCl между 150 мМ и 300 мМ NaCl. Белок, полученный в промывочном растворе использовали для иммунизации мышей. Эта форма белка, вероятно, представляет собой полностью процессированную, липидированную молекулу.
Очищенный липопротеин 31 кДа представлен на фигуре 3. ORF4 пригоден для комбинирования с одной или несколькими последовательностями SEQ ID NO:1-8376.
Пример 5. Компьютерное прогнозирование
Выполняли компьютерный анализ ORF 2, 5, 6а, 7, 9, 13а, 15, 22, 23, 27, 28, 32, 65, 72, 73, 76, 79, 89, 105, 106-1, 132, 137, 138, 143 и 147 (как описано в WO 99/24578). Фигуры 4-28 показывают, для каждого из этих ORF, график гидрофильности (верхний), график антигенного индекса (средний) и AMPHI-анализ (нижний). Программу AMPHI использовали для прогнозирования Т-клеточных эпитопов [Gao et al. (1989) J. Immunol. 143:3007; Roberts et al. (1996) AIDS Res Hum Retrovir 12:593; Quakyi et al. (1992) Scand. J. Immunol. suppl.11:9] и она доступна в пакете Protean DNASTAR, Inc. (1228 South Park Street, Madison, Wisconsin 53715 USA).
Каждый из этих ORF может быть комбинирован с одной или несколькими из последовательностей SEQ ID NO:1-8376.
Пример 6. Четырехвалентная смесь
Готовили смесь белков 919 (WO 99/57280), 225 (WO 99/57280), ORF4 (WO 99/24578, пример 26) и ORF40 (WO 99/36544, пример 1) и оценивали при помощи ELISA и FACS. Титры ELISA против 13 тест-штаммов были следующими:
| Штамм | М7 conF | 2996 | МС58 | BZ133 | BZ232 | Н44/76 | 1000 |
| Титр | 38176 | 7892 | 17216 | 41488 | 17945 | 83990 | 6575 |
| Штамм | BZ198 | NG6/88 | BZ169 | BZ147 | NG3/88 | 297-0 | |
| Титр | 3329 | 59275 | - | - | 12877 | 25640 |
Результаты FACS показаны на фигуре 33. Видно, что четырехвалентная смесь дает превосходные результаты, независимо от конкретного используемого штамма menB. Кроме того, антисыворотка, индуцированная против этой смеси, в штамме 2996 является бактерицидной вплоть до разведения 1:2048.
Пример 7. Пятивалентная смесь
Готовили смесь белков ORF4-L (липидированного белка - см. пример 4 выше), ORF37 (WO 99/24578, пример 1), ORF40 (WO 99/36544, пример 1), 502 (WO 99/52780, страницы 687-690) и 8 (WO 99/57280, страницы 165-167). Титры ELISA против 13 тест-штаммов были следующими:
| Штамм | М7 conF | 2996 | МС58 | BZ133 | BZ232 | Н44/76 | 1000 |
| Титр | - | - | 25428 | - | 58300 | >109350 | >109350 |
| Штамм | BZ198 | NG6/88 | BZ169 | BZ147 | NG3/88 | 297-0 | - |
| Титр | 10999 | 109532 | 42888 | 28324 | 104212 | 33996 | - |
Результаты FACS показаны на фигуре 34. Очевидно, что пятивалентная смесь дает превосходные результаты, независимо от конкретного используемого штамма menB. Кроме того, антисыворотка, индуцированная против этой смеси, в штамме 2996 является бактериостатической.
Пример 8. Трехвалентная смесь
Белки ORF1 (например, пример 77 WO 99/24578; см. также WO 99/55873), ‘287’ (например, фигура 21 WO 99/57280; также SEQ ID NO:3103-3108 в ней) и ‘919’ (например, фигура 23 WO 99/57280 и SEQ ID NO:3069-3074 в ней) объединяли и добавляли в качестве адъюванта Аl(ОН)3. Эти белки были из штамма 2996 MenB.
Эту смесь объединяли также с полисахаридным конъюгатным антигеном MenC [Constantino et al. (1992) Vaccine 10:691-698]. OMV использовали в качестве контролей.
Смесь использовали в бактерицидном анализе против гомологичного штамма, а также гетерологичных штаммов MenB. Титры были следующими:
| 2996 | BZ133 | BZ232 | 1000 | МС58 | NGH38 | |
| Трехвалентная | 2048 | 2048 | 4 | <4 | 64 | 4 |
| +МеnС | 2048 | >32000 | 4 | 128 | 1024 | 128 |
| Контроль | 32765 | 4096 | 8192 | 16384 | 16384 | 8192 |
Пример 9. Белки 287, 919 и 953
Белки 287, 919 и 953 описаны в WO 99/57280. Эти белки из штамма 2996 серологической группы N.meningitidis экспрессировали и испытывали в бактерицидном анализе в отношении штамма 2996 одного и в комбинациях. OMV из 2996 использовали в качестве положительного контроля.
| Антиген | 287 | 919 | 953 | Контроль |
| Титр | 8192 | 2048 | 128 | 65536 |
| Комбинация | 287+919 | 287+953 | 919+953 | 287+919+953 |
| Титр | 32000 | 8192 | 8192 | 8192 |
Фигура 35 показывает данные FACS для индивидуальных антигенов и для четырех комбинаций.
Очевидно, что смеси антигенов являются более эффективными, чем отдельные антигены, и, в частности, что комбинации 919+953 дают удивительно хорошие результаты.
Индивидуальные антигены из 2996 и комбинации испытывали также против штаммов А, В и С различных серологических групп (т.е. гетерологичная стимуляция). Бактерицидные титры были следующими:
| Антиген | Штаммы серологической группы В (МеnВ) | MenA | MenC | ||||
| 2996 | BZ133 | BZ232 | МС58 | NGH38 | F6124 | С11 | |
| 287 | 8192 | >4096 | 256 | 1024 | 2048 | 1024 | 2048 |
| 919 | 2048 | - | 1024 | - | - | - | - |
| 953 | 128 | - | - | - | - | - | - |
| 287+919 | 32000 | >4096 | 512 | 512 | 1024 | 512 | >2048 |
| 287+953 | 8192 | >4096 | 1024 | 512 | 2048 | 2048 | >2048 |
| 919+953 | 8192 | - | 8192 | - | - | - | - |
| Трехвалентная | 8192 | >2048 | 256 | - | 1024 | >2048 | >2048 |
| Контроль | 65536 | - | 8192 | 2048 | - | 2048 | 32768 |
Очевидно, что эти смеси антигенов применимы для обеспечения перекрестной активности штаммов.
Во второй серии экспериментов титры для индивидуальных антигенов были следующими:
| Антиген | Штаммы серологической группы В (МеnВ) | MenA | MenC | ||||
| 2996 | BZ133 | BZ232 | МС58 | NGH38 | F6124 | С11 | |
| 287 | 16000 | 2048 | 16 | 512 | 2048 | 64 | 1024 |
| 919 | 16000 | - | 2048 | - | - | - | - |
| 953 | 2048 | - | 16 | - | - | - | - |
Эти три белка, использованные в данном примере, экспрессировали и использовали в следующих формах:
(1) белок 287 экспрессировали в Е.coli в виде GST- гибрида;
(2) белок 919 экспрессировали в Е.coli без его лидерного пептида, без его зрелого N-концевого цистеина и без какого-либо гибридного партнера (“919-без метки”); и
(3) белок 953 экспрессировали с применением гистидиновой метки.
Три иммунизации проводили с адъювантами Фрейнда - первая включала CFA, а две последние включали IFA.
Пример 10. Дополнительные поливалентные комбинации
Дополнительные комбинации антигенов испытывали в мышах CD1:
| Антигены * | Адъювант | FACS | ELISA | Бактерицидная активность |
| 919-his+0rf4-his+225-his+0rf40-his | Фрейнд | +++ | + | 8192 |
| Orf4-L+Orf37-GST+Orf40-his+502-his+8-his | Фрейнд | +++ | + | бактериостатическая |
| 919-без мeтки+791-his+792-his | Фрейнд | +++ | + | 4096 |
| 919-без мeтки+287-GST+953-his | Фрейнд | +++ | + | 8192 |
| 919-без метки+281-GST | Фрейнд | +++ | + | 32000 |
| 287-GST+953-his | Фрейнд | +++ | + | 8192 |
| 919-без метки+953-his | Фрейнд | +++ | + | 8192 |
| 919-без мeтки+Orfl-his+287-GST | Аl(ОН)3 | +++ | + | 2048 |
| 919-без мeтки+Orfl-his+287-GST+MenC гликоконъюг. | Аl(ОН)3 | +++ | + | 2048 |
| Orf-46.1-his+287-GST | Аl(ОН)3 | не опр. | 128 |
*: "his" обозначает экспрессию и иммунизацию меченого гистидином белка;
"ORF4-L" обозначает липидированную форму ORF4;
"GST" обозначает экспрессию и иммунизацию GST- гибридного белка;
"919-без метки" обозначает то же, что и в примере 9;
"МеnС гликоконъюг." обозначает МеnС-гликоконъюгат, описанный в примере 8.
Дополнительные комбинации антигенов испытывали в морских свинках:
| Антигены | Адъювант | FACS | ELISA | Бактерицидная активность |
| 919-his+287-GST+953-his+Orf46.1-his | Фрейнд | + | + | 4096 |
| 919-без метки+287-GST+953-his | Фрейнд | + | + | 4096 |
| 287-GST+953-his | Аl(ОН)3 | не опр. | + | 256 |
Очевидно, что эти комбинации дают превосходные иммунологические результаты.
Пример 11. Комбинации NspA
Белок NspA описан в WO 96/29412 и представлен здесь как SEQ ID NO:4008-4033. В соответствии с научными данными по этому белку [Martin et al. (1997) J. Exp. Med. 185 1173-1183] этот белок является высококонсервативным в штаммах Neisseria (99% перекрестной реактивности антител против NspA с 250 менингококковыми штаммами А, В и С), а также является эффективной защитой против опасного заражения живыми бактериями. Были сообщения о том, что NspA, адсорбированный на квасцах, вызывает гуморальный ответ, характерный для бактерий менингококков у кроликов и обезьян [Martin et al. (1998) Abstracts of 11th International pathogenic Neisseria conference, page 198]. На основании этих данных, rNspA (рекомбинантный NspA) разрабатывают в качестве вакцины для профилактики менингококкового заболевания, вызываемого всеми серологическими группами.
Однако, несмотря на консервативность последовательности, неожиданно было обнаружено, что эпитопы клеточной поверхности rNspA- обнаруживаются только у 65% штаммов серологической группы В и чувствительность к бактерицидной активности антител против NspA также является меньшей по сравнению с данными Martin et al. Эти результаты противоречат результатам Martin et al. и предполагают, что менингококковые В-вакцины на основе rNspA должны быть дополнены дополнительными антигенами, чтобы быть эффективными.
Штаммы N.meningitidis, испытанные в данном примере, были выделены из пациентов, находящихся в разных странах, на протяжении периода более 30 лет (см. таблицу на стр. 87 описания на русском языке). Эти штаммы были подвергнуты отбору таким образом, что они являются репрезентативными для широко дивергентных "клональных" групп, как определено типированием мультилокусных изоферментов [Seiler et al. (1996) Mol. Microbiol. 19:841-856] и/или типированием мультилокусных последовательностей [Maiden et al. (1998) PNAS USA 95:3140-45]. Штамм М7, который происходит из штамма NMB, содержит вставку транспозона, которая блокирует биосинтез капсульного полисахарида [Stephens et al. (1991) Infect. Immun. 59:4097-4102], но все другие штаммы являются инкапсулированными.
На основе нуклеотидной последовательности в Martin et al. (1997), были сконструированы ПЦР-праймеры и был амплифицирован ген NspA из штамма 8047. Эту последовательность, включающую промоторный участок, клонировали в плазмиду pSK+ (rNspA). Использовали также плазмиду pTrc.NspA.1, кодирующую белок, в котором часть сигнальной последовательности была заменена полигистидиновой меткой. Обе плазмиды экспрессировали в штамме Е.coli BL21 (DE3) и эти белки очищали. В Е.coli rNspA секретируется, а не остается связанным с наружной мембраной. Этот белок частично очищали из культуральной среды осаждением 55% (масса/объем) сульфатом аммония и он имел приблизительную молекулярную массу (MW) 18,6 кДа, подтвержденную Вестерн-блоттингом.
Две формы NspA (rNspA и денатурированный меченный гистидином NspA) инъецировали в шестинедельных самок мышей CD-1 для получения антисывороток. Их способность связываться с поверхностью штамма В N.meningitidis определяли с использованием проточного цитометрического детектирования непрямого флуоресцентного анализа [Granoff et al. (1998) J.Immunol. 160:5028-36]. Результаты для штаммов NMB и М7 (лишенного капсулы мутанта NMB) показаны на фигуре 30. Как ожидалось, моноклональное антитело (mAb) SEAM-3 в отношении полисахарида группы В [Granoff et al.] связывается только с инкапсулированным штаммом, тогда как являющееся положительным контролем mAb против Р1.2 (PorА) связывается с обоими штаммами. Антисыворотка, индуцированная в отношении rNspA, способна связывать оба штамма. Однако антисыворотки в отношении меченного гистидином NspA давали отрицательные результаты. Эти антисыворотки были также отрицательными для штаммов 8047, CU385 и М986 (фигура 31А), но при Вестерн-блоттинге эти антисыворотки давали положительные результаты.
Эти результаты предполагают, что антитела, полученные с использованием меченного гистидином NspA, узнают эпитопы, которые присутствуют в денатурированном NspA, но не в нативном NspA, обнаруживаемом на клеточной поверхности in vivo. В противоположность этому, антитела, полученные против rNspA, по-видимому, узнают конформационные эпитопы NspA.
Проточный цитометрический анализ применяли к штаммам, показанным в таблице на странице 87. Фигура 31А показывает, что мышиные антитела, индуцированные в отношении rNspA, связываются с поверхностью штамма 8047 (штамма, из которого был клонирован ген nspA) и штамма CU385, но не М986. Фигура 31В показывает сходные отрицательные результаты для штаммов BZ232, МС58, NG3/88 и NGP165. Однако во всех этих негативных случаях контрольное противокапсульное mAb было положительным.
Таблица на стр.85 суммирует результаты проточной цитометрии. Хотя сообщалось, что NspA является доступным на поверхности всех испытанных интактных штаммов N.Meningitides [Martin et al. (1997) J. Exp. Med. 185 1173-1183; Plante et al. (1999) Infect. Immun. 67:2855-61], только 11 из 17 испытанных штаммов (65%) взаимодействовали с сыворотками против rNspA. He было заметной связи между экспрессией клеточной поверхностью в конкретном штамме и классификацией (по серотипу, подтипу или электрофоретическому типу) или связи с годом или страной выделения.
В попытке объяснения этих различий в реактивности с сыворотками против rNspA, секвенировали гены nspA пяти из шести негативных штаммов (ВХ232, NG3/88, NGP165, М135 и М986) и трех позитивных штаммов (8047, CU385 и NG6/88). Последовательность для шестого негативного штамма (МС58) была уже известна на основании полной геномной последовательности.
Последовательности nspA для всех десяти штаммов были высококонсервативными, с варьированием самое большее 5 нуклеотидов в сравнении с последовательностью-прототипом по Martin et al. Наиболее вариантный белок имел только 3 отличающиеся аминокислоты (см. фигуру 29). За одним исключением, все аминокислотные варианты включали одни и те же соответствующие остатки в отдельных сегментах этого белка. Они включали сигнальный пептид, который не присутствовал в зрелом белке, и два коротких сегмента в 50 С-концевых остатках. Эти различия не объясняют результатов, полученных с антисыворотками, так как имеются примеры идентичных вариантных последовательностей в штаммах, которые были положительными, и штаммах, которые были отрицательными (сравнение М136 и 8047; NG165 и NG6/88; МС58 и CU385).
Поскольку ни отсутствие гена, ни полиморфизм не объясняли полученные с антисыворотками результаты, определяли количество белка NspA в наружных мембранах пяти штаммов (8047, CU385 и NG6/88 - все положительные в отношении анти-rNspA; М986 и М136 - оба отрицательные). Осадки бактериальных клеток экстрагировали лаурилсаркозинатом и анализировали фракции нерастворимых наружных мембран. Полоса 18,6 кДа была видна для всех пяти штаммов и она была перекрестно-реактивной с анти-His-мечеными-NspA согласно Вестерн-блоттингу. Таким образом, различия между штаммами в экспрессии nspA также не смогли объяснить эти результаты.
На способность анти-rNspA связываться с поверхностью бактериальных клеток могло бы влиять количество присутствующей полисахаридной капсулы. Поэтому количество капсульного полисахарида, продуцируемого 17 тест-штаммами, оценивали с использованием ингибирующего ELISA.
Экстракты капсульного полисахарида получали по способу, описанному Corn et al. [J. Infect. Dis. (1993) 167:356-64]. Индивидуальные бактериальные клоны выращивали до OD620 0,5-0,7 в 7 мл бульона Мюллера-Хинтона. Бактерии собирали центрифугированием при 5000g в течение 15 мин, промывали в 0,6 мл 10 мМ HEPES, рН 8,0 и затем ресуспендировали в 0,6 мл того же самого буфера, содержащего 10 мМ ЭДТА, и инкубировали при 37°С в течение 1 час. Клетки осаждали при 10000 g в течение 1 мин и о