Диагностические способы обнаружения мутации цихрома b в грибах
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, в частности к способам обнаружения низких частот встречаемости мутаций в гене цитохрома b. Выделяют ДНК из заданных грибов для конструирования олигонуклеотидного зонда или праймера. Проводят ПЦР-реакцию, в результате которой определяют связывание олигонуклеотидного зонда с ампликоном, генерированным в процессе данной реакции, или обнаруживают присутствие ампликона, который генерировался в результате ПЦР-реакции с использованием указанных праймеров. Изобретение позволяет быстро и точно определить мутации, придающие устойчивость гриба к фунгициду. 7 с. и 17 з.п. ф-лы, 9 ил.,14 табл.
Реферат
Область изобретения
Данное изобретение относится к диагностическому способу для обнаружения мутации цитохрома b в грибах, которая приводит к устойчивости к аналогам стробилурина или соединениям в той же самой группе перекрестной устойчивости, с использованием способа детектирования полиморфизма любого (или одного) единственного нуклеотида, предпочтительно с использованием системы амплификации рефракторной (устойчивой) мутации (ARMS). Данное изобретение относится также к специфическим праймерам с мутациями для применения в данном способе и к диагностическим наборам, содержащим эти праймеры. Кроме того, данное изобретение относится к идентификации специфической мутации в гене цитохрома b грибов, которая приводит к устойчивости грибов, содержащих указанную мутацию, к аналогам стробилурина или соединениям в той же самой группе перекрестной устойчивости.
Предпосылки изобретения
Широко распространенное применение фунгицидов в сельском хозяйстве является относительно недавним явлением, и большинство основных разработок имели место во время последних 40 лет. Ранее фермеры часто игнорировали или не распознавали действие, которое грибковые патогены оказывают на урожай и качество их урожаев. Однако в настоящее время эти потери являются неприемлемыми, и фермеры полагаются на применение фунгицидных химикалиев для борьбы с грибными болезнями. В результате коммерческие фунгициды стали важным компонентом общей агрохимической практики с распространенными по всему миру продажами в 1996 году около 5,9 биллионов долларов, что эквивалентно 18,9% общего агрохимического рынка (Wood Mackenzie, 1997a ‘Agcheiu products - The key agrochemical product groups’, in Agrochemical Service, Update of the Products Section, May 1997, 1-74). Большое количество фунгицидов уже доступны для фермера; недавнее издание The Pesticide Manual (Tomlin, 1994 10th Edition, British Crop Protection Council, Farnham, UK, and the Royal Society of Chemistry, Cambridge, UK) содержит 158 различных фунгицидных активных ингредиентов для применения в настоящее время. Тем не менее дальнейшее промышленное исследование, нацеленное на обнаружение и развитие новых соединений, является чрезвычайно интенсивным и процедуры управления по продукту являются крайне важными в гарантировании наилучшей и наиболее продолжительной производительности от применения фунгицидов с конкретным способом действия и/или принадлежащих к конкретным сериям соединений. В частности жизненно важной является разработка стратегий борьбы с устойчивостью при введении фунгицидов с новыми механизмами действия (Fungicide Resistance Management: Into The Next Millenium (Russel) 1999, in Pesticide Outlook, October 1999 (213-215).
Аналоги стробилурина составляют основную новую серию сельскохозяйственных фунгицидов, которые считаются наиболее захватывающим развитием на сцене сельскохозяйственных фунгицидов со времени обнаружения 1,2,4-триазолов в 1970-х годах.
Фунгицидная активность аналогов стробилурина является результатом их способности ингибировать митохондриальное дыхание в грибах. Более конкретно, было установлено, что эти соединения имеют новый односайтный способ действия, проявляя свое действие на грибы блокированием комплекса убихинол : цитохром с-оксидоредуктазы (цитохрома bc1), уменьшая, таким образом, генерирование богатого энергией АТФ в грибной клетке (Becker et al. FEBS Letts. 132:329-33). Это семейство ингибиторов предотвращает транспорт электронов в окислительно-восстановительном сайте убихинона Q0 на мультимерном белке цитохрома b (Esposti et al. 1993 Biochem. et Biophys. Acta 243-271). В противоположность многим митохондриальным белкам белок цитохрома b является митохондриально кодируемым.
Сообщения в литературе показывают, что специфические замены аминокислот в сайте-мишени цитохрома b могут влиять на активность аналогов стробилурина. Глубокие исследования мутагенеза проводились на Saccharomyces cerevisiae (далее назваемом S. cerevisiae) (JP Rago et al. 1989 J. Biol. Chem. 264, 14543-14548), мыши (Howell et al. 1988 J. Mol. Biol. 203, 607-618), Chlamydomonas reinhardtii (Bennoun et al. 1991 Genetics 127, 335-343) и Rhodobacter spp (Daldal et al., 1989, EMBO J. 3951-3961). Относящаяся к данной проблеме информация была также собрана из исследования природной основы для устойчивости к аналогам стробилурина у морского ежа Paracentrotus lividus (Esposti et al., 1990, FEBS 263, 245-247) и грибов семейства базидиомицетов Mycena galopoda и Strobilurus tenacellus (Kraiczy et al., 1996 Eur. J. Biochem. 235, 54-63), которые продуцируют природные варианты аналогов стробилурина. Имеются два различающихся района гена цитохрома b, где аминокислотные замены оказывают драматическое действие на активность аналогов стробилурина. Эти зоны охватывают аминокислотные остатки 125-148 и 250-295 (на основе системы нумерации остатков S. cerevisiae). Было показано более точно, что аминокислотные замены остатков 126, 129, 132, 133, 137, 142, 143, 147, 148, 256, 275 и 295 приводят к появлению устойчивости к аналогам стробилурина (Brasseur et al., 1996, Biochim. Biophys. Acta, 1275, 61-69 и Esposti et al. (1993), Biochimica et Biophysica Acta, 1143, 243-271).
Данное изобретение идентифицирует впервые ключевую важность одной из этих мутаций в гене цитохрома b полевых изолятов важных фитопатогенных грибов, обнаруживающих устойчивость к аналогу стробилурина или соединению в той же самой группе перекрестной устойчивости.
Сущность изобретения
Согласно первому аспекту данного изобретения авторы обеспечивают способ для обнаружения мутации в грибной нуклеиновой кислоте, где присутствие указанной мутации вызывает появление грибной устойчивости к аналогу стробилурина или любому другому соединению в той же самой группе перекрестной устойчивости, причем указанный способ предусматривает идентификацию присутствия или отсутствия указанной мутации в грибной нуклеиновой кислоте с использованием способа детектирования полиморфизма любого (или одного) единственного нуклеотида.
В данном изобретении авторы в настоящее время придумали новые диагностические способы для обнаружения точковой мутации в грибном гене цитохрома b на основе способов детектирования полиморфизма единственного нуклеотида, включающих в себя аллель-специфическую амплификацию. Специалисту с квалификацией в данной области будет очевидным, что имеется большое число аналитических процедур, которые могут быть использованы для обнаружения присутствия или отсутствия вариантных нуклеотидов в одном или нескольких полиморфных положениях в соответствии с данным изобретением. Обычно обнаружение аллельной вариации требует способа дискриминации мутаций, необязательно реакции амплификации и необязательно системы генерирования сигнала. Многие современные способы для обнаружения аллельной вариации обсуждаются в обзоре Nollau et al. Clin. Chem. 43, 1114-1120, 1997 и в стандартных руководствах, например, ’Laboratory Protocols for Mutation Detection’, Ed. by U. Landegren, Oxford University Press, 1996 и ’PCR’ 2nd Edition by Mewton and Graham, BIOS Scientific Publishers limited, 1997. Аллель-специфические реакции амплификации включают способы на основе праймеров, в том числе способы на основе полимеразной цепной реакции (ПЦР) и, более конкретно, развитие аллель-специфической полимеразной цепной реакции (ASPCR) и конкретно ARMS (системы амплификации рефракторного мутагенеза (Amplification Refractory Mutagenesis System)), где мутация вызывает появление устойчивости к аналогу стробилурина, и эти способы являются особенно предпочтительными для использования в способах данного изобретения. Способы данного изобретения включают в себя также не дискриминирующие ПЦР с последующим специфическим зондированием генерируемого ампликона (продукта амплификации). Эти способы пригодны для обнаружения специфических аллелей, которые могут придавать устойчивость к любому из аналогов стробилурина или любому другому соединению в той же самой группе перекрестной устойчивости. Надежные тесты были разработаны для детектирования этой точковой мутации в диапазоне грибных фитопатогенов. Соединения могут считаться находящимися в одной и той же группе перекрестной устойчивости, когда механизм устойчивости к одному соединению сообщает также устойчивость к другому соединению, даже в том случае, когда способы их действия не являются одними и теми же. Способ ASPCR описан в патенте США с номером 5639611, а способ ARMS описан подробно в Европейском патенте с номером ЕР 332435.
Другие способы обнаружения единственного полиморфизма, которые могут быть использованы для обнаружения мутаций, включают в себя, например, полиморфизм длины рестрикционных фрагментов (RFLP), полиморфизм конформации одной цепи, множественный клональный анализ, аллель-специфическая гибридизация олигонуклеотидов, праймерное удлинение единственного нуклеотида (Juvonen et al. (1994) Hum Genet 93 16-20; Huoponen et al., (1994) Hum Mutat 3 29-36; Mashima et al., (1995), Invest Opthelmol. Vision. Sci 36, 1714-20; Howell et al. (1994) Am. J. Hum Genet. 55 203-206; Koyabashi et al. (1994) Am. J. Hum. Genet. 55 206-209; Johns and Neufeld (1993) Am. J. Hum Genet 53 916-920; Chomyn et al. (1992) Proc. Natl. Acad. Sci. USA 89 4221-4225) и способ Invader™ (доступный из Third Wave Technologies Inc. 502 South Rosa Road, Madison, WI 53719 USA).
Предпочтительным является применение систем детектирования на основе ПЦР.
Согласно предпочтительному варианту первого аспекта данного изобретения авторы обеспечивают способ обнаружения мутации в грибной нуклеиновой кислоте, где присутствие указанной мутации вызывает появление грибной устойчивости к аналогу стробилурина или любому другому соединению в той же самой группе перекрестной устойчивости, причем указанный способ предусматривает детектирование присутствия ампликона, генерируемого во время ПЦР-реакции, где указанная ПНР-реакция предусматривает контактирование тест-пробы, содержащей грибную нуклеиновую кислоту, с праймером в присутствии подходящих нуклеотидтрифосфатов и агента для полимеризации, причем детектирование указанного ампликона непосредственно связано с присутствием или отсутствием указанной мутации в указанной нуклеиновой кислоте.
Обнаружение ампликона, генерируемого во время ПЦР-реакции, может быть непосредственно зависимым от удлинения праймера, специфического в отношении присутствия этой мутации, т.е. когда удлинение праймера зависит от присутствия данной мутации и, следовательно, ампликон генерируется только в том случае, когда этот праймер связывается и/или удлиняется, когда данная мутация присутствует (как это имеет место в случае технологии ARMS), подобным образом оно может непосредственно зависеть от удлинения праймера, специфического в отношении отсутствия этой мутации, например, последовательности дикого типа, или может быть непосредственно связано с продуктом удлинения ПЦР, содержащим мутантную последовательность ДНК, т.е. когда это обнаружение относится к ампликону, содержащему мутантную ДНК-последовательность. Первая альтернатива является особенно предпочтительной.
Ампликон может быть ампликоном из любого цикла ПЦР и он включает в себя первый продукт удлинения аллель-специфического праймера.
В дополнительном предпочтительном варианте данное изобретение обеспечивает способ обнаружения мутации в грибной нуклеиновой кислоте, где присутствие указанной мутации вызывает появление грибной устойчивости к аналогу стробилурина или любому другому соединению в той же самой группе перекрестной устойчивости, причем указанный способ предусматривает контактирование тест-пробы, содержащей грибную нуклеиновую кислоту, с подходящим диагностическим праймером в присутствии подходящих нуклеотидтрифосфатов и агента для полимеризации, так что этот диагностический праймер удлиняется либо когда указанная мутация присутствует в пробе, либо когда присутствует последовательность дикого типа; и детектирование присутствия или отсутствия указанной мутации по присутствию или отсутствию продукта удлинения диагностического праймера.
В дополнительном предпочтительном варианте данное изобретение обеспечивает способ обнаружения мутации в грибной нуклеиновой кислоте, где присутствие указанной мутации вызывает появление грибной устойчивости к аналогу стробилурина или любому другому соединению в той же самой группе перекрестной устойчивости, причем указанный способ предусматривает контактирование тест-пробы, содержащей грибную нуклеиновую кислоту, с диагностическим праймером для специфической мутации в присутствии подходящих нуклеотидтрифосфатов и агента для полимеризации, так что этот диагностический праймер удлиняется, когда указанная мутация присутствует в пробе, и детектирование присутствия или отсутствия указанной мутации по присутствию или отсутствию продукта удлинения диагностического праймера.
Согласно особенно предпочтительному варианту первого аспекта данного изобретения авторы обеспечивают способ обнаружения мутации в грибной нуклеиновой кислоте, где присутствие указанной мутации вызывает появление грибной устойчивости к аналогу стробилурина или любому другому соединению в той же самой группе перекрестной устойчивости, причем указанный способ предусматривает контактирование тест-пробы, содержащей грибную нуклеиновую кислоту, с диагностическим праймером для специфической мутации в присутствии подходящих нуклеотидтрифосфатов и агента для полимеризации, так что этот диагностический праймер удлиняется только в том случае, когда указанная мутация присутствует в пробе, и детектирование присутствия или отсутствия указанной мутации по присутствию или отсутствию продукта удлинения диагностического праймера.
В применении здесь термин диагностический праймер используют для обозначения праймера, который используется специфически для идентификации присутствия или отсутствия мутации или последовательности дикого типа, а термин обычный праймер используют для обозначения праймера, связывающегося с противоположной цепью ДНК относительно диагностического праймера и 3’ относительно района, узнаваемого этим диагностическим праймером, и который, действуя с указанным диагностическим праймером, позволяет амплификацию лежащего между ними участка ДНК во время ПЦР. Если диагностический праймер является праймером ARMS, он может иметь 3’ дефект спаривания по сравнению с мутантной последовательностью или последовательностью дикого типа.
В этом и во всех последующих аспектах и вариантах данного изобретения предпочтительно детектировать удлинение продукта праймерного удлинения с использованием системы детектирования, которая является интегральной частью либо диагностического праймера, либо обычного праймера на противоположной цепи. Это описано более подробно здесь.
Способы данного изобретения особенно пригодны для обнаружения мутаций в митохондриальном гене, который кодирует белок, являющийся мишенью для фунгицида, особенно для обнаружения мутаций в грибном гене цитохрома b, где указанные мутации приводят к ингибированию фунгицидной активности белка цитохрома b, но все еще позволяют осуществление генерирования АТФ и наиболее предпочтительно, где указанная мутация в грибном гене цитохрома b приводит к одной из следующих аминокислотных замен: A126T, F129L, Y132C, C133Y, G137R/S/E/V, W142T/K, G143A, I147F, T148M, N256Y/K/I, I275F/S/T или L295F, где первая аминокислота заменяется второй аминокислотой в положении в последовательности, обозначенном номером, присутствие которой вызывает появление грибной устойчивости к аналогам стробилурина или любому другому соединению в той же самой группе перекрестной устойчивости, причем идентификация остатков основана на системе нумерации остатков цитохрома в S. cerevisiae.
Аналоги стробилурина и соединения в той же самой группе перекрестной устойчивости включают в себя, например, азоксистробин, пикоксистробин, крезоксим-метил, трифлоксистробин, фамоксадон и фенамидон.
Авторы изобретения нашли, что положение в нуклеиновой кислоте грибного цитохрома b, соответствующее 143-ему кодону/аминокислоте в последовательности цитохрома b S. cerevisiae, является ключевым определяющим фактором грибной устойчивости к аналогам стробилурина или любому другому соединению в той же самой группе перекрестной устойчивости в полевых изолятах, устойчивых к аналогам стробилурина фитопатогенных грибов. Способы данного изобретения, описанные здесь, пригодны, в частности, для обнаружения мутации в положении, соответствующем остатку 143 цитохрома b Saccharomyces cerevisiae, где остаток глицина заменен другой аминокислотой, которая ингибирует активность аналогов стробилурина или любого другого соединения в той же самой группе перекрестной устойчивости и приводит к устойчивому фенотипу в грибах, несущих мутантный ген цитохрома b, вызывая тем самым появление грибной устойчивости к аналогам стробилурина или любого другого соединения в той же самой группе перекрестной устойчивости.
Этот способ предпочтительно используют для обнаружения мутации, приводящей к замене указанного остатка глицина в положении, соответствующем остатку 143 цитохрома b S. cerevisiae, аминокислотой, выбранной из группы аргинин, серин, цистеин, валин, аспарагиновая кислота, глутаминовая кислота, триптофан и, наиболее предпочтительно, аланин.
Еще в одном предпочтительном варианте первого аспекта данного изобретения авторы изобретения обеспечивают способ обнаружения мутации в грибном гене цитохрома b, приводящей к замене глицина на аланин в положении, соответствующем остатку 143 цитохрома b S. cerevisiae (G143A), в кодируемом белке, приводящей, таким образом, к появлению грибной устойчивости к аналогам стробилурина или любому другому соединению в той же самой группе перекрестной устойчивости, причем указанный способ предусматривает идентификацию присутствия или отсутствия указанной мутации в грибной нуклеиновой кислоте с использованием способа детектирования полиморфизма любого (или одного) единственного нуклеотида.
Мутация в грибном гене цитохрома b, приводящая к замене G143A в кодируемом белке, обычно представляет собой замену основания гуанина на основание цитозин во втором положении (основании) этого кодона, и обнаружение этого полиморфизма единственного основания является предпочтительным для всех аспектов и вариантов описанного здесь изобретения.
Еще в одном предпочтительном варианте первого аспекта данного изобретения авторы обеспечивают диагностический способ обнаружения мутации в грибном гене цитохрома b, приводящей к замене G143A в кодируемом белке, причем указанный способ предусматривает детектирование присутствия ампликона, генерируемого во время ПЦР-реакции, причем указанная ПЦР-реакция предусматривает контактирование тест-пробы, содержащей грибную нуклеиновую кислоту, с диагностическим праймером в присутствии подходящих нуклеотидтрифосфатов и агента полимеризации, где детектирование указанного ампликона прямо связано с присутствием или отсутствием указанной мутации в указанной нуклеиновой кислоте.
В особенно предпочтительном варианте первого аспекта данного изобретения авторы изобретения теперь обеспечивают диагностический способ обнаружения мутации в грибном гене цитохрома b, приводящей к замене G143A в кодируемом белке, причем указанный способ предусматривает контактирование тест-пробы, содержащей грибную нуклеиновую кислоту, с диагностическим праймером для мутации, приводящей к замене G143A в кодируемом белке, в присутствии подходящих нуклеотидтрифосфатов и агента полимеризации, так что этот диагностический праймер удлиняется, когда мутация присутствует в пробе, приводя к замене G143A в кодируемом белке; и детектирование присутствия или отсутствия указанной мутации по присутствию или отсутствию продукта удлинения диагностического праймера.
В следующем особенно предпочтительном варианте первого аспекта данного изобретения авторы теперь обеспечивают диагностический способ обнаружения мутации в грибном гене цитохрома b, приводящей к замене G143A в кодируемом белке, причем указанный способ предусматривает контактирование тест-пробы, содержащей грибную нуклеиновую кислоту, с диагностическим праймером для мутации, приводящей к замене G143A в кодируемом белке, в присутствии подходящих нуклеотидтрифосфатов и агента полимеризации, так что этот диагностический праймер удлиняется только в том случае, когда мутация, приводящая к замене С143А в кодируемом белке, присутствует в пробе; и детектирование присутствия или отсутствия указанной мутации по присутствию или отсутствию продукта удлинения диагностического праймера.
В применении здесь термин G143A используется для обозначения замены остатка глицина остатком аланина в последовательности грибного цитохрома b в эквивалентном положении 143 его кодона/аминокислоты последовательности цитохрома b S. cerevisiae. Эта номенклатура используется для всех других замен остатков, цитируемых здесь, т.е. все положения цитируются относительно белковой последовательности цитохрома b S. cerevisiae. Последовательности гена и белка цитохрома b S. cerevisiae доступны на базах данных EMBL и SWISSPROT (см. EMBL ACCESSION NO. X84042 и SWISSPROT ACCESSION NO. P00163). Специалисту с квалификацией в данной области будет понятно, что точная длина и спектр эквивалентных белков из различных видов могут варьироваться как результат амино- или карбоксиконцевых и/или одной или нескольких внутренних делений или инсерций. Поскольку аминокислотный участок, содержащий остаток, соответствующий 6143 в S. cerevisiae, является достаточно консервативным (Widger et al. Proc. Natl. Acad. Sci. USA 81 (1984) 674-678), нетрудно идентифицировать точно соответствующий остаток во вновь полученной последовательности грибного цитохрома b либо визуальным исследованием, либо с использованием одной из нескольких программ сопоставления последовательностей, в том числе Megalign или Macaw. Хотя и обозначенное как G143 в данной заявке, вследствие позиционной и функциональной эквивалентности точное положение этого глицина в новом цитохроме b может не быть 143-м остатком от его амино-конца. Консенсусная последовательность цитохрома b S. cerevisiae обеспечена в SWISSPROT ACCESSION NO. P00163. Во всех аспектах и вариантах данного изобретения, описанных здесь, положения в последовательности цитохрома b являются предпочтительно определенными относительно последовательности цитохрома b S. cerevisiae, обеспеченной в EMBL ACCESSION NO. Х84042. Альтернативно, во всех аспектах и вариантах данного изобретения, описанных здесь, положения в последовательности цитохрома b являются предпочтительно определенными относительно консенсусной последовательности цитохрома b S. cerevisiae, обеспеченной в SWISSPROT ACCESSION NO. P00163.
Согласно одному аспекту данного изобретения обеспечен способ для диагностики полиморфизма единственного нуклеотида в грибном гене цитохрома b, причем этот способ предусматривает определение последовательности грибной нуклеиновой кислоты в положении, соответствующем одному или нескольким основаниям в триплете, кодирующем аминокислоту в положении, соответствующем остатку 143 цитохрома b S. cerevisiae, в белке цитохрома b, и определение состояния устойчивости указанных грибов в отношении аналога стробилурина или соединения в той же самой группе перекрестной устойчивости по полиморфизму в гене цитохрома b.
Во всех аспектах и вариантах данного изобретения, описанных здесь, предпочтительно, чтобы только одно основание в триплете, кодирующем аминокислоту в положении, соответствующем остатку 143 цитохрома b S. cerevisiae, в белке цитохрома b, обнаруживало мутацию, т.е. где имеется полиморфизм единственного нуклеотида, имеющий место только в одном положении и, кроме того, предпочтительно, чтобы мутация находилась в первом или втором основании этого триплета и наиболее предпочтительно, чтобы она находилась во втором основании этого триплета.
Согласно предпочтительному варианту этого аспекта данного изобретения, обеспечен способ для диагностики полиморфизма единственного нуклеотида в грибном гене цитохрома b, причем этот способ предусматривает определение последовательности грибной нуклеиновой кислоты в положении, соответствующем второму основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 143 цитохрома b S. cerevisiae, в белке цитохрома b, и определение состояния устойчивости указанных грибов в отношении аналога стробилурина или соединения в той же самой группе перекрестной устойчивости по полиморфизму в гене цитохрома b.
В варианте вышеописанного аспекта данного изобретения способ для диагностики, описанный здесь, является способом, в котором полиморфизм единственного нуклеотида в положении ДНК, соответствующем второму основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 143 цитохрома b S. cerevisiae, в белке цитохрома b, представляет собой присутствие G и/или С.
| Таблица 1Использование кодонов | |||
| Первое положение | Второе положение | Третье положение | |
| 5’-конец | С | G | 3’-конец |
| G | Аланин | Глицин | U |
| Аланин | Глицин | С | |
| Аланин | Глицин | А | |
| Аланин | Глицин | G |
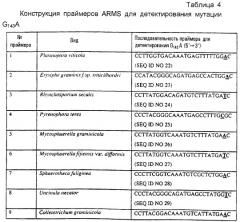
Точковая мутация глицина в аланин требует замены G на С во втором основании этого кодона. Другие мутации могут также возникать в 3-м положении в этом кодоне вследствие вырожденности генетического кода в отношении аланина и глицина (см. таблицу 1), но это легко учесть при конструировании диагностического праймера. Диагностический праймер является предпочтительно праймером ARMS (Концепция праймеров ARMS в полном виде описана в Newton et al. Nucleic Acid Research 17(7) 2503-2516 1989). В результате праймеры ARMS могут быть сконструированы для обнаружения точковой мутации G143A при условии информации только о последовательности чувствительного к аналогу стробилурина гена цитохрома b дикого типа. Нет необходимости иметь доступный устойчивый изолят в новых представляющих интерес грибах, происходящий из мутации G143A. Некоторые примеры релевантных фитопатогенных грибов приведены в списке в таблице 2. Этот список не рассматривается как каким-либо образом ограничивающий. Квалифицированный фитопатолог будет способен легко идентифицировать те грибы, к которым могут быть применены способы данного изобретения.
| Таблица 2Пример видов, в которых может анализироваться G143A | |
| Примеры видов, в которых может анализироваться G143A | |
| 1 | Plasmopara viticola |
| 2 | Erysiphe graminis f.sp. tritici/hordei |
| 3 | Rhynchosporium secalis |
| 4 | Pyrenophora teres |
| 5 | Mycosphaerella graminicola |
| 6 | Mycosphaerella fijiensis var. difformis |
| 7 | Sphaerotheca fuliginea |
| 8 | Uncinula necator |
| 9 | Colletotrichum graminicola |
| 10 | Pythium aphanidermatum |
| 11 | Colletotrichum gloeosporioides |
| 12 | Oidium lycopersicum |
| 13 | Leveillula taurica |
| 14 | Pseudoperonospora cubensis |
| 15 | Alternaria solani |
| 16 | Cercospora arachidola |
| 17 | Rhizoctonia solani |
| 18 | Venturia inaequalis |
| 19 | Magnaporthe grisea |
| 20 | Phytophthora infestans |
| 21 | Mycosphaerella musicola |
Способы данного изобретения, описанные здесь, особенно применимы в связи с фитопатогенными грибами, в частности со следующими видами грибов: Plasmopara viticola, Erysiphe graminis f.sp. tritici/hordei, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Venturia inaequalis, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Magnaporthe grisea, Phytophthora infestans, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctonia solani, Mycosphaerella musicola и Cercospora arachidola.
В дополнительном аспекте данное изобретение обеспечивает способ обнаружения грибной устойчивости к аналогу стробилурина или любого другого соединения в той же самой группе перекрестной устойчивости, причем указанный способ предусматривает идентификацию присутствия или отсутствия мутации в грибной нуклеиновой кислоте, причем присутствие указанной мутации вызывает появление устойчивости к аналогу стробилурина или любому другому соединению в той же самой группе перекрестной устойчивости, причем указанный способ предусматривает идентификацию присутствия или отсутствия полиморфизма единственного нуклеотида, имеющего место в положении, соответствующем одному или нескольким основаниям в триплете, кодирующем аминокислоту в положении, соответствующем остатку 143 цитохрома b S. cerevisiae, в белке цитохрома b.
В дополнительном предпочтительном варианте этого аспекта данное изобретение обеспечивает способ обнаружения грибной устойчивости к аналогу стробилурина или любому другому соединению в той же самой группе перекрестной устойчивости, причем указанный способ предусматривает идентификацию присутствия или отсутствия мутации в грибной нуклеиновой кислоте, причем присутствие указанной мутации вызывает появление устойчивости к аналогу стробилурина или любому другому соединению в той же самой группе перекрестной устойчивости, причем указанный способ предусматривает идентификацию присутствия или отсутствия полиморфизма единственного нуклеотида, имеющего место в положении, соответствующем второму основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 143 цитохрома b S. cerevisiae, в белке цитохрома b.
В предпочтительном варианте этого аспекта данного изобретения присутствие или отсутствие полиморфизма единственного нуклеотида в положении, соответствующем второму основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 143 цитохрома b S. cerevisiae, в гене цитохрома b в грибной нуклеиновой кислоте, идентифицируют с использованием способов детектирования полиморфизма любого (или одного) единственного нуклеотида.
Далее, данное изобретение обеспечивает грибную последовательность ДНК, кодирующую весь белок цитохрома b дикого типа или часть этого белка, причем указанная последовательность ДНК кодирует остаток глицина в положении, соответствующем остатку 143 цитохрома b S. cerevisiae, в белке дикого типа, причем указанная последовательность может быть получена или получена из гриба, выбранного из группы, состоящей из Plasmopara viticola, Erysiphe graminis f.sp. tritici/hordei, Rhynchosporium secalis, Pyrenophora teres, Mycosphaerella graminicola, Mycosphaerella fijiensis var. difformis, Sphaerotheca fuliginea, Uncinula necator, Colletotrichum graminicola, Pythium aphanidermatum, Colletotrichum gloeosporioides, Oidium lycopersicum, Leveillula taurica, Pseudoperonospora cubensis, Alternaria solani, Rhizoctania solani, Mycosphaerella musicola и Cercospora arachidola.
Грибные последовательности ДНК в соответствии с вышеописанными аспектами данного изобретения предпочтительно содержат около 30 нуклеотидов на любой или на обеих сторонах от положения в этой ДНК, соответствующего одному или более основаниям в триплете, предпочтительно соответствующего второму основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 143 цитохрома b S. cerevisiae, в белке, так как эта степень нуклеиновой кислоты обеспечивает специалиста всей информацией, необходимой для конструирования видо- и мутация-специфических реагентов и/или способов для использования во всех способах детектирования полиморфизма единственного нуклеотида. В применении здесь термин около 30 означает, что эта последовательность может содержать до 30 нуклеотидов, например 5, до 10, 15, 20 или 25 нуклеотидов, или может содержать более 30 нуклеотидов.
В применении здесь в связи со всеми ДНК- и белковыми последовательностями термин "вся или часть" используется для обозначения ДНК-последовательности или белковой последовательности или их фрагмента. Фрагмент ДНК или белка может составлять, например, 10, 20, 25, 30, 40, 50, 60, 70, 75, 80, 85, 90 или 95% длины всей последовательности.
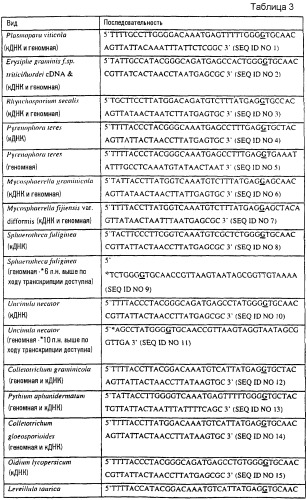
Специалисту с квалификацией в данной области будет очевидно, что пробы, содержащие как геномную (митохондриальную) ДНК, так и кДНК, могут анализироваться в соответствии с данным изобретением. Если проба содержит геномную ДНК, следует учитывать интронную организацию при использовании информации последовательности. Примеры грибных последовательностей ДНК дикого типа, содержащих часть последовательности гена цитохрома b дикого типа, в соответствии с вышеописанным аспектом данного изобретения, обеспечены в таблице 3 и указанные последовательности образуют следующий аспект данного изобретения.
В таблице 3 второе основание в триплете, кодирующем аминокислоту в положении, соответствующем остатку 143 цитохрома b S. cerevisiae, которое приводит к замене обычного остатка глицина альтернативной аминокислотой, причем указанная замена сообщает устойчивость к аналогам стробилурина или соединению в той же самой группе перекрестной устойчивости, выделено жирным шрифтом и подчеркнуто.
Данное изобретение относится также к грибной последовательности ДНК, обнаруживающей гомологию или идентичность последовательности относительно указанных последовательностей ДНК в таблице 3, и включает в себя, например, вариации в последовательностях ДНК, обнаруживаемые в различных пробах или изолятах одного и того же вида. Эти вариации могут, например, быть следствием использования альтернативного кодона, варьирующей митохондриальной организации интрон/экзон и замены аминокислот.
В следующем аспекте данное изобретение обеспечивает грибную последовательность ДНК, кодирующую весь белок цитохрома b или его часть, которая, при выстраивании против соответствующей последовательности ДНК дикого типа, кодирующей белок цитохрома b, содержит, как это видно, мутацию полиморфизма единственного нуклеотида в положении в ДНК, соответствующем одному или более основаниям в триплете, кодирующем аминокислоту в положении, соответствующем остатку 143 цитохрома b S. cerevisiae, в этом белке, что приводит к замене обычного остатка глицина альтернативной аминокислотой, при условии, что указанная последовательность ДНК не является последовательностью Mycena galopoda, кодирующей цитохром b.
В следующем предпочтительном варианте этого аспекта данное изобретение обеспечивает грибную последовательность ДНК, кодирующую весь белок цитохрома b или его часть, которая при выстраивании против соответствующей последовательности ДНК дикого типа, кодирующей белок цитохрома b, содержит, как это видно, мутацию полиморфизма единственного нуклеотида в положении в ДНК, соответствующем второму основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 143 цитохрома b S. cerevisiae, в этом белке, что приводит к замене обычного остатка глицина альтернативной аминокислотой, при условии, что указанная последовательность ДНК не является последовательностью Mycena galopoda, кодирующей цитохром b.
Грибная последовательность ДНК в соответствии с вышеописанным аспектом данного изобретения содержит предпочтительно около 30 нуклеотидов на любой стороне или на обеих сторонах от положения в этой ДНК, соответствующего одному или нескольким основаниям в триплете, предпочтительно соответствующего второму основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 143 цитохрома b S. cerevisiae, в белке, так как эта степень нуклеиновой кислоты обеспечивает специалиста всей информацией, необходимой для конструирования видо- и мутация-специфических реагентов и/или способов для использования во всех способах детектирования полиморфизма единственного нуклеотида. В применении здесь термин около 30 означает, что эта последовательность может содержать до 30 нуклеотидов, например 5, до 10, 15, 20 или 25 нуклеотидов, или может содержать более 30 нуклеотидов.
Далее, данное изобретение обеспечивает грибную последовательность ДНК, кодирующую весь мутантный белок цитохрома b или его часть, причем присутствие мутации в указанной ДНК сообщает устойчивость к аналогу стробилурина или соединению в той же самой группе перекрестной устойчивости, причем указанная мутация имеет место в положении в ДНК, соответствующем одному или более основаниям в триплете, кодирующем аминокислоту в положении, соответствующем остатку 143 цитохрома b S. cerevisiae, в белке, при условии, что указанная последовательность ДНК не является последовательностью Мyсеnа galopoda, кодирующей цитохром b.
В предпочтительном варианте этого аспекта данное изобретение обеспечивает также грибную последовательность ДНК, кодирующую весь мутантный белок цитохрома b или его часть, причем присутствие мутации в указанной ДНК сообщает устойчивость к аналогу стробилурина или соединению в той же самой группе перекрестной устойчивости, причем указанная мутация имеет место в положении в ДНК, соответствующем второму основанию в триплете, кодирующем аминокислоту в положении, соответствующем остатку 143 цитохрома b S. cerevisiae, в белке, при условии, что указанная последовательность ДНК не является последовательностью Mycena galopoda, кодирующей цитохром b.
В приведенных