Способ прогнозирования метастазирования увеальной меланомы на основе маркеров апоптоза bax и bcl-2
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к офтальмоонкологии, и предназначено для повышения точности прогнозирования метастазирования увеальной меланомы. Сущность изобретения заключается в проведении иммуногистохимического анализа клеток удаленной опухоли с последующим определением процента клеток, экспрессирующих Вах, по отношению к общему количеству опухолевых клеток в поле зрения, процента клеток, экспрессирующих Bcl-2, и индекса соотношения этих двух показателей и в случаях, где этот индекс менее 1,0 прогнозируют высокую вероятность метастазирования. Преимущество изобретения заключается в том, что способ позволяет с высокой точностью прогнозировать вероятность появления метастазов при увеальной меланоме с целью своевременного назначения адекватного лечения и увеличения продолжительности жизни тяжелого контингента больных. 2 ил.
Реферат
Изобретение относится к офтальмологии, а именно к офтальмоонкологии, и предназначено для прогнозирования метастазирования увеальной меланомы (УМ) с целью своевременного и адекватного лечения больных с этим заболеванием и увеличения продолжительности их жизни.
УМ является чрезвычайно злокачественной опухолью органа зрения, представляющей угрозу не только зрительным функциям, но и жизни пациента. Заболеваемость УМ по данным различных авторов колеблется от 2,3 до 7 человек на 1 млн. населения, а частота метастазирования после энуклеации достигает 80% при 10-ти летнем сроке наблюдения [Opthalmic Pathology and Intraocular Tumors. - 1996 - 1997 - р.186-190. - American Academy of Ophthalmology. San-Franciscol. Непредсказуемость этой опухоли позволяет отнести ее к разряду самых загадочных биологических феноменов. Между тем, исследования последних лет показали, что существенную помощь в прогнозировании могут оказать молекулярно-биологические маркеры, регулирующие основные биологические процессы в клетке, например апоптоз.
Известно, что биологическое поведение опухоли определяется балансом двух диаметрально противоположных по смыслу процессов пролиферации и апоптоза.
Апоптоз - генетически программированный клеточный суицид, обеспечивающий количественный гомеостаз конкретной клеточной популяции, или физиологический механизм регуляции клеточного гомеостаза тканей и органов. Нарушения апоптоза на уровне регуляции обусловливают развитие многих патологических процессов, в том числе злокачественных опухолей. В запуске апоптоза участвуют биохимические, морфологические, иммунологические и функциональные сигналы-индукторы. Их комбинации варьируют в различных клетках, органах и тканях в разных физиологических и патологических условиях.
Физиологический апоптоз, то есть протекающий в нормальных клетках, имеет принципиальные отличия от апоптоза опухолевых клеток. В последнем случае меняются не только его функции, но и механизмы регуляции. Если физиологический апоптоз - это механизм поддержания гомеостаза (объема органа, ткани и т.д.), а также генетического постоянства, то апоптоз в опухоли - один из способов иммортализации (закрепления) и усиления злокачественного фенотипа опухолевой клетки, его агрессивности, метастатического потенциала, а также регулятор скорости прогрессирования.
На широком спектре опухолей человека доказано, что интенсивность апоптоза прямо ассоциируется с прогрессированием, снижением степени зрелости и повышением агрессивности [Лушников Е.Ф., Абросимов А.Ю. Гибель клетки. - Москва. - Медицина. - 2001 - стр. 189]. Многие авторы пришли к выводу, что интенсивность апоптоза является надежным прогностическим маркером. Чем он выше, тем выше злокачественный потенциал и хуже прогноз.
Для оценки апоптоза и основных механизмов, ответственных за его развитие, в практическом плане широко используются маркеры ключевых точек генетической программы клеточной смерти: протеинов р53, Всl-2, Вах, Fas (APO-1/CD-95). Из этого числа можно исследовать отдельные показатели, некоторые их сочетания или весь комплекс в зависимости от поставленных задач.
В мире существует немного публикаций об экспрессии Вах в опухолях вообще и меланоме, в частности, причем литературные данные противоречивы. Одни авторы указывают, что в первичной и метастатической меланоме кожи, как и в невусах, имеет место гиперэкспрессия Вах. Другие исследователи находят гиперэкспрессию Вах только в первичных меланомах [Tang L, Tron VA, Reed JC. еt al. Expression of apoptosis regulators in cutaneous malignant melanoma. Clin Cancer Res 1998; 4(8): 1865-71.]. Связи экспрессии Вах с прогнозом кожных меланом не установлено. Но при раке молочной железы, толстой кишки, поджелудочной железы доказано, что экспрессия Вах является благоприятным прогностическим признаком. Наши более ранние собственные исследования по Вах показали, что этот маркер может служить достоверным информативным маркером прогноза метастазирования (В.Г.Лихванцева. “Роль цитокинов в патогенезе, прогнозе и лечении увеальной меланомы.” - Диссертация на соискание ученой степени докт. мед наук).
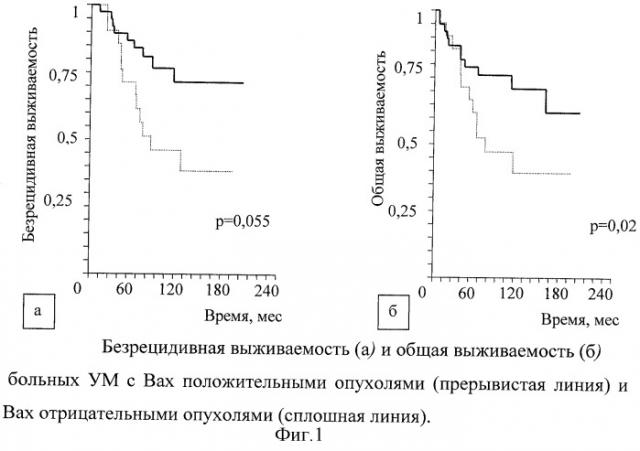
Экспрессия Вах выявлена нами в 35% тестируемых опухолей. Не обнаружено корреляций между экспрессией Вах и традиционными клинико-патологическими характеристиками опухоли. Вместе с тем, было обнаружено, что низкая общая выживаемость наблюдалась у больных, положительных по Вах, по сравнению с Вах-отрицательной группой (р=0,022; фиг.1б). При анализе все пациенты были распределены на две группы А и В. Группу А образовали 61 пациент с Вах-негативными больными, из которых за время наблюдения (209,6±3,3 месяца) умерло от генерализации 10 человек. Группу В составили 33 пациента с Вах-позитивными УМ, из которых умерло 13 человек от метастазов при средних сроках наблюдения 89,8±9,3 месяца. Таким образом, выживаемость в группе А при 10-летнем сроке наблюдения составила 80%, а в группе В при тех же сроках наблюдения - в два раза меньше (40%, р<0,01). Медиана продолжительности жизни с момента оперативного вмешательства до смерти от метастазов составила 81 месяц. При оценке безрецидивной выживаемости выявлена сильная тенденция к более частому развитию метастазов у Вах-положительных больных (группа В, прерывистая линия на фиг. 1а и б) по сравнению с Вах-отрицательными (группа А, сплошная линия на фиг. 1а и б)) больными (р=0,055; фиг. 1а). Медиана времени до появления метастазов в группе Вах-позитивных больных составила 72 мес.
Полученные результаты позволяют предположить, что этот белок играет важную роль в прогрессировании УМ, поскольку безрецидивная и общая выживаемость у Вах-отрицательных больных значительно выше, а разница в показателях выживаемости в обеих анализируемых группах - высоко достоверна (р=0,02). Таким образом, результаты проведенных нами исследований позволяли прийти к заключению, что количественное определение экспрессии Вах в УМ может служить достоверным и информативным маркером прогнозирования клинического течения УМ. Вместе с тем, выявление только позитивности или негативности экспрессии маркера в тестируемой опухоли позволяет отобрать группу повышенного риска развития метастазов, в которой из 10 отобранных пациентов прогноз оправдывается только у 8 человек, то есть частота совпадения прогноза не более 80%. Мы взяли этот способ прогнозирования за ближайший аналог.
Мы также предположили, что недостаточно высокая информативность и достоверность связаны с тем, что Вах жизненно характеризует только один важный аспект жизнедеятельности опухоли апоптоз, между тем в исследованиях не нашел отражение другой, не менее важный, а главное диаметрально противоположный, по сути, биологический процесс - пролиферация. В связи с чем, мы продолжили наши исследования и изучили экспрессию маркера-регулятора и апоптоза (антиапоптический регулятор) и пролиферации - Всl-2. Ретроспективный анализ совместной экспрессии этих маркеров (со-экспрессии) во взаимосвязи с исходом опухолевого процесса показал, что мы находимся на верном пути.
В целом на срезах УМ Всl-2 выявлен в большинстве случаев (72,3%, n=70). Несмотря на значительные колебания в показателях (от 5 до 100%), тестируемых УМ (n=42). В качестве самостоятельного показателя этот пептид дал мало информации. Но в совокупности с Вах информативность маркера в плане прогноза оказалась высока. Причем наихудший прогноз оказался у пациентов с индексом соотношения Bax/Bcl-2≤1. Для проверки вывода мы подвергли корреляционно-регрессионному анализу кривые выживаемости по Каплан-Мейеру для пациентов, чей индекс Всl-2/Вах≤1 и для тех, у кого он >2 (фиг. 2). В группу А вошли 82 человека со значениями индекса >2,0, продолжительность наблюдения за ними составила 194,5±13,2 месяцев; в группу В - 15 с индексом ≤1,0, продолжительность наблюдения - 54,8±8,6 месяцев. Анализ кривых выбывания показал, что при одинаковом сроке наблюдения (10 лет) в группе А по причине смерти от метастатической болезни выбыло только 20%, в то время как в группе В - 90% (р=0,0280).
Задачей предлагаемого изобретения является разработка способа прогнозирования клинического течения УМ, в частности вероятность развития метастазов у каждого конкретного больного.
За ближайший аналог изобретения мы взяли способ прогнозирования клинического течения УМ на основе иммуногистохимического анализа экспрессии маркера апоптоза - Вах в опухолевых клетках (В.Г. Лихванцева. "Роль цитокинов в патогенезе, прогнозе и лечении УМ". Диссертация на соискание ученой степени доктора мед. наук. Москва. - 2001 г.). Способ надежен, эффективен, однако вероятность совпадения прогноза достигает не более 80%, что заставило нас искать пути повышения достоверности и надежности прогноза.
Техническим результатом является объективизация и повышение точности прогнозирования.
Технический результат достигается за счет использования дополнительного маркера, отвечающего за подавление апоптоза и регуляцию пролиферации опухолевых клеток- Всl-2.
Предлагаемый нами способ прогнозирования осуществляют следующим образом.
1. После энуклеации глаза с увеальной меланомой готовили из стандартного блока с опухолью 2 парафиновых среза толщиной 3-5 микрон по стандартной методике, депарафинировали в ксилоле и регидратировали в батарее спиртов. Один из срезов использовали для проведения иммуногистохимической реакции с маркерами Вах, а на другом срезе определяли экспрессию Всl-2. Последовательность этапов проведения реакции с каждым из маркеров совпадала.
2. Иммуногистохимическое исследование проводили по стандартной методике. Для открытия антигенных детерминант проводили обработку срезов в цитратном буфере [рН 6,0] в течение 30 минут при 95°С на водяной бане.
3. Инкубацию с первичными антителами проводили в течение ночи при 4°С. В качестве первичных антител при оценке экспрессии Вах использовали кроличьи поликлональные антитела к Вах (разведение 1:500, DAKO Corp), а при оценке экспрессии Bcl-2 - моноклональные антитела к Всl-2 (разведение 1:80, DAKO Corp).
4. Для визуализации реакции антиген-антитело использовали стрептавидин-биотиновую тест-систему LSAB+kit [DAKO Corp] согласно инструкции. В качестве хромогена использовали ДАБ+[DAKO Corp].
5. Затем срезы докрашивали гематоксилином и заключали в бальзам.
6. Реакцию оценивали с применением светового микроскопа (увеличение×40) по следующим критериям. Количество положительных клеток оценивали в зонах, содержащих их максимальное количество. В качестве негативного контроля использовали иммуногистохимическую реакцию без добавления первичных антител.
7. Оценку экспрессии Вах на срезе определяли по факту окраски иммунопозитивных клеток маркером на Вах среди общего числа клеток в поле зрения микроскопа×40.
8. Оценку экспрессии Всl-2 на срезе определяли по факту окраски иммунопозитивных клеток маркером на Всl-2 среди общего числа клеток в поле зрения микроскопа×40.
9. Подсчитывали индекс соотношения процента позитивных клеток Вах к проценту позитивных клеток Bcl-2 - при выявлении этого индекса менее или равного 1,0 считали прогноз для конкретного пациента с таким показателем неблагоприятным: с короткой продолжительностью жизни и высокой вероятностью метастазирования. Пациента выделяли в группу риска и проводили профилактическое антиметастатическое лечение.
Пример 1. Пациент 68 лет. Диагноз УМ в стадии Т3NоМо. Размеры опухоли не позволяли провести органосохранное лечение. Безальтернативным методом являлась энуклеация. Иммуногистохимические исследования парафинового среза опухоли по указанному способу выявили 25% Вax-позитивных клеток и 55% Bcl-2-позитивных клеток на срезе УМ при увеличении×40. Индекс их соотношения оказался 0,45, то есть менее 1,0. Больной отнесен в группу высокого риска развития метастазов. Назначены укороченные интервалы между визитами врача. Незадолго до окончания года наблюдения после энуклеации у больного выявлены метастазы в печени. Проведена иммунотерапия с целью замедления скорости метастазирования.
Пример 2. Пациентка 70 лет. Перенесла энуклеацию по поводу УМ значительных размеров. Размеры, локализация, возраст являлись факторами высокого риска развития метастазов. Однако проведенные исследования по определению уровня Вах и Bcl-2 и индекса их соотношения показали, что индекс их соотношения более 2,0. Что расценено как благоприятный прогноз для пациента. Наблюдение на протяжении 8 лет не выявило вторичных очагов УМ.
Способ прогнозирования метастазирования увеальной меланомы, включающий иммуногистохимическое определение в удаленной опухоли процента клеток, экспрессирующих Вах, по отношению к общему количеству опухолевых клеток в поле зрения, отличающийся тем, что дополнительно определяют процент клеток, экспрессирующих Bcl-2, подсчитывают индекс отношения первого показателя ко второму и, если индекс составляет менее 1,0, прогнозируют высокую вероятность метастазирования.