Иммуностимулирующие нуклеиновые кислоты
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к способу стимуляции иммунного ответа композициями иммуностимулирующих нуклеиновых кислот, композиции, содержащей олигонуклеотид, и к способу лечения или профилактики аллергии или астмы. Сущность изобретения состоит в том, что для стимуляции иммунного ответа вводят обогащенную тимидином нуклеиновую кислоту, содержащую последовательности поли-Т и/или содержащую более 60% нуклеотидных остатков тимидина. Техническим результатом является новый способ стимуляции иммунного ответа за счет введения предложенной иммуностимулирующей нуклеиновой кислоты. 3 н. и 24 з.п. ф-лы, 12 ил., 10 табл.
Реферат
Предшествующий уровень техники
Бактериальная ДНК, но не ДНК позвоночных обладает иммуностимулирующими эффектами на мононуклеарные клетки периферической крови (РВМС) in vitro (Krieg et al., 1995). Бактериальная ДНК, но не ДНК позвоночных характеризуется иммуностимулирующими эффектами в отношении активации В-клеток и клеток-естественных киллеров (Tokunaga, Т., et al., 1988. Jpn. J. Cancer Res. 79: 682-686; Tokunaga, Т., et ai., 1984, JNCI 72: 955-962; Messina, J.P., et al., 1991, J.Immunol. 147: 1759-1764; и в обзоре Krieg, 1998, In: Applied Oligonucieotide Technology, C.A. Stein and A.M. Krieg, (Eds.), Jone Wiley and Sons, Inc., New York, NY, pp.431-448). Сейчас ясно, что данные иммуностимулирующие эффекты бактериальной ДНК являются результатом присутствия неметилированных CpG-динуклеотидов в особых контекстах оснований (мотивы CpG), которые обычны для бактериальной ДНК, но метилированы и недостаточно представлены (уменьшение CpG от 1/50 до 1/60) в ДНК позвоночных (Krieg et al, 1995 Nature 374: 546-549; Krieg, 1999 Biochim. Biophys. Acta 93321: 1-10). Иммуностимулирующие эффекты бактериальной ДНК могут быть смоделированы с помощью синтетических олигодезоксинуклеотидов (ОДН), содержащих данные CpG-мотивы. Представляется вероятным, что быстрая активация иммунной системы в ответ на CpG-ДНК может развиваться как один из компонентов природных иммунных защитных механизмов, которые узнают структурные характеристики, специфичные для молекул микробов.
ОДН CpG обладают сильными стимулирующими эффектами в отношении лейкоцитов человека и мыши, индуцируя пролиферацию почти всех (>95%) В-клеток, и увеличивают секрецию иммуноглобулинов (Ig); секрецию цитокинов; лизисную активность клеток-естественных киллеров (NK) и секрецию lFN-γ; и активацию дендритных клеток (DC) и других антиген-представляющих клеток в отношении экспрессии костимулирующих молекул и секреции цитокинов, особенно Th1-подобных цитокинов, которые важны для поддержки развития Th1-подобных ответов Т-клеток. Активация В-клеток под действием CpG-ДНК является независимой от Т-клеток и антигеннеспецифической. Однако активация В-клеток низкими концентрациями CpG-ДНК характеризуется выраженным синергизмом с сигналами, передаваемыми через антигенные рецепторы В-клеток, в отношении как пролиферации В-клеток, так и секреции Ig (Krieg et al., 1995). Данный выраженный синергизм между сигнальными путями В-клеток, триггером которых является антигенный рецептор В-клеток, и CpG-ДНК способствует развитию антигенспецифическимх иммунных ответов. В дополнение к их прямым эффектам на В-клетки CpG-ДНК также прямо активируют моноциты, макрофаги и дендритные клетки в отношении секреции цитокинов, включая высокие уровни ИЛ-12 (Klinman et al., 1996; Halpern et al., 1996; Cowdery et al., 1996). Данные цитокины стимулируют клетки-естественные киллеры (NK) для секреции интерферона гамма (IFN-γ) и увеличивают их лизисную активность (Klinman et al., 1996, выше; Cowdery et al., 1996, выше; Yamamota et al., 1992; Ballas et al., 1996). В общем CpG-ДНК индуцирует Th1-подобный характер продукции цитокинов с преобладанием ИЛ-12 и IFN-γ и с небольшой секрецией Th2-цитокинов (Klinman et al., 1996). Сильные прямые эффекты (независимые от Т-клеток) CpG-ДНК на В-клетки, также как индукция цитокинов, которые могут характеризоваться непрямыми эффектами на В-клетки через Т-хелперные пути, предполагает использование CpG-ДНК в форме ОДН в качестве адъюванта вакцины. (Смотри патентную заявку РСТ, публикация No.: WO 98/40100).
Данные иммуностимулирующие эффекты природного фосфодиэфирного остова CpG ОДН высокоспецифичны для CpG так, что эффекты практически исчезают, если мотив CpG метилирован, изменен на GpC или уничтожен или изменен другим путем (Krieg et al., 1995 Nature 374: 546-549; Hartmann et al, 1999 Proc. Natl. Acad. Sci USA 96: 9305-10). Фосфодиэфирные CpG ОДН могут быть заключены в пузырьки из липидов, квасцов или в пузырьки других типов со свойствами запасания или улучшенного захвата клетками для увеличения иммуностимулирующих эффектов (Yamamoto et al., 1994 Microbiol. Immunol. 38: 831-836; Gramzinski et al., 1998 Mol. Med. 4: 109-118).
В ранних исследованиях предполагалось, что иммуностимулирующий мотив CpG соответствует формуле пурин-пурин-СрG-пиримидин-пиримидин (Krieg et al., 1995 Nature 374: 546-549; Pisetsky, 1996 J. Immunol. 156: 421-423; Hacker et al., 1998 EMBO J. 17: 6230-6240; Lipford et al., 1998 Trends in Microbiol. 6:496-500). Однако сейчас ясно, что лимфоциты мыши вполне хорошо отвечают на фосфодиэфирные CpG-мотивы, которые не соответствуют данной "формуле" (Yi et al., 1998 J. Immunol. 160: 5898-5906), и то же самое справедливо для В-клеток человека и дендритных клеток (Hartmann et al., 1999 Proc. Natl. Acad. Sci USA 96: 9305-10; Liang, 1996 J. Clin. Invest. 98: 1119-1129).
Несколько исследователей в прошлом изучали, может ли содержание нуклеотидов в ОДН действовать независимо от последовательности ОДН. Интересно, что было обнаружено, что антисмысловые ОДН обычно обогащены GG, ССС, СС, САС и CG последовательностями, в то же время имея сниженную частоту нуклеотидных последовательностей ТТ или ТСС по сравнению с ожидаемым, если использование оснований было случайным (Smetsers et al., 1996 Antisense Nucleic Acid Drug Develop. 6: 63-67). Это увеличивает возможность того, что представленные в большем количестве последовательности могут содержать предпочтительные элементы, направленные на мишень в виде антисмысловых олигонуклеотидов, и наоборот. Одна из причин избегать применения тимидин-обогащенных ОДН для экспериментов по антисмысловым последовательностям заключается в том, что разрушение ОДН нуклеазами, присутствующими в клетках, ведет к высвобождению свободного тимидина, который конкурирует с 3H-тимидином, который часто применяют в экспериментах для оценки клеточной пролиферации (Matson et al., 1992 Antisense Research and Development 2:325-330).
Краткое изложение существа изобретения
Настоящее изобретение относится частично к обогащенным пиридином (Ру-обогащенным) и в некоторых осуществлениях к обогащенных тимидином (Т) иммуностимулирующим нуклеиновым кислотам, для которых не требуется присутствие CpG-мотива. Настоящее изобретение также относится частично к открытию того, что нуклеиновые кислоты, которые содержат TG-динуклеотидный мотив, также являются иммуностимулирующими. Изобретение частично основано на неожиданных данных о том, что последовательности нуклеиновых кислот, которые не содержат CpG-мотивы, являются иммуностимулирующими. При анализе иммуностимулирующих свойств многих последовательностей нуклеиновых кислот было открыто, что данные последовательности могут быть Ру-обогащенными, например Т-обогащенными, или они могут содержать TG-мотивы. Было также открыто, что данные последовательности предпочтительно активируют иммунные клетки животных, отличных от грызунов. Ру-обогащенные и TG-последовательности обладают только минимальными иммуностимулирующими свойствами в отношении иммунных клеток грызунов по сравнению с иммунными клетками животных, отличных от грызунов. Таким образом, возможно в соответствии со способами изобретения индуцировать иммунный ответ у субъекта, не являющегося грызуном, путем введения Ру-обогащенных или содержащих TG-мотивы иммуностимулирующих нуклеиновых кислот. Ру-обогащенные или содержащие TG-мотивы иммуностимулирующие нуклеиновые кислоты согласно изобретению могут - необязательно - включать в себя CpG-мотивы. Эти данные имеют важное значение для развития клинического применения иммуностимулирующих содержащих CpG и не содержащих CpG нуклеиновых кислот.
В одном варианте изобретения предлагается фармацевтическая композиция, содержащая эффективное количество для стимуляции иммунного ответа выделенных Ру-обогащенных или содержащих TG-мотивы иммуностимулирующих нуклеиновых кислот и фармацевтически приемлемый носитель. В других вариантах изобретения предлагается композиция предмета изобретения, включающая в себя выделенную Ру-обогащенную или содержащую TG-мотивы иммуностимулирующую нуклеиновую кислоту. В других осуществлениях иммуностимулирующая нуклеиновая кислота может быть Т-обогащенной. Еще в одном аспекте иммуностимулирующая нуклеиновая кислота может быть Т-обогащенной и также иметь по меньшей мере один TG-мотив.
Предпочтительно Ру-обогащенная нуклеиновая кислота представляет собой Т-обогащенную нуклеиновую кислоту. В некоторых осуществлениях Т-обогащенная нуклеиновая кислота представляет собой поли-Т нуклеиновую кислоту, включающую в себя 5’ТТТТ3’. Еще в одном осуществлении поли-Т нуклеиновая кислота включает в себя в себя 5’Х1Х2ТТТТХ3Х43’, где X1, Х2, Х3 и Х4 являются нуклеотидами. В некоторых осуществлениях X1X2 представляют собой ТТ и/или Х3Х4 представляют собой ТТ. В других осуществлениях X1X2 выбирают из группы, состоящей из ТА, TG, ТС, AT, АА, AG, АС, СТ, СС, СА, CG, GT, GG, GA и GC; и/или Х3Х4 выбирают из группы, состоящей из ТА, TG, ТС, AT, АА, AG, АС, СТ, СС, СА, CG, GT, GG, GA и GC.
Т-обогащенная иммуностимулирующая нуклеиновая кислота может иметь только один поли-Т-мотив или она может иметь множество поли-Т-мотивов нуклеиновой кислоты. В некоторых осуществлениях Т-обогащенная иммуностимулирующая нуклеиновая кислота включает в себя по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7 или по меньшей мере 8 Т-мотивов. В других осуществлениях она включает в себя по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 7 или по меньшей мере 8 CpG-мотивов. В предпочтительных осуществлениях множество CpG-мотивов и поли-Т-мотивов рассеяно.
Еще в одном осуществлении по меньшей мере одно из множеств поли-Т-мотивов содержит по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 6 по меньшей мере 7, по меньшей мере 8 или по меньшей мере 9 соприкасающихся Т-нуклеотидных остатка. В других осуществлениях множество поли-Т-мотивов представляет собой по меньшей мере 3 мотива и из данных по меньшей мере 3 мотивов, каждый включает в себя по меньшей мере 3 соприкасающихся Т-нуклеотидных остатка или множество поли-Т-мотивов представляет собой по меньшей мере 4 мотива и из данных по меньшей мере 4 мотивов, каждый включает в себя по меньшей мере 3 соприкасающихся Т-нуклеотидных остатка.
В некоторых случаях Т-обогащенная иммуностимулирующая нуклеиновая кислота может быть свободной от поли-Т-мотивов, но может предпочтительно включать в себя нуклеотидный состав с более чем 25% Т. В других осуществлениях Т-обогащенные иммуностимулирующие нуклеиновые кислоты имеют поли-Т-мотивы и также включают в себя нуклеотидный состав с более чем 25% Т. В предпочтительных осуществлениях Т-обогащенная иммуностимулируюшая нуклеиновая кислота включает в себя нуклеотидный состав с более чем 35% Т, более чем 40% Т, более чем 50% Т, более чем 60% Т, более чем 80% Т или более чем 90% Т-нуклеотидных остатков. В важных осуществлениях нуклеиновая кислота имеет по меньшей мере 50% Т.
Т-обогащенные и иммуностимулирующие TG-нуклеиновые кислоты могут иметь любую длину, большую, чем 7 нуклеотидов, но в некоторых осуществлениях могут иметь между 8 и 100 нуклеотидными остатками в длину. В предпочтительных осуществлениях Т-обогащенная иммуностимулирующая нуклеиновая кислота включает в себя по меньшей мере 20 нуклеотидов, по меньшей мере 24 нуклеотида, по меньшей мере 27 нуклеотидов или по меньшей мере 30 нуклеотидов. В предпочтительных осуществлениях иммуностимулирующая TG-нуклеиновая кислота в длину составляет между 15 и 25 нуклеотидами. Т-обогащенная и иммуностимулирующие TG-нуклеиновые кислоты могут быть односпиральными и двуспиральными.
В одном предпочтительном осуществлении иммуностимулирующая нуклеиновая кислота имеет Т-обогащенную область, расположенную в середине ее длины (т.е. приблизительно равное количество нуклеотидов прилегает к Т-обогащенной области с 5’ и 3’ концов).
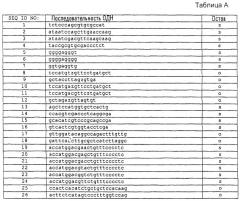
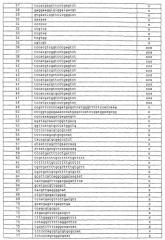
Т-обогащенную нуклеиновую кислоту в некоторых осуществлениях выбирают из группы, состоящей из SEQ ID NO: 59-63, 73-75, 142, 215, 226, 241, 267-269, 282, 301, 304, 330, 342, 358, 370-372, 393, 433, 471, 479, 486, 491, 497, 503, 556-558, 567, 694, 793-794, 797, 833, 852, 861, 867, 868, 882, 886, 905, 907, 908 и 910-913. В других осуществлениях Т-обогащенные нуклеиновые кислоты представляют собой последовательность, выбранную из группы, состоящей из SEQ ID NO: 64, 98, 112, 146, 185, 204, 208, 214, 224, 233, 244, 246, 247, 258, 262, 263, 265, 270-273, 300, 305, 316, 317, 343, 344, 350, 352, 354, 374, 376, 392, 407, 411-413, 429-432, 434, 435, 443, 474, 475, 498-501, 518, 687, 692, 693, 804, 862, 883, 884, 888, 890 и 891.
В других осуществлениях Ру-обогащенная иммуностимулирующая нуклеиновая кислота представляет собой С-обогащенную нуклеиновую кислоту. Иммуностимулирующая С-обогащенная нуклеиновая кислота представляет собой нуклеиновую кислоту, содержащую по меньшей мере одну, и предпочтительно по меньшей мере 2 поли-С-области, или содержащую 50% или более С-нуклеотидов.
Ру-обогащенные и иммуностимулирующие TG-нуклеиновые кислоты могут включать в себя один или более CpG-мотивов. Мотивы могут быть метилированы или неметилированы. В других осуществлениях Ру-обогащенные и иммуностимулирующие TG-нуклеиновые кислоты свободны от одного или более CpG-динуклеотидов.
В других осуществлениях Ру-обогащенные и иммуностимулирующие TG-нуклеиновые кислоты также включают в себя поли-А, поли-G и/или поли-С мотивы. Еще в одном осуществлении Ру-обогащенная или иммуностимулирующая TG-нуклеиновая кислота свободна от двух поли-С-последовательностей из по меньшей мере 3 смежных С-нуклеотидных остатков или свободна от двух поли-А-последовательностей из по меньшей мере 3 соприкасающихся А-нуклеотидных остатков. В других осуществлениях Ру-обогащенная или иммуностимулирующая TG-нуклеиновая кислота имеет нуклеотидный состав из более чем 25% С или более чем 25% А. Еще в одном осуществлении Ру-обогащенная или иммуностимулирующая TG-нуклеиновая кислота свободна от поли-С-последовательностей, поли-С-последовательностей или поли-А-последовательностей.
Поли-G нуклеиновую кислоту в некоторых осуществлениях выбирают из группы, состоящей из SEQ ID NO: 5, 6, 73, 215, 267-269, 276, 282, 288, 297-299, 355, 359, 386, 387, 444, 476, 531, 557-559, 733, 768, 795, 796, 914-925, 928-931, 933-936 и 938. В других осуществлениях поли-G нуклеиновая кислота включает в себя последовательность, выбранную из группы, состоящей из SEQ ID NO: 67, 80-82, 141, 147, 148, 173, 178, 183, 185, 214, 224, 264, 265, 315, 329, 434, 435, 475, 519, 521-524, 526, 527, 535, 554, 565, 609, 628, 660, 661, 662, 725, 767, 825, 856, 857, 876, 892, 909, 926, 927, 932 и 937.
В соответствии с другим вариантом изобретения иммуностимулирующие нуклеиновые кислоты могут быть определены как таковые, обладающие TG-мотивом, их здесь обозначают как иммуностимулирующие TG-нуклеиновые кислоты. TG-нуклеиновая кислота в одном осуществлении содержит по меньшей мере один TG-динуклеотид, имеющий последовательность, включающую в себя по меньшей мере следующую формулу: 5’N1X1TGX2N23’. В сходных осуществлениях N1 представляет собой последовательность нуклеиновой кислоты, состоящую из количества нуклеотидов, колеблющегося в диапазоне от (11-N2) до (21-N2), и N2 представляет собой последовательность нуклеиновой кислоты, состоящую из количества нуклеотидов, колеблющегося в диапазоне oт (11-N2) до (21-N1). В предпочтительном осуществлении X2 представляет собой тимидин.
В других осуществлениях TG-нуклеиновая кислота имеет по меньшей мере следующую формулу: 5’X1X2TGX3X43’. Еще в одном осуществлении TG-нуклеиновая кислота включает в себя следующую последовательность: 5’N1X1X2TGX3X4N23’. В сходном осуществлении N1 представляет собой последовательность нуклеиновой кислоты, состоящую из количества нуклеотидов, колеблющегося в диапазоне от (9-N2) до (19-N2), и N2 представляет собой последовательность нуклеиновой кислоты, состоящую из количества нуклеотидов, колеблющегося в диапазоне от (9-N1) до (19-N1). В одном предпочтительном осуществлении Х3 представляет собой тимидин. Х1Х2 представляют собой нуклеотиды, которые могут быть выбраны из группы, состоящей из GT, GG, GA, АА, AT, AG, СТ, СА, CG, ТА и ТТ, а Х3Х4 представляют собой нуклеотиды, которые могут быть выбраны из группы, состоящей из ТТ, СТ, AT, AG, CG, TC, АС, СС, ТА, АА и СА. В некоторых предпочтительных осуществлениях Х3 представляет собой тимидин. В важных осуществлениях Х3Х4 представляют собой нуклеотиды, которые могут быть выбраны из группы, состоящей из ТТ, TC, ТА и TG. В другом осуществлении X1X2 представляют собой GA или GT, а Х3Х4 представляют собой ТТ. Еще в одном осуществлении X1 или Х2, или оба являются пуринами, а Х3 или Х4, или оба являются пиримидинами, или X1X2 представляют собой GpA, а Х3 или Х4, или оба они являются пиримидинами. В одном осуществлении X2 представляет собой Т, а Х3 является пиримидином.
В одном осуществлении 5’X1X2TGX3X13’ последовательность TG-нуклеиновой кислоты либо TG-нуклеиновая кислота полной длины, либо ее некоторый фрагмент представляют собой непалиндромную последовательность, а в других осуществлениях - палиндромную последовательность.
В некоторых предпочтительных осуществлениях TG-нуклеиновая кислота является также Т-обогащенной.
Ру-обогащенные и иммуностимулирующие TG-нуклеиновые кислоты в некоторых осуществлениях имеют нуклеотидный остов, который включает в себя по меньшей мере одну модификацию остова, такую как фосфортиоатная модификация. Нуклеотидный остов может быть гибридным или предпочтительно нуклеотидный остов является полностью модифицированным. В одном предпочтительном осуществлении иммуностимулирующая нуклеиновая кислота имеет поли-Т-мотив и фосфортиоатный остов.
В другом варианте изобретение представляет собой композицию иммуностимулирующей нуклеиновой кислоты в форме Ру-обогащенной или иммуностимулирующей TG-нуклеиновой кислоты и антигена, где нуклеиновая кислота является свободной от неметилированных CpG-мотивов.
Другая композиция согласно изобретению представляет собой Ру-обогащенную или иммуностимулирующую TG-нуклеиновую кислоту и противомикробный агент, где Ру-обогащенная или TG-нуклеиновая кислота является свободной от неметилированных CpG-мотивов. Предпочтительно противомикробный агент выбирают из группы, состоящей из противовирусного агента, антипаразитарного агента, антибактериального агента и противогрибкового агента.
Композиция устройства с постоянным высвобождением, включающая в себя Ру-обогащенную и/или иммуностимулирующую TG-нуклеиновую кислоту, где Ру-обогащенная и/или TG-нуклеиновая кислота является свободной от неметилированных CpG-мотивов, предлагается в соответствии с другим вариантом изобретения.
Изобретение также включает в себя пищевые добавки Ру-обогащенной или иммуностимулирующей TG-нуклеиновой кислоты и устройство для доставки, выбранное из группы, состоящей из капсулы, пилюли и подъязычной таблетки, где Ру-обогащенная или TG-нуклеиновая кислота является свободной от неметилированных CpG-мотивов.
Должно быть понятно, что когда полезно вводить Ру-обогащенный, например поли-Т, Т-обогащенный, С-обогащенный или TG-олигонуклеотид и CpG-олигонуклеотид, может быть также желательным совместное введение Ру-обогащенного или TG-олигонуклеотида вместе с физически отдельным CpG, Py-обогащенным или TG-олигонуклеотидом. В противоположном варианте CpG, Ру-обогащенный или TG-мотив может присутствовать в одной и той же нуклеиновой кислоте в виде прилегающего Ру-обогащенного или TG-олигонуклеотида. Еще в одном осуществлении все или некоторые сочетания Ру-обогащенной, TG- и CpG-нуклеиновых кислот можно вводить совместно либо как отдельные нуклеиновые кислоты, либо в одной и той же молекуле нуклеиновой кислоты. Под совместным введением подразумевается, что нуклеиновые кислоты будут вводиться достаточно близко по времени одна к другой для достижения объединенного полезного действия обоих олигонуклеотидов, предпочтительно большего, чем полезное действие, достигаемое введением каждого из олигонуклеотидов по отдельности в той же дозе.
CpG-олигонуклеотиды имеют в целом формулу 5’X1X2CGX3X43’, где X1, X2, Х3 и Х4 представляют собой нуклеотиды и где по меньшей мере С из CpG неметилирован. Предпочтительные CpG-олигонуклеотиды составляют 8-100 нуклеотидов в длину и имеют модифицированные остовы. Конкретные структуры подробно описаны в опубликованных заявках РСТ, заявках США и цитированных здесь ссылках, открытия которых включены здесь полностью. В одном осуществлении CpG-олигонуклеотид свободен от поли-Т и TG-мотивов и не является Т-обогащенным.
В других осуществлениях CpG-олигонуклеотид имеет последовательность, выбранную из группы, состоящей из SEQ ID NO: I, 3, 4, 14-16, 18-24, 28, 29, 33-46, 49, 50, 52-56, 58, 64-67, 69, 71, 72, 76-87, 90, 91, 93, 94, 96, 98, 102-124, 126-128, 131-133, 136-141, 146-150, 152-153, 155-171, 173-178, 180-186, 188-198, 201, 203-214, 216-220, 223, 224, 227-240, 242-256, 258, 260-265, 270-273, 275, 277-281, 286-287, 292, 295-296, 300, 302, 305-307, 309-312, 314-317, 320-327, 329, 335, 337-341, 343-352, 354, 357, 361-365, 367-369, 373-376, 378-385, 388-392, 394, 395, 399, 401-404, 406-426, 429-433, 434-437, 439, 441-443, 445, 447, 448, 450, 453-456, 460-464, 466-469, 472-475, 477, 478, 480, 483-485, 488, 489, 492, 493, 495-502, 504-505, 507-509, 511, 513-529, 532-541, 543-555, 564-566, 568-576, 578, 580, 599, 601-605, 607-611, 613-615, 617, 619-622, 625-646, 648-650, 653-664, 666-697, 699-706, 708, 709, 711-716, 718-732, 736, 737, 739-744, 746, 747, 749-761, 763, 766-767, 769, 772-779, 781-783, 785-786, 7900792, 798-799, 804-808, 810, 815, 817, 818, 820-832, 835-846, 849-850, 855-859, 862, 865, 872, 874-877, 879-881, 883-885, 888-904 и 909-913.
В другом осуществлении Ру-обогащенный или TG-олигонуклеотид свободен от CpG-мотивов. Данное осуществление изобретения также включает в себя фармацевтические композиции и наборы, которые содержат как CpG-олигонуклеотид (который может быть свободен от поли-Т и TG-мотивов и не является Т-обогащенным), так и Ру-обогащенный и/или TG-олигонуклеотид, физически отдельный от CpG-олигонуклеотида. Фармакологические препараты находятся в эффективных количествах и обычно включают в себя фармацевтически приемлемые носители - все, как здесь подробно объясняется, для Ру-обогащенных и TG-олигонуклеотидов. Наборы включают в себя по меньшей мере один контейнер, содержащий олигонуклеотид, который представляет собой Ру-обогащенный или TG-олигонуклеотид (или некоторые их сочетания). Тот же контейнер или в других осуществлениях второй контейнер может содержать олигонуклеотид с CpG-мотивом, который может быть свободен от Ру-обогащенного и/или TG-мотивов. Набор также содержит инструкции для введения олигонуклеотидов субъекту. Наборы также могут включать в себя контейнер, содержащий растворитель или разбавитель.
В целом, как здесь полностью цитируется, CpG-олигонуклеотид, физически отделенный от Ру-обогащенного или TG-олигонуклеотида, может быть применен совместно с Ру-обогащенным или TG-олигонуклеотидами в способах, композициях и продуктах, описанных выше.
Изобретение относится к другим аспектам иммуностимулирующих олигонуклеотидов, которые имеют химерные остовы и которые не требуют присутствия CpG-мотива. Изобретение частично основано на открытии того, что последовательности нуклеиновых кислот, которые не содержали CpG-мотивов, были иммуностимупирующими, и что те, которые имеют химерные остовы, обладают неожиданно увеличенными иммуностимулирующими свойствами. Таким образом, изобретение в одном варианте относится к составу олигонуклеотида, имеющего формулу: 5’Y1N1ZN2Y23’, где Y1 и Y2 независимо друг от друга представляют собой молекулы нуклеиновых кислот, имеющие от 1 до 10 нуклеотидов, где Y1 включает в себя по меньшей мере одну модифицированную межнуклеотидную связь, a Y2 включает в себя по меньшей мере одну модифицированную межнуклеотидную связь, и где N1 и N2 представляют собой молекулы нуклеиновых кислот, которые независимо друг от друга имеют от 0 до 5 нуклеотидов, но где N1ZN2 имеет по меньшей мере 6 нуклеотидов в сумме, и где нуклеотиды N1ZN2 имеют фосфодиэфирный остов, и где Z представляет собой иммуностимулирующий мотив нуклеиновой кислоты, но не включает в себя CG. В одном осуществлении Z представляет собой последовательность нуклеиновой кислоты, выбранную из группы, состоящей из ТТТТ, TG, и последовательности, в которой по меньшей мере 50% оснований последовательности представляют собой Ts.
В некоторых осуществлениях Y1 и/или Y2 имеют от 3 до 8 нуклеотидов. В других осуществлениях Y1 и/или Y2 включают в себя по меньшей мере три Gs, по меньшей мере четыре Gs, по меньшей мере семь Gs или все Gs. В других осуществлениях Y1 и/или Y2 выбирают из группы, состоящей из TCGTCG, TCGTCGT и TCGTCGTT (SEQ ID NO:1145). Еще в одном осуществлении Y1 и/или Y2 включают в себя по меньшей мере одну, две, три, четыре или пять поли-А, поли-Т или поли-С-последовательности.
Центральные нуклеотиды (N1ZN2) формулы Y1N1ZN2Y2 имеют фосфодиэфирные межнуклеотидные связи, а Y1 и Y2 имеют по меньшей мере одну модифицированную межнуклеотидную связь. В некоторых осуществлениях Y1 и/или Y2 имеют по меньшей мере две модифицированные межнуклеотидные связи. В других осуществлениях Y1 и/или Y3 имеют от двух до пяти модифицированных межнуклеотидных связей. Еще в одном осуществлении Y1 имеет две модифицированные межнуклеотидные связи, и Y2 имеет пять модифицированных межнуклеотидных связей или Y1 имеет пять модифицированных межнуклеотидных связей и Y2 имеет две модифицированные межнуклеотидные связи. Модифицированная межнуклеотидная связь в некоторых осуществлениях представляет собой фосфортиоатную модифицированную связь, фосфордитиоатную модифицированную связь или п-этокси-модифицированную связь.
Части формулы Y1N1ZN2Y2 могут необязательно формировать палиндром. Таким образом, в некоторых осуществлениях нуклеотиды N1ZN2 образуют палиндром. В некоторых осуществлениях палиндром не представляет собой прямой повтор. Еще в одних осуществлениях нуклеотиды N1ZN2 не образуют палиндром.
В соответствии с другими осуществлениями N1ZN2 имеют последовательность нуклеотидов, выбранную из группы, состоящей из
GATTTTATCGTC (SEQ ID NO: 1098),
TCGATTTTTCGA (SEQ ID NO: 1099); TCATTTTTATGA (SEQ ID NO: 1100);
GTTTTTTACGAC (SEQ ID NO: 1101); TCAATTTTTTGA (SEQ ID NO: 1102);
ACGTTTTTACGT (SEQ ID NO: 1103); TCGTTTTTACGA (SEQ ID NO: 1104);
TCGATTTTTACGTCGA (SEQ ID NO: 1105); AATTTTTTAACGTT (SEQ ID NO:
1106); ТСGТTTTTTAACGA (SEQ ID NO: 1107); ACGTTTTTTAACGT (SEQ ID
NO: 1108); GATTTTTATCGTC (SEQ ID NO: 1109); GACGATTTTTCGTC (SEQ
ID NO: 1110); GATTTTAGCTCGTC (SEQ ID NO: 1111); GATTTTTACGTC
(SEQ ID NO: 1112); ATTTTATCGT (SEQ ID NO: 1113); AACGATTTTTCGTT
(SEQ ID NO: 1114); TCACTTTTGTGA (SEQ ID NO: 1115); TCGTATTTTA (SEQ ID NO: 1116); ACTTTTGTACCGGT (SEQ ID NO: 1117); TCGATTTTTCGACGTCGA (SEQ ID NO: 1118); ACGATTTTTCGT (SEQ ID NO: 1119); GATGATCGTC (SEQ ID NO: 1120); TCGATGTCGA (SEQ ID NO: 1121); TCATGTATGA (SEQ ID NO: 1122);
GTGTTACGAC (SEQ ID NO: 1123); TCAATGTTGA (SEQ ID NO: 1124);
ACGTGTACGT (SEQ ID NO: 1125); TCGTGTACGA (SEQ ID NO: 1126);
TCGATGTACGTCGA (SEQ ID NO: 1127); AATGTTAACGTT (SEQ ID NO:
1128);
TCGTGTTAACGA (SEQ ID NO: 1129); ACGTGTTAACGT (SEQ ID NO: 1130);
GATGTATCGTC (SEQ ID NO: 1131); GACGATGTCGTC (SEQ ID NO: 1132);
GATGAGCTCGTC (SEQ ID NO: 1133); GATGTACGTC (SEQ ID NO: 1134);
ATGATCGT (SEQ ID NO: 1135); AACGATGTCGTT (SEQ ID NO: 1136);
TCACTGGTGA (SEQ ID NO: 1137); TCGTATGA (SEQ ID NO: 1138);
ACTGGTACCGGT (SEQ ID NO: 1139); TCGATGTCGACGTCGA (SEQ ID NO:
1140); и ACGATGTCGT(SEQIDNO:1141).
Композиция может необязательно включать в себя фармацевтический носитель и/или может быть составлена в виде устройства для доставки. В некоторых осуществлениях устройство для доставки выбирают из группы, состоящей из катионных липидов, проникающих в клетку белков, и устройств с постоянным высвобождением. В одном предпочтительном осуществлении устройство с постоянным высвобождением представляет собой биодеградируемый полимер. В другом осуществлении устройство с постоянным высвобождением представляет собой микрочастицу.
В другом варианте в изобретении предлагается композиция иммуностимулирующего олигонуклеотида, имеющего формулу Y1N1ZN2Y2, и антигена.
Другая композиция согласно изобретению представляет собой иммуностимулирующий олигонуклеотид, имеющий формулу Y1N1ZN2Y2, и противомикробный терапевтический агент. Предпочтительно противомикробный терапевтический агент выбирают из группы, состоящей из противовирусного агента, антипаразитарного агента, антибактериального агента или противогрибкового агента.
Композиция устройства для постоянного высвобождения, включающая в себя иммуностимулирующий олигонуклеотид, имеющий формулу Y1N1ZN2Y2, предлагается в соответствии с другим вариантом изобретения.
Изобретение также включает в себя пищевые добавки иммуностимулирующего олигонуклеотида, имеющего формулу Y1N1ZN2Y2, в устройстве для доставки, выбранное из группы, состоящей из капсулы, подъязычной таблетки и пилюли.
В другом варианте композиции, описанные выше, также включают в себя иммуностимулирующую нуклеиновую кислоту, имеющую неметилированный CG-динуклеотид, TG-нуклеотид или Ру-обогащенную последовательность, где иммуностимулирующая нуклеиновая кислота, имеющая неметилированный CG-динуклеотид, TG-динуклеотид или Ру-обогащенную последовательность, имеет последовательность, отличную от олигонуклеотида, включающего в себя 5’Y1N1ZN2Y23’.
В некоторых осуществлениях иммуностимулирующая нуклеиновая кислота, имеющая неметилированный CG-динуклеотид, TG-динуклеотид или Ру-обогащенную последовательность, имеет полностью фосфодиэфирный остов, и в других осуществлениях иммуностимулирующая нуклеиновая кислота, имеющая неметилированный CG-динуклеотид, TG-динуклеотид или Ру-обогащенную последовательность, имеет модифицированный остов, который необязательно может иметь межнуклеотидные связи, выбранные из группы, состоящей из фосфортиоата, фосфордитиоата и п-этокси.
В одном осуществлении иммуностимулирующая нуклеиновая кислота, имеющая неметилированный CG-динуклеотид, имеет формулу, включающую в себя 5’X1X2CGX3X43’, где X1, Х2, Х3 и Х4 представляют собой нуклеотиды. В других осуществлениях последовательность иммуностимулирующей нуклеиновой кислоты включает в себя по меньшей мере следующую формулу:
5’TCNTX1X2CGX3X43’, где N представляет собой последовательность нуклеиновой кислоты, состоящую приблизительно из 0-25 нуклеотидов, где по меньшей мере один нуклеотид имеет модифицированную межнуклеотидную связь и где нуклеиновая кислота имеет менее чем или ровно 100 нуклеотидов. В соответствии с некоторыми осуществлениями X1X2 представляют собой нуклеотиды, выбранные из группы, состоящей из GT, GG, GA и АА, а Х3Х4 представляют собой нуклеотиды, выбранные из группы, состоящей из ТТ, СТ или GT. В предпочтительном осуществлении X1X2 представляют собой GA, a Х3Х4 представляют собой ТТ.
В другом осуществлении последовательность иммуностимулирующей нуклеиновой кислоты, имеющая неметилированный CG-динуклеотид, включает в себя по меньшей мере одну из следующих последовательностей:
ATCGACTCTCGAGCGTTCTC (SEQ ID No. 15); TCCATGTCGGTCCTGCTGAT
(SEQ ID No. 32); TCCATGTCGGTZCTGATGCT (SEQ ID No. 31);
ATCGACTCTCGAGCGTTZTC (SEQ ID No. 18); TCCATGTCGGTCCTGATGCT
(SEQ ID No. 28); GGGGGG (SEQ ID No. 12); TCCATGACGGTCCTGATGCT
(SEQ ID No. 35); TCCATGGCGGTCCTGATGCT (SEQ ID No. 34);
TCCATGACGTTCCTGATGCT (SEQ ID No. 7); TCCATGTCGTTCCTGATGCT
(SEQ ID No. 38); GGGGTCAGTCTTGACGGGG (SEQ ID No. 41);
TCCATGTCGCTCCTGATGCT (SEQ ID No. 37); TCCATGTCGATCCTGATGCT
(SEQ ID No. 36); TCCATGCCGGTCCTGATGCT (SEQ ID No. 33);
TCCATAACGTTCCTGATGCT (SEQ ID No. 3); TCCATGACGTTCCTGATGCT
(SEQ ID No. 7); TCCATGACGTCCCTGATGCT (SEQ ID No 39);
TCCATCACGTGCCTGATGCT (SEQ ID No. 48); TCCATGACGTTCCTGACGTT
(SEQ ID No. 10); ATGACGTTCCTGACGTT (SEQ ID No. 70);
TCTCCCAGCGCGCGCCAT (SEQ ID No. 72); TCCATGTCGTTCCTGTCGTT
(SEQ ID No. 73); TCCATAGCGTTCCTAGCGTT (SEQ ID No. 74);
TCCTGACGTTCCTGACGTT (SEQ ID No. 76); TCCTGTCGTTCCTGTCGTT
(SEQ ID No. 77); TCCTGTCGTTCCTTGTCGTT (SEQ ID No. 52);
TCCTTGTCGTTCCTGTCGTT (SEQ ID No 121); TCCTGTCGTTTTTTGTCGTT
(SEQ ID No. 208); TCGTCGCTGTTGTCGTTTCTT (SEQ ID No. 120);
TCCATGCGTTGCGTTGCGTT (SEQ ID No. 81); TCCACGACGTTTTCGACGTT
(SEQ ID No. 82); TCGTCGTTGTCGTTGTCGTT (SEQ ID No. 47);
TCGTCGTTTTGTCGTTTTGTCGTT (SEQ ID No. 46);
TCGTCGTTGTCGTTTTGTCGTT (SEQ ID No. 49);
GCGTGCGTTGTCGTTGTCGTT (SEQ ID No. 56);
TGTCGTTTGTCGTTTGTCGTT (SEQ ID No. 48);
TGTCGTTGTCGTTGTCGTTGTCGTT (SEQ ID No. 84);
TGTCGTTGTCGTTGTCGTT (SEQ ID No. 50); TCGTCGTCGTCGTT (SEQ ID No.
51); и TGTCGTTGTCGTT (SEQ ID No. 85).
В другом осуществлении иммуностимулирующая нуклеиновая кислота, имеющая Ру-обогащенную или TG-последовательность, представляет собой нуклеиновую кислоту, описанную выше.
В другом осуществлении изобретение относится к фармацевтическим композициям и наборам, которые содержат как олигонуклеотид, имеющий формулу Y1N1ZN2Y2, так и CpG-олигонуклеотид (который необязательно может быть свободен от поли-Т и TG-мотивов и не быть Ру-обогащенным), Ру-обогащенный и/или TG-олигонуклеотид, физически отдельные от олигонуклеотида, имеющего формулу Y1N1ZN2Y2. Фармацевтические препараты находятся в эффективных количествах и обычно включают в себя фармацевтически приемлемые носители, и все это здесь подробно объясняется. Наборы включают в себя по меньшей мере один контейнер, содержащий олигонуклеотид, который имеет формулу Y1N1ZN2Y2. Тот же контейнер или в других осуществлениях второй контейнер может содержать олигонуклеотид с CpG-мотивом, который необязательно может быть свободен от Ру-обогащенного и/или TG-мотивов, и/или Ру-обогащенный или TG-олигонуклеотид (или некоторое их сочетание). Набор также содержит инструкции для введения олигонуклеотидов субъекту. Наборы также могут включать в себя контейнер, содержащий растворитель или разбавитель.
В целом, как здесь полностью цитируется, олигонуклеотид, имеющий формулу Y1N1ZN2Y2, который физически отделен от CpG, Ру-обогащенного или TG-олигонуклеотида, может быть применен совместно с CpG, Ру-обогащенным или TG-олигонуклеотидами в описанных здесь способах, композициях и продуктах.
В другом варианте изобретение относится к фармацевтической композиции, включающей в себя по меньшей мере два олигонуклеотида согласно изобретению, где по меньшей мере два олигонуклеотида имеют отличные друг от друга последовательности, и фармацевтически приемлемый носитель.
В соответствии с другим вариантом изобретения предлагается состав вакцины. Вакцина включает в себя любую из композиций в сочетании с антигеном.
В соответствии с другим вариантом изобретения предлагается способ стимуляции иммунного ответа. Способ включает в себя введение Ру-обогащенной или иммуностимулирующей TG-нуклеиновой кислоты субъекту, не являющемуся грызуном, в количестве, эффективном для индукции иммунного ответа у субъекта, не являющегося грызуном. Предпочтительно Ру-обогащенную или иммуностимулирующую TG-нуклеиновую кислоту вводят перорально, местно, в устройстве с постоянным высвобождением, на слизистую поверхность, системно, парентерально или внутримышечно. Когда Ру-обогащенную или иммуностимупирующую TG-нуклеиновую кислоту вводят на слизистую поверхность, она должна быть доставлена в количестве, эффективном для индукции иммунного ответа в слизистой или системного иммунного ответа. В предпочтительных осуществлениях слизистую поверхность выбирают из группы, состоящей из поверхности ротовой полости, носовой полости, ректальной, влагалищной поверхности и поверхности глазной полости.
В некоторых осуществлениях способ включает в себя введение субъекту антигена, когда иммунный ответ является антиген-специфическим иммунным ответом. Антиген может кодироваться вектором нуклеиновой кислоты, который может доставляться субъекту. В некоторых осуществлениях антиген выбирают из группы, состоящей из опухолевого антигена, вирусного антигена, бактериального антигена, паразитарного антигена и пептидного антигена.
Ру-обогащенные и иммуностимулирующие TG-нуклеиновые кислоты способны вызывать широкий спектр иммунного ответа. Например, данные иммуностимулирующие нуклеиновые кислоты могут быть применены для переключения иммунного ответа с Th2 на Th1. Ру-обогащенные и TG-нуклеиновые кислоты можно также применять для активации иммунной клетки, такой как лейкоцит, дендритная клетка и клетка NK. Активация может быть проведена in vivo, in vitro или ex vivo, т.е. путем выделения иммунной клетки у субъекта, контактирования иммунной клетки с эффективным количеством Ру-обогащенной или иммуностимулирующей TG-нуклеиновой кислоты для активации иммунной клетки и повторного введения активированной иммунной клетки субъекту. В некоторых осуществлениях дендритная клетка экспрессирует раковый антиген. Дендритная клетка может быть экспонирована с раковым антигеном ex vivo.
Иммунный ответ, вызываемый Ру-обогащенными или TG-нуклеиновыми кислотами, может также приводить к индукции продукции цитокинов, например продукции ИЛ-6, ИЛ-12, ИЛ-18, TNF, IFN-α и IFN-γ.
Еще в одном осуществлении Ру-обогащенные и TG-нуклеиновые кислоты полезны для лечения рака. Ру-обогащенные и TG-нуклеиновые кислоты в соответствии с другими вариантами изобретения полезны также в профилактике рака (например, снижении риска развития рака) у субъекта с риском развития рака. Рак может быть выбран из группы, состоящей из рака желчных путей, рака молочной железы, рака шейки матки, хориокарциномы, рака прямой кишки, рака эндометрия, рака желудка, внутриэпителиальных неоплазий, лейкозов, рака печени, рака легких (например, мелкоклеточного и немелко