Способ коррекции обезболивающей терапии
Иллюстрации
Показать всеИзобретение относится к медицине, к анестезиологии, интенсивной терапии и хирургии и может быть использовано для коррекции обезболивающей терапии в послеоперационном периоде. Используют модифицированную визуально-аналоговую шкалу боли, на которой пациент самостоятельно отмечает свои болевые ощущения, фиксируя их на вертикальных отрезках шкалы за каждые 2 часа в течение суток, после чего врач вычерчивает алгограмму суточных колебаний болевых ощущений пациента; проводит их анализ в плане оценки силы болевых ощущений и адекватности проводимой анальгетической терапии; и с учетом полученных данных проводит коррекцию программы обезболивания на следующий день. Данное изобретение позволяет адекватно оценить болевые ощущения пациента в послеоперационном периоде для последующего проведения адекватной предупредительной анальгетической терапии болевого синдрома, что, в свою очередь, способствует предупреждению патологического послеоперационного синдромокомплекса. 2 з.п. ф-лы, 3 ил.
Реферат
Изобретение относится к области медицины, а именно к анестезиологии, интенсивной терапии и хирургии, т.е. тогда, когда необходима оценка интенсивности болевой импульсации после оперативного вмешательства.
Актуальность данного способа заключается в том, что недостаточная оценка болевых ощущений пациентов может приводить к неадекватному послеоперационному обезболиванию. При этом известно, что от 33 до 75% пациентов жалуются на среднюю и сильную боль в послеоперационном периоде (Ferrante P.M., VadeBoncouer T.R. 1998). Зарубежные мультицентровые исследования определили состояния послеоперационного обезболивания катастрофическим, поскольку адекватность анальгезии, по субъективным оценкам пациентов, не превышала 50% (Owen H., McMillan V. and Rogowski D. Postoperative pain therapy: a survey of patients' expectations and their experiences. // Pain. - 1990. - V.41. - P.303-309).
За последние десятилетия отмечается неуклонный рост частоты выполнения сложных расширенных и симультанных операций, в частности, на органах брюшной полости. При этом большая часть больных, подвергшихся операции, имеют выраженные сопутствующие заболевания со стороны внутренних органов. Это требует особого анестезиолого-реанимационного подхода к ведению данной категории больных, в том числе в оценке адекватности купирования болевого компонента в послеоперационном периоде.
Известно, что болевые ощущения являются первопричиной развития патологического послеоперационного синдромокомплекса. Острая боль повышает ригидность мышц передней брюшной стенки и грудной клетки, что ведет к снижению дыхательного объема, жизненной емкости легких, функциональной остаточной емкости и альвеолярной вентиляции. Следствием этого является коллапс альвеол, гипоксемия и снижение оксигенации крови (Liu S, Carpenter R, Neal J. Epidural anesthesia and analgesia. Their role in postoperative outcome. // Anesthesiology. 1995. - V.82. - P.1474-1506). Затруднение откашливания на фоне болевого синдрома нарушает эвакуацию бронхиального секрета, что способствует развитию легочной инфекции.
Боль сопровождается гиперактивностью симпатической нервной системы, вызывая тахикардию, гипертензию и повышением периферического сосудистого сопротивления. Симпатическая активация также вызывает послеоперационную гиперкоагуляцию и повышает риск тромбообразования. На этом фоне у пациентов высока вероятность резкого увеличения потребности миокарда в кислороде с развитием острого инфаркта миокарда (Breivik H. Postoperative pain management. // Bailliere's Clinical Anaesthesiology. -1995. - V.9. - P.403-585).
Активация вегетативной нервной системы на фоне болевого синдрома снижает перистальтическую активность и может являться причиной послеоперационного пареза.
Интенсивная боль является одним из факторов реализации катаболического гормонального ответа на травму: задержки воды и натрия с увеличением секреции АДГ и альдостерона, а также гипергликемией за счет гиперсекреции кортизола и адреналина (Kehlet H., Dahl J.B. Postoperative pain. // World J.Surg. 1993. V.17. P.215-219), нарастает отрицательный азотистый за счет гиподинамии, отсутствия аппетита и нарушения нормального режима питания; ухудшение иммунного статуса и повышение частоты септических осложнений при неадекватном купировании послеоперационной боли, особенно у пациентов повышенного риска (Yeagcr M, Glass D, Neff R, Brick Johnsen f. Epidural anaesthesia and analgesia in high risk surgical patjents. // Anesthesiology. - 1988. - V.73. - P.729-736).
Результатом недостаточного купирования боли является также формирование хронических послеоперационных нейропатических болевых синдромов (Kalso E, Perttunen К, Kaasinen S. Pain after thoracic surgery. // Acta Anaesth. Scand. 1992. V.36. P.96-100).
По определению американской организации по изучению боли (IASP Pain Terminology) боль - это неприятное чувствительное или эмоциональное ощущение, возникающее в момент или при угрозе повреждения тканей, либо описываемое в терминах такого повреждения. Примечание: Боль всегда субъективна. Каждая личность воспринимает и применяет это слово через свой индивидуальный опыт, связанный с повреждениями, перенесенными ранее (Classification of Chronic Pain, Second Edition, IASP Task Force on Taxonomy, edited by H. Merskey and N. Bogduk, IASP Press, Seattle, © 1994, pp. 209-214).
Таким образом, сложность проблемы в оценки болевых ощущений состоит в том, что нет точных физиологических или клинических признаков для измерения боли. Идеальный инструмент для измерения боли должен оценивать как само ее наличие, так и динамику с течением времени (Но Kendall; Spence Julie; Murphy Michael F..Review of pain-measurement tools. Ann. Emergency Med. 1996. №4. С.427-432).
Боль является субъективным ощущением, зависящим от индивидуального порога ее восприятия. Боль представляет собой многомерный феномен, включающий ноцицепцию, ощущение, переживание боли и болевое поведение (Hunfeld J.A.M.; Passchier J. Боль и оценка степени боли у детей. Рус. мед. ж. 1997 №7. С.420-424).
Тяжесть боли может быть проанализирована субъективно самим больным, находящимся в сознании. Нет адекватных методов для оценки тяжести боли другими людьми у больных с потерей сознания (Memran N.; Steib A.; Esteve M.; Servin F.; Vulser C.; Lassalle C.; Pipien I.; Cousin M.T. Prise en charge de la douleur postoperatoire chez le sujet age. Sem. hop. Paris. 1998. P.700-708. Vol.15-16). Ноцицептивная импульсация, независимо от своей мощности, становиться болью тогда и только тогда, когда ЦНС при поступлении этой информации распознает ее как "образ боли" (Петров О.В. с соавт. Информационная теория боли. 2-й Съезд биофизиков России, M., 23-27 авг., 1999. M., 1999. Т. 2, стр. 436). Более тонкие механизмы оценки и контроля боли могут коррелировать с субъективной оценкой боли. (Данилов А.Б.; Данилов Ал.Б.; Вейн А.М. Ноцицептивный флексорный рефлекс: метод изучения мозговых механизмов контроля боли. Ж. неврол. и психиатрии. 1996. №1. С.107-111).
Следовательно, разработка и исследование методов измерения боли, ее силы, временной протяженности субъективными визуально-аналоговыми методами является актуальной проблемой для современной анестезиологии, интенсивной терапии, хирургии и других сопряженных специальностей, участвующих в лечении и ведении послеоперационных больных.
Одним из аналогов предлагаемого изобретения является способ, описанный в источнике Федоров В.В. с соавт: Оценка дискомфорта и болей после лапароскопической операции. Матер. VI Междунар. конф. хирург.-гепатол. стран СНГ "Актуальн. пробл. хирургич. гепатол.", Киев, 4-6 нояб., 1998. Анналы хирург, гепатол. 1998. №3. С.111, в котором больным, перенесшим, в частности, лапароскопические операции, предлагалось с помощью анкеты оценить свое состояние после операции по 5-балльной системе в фиксированные часы после операции.
Использование данного метода позволяет больным субъективно оценить свои болевые ощущения после операции.
Однако вышеуказанный способ только фиксирует болевые ощущения пациентов после операции, но не предусматривает соответствующую коррекцию обезболивающей терапии.
Известен, также, другой метод, в котором эффективность лечения и интенсивность болевого синдрома определяли по шкале вербальных оценок: 0 - боли нет, 1 - слабая боль, 2 - умеренная, 3 - сильная, 4 - очень сильная (Новиков Г.А. и др. Хроническая боль и оценка качества жизни онкологических больных. Рос. мед. журнал. 1997. №2, стр.32-36).
Использование данного метода ограничено лишь вербальной оценкой болевых ощущений пациента, перенесших операцию по поводу онкологического заболевания.
Наиболее близким к заявленному способу является аналог, взятый нами за прототип, описанный в источнике Майкл Ферранте. Послеоперационная боль. Пер. с анг. М.: Медицина, 1998, стр. 119. В этом источнике используют визуально-аналоговую шкалу боли, которая представляет из себя прямую линию длинной 10 см, концы которой соответствуют крайним степеням интенсивности боли ("нет боли" - на одном конце, "нестерпимая боль" - на другом), (см. фиг.1).
Данный прототип не позволял оценивать боль в длительном временном промежутке и является критерием оценки только на текущий момент; не позволяет, также, строить графическое изображение динамики изменения болевой импульсации за сутки, что, в свою очередь, затрудняет оценку динамики боли, и строить программу адекватного послеоперационного обезболивания, которая позволяет предупреждать, а не лечить возникшие болевые ощущения.
Целью настоящего изобретения является адекватная оценка болевых ощущений визуально-аналоговым методом у больных после оперативного вмешательства.
Технический результат, на который направленно настоящее изобретение, заключается в адекватной оценке болевых ощущений пациента визуально-ананлоговым методом в послеоперационом периоде для проведения достаточной предупредительной терапии болевого синдрома.
Для достижения заявленного технического результата нами была разработана модифицированная визуально-аналоговая шкала (МВАШ) (см. фиг.2), на которой пациент отмечает свои болевые ощущения на данный момент времени, через каждые два часа, которые он фиксирует на вертикальных отрезках заранее заготовленных бланков МВАШБ. При этом эти отметки больной отмечает на вертикальных отрезках бланка МВАШБ в виде точки, соответствующей, на его взгляд, интенсивности боли, учитывая, при этом, что начало отрезка, т.е. нижняя его часть - обозначает отсутствие боли (или абсолютный “0” в болевых ощущениях), а конец отрезка, т.е. верхняя его часть - максимальная боль (или нестерпимая боль). В ночной период больной отмечает свои ощущения только в период бодрствования. Данный анализ боли проводят в течение семи суток после операции.
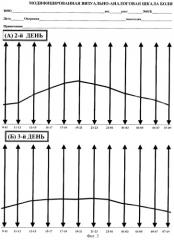
На основании указанных отметок врач вычерчивают алгограмму, т.е. кривую интенсивности боли (КИБ), которая представляет собой графическое отображение болевых ощущений пациента за истекшие сутки и показывает адекватность или неадекватность проводимой анальгетической терапии в этот период.
На основании алгограммы проводят коррекцию анальгетической терапии. Которая заключается или в замене одного анальгетика на другой, или в комбинации анальгетиков, или в увеличении дозы вводимого препарата, или в увеличении кратности вводимого препарата, или в проведении дополнительного обезболивания иными методами, например регионарными методами обезболивания.
Реализация предложенного способа иллюстрируется следующими клиническими примерами.
Пример 1. Больной К., 63 лет, вес 75 кг, поступил в ГУ ГНЦ колопроктологии с диагнозом: “Рак нижнеампулярного отдела прямой кишки с переходом на анальный канал Т3NхМо”, которому была выполнена брюшно-промежностная экстирпация прямой кишки с формированием гладкомышечной манжетки, тазового толстокишечного резервуара с низведением их в полость малого таза, расширенная аортоподвздошно-тазовая и латеральная лимфаденэктомия.
После окончания операции больной в плановом порядке поступил в палату интенсивной терапии (ПИТ), где ему была проведена обезболивающая терапия в виде промедола 1% - 2,0 в/м по показаниям.
На следующий (2-й) день после операции пациенту предложили отмечать свои болевые ощущения на шкале МВАШБ согласно существа заявленного способа. Анальгетическая терапия была назначена пациенту также в виде в/м инъекций промедола 1% - 2,0 по схеме: 12-18-24-6 часов.
На основании полученных данных за истекший 2-й день лечащим врачом была вычерчена алгограмма или КИБ, из которой следовало, что больной испытывал максимальные болевые ощущения в период с 13 ч до 24 ч, следовательно, проводимая обезболивающая терапия была неадекватной в данный период (см. фиг.За). В этот период палатным врачом дополнительно назначался Кеторолак в дозе 2,0 мл в/м в 18 ч и 20 ч. На основании анализа алгограммы, полученной за второй день, следует, что болевые ощущения в этот период времени потребовали усиление схемы анальгетической терапии введением Кеторолака, что было учтено при составлении программы обезболивания для 3-го дня послеоперационного периода.
На 3-й день после операции пациенту также предложили отмечать свои болевые ощущения на шкале МВАШБ согласно существа заявленного способа, после чего также была вычерчена КИБ (см. фиг.3б). Анальгетическая терапия была назначена пациенту с учетом изменений на КИБ за 2-й день в виде в/м инъекций промедола 1% - 2,0 по схеме: 12-18-24-6 часов, при этом в 13-00 и 21-00 была назначена дополнительная инъекция Кеторолака 2,0 мл в/м. На основании анализа КИБ за истекший 3-й день видно, что наиболее алгогенный период имел менее выраженную интенсивность, что дало повод сохранить данную схему для обезболивания на 4-й день, который пациент перенес гладко - без выраженных болевых ощущений. Данный факт дал возможность провести предварительную коррекцию схемы обезболивания для 5-го дня.
На 5-й день после операции пациенту также предложили отмечать свои болевые ощущения на шкале МВАШБ согласно существа заявленного способа, после чего также была вычерчена КИБ (см. фиг.3в). Анальгетическая терапия была назначена пациенту с учетом изменений на КИБ за 3-й день и характера субъективных ощущений 4-го дня. И была представлена в виде в/м инъекций промедола 1% - 2,0 по схеме в 18-00 и 24-00, при этом в 12-00 и 6-00 инъекция промедола была заменена инъекцией Кеторолака 2,0 мл в/м. На основании алгограммы за 5-й день отмечается увеличение болевых ощущений в период с 15-00 до 17-00, в связи с чем палатным врачом в этот период была введена дополнительная инъекция баралгина 5,0 мл в/м, которая адекватно купировала усиление болевого компонента. На шестой день схему пятого послеоперационного дня решено было сохранить, что обеспечило адекватную анальгетическую поддержку пациенту.
На 7-й день после операции пациенту также предложили отмечать свои болевые ощущения на шкале МВАШБ согласно существа заявленного способа и вычертили КИБ (см. фиг.3г). Анальгетическая терапия была назначена пациенту с учетом изменеий на КИБ за предыдущие дни и была представлена в виде в/м инъекций только Кеторолака 2,0 мл в/м по схеме в 10-00, 17-00, 24-00. Оценка КИБ на седьмой день показала, что болевой синдром практически не вызывает неприятных субъективных ощущений у пациента, в связи с чем проводимую терапию предложено продолжить в той же дозе и той же кратности до полного купирования болевого синдрома.
Таким образом, заявленный способ позволяет адекватно оценить боль у больных в послеоперационном периоде и скорректировать анальгетическую терапию так, чтобы больной не испытывал выраженного дискомфорта, связанных с болевыми ощущениями. При этом коррекция проводимой анальгетической терапии позволяет избежать увеличения наркогенного потенциала послеоперационного периода, т.е. снизить дозу, кратность применения наркотических анальгетиков, расшить показания к применению ненаркотических анальгетиков; расширить показания к применению регионарных методов обезболивания и иных официальных методов, направленных на купирование болевого синдрома в послеоперационном периоде. Данный метод позволяет, также, снизить число послеоперационных осложнений, связанных с проблемой неадекватного обезболивания в послеоперационном периоде.
Заявленный способ может быть рекомендован для адекватной оценки болевого синдрома в клинической практике.
1. Способ коррекции обезболивающей терапии у больных в первые дни после оперативного вмешательства, включающий оценку болевых ощущений с помощью визуально-аналоговой шкалы боли, отличающийся тем, что используют модифицированную визуально-аналоговую шкалу боли, состоящую из горизонтально расположенного отрезка прямой линии, к которому восстановлены вертикальные отрезки прямой линии через равные промежутки, соответствующие 2 ч; пациент самостоятельно отмечает свои болевые ощущения, фиксируя их на вертикальных отрезках шкалы за каждые 2 ч в течение суток, после чего врач вычерчивает алгограмму суточных колебаний болевых ощущений пациента; проводит их анализ в плане оценки силы болевых ощущений и адекватности проводимой анальгетической терапии и с учетом полученных данных проводит коррекцию программы обезболивания на следующий день.
2. Способ по п.1, отличающийся тем, что в ночное время пациент фиксирует свои болевые ощущения только в период бодрствования.
3. Способ по п.1, отличающийся тем, что алгограмму вычерчивают за семь ближайших суток после операции.