Гамма-гидроксипропиламиний-5-гидроксиникотинат, обладающий противоишемической, антиаритмической и гиполипидемической активностью
Иллюстрации
Показать всеИзобретение относится к области синтеза новых биологически активных веществ, а именно к γ-гидроксипропиламиний-5-гидроксиникотинату формулы
обладающему противоишемической, антиаритмической и гиполипидемической активностью. Указанное соединение характеризуется низкой токсичностью и отсутствием кардидепрессивного действия. Соединение формулы (I) получают взаимодействием 5-гидроксиникотиновой кислоты с 3-амино-1-пропанолом в присутствии растворителя при нагревании. 7 табл.
Реферат
Изобретение относится к области медицины, конкретно к новому химическому соединению - производному 5-гидрокси-никотиновой кислоты, обладающему противоишемической, антиаритмической и гиполипидемической активностью.
Указанные свойства позволяют предполагать возможность применения соединения для профилактики и лечения ишемической болезни сердца.
Известное противоишемическое и антиаритмическое средство из группы β-адреноблокаторов анаприлин (М.Д.Машковский. Лекарственные средства, М., “Медицина”, 1993, ч.1, стр. 330) обладает кардиодепрессивным действием, не проявляет гиполипидемических свойств и имеет сравнительно высокую токсичность.
Цель изобретения - новое соединение, обладающее сочетаными противоишемическими, антиаритмическими и гиполипидемическими свойствами, низкой токсичностью и отсутствием кардиодепрессивного действия.
Поставленная цель достигается новым соединением, а именно γ-гидроксипропиламиний-5-гидроксиникотинатом формулы I:
получаемым известным способом: взаимодействием 5-гидроксиникотиновой кислоты с 3-амино-1-пропанолом в присутствии растворителя при нагревании.
Пример 1. γ-Гидроксипропиламиний-5-гидроксиникотинат (I).
К раствору 9,0 г (0,12 моля) 3-амино-1-пропанола в 180 мл спирта добавляют при перемешивании 16,68 г (0,12 моля) 5-гидроксиникотиновой кислоты. Реакционную смесь нагревают при 75-80°С в течение 5-7 минут с обратным холодильником, фильтруют, фильтрат охлаждают до 5-7°С. Образовавшийся осадок отделяют, промывают 25 мл охлажденного спирта, сушат, получают 21,85 г соединения I (выход 85,1%) - белый кристаллический продукт, т. пл. 137-137,5°С.
Найдено, %: С 50,51; Н 6,67; N 13,09: C9H14N2O4.
Вычислено. %: С 50,47; Н 6,54; N 13,08.
ИК-спектр, см-1: 3180, 3025, 1600, 1570. 1300, 1150, 1050.
Пример 2. Определение острой токсичности соединения I.
Острая токсичность соединения I изучена в опытах на белых мышах массой 18-20 г с определением ЛД50 по методу Литчфилда и Уилкоксона при внутрибрюшинном введении. Наблюдение за животными проводили в течение 48 часов после введения вещества. Результаты исследования показали, что ЛД50 соединения I для мышей при внутрибрюшинном введении составляет свыше 5000 мг/кг.
Пример 3. Исследование кардиотропного действия соединения I.
3.1. Противоишемическая активность соединения I.
3.1.1. Влияние соединения I на порог ишемии миокарда у бодрствующих кроликов.
Эксперименты поставлены на кроликах породы Шиншилла массой 5-5,5 кг с предварительно имплантированным на коронарную артерию окклюдером (Ю.Б.Розонов, Т.В.Морозова. Бюллетень экспериментальной биологии и медицины, 1984, №10, стр. 460-462). Испытуемое соединение I и препарат сравнения анаприлин вводились внутривенно сразу после установления стабильного порога ишемии миокарда.
Соединение I в диапазоне доз от 0,2 до 5,0 мг/кг повьшало порог ишемии миокарда у бодрствующих кроликов с длительностью эффекта 30-40 мин (табл. 1). По выраженности профилактического противоишемического эффекта соединение I не уступало препарату сравнения анаприлину, взятому в эффективной дозе (1 мг/кг).
3.1.2. Влияние соединения I на размеры зоны ишемии и некроза при острой ишемии миокарда.
Эксперименты поставлены на нелинейных крысах-самцах массой 250-500 г, наркотизированных этаминалом натрия (40 мг/кг внутрибрюшинно). У животных, переведенных на управляемое дыхание, моделировали инфаркт миокарда перевязкой нисходящей ветви левой коронарной артерии на уровне нижнего края ушка предсердия. Размеры зоны некроза и зоны ишемии определяли через 4 часа после окклюзии коронарной артерии дифференциальным индикаторным методом, принцип которого основан на раздельном количественном определении синьки Эванса (индикатор зоны ишемии) и красного формазана (индикатор зоны некроза).
Как следует из данных, представленных в табл. 2, соединение I в диапазоне доз от 5,0 до 100,0 мг/кг уменьшает размеры зоны некроза через 4 часа после окклюзии коронарной артерии у крыс. Наиболее эффективной оказалась доза 100,0 мг/кг, в которой изучаемое соединение не отличалось по действию от препарата сравнения анаприлина, взятого в дозе 1,0 мг/кг.
3.1.3. Влияние соединения I на кардиогемодинамику интактных крыс и крыс с острой ишемией миокарда.
Эксперименты выполнены на нелинейных крысах-самцах массой 250-500 г, наркотизированных этаминалом натрия (40 мг/кг внутривенно). Подопытных животных переводили на управляемое дыхание, вскрывали грудную клетку, перикард и пунктировали левый желудочек в области верхушки сердца. Внутрижелудочковое давление и системное артериальное давление в сонной артерии регистрировали с помощью датчиков “Бентли”. При помощи дифференцирующего устройства регистрировали скорость сокращения (dp/dt)max и скорость расслабления (dp/dt)min левого желудочка сердца. Частоту сердечных сокращений рассчитывали по интервалам R-R на ЭКГ, которую регистрировали во II стандартном отведении. Указанные показатели устанавливали у интактных крыс и у животных с экспериментальным инфарктом миокарда. Инфаркт миокарда вызывали путем перевязки левой коронарной артерии на уровне ее средней трети.
На первом этапе исследований было изучено влияние соединения I на кардиогемодинамику интактных крыс при внутривенном введении в дозе 5 мг/кг. Как видно из данных, представленных в табл. 3, соединение I вызывало повышение сократимости миокарда, которая в течение всего периода наблюдений была выше, чем в контроле. Исследуемое соединение повышало и уровень среднего артериального давления (САД), которое превышало показатели, установленные в контроле. Частота сердечных сокращений (ЧСС) при этом существенно не менялась.
В условиях острой ишемии миокарда (табл. 4) внутривенное введение соединения I позитивно влияло на показатели кардиогемодинамики. Кардиопротекторное действие вещества сохранялось на протяжении 30 мин от начала эксперимента. В условиях острой ишемии миокарда введение соединения I не вызывало значимых изменений ЧСС.
3.1.4. Влияние соединения I на течение острой ишемии миокарда у собак.
Эксперименты поставлены на беспородных собаках обоего пола массой 14-18 кг. Наркотизированных этаминалом натрия (40 мг/кг внутрибрюшинно) собак интубировали, переводили на управляемое дыхание при помощи объемного респиратора “Вита”, послойно вскрывали грудную клетку, удаляя при этом третье и четвертое ребра слева, перикард, рассеченные края которого подшивали к краям операционной раны. Под отсепарированную на небольшом участке артерию первого порядка из системы межжелудочковой ветви левой коронарной артерии подводили две лигатуры. После инъекции гепарина (500 ед./кг) на 2-4 мм ниже предполагаемого уровня перевязки коронарной артерии вводили в вену полиэтиленовый катетер, который фиксировали лигатурой, подведенной атравматической иглой. Затем осуществляли отбор венозной крови для определения биохимических показателей (исходный уровень). После перевязки коронарной артерии катетировали дистальный ее участок для определения уровня коллатерального коронарного кровотока и ретроградного давления.
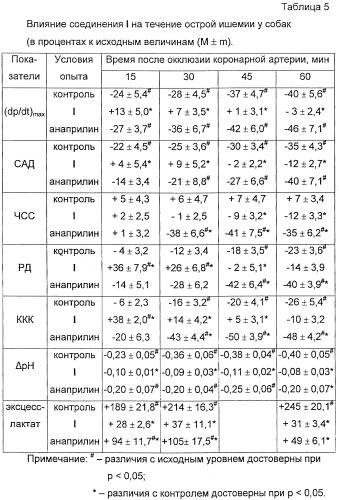
Из данных, представленных в табл. 5, следует, что в контрольной серии экспериментов в течение 60 мин после окклюзии коронарной артерии (ОКА) наблюдаются прогрессирующие негативные сдвиги показателей кардиогемодинамики, ухудшение кровоснабжения ишемизированного миокарда, формирование регионального метаболического ацидоза и рост степени эксцесс-лактата.
Внутривенное введение соединения I в дозе 100 мг/кг через 5 мин после ОКА способствовало повышению сократимости сердечной мышцы, стабилизации уровня САД, улучшению кровоснабжения ишемизированного участка миокарда. Препарат сравнения анаприлин, вводимый внутривенно в дозе 1 мг/кг через 5 мин после ОКА, также снижал уровень закисления крови, оттекающей из зоны ишемии, и уменьшал уровень эксцесс-лактата. Однако эти позитивные биохимические изменения в отличие от эффекта соединения I наблюдались на фоне выраженной брадикардии, снижения сократимости ишемизированного миокарда, гипотензии и ухудшения кровоснабжения ишемизированного участка миокарда.
3.2. Антиаритмическая активность соединения I.
Опыты выполнены на 56 половозрелых обоеполых крысах линии Вистар массой 160-240 г, наркотизированных внутриброшинной инъекцией тиопентал-натрия в дозе 50 мг/кг.
Соединение I вводили внутривенно, струйно, одномоментно в дозах 5 и 20 мг/кг за 5 мин до окклюзии коронарной артерии. Препараты сравнения лидокаин (2,5 и 5 мг/кг) и анаприлин (0,5 и 1 мг/кг) вводили внутривенно непосредственно перед ОКА.
Результаты исследования противоаритмической активности соединения I на модели острой окклюзионной аритмии представлены в табл. 6.
В контрольной серии эксперимента у всех подопытных животных через 249±33 сек после ОКА возникала политопная желудочковая экстрасистолия и эпизоды желудочковой тахикардии, длительность которых составила 60±17 сек. Инъекция соединения 1 в дозе 5 мг/кг за 5 мин до острой коронароокклюзии не оказала профилактического противоаритмического действия на данной модели. При повышении дозы соединения I до 20 мг/кг число экстрасистол сократилось (р<0,05), а длительность желудочковой тахикардии составила 7,3±3,6 сек (р<0,05). Положительное действие соединения 1 в дозе 20 мг/кг выражалось и в том, что под его влиянием латентный период окклюзионных аритмий увеличился до 382±25 сек против 249±33 сек в контрольной серии опытов. Особо следует отметить, что фибрилляция желудочков на фоне действия препарата не возникала ни в одном опыте.
Лидокаин статистически достоверно уменьшал частоту возникновения желудочковой тахикардии и укорачивал продолжительность приступов до 7±0,3 сек (р<0,05), тогда как на другие параметры влияния не оказывал. Противоаритмическая активность лидокаина в дозе 5 мг/кг была выше, чем у исследуемого соединения, однако он оказывал угнетающее действие на атриовентрикулярную проводимость. Анаприлин более чем в 5 раз уменьшал число желудочковых экстрасистол, возникающих за 10 мин коронароокклюзии, и укорачивал продолжительность приступов тахикардии до 18±12 сек против 60± 17 сек в контрольной серии опытов, однако так же, как и лидокаин, угнетал проводимость атриовентрикулярного узла.
Таким образом, на модели острых окклюзионных аритмий у крыс соединение I в дозе 20 мг/кг оказывает выраженное профилактическое противоаритмическое и противофибрилляторное действие, не уступая активности анаприлина и лидокаина. Важно подчеркнуть, что в отличие от препаратов сравнения соединение I не оказывает угнетающего воздействия на функцию проводимости сердечной мышцы.
3.3. Гиполипидемическая активность соединения I.
Эксперимент выполнен на беспородных крысах-самцах массой 220-250 г. Гиперлипидемию индуцировали ежедневным пероральным введением животным масляной суспензии, содержавшей 10% холестерина и 1% холевой кислоты, в течение 10 дней; объем вводимой суспензии составлял 1 мл/100 г массы тела. Соединение I вводили в те же сроки в дозе 1 мг/кг. Выраженность гиполипидемической активности оценивали по степени торможения индуцированной гиперлипидемии, определяя в сыворотке крови содержание общего холестерина (ХС-общего), холестерина в составе атерогенных фракций липопротеидов - липопротеидов низкой и очень низкой плотности (ХС-ЛПНП) и (ХС-ЛПОНП), холестерина липопротеидов высокой плотности (ХС-ЛПВП) и триглицеридов.
Как видно из результатов, приведенных в табл. 7, воздействие атерогенного рациона сопровождается повышением уровня ХС-общего за счет атерогенной фракции ЛПОНП. Накопление холестерина наблюдается на фоне устойчивой гипертриглицеридемии.
При введении соединения I уровень триглицеридов снизился на 33%, содержание холестерина в составе антиатерогенной фракции ЛПВП повысилось на 28%, а гипохолестеринемический эффект реализовался за счет снижения ХС-ЛПОНП. Приведенные данные свидетельствуют о выраженности липидрегулирующей активности соединения I, при этом следует отметить важную для кардиопротекторного средства способность соединения повышать уровень ЛПВП, обеспечивающих обратный транспорт холестерина.
Таким образом, заявляемое соединение γ-гидроксипропиламиний-5-гидроксиникотинат обладает сочетанными противоишемическими, антиаритмическими и гиполипидемическими свойствами. Существенным преимуществом заявляемого соединения перед β-адреноблокаторами является его способность снижать уровень триглицеридов в крови, тогда как используемый при терапии ИБС анаприлин способствует накоплению триглицеридов и снижению содержания ЛПВП, повышая тем самым риск коронарного атеросклероза.
При сохранении спектра и выраженности кардиопротекторного действия соединение I значительно менее токсично (ЛД50 свыше 5000 мг/кг) по сравнению с анаприлином и не имеет кардиодепрессивных свойств, что существенно расширяет область возможного применения его в медицине для профилактики и лечения ишемической болезни сердца.
| Таблица 1.Влияние соединения I на порог ишемии миокарда у бодрствующих кроликов. | |||||
| Препарат | Доза. мг/кг | Общее Кол-во опытов | Наличие эффекта | Отсутствие эффекта | Длительность эффекта, мин |
| КонтрольI | - | 6 | 0 | 6 | - |
| 0,2 | 6 | 6 | 0 | 20-30 | |
| 1,0 | 6 | 6 | 0 | 30-40 | |
| 5,0 | 6 | 6 | 0 | 30-40 | |
| Анаприлин | 1,0 | 6 | 6 | 0 | 30-40 |
| Таблица 2.Влияние соединения I на размеры зоны некроза через 4 часа после окклюзии коронарной артерии у крыс (М±m) | |||||
| Препарат | Доза, мг/кг | Кол-воживотных | Зона ишемии (в % к общей массе миокарда) | Зона некроза (в % к общеймассе миокарда) | Зона некроза (в % к зоне ишемии) |
| КонтрольI | - | 17 | 34±2,6 | 22±2,0 | 68±4,3 |
| 5,0 | 8 | 35±3,1 | 16±1,5 | 46±4,8* | |
| 20,0 | 7 | 25±3,2 | 10±2,2 | 40±2,8* | |
| 100,0 | 8 | 30±1,3 | 10±2,6* | 33±2,6* | |
| Анаприлин | 1,0 | 8 | 30±3,5 | 11±1,6* | 39±5,5* |
| Примечание: * - различия с контролем достоверны при р<0,05. |
| Таблица 3Влияние соединения I в дозе 5 мг/кг на кардиогемодинамику интактных крыс в условиях открытой грудной клетки (в процентах к исходным величинам (М±m) (n=10) | ||||||
| Время от начала опыта, мин | Регистрируемые параметры | |||||
| (dp/dt)max | САД | ЧСС | ||||
| контроль | опыт | контроль | опыт | контроль | опыт | |
| 5 | -7±2,5 | +1±2,9 | -6±3,4 | +5 ±6,3 | +1±2,7 | +1±1,9 |
| 10 | -14±5,7 | +1±2,7* | -13±4,2 | +6±7,4 | +2±2,4 | +3±1,5 |
| 15 | -17±4,9# | +1±2,1* | -18±7,4 | +5±5,4 | -1±3,5 | +3±1,4 |
| 20 | -16±2,9# | -1±1,7 | +4±5,8# | +4±8,5* | -1±3,5 | +4±1,5 |
| 30 | -17±3,3# | -2±1,6* | -17±4,7 | -3±9,0 | -2±2,8 | +2±1,7 |
| 40 | -14±2,7# | -1±1,9* | -20±1,6# | - 4±8,2* | -7±1,6 | +5±2,6 |
| 50 | -16±2,8# | -1±1,4* | -26±1,3# | -8±6,1 | -7±1,7 | +5±1,9 |
| 60 | -17±3,1# | -6±2,8* | -29±1,4# | -9±6,2* | -9±2,3 | +4±2,3 |
| Примечание: #- различия с исходным уровнем достоверны при р<0,05;* - различия с контролем достоверны при р<0,05. |
| Таблица 4Влияние соединения I в дозе 5 мг/кг на кардиогемодинамику крыс с острой ишемией миокарда (в процентах к исходным величинам (М±m) (n=10) | ||||||
| Время после ОКА, мин | Регистрируемые параметры | |||||
| (dp/dt)max | САД | ЧСС | ||||
| контроль | опыт | контроль | опыт | контроль | опыт | |
| 5 | -12±4,0 | -3±4,4 | -15±4,4# | -4±3,3 | -9±3,4 | -1±2,4 |
| 10 | -17±4,0# | -1±3,8* | -17±4,9# | -5±4,5* | -7±2,7 | -1±3,9 |
| 15 | -15±3,9# | +4±4,7* | -18±5.5# | -5±5,5* | -8±3,3 | +2±2,9 |
| 20 | -14±4,3# | +1±8,5* | -22±5,8# | -8±5,6* | -7±4,0 | +2±2,9 |
| 30 | -15±4,5# | -2±8,5* | -22±5,8# | -9±6,3 | -6±3,7 | +4±3,5 |
| 40 | -17±4,0# | -7±7,0 | -23±6,5# | -12±4,7 | -8±4,3 | +3±2,9 |
| 50 | -18±4,7# | -8±6,0 | -24±6,2# | -12±5,7 | -9±4,9 | +1±2,2 |
| 60 | -19±4,9# | -10±6,5 | -20±7,0# | -13±5,4 | -8±4,5 | +2±4,7 |
| Примечание: #- различия с исходным уровнем достоверны при р<0,05;* - различия с контролем достоверны при р<0,05. |
| Таблица 6Противоаритмическая активность соединения I при ранних постокклюзионных аритмиях у крыс (М±m). | ||||||||
| Условия опыта | Доза, мг/кг | Кол-во животных | Латентный период, сек | Длительность ЖТ, сек | Кол-во ЖЭ | |||
| всего | у которых возникла | |||||||
| ЖЭ | ЖТ | ФЖ | ||||||
| Контроль1 | -5,0 | 127 | 127 | 127 | 52 | 249±33230±53 | 60±1448±19 | 82±1481±23 |
| 20,0 | 7 | 7 | 6 | 0* | 382±25* | 7,3±3,6* | 41±7* | |
| Лидокаин | 2,5 | 8 | 7 | 3* | 2 | 313±44 | 1,0±0,3* | 55±19 |
| Лидoкaинa | 5,0 | 5 | 3 | 1* | 0* | 396±90 | 2,0 | 21±15 |
| Лидокаина | 0,5 | 10 | 8 | 5* | 0* | 333±59 | 18±12 | 15±7 |
| Примечание: ЖЭ - желудочковая экстрасистолия;ЖТ - желудочковая тахикардия;ФЖ - фибрилляция желудочков;* - различия с контролем достоверны при р<0,05; а - препарат вызывает нарушения атриовентрикулярной проводимости. |
| Таблица 7Влияние соединения I на содержание холестерина и триглицеридов в сыворотке крови крыс с экспериментальной гиперлипидемией (М±m) (n=8). | ||||||
| Условия опыта | Доза, мг/кг/сут | Содержание холестерина, мг/100 мл | Содержание триглицеридов, мг/100 мл | |||
| ХС-общий | ХС-ЛПВП | ХС-ЛПНП | ХС-ЛПОНП | |||
| Контроль (интактные животные) | - | 77,9±5,5 | 42,1±2,6 | 17,7±1,6 | 18,1±2,3 | 90,5±11,4 |
| Атерогенная диета | - | 101,4±5,5* (Р<0,02) | 45,0±3,8 | 23,4±2,7 | 33,0± 3,2* (р<0,01) | 165,0±16,0* (Р<0,01) |
| Атерогенная диета +I | 1,0 | 107,5±3,2 | 57,7±2,6** (Р<0,02) | 27,5±1,2 | 22,3±2,6** (Р<0,05) | 111,4±12,8** (Р<0,05) |
| Примечание: * - достоверность различий с данными контрольной группы;**-достоверность различий с данными группы животных с экспериментальной гиперлипидемией. |
γ-Гидроксипропиламиний-5-гидроксиникотинат формулы
,
обладающий противоишемической, антиаритмической и гиполипидемической активностью.