Антиген neisseria, кодирующая его нуклеиновая кислота, их использование
Иллюстрации
Показать всеИзобретение относится к биотехнологии и может быть использовано при производстве лечебно-профилактических препаратов, активных в отношении Neisseria meningitidis. В изобретении представлена группа белков нейссерий, проявляющих свойства антигена. Белок со свойствами антигена включает фрагмент белка ORF 40 (аминокислотная последовательность (АП) ORF 40 приведена в формуле), который включает 7 или более расположенных подряд консервативных аминокислот. Белки, входящие в заявленную группу белков, используют в качестве лекарственного средства или для его производства для лечения и профилактики инфекции, вызванной нейссерией, а также для производства диагностического препарата. Изобретение охватывает и нуклеиновую кислоту (Н.К.), кодирующую белок Neisseria. Н.К. используется аналогично белку. Использование изобретения обеспечивает максимальную распознаваемость и реактивность между штаммами нейссерий. 5 н. и 22 з.п. ф-лы, 20 ил., 7 табл.
Реферат
Содержание всех цитируемых в данном тексте документов в полном объеме включено здесь для сведения в виде библиографических ссылок.
Область техники, к которой относится изобретение
Настоящее изобретение касается консервативных антигенов бактерий рода Neisseria.
Предпосылки
Бактерии Neisseria meningitidis (менингококк) и Neisseria gonorrhoeae (гонококк) являются неподвижными грам-отрицательными диплококками, патогенными для человека.
Исходя из параметров полисахаридов, составляющих оболочку менингококка, было идентифицировано 12 серогрупп N. meningitidis. Группа А включает патоген, который в основном связан с эпидемическими формами заболевания в присахарских областях Африки. Серогруппы В и С связаны с подавляющим большинством случаев менингита в США и большинстве развитых стран. Серогруппы W135 и Y связаны с остальными случаями в США и развитых странах.
В настоящее время в качестве менингококковой вакцины применяется тетравалентная полисахаридная вакцина, содержащая серогруппы А, С, Y и W135. Однако данный подход не может быть применен в отношении менингококка - В из-за того, что оболочечный полисахарид men B является полимером α(2-8)-сшитой N-ацетилнейраминовой кислоты, которая также присутствует в тканях млекопитающих. В одном из подходов к созданию вакцин к men B используют смеси белков внешней мембраны (ОМР). Для преодоления антигенной изменчивости были созданы поливалентные вакцины, содержащие вплоть до девяти разных белков [например, Poolman, 1992, "Development of a meningococcal vaccine". Infect. Agents Dis., 4, 13-28]. Дополнительными белками, предназначенными для использования в вакцинах с белками внешней мембраны, являлись белки ора и орс, однако ни один из указанных подходов не смог преодолеть антигенную изменчивость [например, Ala’Aldeen & Borriello, 1996, "The meningococcal transferrin-binding proteins 1 and 2 are both surface exposed and generate bactericidal antibodies capable of killing homologous and heterologous strains", Vaccine, 14 (1), 49-53].
Большое число белковых и нуклеотидных последовательностей нейссерий описано в международных патентных заявках WO 99/24578, WO 99/36544, WO 99/57280 и WO 00/22430. Содержание указанных четырех заявок включено здесь для сведения в виде библиографической ссылки. Соответствующие данные по последовательностям штамма МС 58 опубликованы у Tettelin et al., 2000, Science, 287, 1809-1815: содержание чего также включено здесь для сведения в виде библиографической ссылки.
Описание изобретения
Для обеспечения максимальной распознаваемости и реактивности между штаммами могут быть использованы участки белков, которые консервативны у разных видов, серогрупп и штаммов нейссерий. Таким образом, настоящее изобретение представляет белки, включающие участки аминокислотной последовательности, которые являются общими для большинства Neisseria, в частности, для N.meningitidis и N.gonorrhoeae.
Изобретение представляет белок, включающий фрагмент белка нейссерий, причем упомянутый фрагмент состоит из “n” непрерывных консервативных аминокислот, при условии, что изобретение не охватывает своим объемом полноразмерные белки нейссерий. В зависимости от конкретного белка n равно 7 или больше (например, 8, 10, 12, 14, 16, 18, 20 или больше). Предпочтительно фрагмент включает антигенный или иммуногенный сегмент белка нейссерий.
“Консервативной” является аминокислота, которая присутствует в конкретном белке нейссерий, по крайней мере, у х% всех Neisseria. Величина х может составлять 50% или больше, например, 66%, 75%, 80%, 90%, 95% или даже 100% (т.е. аминокислота обнаруживается в анализируемом белке у всех Neisseria).
С целью определения того, является ли аминокислота “консервативной” в конкретном белке нейссерий, необходимо сравнить такой аминокислотный остаток в последовательностях анализируемого белка от множества разных Neisseria (“референсная популяция”). Референсная (контрольная) популяция может включать ряд разных видов рода Neisseria (предпочтительно N.meningitidis и N.gonorrhoeae) или может включать единственный вид. Референсная популяция может включать ряд различных серогрупп конкретного вида (таких, как серогруппы А, В, С, W135, X, Y, Z и 29Е менингококка N.meningitidis) или единственную серогруппу. Также референсная популяция может охватывать ряд разных штаммов конкретной серогруппы (таких, как штаммы NG6/88, BZ198, NG3/88, 297-0, BZ147, BZ169, 528, BZ133, NGE31, NGH38, NGH15, BZ232, BZ83 и 44/76 менингококка-В). Предпочтительная референсная популяция состоит из пяти самых обычных штаммов N.meningitidis и/или пяти наиболее обычных штаммов N.gonorrhoeae.
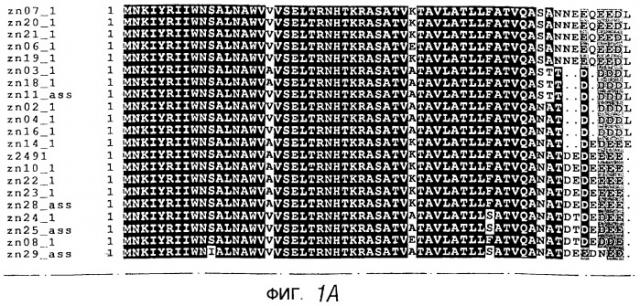
Предпочтительно референсная популяция включает “k” штаммов, происходящих от “k” разных ветвей соответствующего филогенетического древа, такого, как филогенезы, описанные у (a) Ni et al., 1992, Epidemiol. Infect., 109, 227-239; (b) Wolff et al., 1992, Nucleic Acids Res., 20, 4657; (c) Bygraves & Maiden, 1992, J. Gen. Microbiol., 138, 523-531; (d) Caugant et al., 1987, J. Bacteriol., 69, 2781-2792. Другое филогенетическое древо, которое может быть использовано, показано в данном тексте на фигуре 8, а еще одно - на фигуре 9b.
Должно быть понятно, что конкретные вид, серогруппа или штамм должны быть включены в состав референсной популяции, если только они кодируют белок, в котором имеется анализируемая аминокислота. Например, в случае аминокислот в пределах ORF40, описанного далее, референсная популяция не должна включать N.gonorrhoeae потому, что данный вид лишен ORF40.
Следовательно, для белков, обнаруживаемых и у N.meningitidis, и у N.gonorrhoeae, предпочтительная референсная популяция включает:
- N.meningitidis А, штамм Z2491;
- N.meningitidis В, штаммы NG6/88;
- N.meningitidis W, штаммы А22;
- N.gonorrhoeae, штамм Ng F62.
Указанное описано у (a) A.Seiler et al., 1996, Mol. Microbiol., 19 (4), 841-856; (b) Maiden et al., 1998, Proc. Natl. Acad. Sci. USA, 95, 3140-3145; (с) Virji et al., 1992, Mol. Microbiol., 6, 1271-1279; (d) Dempsey et al., 1991, J. Bacteriol., 173, 5476-5486.
Для белков, обнаруживаемых только у N.meningitidis, однако, предпочтительная референсная популяция включает:
- N.meningitidis А, штамм Z2491;
- N.meningitidis В, штаммы NG6/88;
- N.meningitidis W, штаммы А22.
Аминокислотные последовательности различных Neisseria легко могут быть подвергнуты сравнению с помощью компьютерных программ. Обычно они должны включать сопоставление ряда последовательностей с использованием такого алгоритма, как CLUSTAL [Thompson et al., 1994, Nucleic Acids Res., 22, 4673-4680; Trends Biochem. Sci., 1998, 23, 403-405] или, предпочтительно, PILEUP [элемент пакета программ группы GCG из Висконсинского университета: предпочтительна версия 9.0].
Консервативные аминокислоты легко выявляются при множественном сопоставлении последовательностей: в анализируемом аминокислотном положении в сопоставляемых последовательностях должна находиться конкретная аминокислота. Консервативные аминокислоты могут быть более эффективно выявлены с использованием такой программы, как BOXSHADE [доступна, например, в режиме “on-line” от NIH], PRETTYBOX (GCG Wisconsin, vers. 10] или JALVIEW [доступна от EBI в режиме “on-line”].
Предпочтительно белок включает фрагмент одного из белков, описанных в международных патентных заявках WO 99/24578, WO 99/36544, WO 99/57280 или WO 00/22430, или одной из 2158 кодирующих рамок ORF, описанных у Tettelin et al., 2000, Science, 287, 1809-1815. Более конкретно, предпочтительно он включает фрагмент одного или нескольких из ORF4, ORF40, ORF46, белка 225, белка 235, белка 287, белка 519, белка 726, белка 919 и белка 953, описанных в указанных материалах (см. приведенные в данном тексте примеры). Обычно белок по настоящему изобретению не должен включать белковую последовательность, описанную в качестве примеров в WO 99/24578, WO 99/36544, WO 99/57280, WO 00/22430 или у Tettelin et al.
Также настоящее изобретение представляет белок, включающий одну из последовательностей, показанных на фигурах.
Понятно, что белки по настоящему изобретению могут быть получены различными способами (например, с помощью рекомбинантной экспрессии, нативной экспрессии, очистки из клеточной культуры, химического синтеза и т.п.) и в различных формах (например, нативной, в виде химер и т.п.). Предпочтительно их получают в существенно чистой форме (т.е. по существу свободными от других белков нейссерий или белков клетки-хозяина).
В соответствии со следующим аспектом настоящее изобретение представляет антитела, которые связываются с указанными белками. Антитела могут быть поликлональными или моноклональными и могут быть получены с помощью любого подходящего способа.
Согласно следующему аспекту изобретение представляет нуклеиновую кислоту, кодирующую белки по настоящему изобретению. Также должно быть понятно, что изобретение представляет нуклеиновую кислоту, включающую последовательности, комплементарные указанному (например, для антисмысловых конструкций и зондов).
Более того, изобретение представляет нуклеиновую кислоту, которая способна гибридизовать с нуклеиновой кислотой N.meningitidis, описанной в примерах, предпочтительно в условиях “высокой степени жесткости” (например, 65°С в растворе 0,1×SSC, 0,5% ДСН).
Понятно, что нуклеиновая кислота по настоящему изобретению может быть получена различными путями (например, с помощью химического синтеза, из состава геномных или кДНК библиотек, из самих организмов и т.п.) и может принимать различные формы (например, одноцепочечную, двухцепочечную, векторную, форму зонда и т.п.).
Кроме того, понятие “нуклеиновая кислота” охватывает ДНК и РНК, а также их аналоги, такие, как молекулы, включающие модифицированный скелет, а также нуклеопротеины (НКП) и т.п.
В соответствии со следующим аспектом изобретение представляет векторы, включающие нуклеотидные последовательности по настоящему изобретению (например, экспрессирующие векторы) и трансформированные ими клетки-хозяева.
В соответствии с другим аспектом изобретение представляет композиции, содержащие белок, антитело и/или нуклеиновую кислоту по настоящему изобретению. Указанные композиции могут быть пригодными в качестве, например, вакцин или в качестве диагностических реагентов, или в качестве иммуногенных композиций.
Также изобретение представляет нуклеиновую кислоту, белок или антитело по настоящему изобретению для использования в качестве лекарственного средства (например, в качестве вакцин) или в качестве диагностических реагентов. Также оно предусматривает использование нуклеиновой кислоты, белка или антитела по настоящему изобретению в производстве: (i) лекарственного средства для лечения или профилактики инфекции, вызванной бактериями Neisseria; (ii) диагностического реагента для выявления присутствия бактерий Neisseria или антител, сформированных в отношении бактерий Neisseria; и/или (iii) реагента, который способен формировать антитела, специфичные в отношении бактерий Neisseria. Указанное использование предпочтительно применимо для всех видов Neisseria.
Когда белок нейссерии включает более чем q% консервативных аминокислот, изобретение представляет использование белка нейссерии или его фрагмента в качестве неспецифичного по конкретному штамму белка, который проявляет перекрестную реактивность между многими видами, серогруппами и штаммами. Величина q может составлять 50%, 60%, 75%, 80%, 90%, 95% или даже 100%.
Также изобретение представляет способ лечения пациента, включающий введение пациенту терапевтически эффективного количества нуклеиновой кислоты, белка и/или антитела по настоящему изобретению.
В соответствии со следующим аспектом изобретение представляет различные способы.
Представляется способ выработки белков по настоящему изобретению, включающий стадию культивирования клетки-хозяина по настоящему изобретению в условиях, которые индуцируют экспрессию белка.
Представляется способ выработки белка или нуклеиновой кислоты по настоящему изобретению, причем белок или нуклеиновая кислота синтезируют отчасти или полностью с применением химических методов.
Представляется способ выявления полинуклеотидов по настоящему изобретению, включающий стадии: (а) контактирование с биологическим образцом нуклеотидного зонда в соответствии с настоящим изобретением в условиях для гибридизации с образованием дуплексов; и (b) выявление упомянутых дуплексов.
Представляется способ выявления белков по настоящему изобретению, включающий стадии: (а) контактирование антитела по настоящему изобретению с биологическим образцом в условиях, подходящих для образования комплексов “антиген-антитело”; и (b) выявление упомянутых комплексов.
Далее обобщаются стандартные методы и процедуры, которые могут быть использованы с целью осуществления настоящего изобретения (например, с целью использования заявленных последовательностей для вакцинации или в диагностических целях). Указанное обобщение не является ограничением для изобретения, но, напротив, дает примеры того, что может быть использовано, не являясь при этом обязательным.
Общие замечания
В практике настоящего изобретения должны быть использованы, если это специально не оговаривается, стандартные методы молекулярной биологии, микробиологии, рекомбинантных ДНК и иммунологии, которые известны специалистам в данной области техники. Такие методы полностью охарактеризованы в литературе, например, у Sambrook, 1989, "Molecular Cloning: A Laboratory Manual", 2d Edition; "DNA Cloning" Volumes 1 and 2 (D.N.Glover ed. 1985); "Oligonucleotide Synthesis" (M.J. Gait ed., 1984); "Nucleic Acid Hybridization" (B.D. Hames & S.J. Higgins eds., 1984); "TRanscription and Translation" (B.D. Hames & S.J. Higgins eds., 1984); "Animal Cell Culture" (R.I. Freshney ed., 1986); "Immobilized Cells and Enzymes" (IRL Press, 1986); B. Perbal, 1984, "A Practical Guide to Molecular Cloning"; периодические выпуски "Methods in Enzymology" (Academic Press Inc.), в частности, тома 154 и 155; "Gene Transfer Vectors for Mammalian Cells" (J.H. Miller & M.P. Calos eds., 1987, Cold Spring Harbor Laboratory); Mayer & Walker eds., 1987, "Immunochemical Methods in Cell and Molecular Biology" (Academic Press, London); Scopes, 1987, "Protein Purification: Principles and Practice", 2d Edition (Springer-Verlag, NY) ; и "Handbook of Experimental Immunology", Volumes 1-4 (D. M. Weir & C.C. Blackwell eds., 1986).
В настоящей заявке для нуклеотидов и аминокислот используются стандартные аббревиатуры.
Все публикации, патенты и патентные заявки, цитируемые в данном тексте, в полном объеме включены в качестве оиблиографических ссылок. В частности, содержание международных патентных заявок WO 99/24578, WO 99/36544, WO 99/57280 и WO 00/22430 включено здесь для сведения.
Определения
Композиция, содержащая X, “в существенной степени свободна от Y” тогда, когда, по крайней мере, 85% по массе от суммы X+Y в композиции приходится на долю X. Предпочтительно Х составляет, по крайней мере, примерно 90% по массе от общего количества X+Y в данной композиции, более предпочтительно, - по крайней мере, примерно 95% или даже 99% по массе.
Термин “содержащий” соответствует как понятию “включающий”, так и “состоящий”: например, композиция, “содержащая” X, может состоять только из Х или может включать (содержать) нечто дополнительное к X, например, X+Y.
Термин “гетерологичный” относится к двум биологическим компонентам, которые не встречаются вместе в природе. Такими компонентами могут быть клетки-хозяева, гены или регуляторные сегменты, такие, как промоторы. Хотя гетерологичные компоненты в природе вместе не обнаруживаются, они могут обладать совместной функциональностью, например, когда промотор, гетерологичный по отношению к гену, функционально с ним соединен. Другим примером является такая ситуация, в которой последовательность нейссерии гетерологична по отношению к мышиной клетке-хозяину. Дополнительными примерами могут быть два эпитопа из одного и того же или из разных белков, которые были собраны в составе общего белка в таком порядке, который отсутствует в природе.
“Сайт начала репликации” обозначает полинуклеотидную последовательность, которая инициирует и регулирует репликацию полинуклеотидов, таких, как экспрессирующий вектор. Сайт начала репликации ведет себя как автономная единица полинуклеотидной репликации в клетке, обеспечивая способность к репликации под собственным контролем. Присутствие сайта начала репликации может быть необходимым для обеспечения репликации вектора в конкретной клетке-хозяине. При наличии нескольких сайтов начала репликации экспрессирующий вектор может воспроизводиться в большом числе копий в присутствии подходящих белков внутри клетки. Примерами сайтов начала репликации являются автономно реплицирующиеся последовательности, которые эффективны в клетках дрожжей, а также вирусные Т-антигены, эффективные в клетках COS-7.
Термин "мутантная" последовательность определяет ДНК, РНК или аминокислотную последовательность, отличающуюся от нативной или заявленной последовательности, но имеющую сходство с ней. В зависимости от конкретной последовательности уровень идентичности при сравнении нативной или заявленной последовательности и мутантной последовательности предпочтительно превышает 50% (например, 60%, 70%, 80%, 90%, 95%, 99% или больше, что подсчитывают с помощью алгоритма Смита-Уотермана в соответствии с описанным выше). По использованию в данном тексте термин “аллельный вариант” молекулы нуклеиновой кислоты или участка, для которого здесь представляется нуклеотидная последовательность, является молекулой нуклеиновой кислоты или сегментом, который находится в том же самом локусе конкретного генома другого или второго изолята, при том, что, вследствие естественной изменчивости, обусловливаемой, например, мутационным или рекомбинационным процессом, характеризуется сходной, но не идентичной нуклеотидной последовательностью. Кодирующий сегмент аллельного варианта обычно кодирует белок, обладающий сходным уровнем активности по сравнению с таковым у белка, кодируемого тем геном, с которым проводится данное сравнение. Аллельный вариант также может включать изменения в 5’- или 3’-нетранслируемых участках конкретного гена, таких, как регуляторные сегменты (см., например, патент США №5753235).
Экспрессионные системы
Нуклеотидные последовательности Neisseria могут быть экспрессированы в ряде различных экспрессионных систем: например, для этой цели используются клетки млекопитающих, бакуловирусы, растения, бактерии и дрожжи.
i. Системы клеток млекопитающих
Экспрессионные системы на основе клеток млекопитающих хорошо известны в данной области техники. Промотором для клеток млекопитающих может служить любая последовательность ДНК, способная связывать РНК - полимеразу млекопитающих, инициируя тем самым транскрипцию нижерасположенной (т.е. в 3’-сторону) кодирующей последовательности (например, структурного гена) с образованием мРНК. Промотор должен включать участок инициации транскрипции, который обычно располагается проксимально по отношению к 5’-концу кодирующей последовательности, а также бокс ТАТА, обычно находящийся в 25-30 парах нуклеотидов (п.н.) выше сайта инициации транскрипции. Считается, что бокс ТАТА обеспечивает контролируемое РНК - полимеразой 2 начало синтеза РНК в правильном сайте. Промотор клеток млекопитающих также должен включать расположенный выше собственно промоторный элемент, обычно находящийся в 100-200 п.н. выше бокса ТАТА. Верхний промоторный элемент определяет скорость, с которой инициируется транскрипция, и может быть активен в любой ориентации [Sambrook et al., 1989, "Expression of Cloned Genes in Mammalian Cells", In "Molecular Cloning: A Laboratory Manual", 2d ed.].
Гены вирусов млекопитающих обычно характеризуются интенсивной экспрессируемостью и широким кругом хозяев; следовательно, последовательности, кодирующие гены вирусов млекопитающих, являются перспективными для применения в качестве промоторных последовательностей. Примерами являются промотор ранних генов вируса SV40, промотор LTR вируса опухоли молочной железы мыши, промотор главного позднего гена аденовируса (AdMLP) и промотор вируса простого герпеса. Кроме того, последовательности, производные от невирусных генов, таких, как ген металлотионеина мыши, также являются применимыми промоторными последовательностями. Экспрессия может быть как конститутивной, так и регулируемой (индуцибельной), и в зависимости от промотора может быть индуцирована глюкокортикоидами в чувствительных к гормону клетках.
Присутствие энхансерного элемента (энхансера), объединенного с промоторными элементами, описанными выше, обычно должно усиливать экспрессию. Энхансер - это регуляторная последовательность ДНК, которая способна стимулировать транскрипцию до тысячекратного усиления в случае соединения с гомологичными или гетерологичными промоторами, при том, что синтез РНК начинается в нормальном инициирующем сайте РНК. Энхансеры также активны тогда, когда они помещаются или выше, или ниже сайта инициации транскрипции, как в нормальной, так и в инвертированной ориентации, или на расстоянии даже больше 1000 п.н. от промотора [Maniatis et al., 1987, Science, 236, 1237; Alberts et al., 1989, "Molecular Biology of the Cell", 2d ed.]. В частности, могут быть использованы энхансерные элементы, происходящие от вирусов, поскольку они обычно характеризуются более широким кругом хозяев. Примерами являются энхансер раннего гена вируса SV40 [Dijkema et al., 1985, EMBO J., 4, 761] и система “энхансер + промотор”, производная от участка длинных концевых повторов (LTR) вируса саркомы Рауса [German et al., 1982b, Proc. Natl. Acad. Sci., 79, 6777] и цитомегаловируса человека [Boshart et al., 1985, Cell, 41, 521]. Кроме того, некоторые энхансеры являются регулируемыми и становятся активными только в присутствии индуктора, такого, как гормон или ион металла [Sassone-Corsi & Borelli, 1986, Trends Genet., 2, 215; Maniatis et al., 1987, Science, 236, 1237].
Молекула ДНК может быть экспрессирована внутри клеток млекопитающих. Промоторная последовательность может быть напрямую присоединена к молекуле ДНК: в этом случае первая с N-конца аминокислота в составе рекомбинантного белка всегда должна быть метионином, который кодируется старт-кодоном ATG. Если желательно, N-концевая часть может быть отщеплена от белка путем инкубации in vitro с бромцианом.
Альтернативно, чужеродные белки также могут секретироваться из клетки непосредственно в питательную среду в результате создания химерных молекул ДНК, которые кодируют химерный белок, включающий лидерный (сигнальный) сегмент, обеспечивающий секрецию чужеродного белка клетками млекопитающих. Предпочтительным является наличие сайтов процессинга между лидерным сегментом и чужеродным геном, которые могут быть расщеплены либо in vivo, либо in vitro. Лидерная последовательность обычно кодирует сигнальный пептид, состоящий из гидрофобных аминокислот и обеспечивающий секрецию белка из клетки. Аденовирусный трехраздельный лидерный сегмент является примером лидерной последовательности, обеспечивающей секрецию чужеродного белка клетками млекопитающих.
Обычно последовательности терминации транскрипции и полиаденилирования, распознаваемые клетками млекопитающих, являются регуляторными сегментами, расположенными с 3’-стороны от стоп - кодона, т.е., наряду с промоторными элементами, фланкируют кодирующую последовательность. 3’-Конец зрелой мРНК образуется в результате сайт - специфичного посттранскрипционного расщепления и полиаденилирования [Birnstiel et al., 1985, Cell, 41, 349; Proudfoot & Whitelaw, 1988, "Termination and 3’ end processing of eukaryotic RNA", In "Transcription and splicing", ed. B.D. Hames & D.M. Glover; Proudfoot, 1989, Trends Biochem. Sci., 14, 105]. Указанные последовательности обеспечивают транскрипцию мРНК, которая затем может быть транслирована в полипептид, кодируемый исходной ДНК. Примерами сигналов терминации транскрипции и полиаденилирования являются мотивы, происходящие из SV40 (Sambrook et al., 1989, "Expression of cloned genes in cultured mammalian cells". In "Molecular Cloning: A Laboratory Manual"].
Обычно описанные выше компоненты, включая промотор, сигнал полиаденилирования и последовательность терминации транскрипции, встраивают в состав экспрессирующих конструкций одновременно. Энхансеры, интроны, включающие функциональные донорные и акцепторные сайты сплайсинга, и лидерные последовательности могут быть также включены в экспрессирующую конструкцию, если это является желательным. Экспрессирующие конструкции часто поддерживаются в виде репликона, т.е. внехромосомного элемента (например, плазмиды), способного стабильно сохраняться в организме-хозяине, таком, как клетка млекопитающего или бактерия. Репликационные системы для млекопитающих включают системы, происходящие от вирусов животных, для репликации которых необходимо участие транс-регулирующих факторов. Например, плазмиды, включающие репликационные системы паповавирусов, таких, как SV40 [Gluzman, 1981, Cell, 23, 175], или полиомавирусов, реплицируются в исключительно большом числе копий в присутствии подходящего вирусного Т-антигена. Дополнительными примерами репликонов для клеток млекопитающих являются репликоны, происходящие от бычьего папилломавируса и вируса Эпштейна - Барр. Кроме того, такой репликон может нести две репликационные системы, что тем самым обеспечивает возможность поддержания их, например, в клетках млекопитающих с целью экспрессии и в прокариотических клетках с целью клонирования и амплификации. Примерами таких бифункциональных векторов для млекопитающих/бактерий являются векторы рМТ2 [Kaufman et al., 1989, Mol. Cell. Biol., 9, 946] и рНЕВО [Shimizu et al., 1986, Mol. Cell. Biol., 6, 1074].
Выбор используемых процедур трансформации зависит от вида организма - хозяина, который будет трансформирован. Способы внесения гетерологичных полинуклеотидов в клетки млекопитающих хорошо известны в данной области техники и включают опосредуемую декстраном трансфекцию, осаждение фосфатом кальция, трансфекцию с полибреном, слияние протопластов, электропорацию, инкпсулирование полинуклеотидов в липосомы и прямое микроинъецирование ДНК в ядра.
Линии клеток млекопитающих, пригодные в качестве хозяев для целей экспрессии, хорошо известны в данной области техники и включают большое число иммортализованных клеточных линий, доступных из Американской коллекции типовых культур (АТСС), включая, но тем самым не ограничиваясь, клетки яичника китайского хомячка (СНО), клетки HeLa человека, клетки почек новорожденных хомячков (ВНК), клетки почки зеленой мартышки (COS), клетки гепатоклеточной карциномы человека (например, Hep G2) и множество других клеточных линий.
ii. Бакуловирусные системы
Полинуклеотид, кодирующий белок, также может быть встроен в подходящий экспрессирующий вектор для клеток насекомых: его функциональным образом соединяют с регуляторными элементами в составе такого вектора. При конструировании вектора используют методы, хорошо известные в данной области техники. В целом, компонентами экспрессионной системы являются транспортный вектор, обычно являющийся бактериальной плазмидой, который включает фрагмент бакуловирусного генома и подходящий рестрикционный сайт, предназначенный для встраивания гетерологичного гена или генов, которые будут экспрессироваться; бакуловирус дикого типа, имеющий последовательность, которая гомологична специфичному для бакуловирусов фрагменту транспортного вектора (это обеспечивает гомологичную рекомбинацию гетерологичного гена в бакуловирусном геноме); и подходящие клетки-хозяева насекомого и культуральная среда.
После внесения в состав транспортного вектора последовательности ДНК, кодирующей белок, данный вектор и вирусный геном дикого типа трансфецируют в клетку-хозяина насекомого, в которой вектор и вирусный геном могут рекомбинировать. Упакованный рекомбинантный вирус экспрессируется, а рекомбинантные бляшки идентифицируют и очищают. Материалы и методы для конструирования экспрессионных систем “бакуловирус/клетки насекомых” имеются в продаже в виде специальных наборов, помимо прочего, у фирмы Invitrogen, San Diego, СА (набор "Мах-Вас kit"). Названные методы в целом известны специалистам в данной области техники и подробно охарактеризованы в руководстве Саммерса и Смита (Summers & Smith, 1987, Texas Agricult. Exper. Stat. Bull., №1555) (здесь и далее цитируется как "Summers & Smith").
Перед встраиванием последовательности ДНК, кодирующей белок, в состав бакуловирусного генома, описанные выше компоненты, включая промотор, лидерный сегмент (если он желателен), представляющую интерес кодирующую последовательность и последовательность терминации транскрипции, обычно компонуют в промежуточную переносящую конструкцию (транспортный вектор). Такая конструкция может включать единственный ген и функционально присоединенные к нему регуляторные элементы; или множественные гены, каждый из которых имеет “собственный” комплект функционально присоединенных регуляторных элементов; или множественные гены, находящиеся под контролем того же набора регуляторных элементов. Промежуточные переносящие конструкции часто поддерживаются в виде репликона, такого, как внехромосомный элемент (например, плазмида), способного стабильно сохраняться в организме-хозяине, таком, как бактерия. Такой репликон должен включать репликационную систему, что тем самым обеспечит поддержание в подходящем организме-хозяине с целью клонирования и амплифицирования.
В настоящее время наиболее распространенным транспортным вектором для внесения чужеродных генов в AcNPV является рАс 373. Также были сконструированы и многие другие векторы, известные специалистам в данной области техники. Они включают, например, pVL985 (в котором изменяется старт-кодон гена полигедрина с ATG на АТТ и который вносит клонирующий BamHI-сайт в 32 парах нуклеотидов ниже кодона АТТ: см. Luckow & Summers, 1989, Virology, 17, 31).
Обычно плазмида также включает сигнал полиаденилирования гена полигедрина (Miller et al., 1988, Ann. Rev. Microbiol., 42, 177), прокариотический ген резистентности к ампициллину (аmр) и точку начала репликации, необходимые для отбора и воспроизведения в клетках E.coli.
Бакуловирусные транспортные векторы обычно включают бакуловирусный промотор. Бакуловирусный промотор - это любая последовательность ДНК, способная связываться с бакуловирусной РНК-полимеразой и инициировать транскрипцию нижерасположенной кодирующей последовательности (например, структурного гена) в направлении 5’→3’ с образованием мРНК. Промотор должен включать сайт инициации транскрипции, который обычно помещают проксимально по отношению к 5'-концу кодирующей последовательности. Данный участок инициации транскрипции обычно включает сайт связывания РНК - полимеразы и сайт инициации транскрипции. Бакуловирусный транспортный вектор также может включать второй домен, определяемый как “энхансер”, который, если присутствует, обычно находится на расстоянии от структурного гена. Экспрессия может быть либо контролируемой, либо конститутивной.
Структурные гены, интенсивно транскрибируемые на поздних этапах вирусного инфекционного цикла, позволяют выделить конкретно применимые промоторные последовательности. Примерами являются последовательности, производные от гена, кодирующего вирусный белок - полигедрин (полиэдрин) (Friesen et al., 1986, "The Regulation of Baculovirus Gene Expression", in "The Molecular Biology of Baculoviruses", ed. W.Doerfler; EP №№127839 и 155476), и гена, кодирующего белок р10 (Vlak et al., 1988, J. Gen. Virol., 69, 765).
ДНК, кодирующая подходящие сигнальные последовательности, может быть производной от генов, кодирующих секретируемые белки насекомых или бакуловирусов, такие, как ген полигедрина бакуловируса (Carbonell et al., 1988, Gene, 73, 409). Как альтернатива, при том, что сигналы посттрансляционных модификаций в клетках млекопитающих (таких, как отщепление сигнального сегмента, протеолитическое расщепление и фосфорилирование), по-видимому, распознаются и клетками насекомых, а сигналы, необходимые для секреции и накопления в ядре, также, по-видимому, консервативны в клетках позвоночных и беспозвоночных животных, для обеспечения секреции у насекомых также можно использовать лидерные сегменты, происходящие не от насекомых, такие, как производные от генов, кодирующих α-интерферон человека (Maeda et al., 1985, Nature, 315, 592), рилизинг - фактор гастрина человека (Lebacq-Verheyden et al., 1988, Mol. Cell. Biol., 8, 3129), интерлейкин-2 человека (Smith et al., 1985, Proc. Natl. Acad. Sci. USA, 82, 8404), интерлейкин-3 мыши (Miyajima et al., 1987, Gene, 58, 273); и глюкоцереброзидазу человека (Martin et al., 1988, DNA, 7, 99).
Рекомбинантный полипептид или полипротеин может быть экспрессирован внутриклеточно или, если он экспрессируется с участием соответствующих регуляторных последовательностей, он может секретироваться. Для эффективной внутриклеточной экспрессии нехимерных чужеродных белков обычно нужны гетерологичные гены, которые в идеале включают короткую лидерную последовательность, включающую подходящие сигналы инициации трансляции, предшествующие старт - кодону ATG. Если желательно, остаток метионина с N-конца может быть отщеплен от зрелого белка путeм инкубации in vitro с бромцианом.
Как альтернатива, рекомбинантные полипротеины или белки, которые в естественных условиях не являются секретируемыми, могут быть секретированы из клеток насекомых путем создания химерных молекул ДНК, которые кодируют химерный белок, включающий лидерный сегмент, обеспечивающий секрецию чужеродного белка у насекомых. Лидерная последовательность обычно кодирует сигнальный пептид, состоящий из гидрофобных аминокислот и обеспечивающий перемещение белка в эндоплазматический ретикулюм.
После встраивания последовательности ДНК и (или) гена, кодирующего экспрессионный продукт, являющийся предшественником белка, клетку-хозяина насекомого одновременно трансформируют гетерологичной ДНК транспортного вектора и геномной ДНК бакуловируса дикого типа, обычно с применением котрансфекционных методов. Промотор и последовательность терминации транскрипции данной конструкции обычно должны включать сегмент бакуловирусного генома длиной 2-5 т.п.н. Способы внесения гетерологичной ДНК по желаемому сайту в состав бакуловируса известны в данной области техники (см. Summers & Smith, цит. выше; Ju et al., 1987; Smith et al., 1983, Mol. Cell. Biol., 3, 2156; Luckow & Summers, 1989). Например, встраивание может быть произведено внутрь гена, такого, как ген полигедрина, для чего используется двойная перекрестная рекомбинация; также встраивание может быть осуществлено по рестрикционному сайту, сконструированному в пределах желательного бакуловирусного гена (Miller et al., 1989, Bioessays, 4, 91). В случае клонирования в состав экспрессирующего вектора последовательности ДНК вместо гена полигедрина, ее фланкируют с обеих сторон (5’ и 3’) последовательностями, специфичными для гена полигедрина, и помещают ниже полигедринового промотора.
Заново сформированный бакуловирусный экспрессирующий вектор последовательно упаковывают в инфекционный рекомбинантный бакуловирус. Гомологичная рекомбинация происходит с низкой частотой (от примерно 1% до примерно 5%), поэтому подавляющее большинство продуцируемых в результате котрансфекции вирусов представляет собой вирусы дикого типа. Следовательно, к идентификации рекомбинантных вирусов необходим специальный подход. Преимуществом данной экспрессионной системы является возможность визуального скрининга, позволяющего выявлять рекомбинантные вирусы. Белок полигедрин, продуцируемый вирусами дикого типа, вырабатывается в очень большом количестве в ядрах инфицированных клеток на поздних этапах после инфицирования вирусом. Накапливаемый полигедрин образует тельца включения, которые также содержат погруженные в них частицы. Такие тельца включения размером до 15 мкм интенсивно преломляют свет: это придает им яркое свечение, которое может быть легко выявлено в обычном световом микроскопе. В клетках, инфицированных рекомбинантными вирусами, тельца включения отсутствуют. Для разграничения рекомбинантных вирусов и вирусов дикого типа трансфекционный надосадочный слой вносят на монослойную культуру клеток насекомых с применением методов, хорошо известных специалистам в данной области техники. А именно бляшки анализируют под световым микроскопом целью выявления присутствия (как признака вируса дикого типа) или отсутствия (как признака рекомбинантного вируса) телец включения ("Current Protocols in Microbiology", Vol. 2, eds. Ausubel et al., раздел 16.8 (Supp. 10, 1990); Summers & Smith, цит. выше; Miler et al., 1989).
Рекомбинантные бакуловирусные экспрессирующие векторы были сконструированы с целью инфицирования различных типов клеток насекомых. Например, помимо прочего, рекомбинантные бакуловирусы были сконструированы для: комара Aedes aegypti, совки Autographa californica, тутового шелкопряда Bombyx mori, дрозофилы Drosophila melanogaster, Spodoptera frugiperda и совки Trichoplusia ni (WO 89/046699; Carbonell et al., 1985, J. Virol., 56, 153; Wright, 1986, Nature, 321, 718; Smith et al., 1983, Mol. Cell. Biol., 3, 2156; как обзор см. Fraser et al., 1989, In Vitro Cell. Develop. Biol., 25, 225).
Имеются в продаже клетки и культуральные среды как для прямой, так и химерной экспрессии гетерологичных полипептидов в бакуловирусной/экспрессионной системе; технология культивирования клеток в целом хорошо известна специалистам в данной области техники (см., например. Summers & Smith, цит. выше).
Модифицированные клетки насекомых затем могут быть выращены в подходящей питательной среде, которая обеспечит стабильное поддержание плазмиды, присутствующей в модифицированном насекомом-хозяине. В случае, когда экспрессируемый ген находится под контролем индуцибельных регуляторов, организм-хозяин может быть выращен при очень высоки