Способ диагностики онкологических заболеваний
Иллюстрации
Показать всеИзобретение относится к медицине, в частности генетическим исследованиям, к области диагностики онкологических заболеваний путем анализа дезоксирибонуклеиновой кислоты по изменению статуса метилирования генов, участвующих во внутриклеточной регуляции деления, дифференцировки, апоптоза и процессов детоксикации. Способ заключается в том, что измеряют статус метилирования трех генов р16, Е-cadherine и GSTP1 в любых биологических образцах человека, взятых из плазмы крови, мочи, лимфоузлов, опухолевой ткани, межтканевой жидкости, асцитной жидкости, клеток крови и буккального эпителия и других, анализируют ДНК, в которой присутствуют модифицированные гены опухолевого происхождения в любых образцах, в которые могут попадать опухолевые клетки или их компоненты, содержащие дефектные гены, причем анализ осуществляют путем экстрагирования и очистки ДНК из биологических образцов с последующей бисульфитной обработкой этой ДНК для модификации незащищенных цитозиновых оснований при сохранении 5-метилцитозина, представляющего собой защищенное цитозиновое основание, последующего ПЦР анализа обработанных и необработанных бисульфитом исследуемых генов, и при обнаружении изменений, полученных по результату электрофореза ПЦР амплификатов, путем выявления различия в числе и электрофоретической подвижности соответствующих фракций при сопоставлении с контрольными метилированными и неметилированными образцами, содержащими нормальные и гиперметилированные формы генов, диагностируют онкологические заболевания. Способ обеспечивает повышение надежности выявления опухолей, определение оставшихся опухолевых клеток после операций, раннюю оценку эффективности лечения. 3 ил.
Реферат
Изобретение относится к медицине, в частности генетическим исследованиям, к области диагностики онкологических заболеваний путем анализа дезоксирибонуклеиновой кислоты по изменению статуса метилирования генов, участвующих во внутриклеточной регуляции деления, дифференцировки, апоптоза и процессов детоксикации.
Известен метод диагностики и контроля развития рака, включающий анализ амплифицированной ДНК из плазмы крови (патент США №5952170, 1999). Недостатком известного способа является то, что анализ ДНК опухолевого происхождения из одного источника снижает чувствительность диагностики рака.
В настоящее время известно, что нарушение метилирования генов, участвующих во внутриклеточной регуляции деления, дифференцировки, апоптоза и процессов детоксикации приводит к нарушению работы генома в опухолевых и некоторых других клетках и нарушении функционирования соответствующих тканей (patent US 6492144, Dec. 10, 2002, patent US 5726019, Mar. 10, 1998).
Наиболее близким к предлагаемому способу диагностики является метод детекции неопластических клеток, включающий анализ статуса метилирования гена р16 (patent US 5856094, Jan.5, 1999 г.).
Недостатками известного способа диагностики онкологических заболеваний является следующее:
- у различных лиц при одинаковом типе опухолей гиперметилирования промоторных участков ДНК могут отличаться, т.е. профиль гиперметилирования для опухолей индивидуален;
- анализ одного гена, например гена р1-6, показывает наличие опухоли только в половине случаев при диагностике онкозаболеваний, в другой половине случаев опухолевого материала ген не гиперметилирован, а гиперметилированы другие гены регуляции клеточного цикла, например ген E-cadherine.
Кроме того, в отличие от ДНК, выделенной из самой опухоли во многих биологических образцах, также содержащих ДНК опухолевого происхождения, например ДНК плазмы крови онкологических больных, мочи, лимфоузлов, процентное соотношение гиперметилированной формы гена р16 опухолевого происхождения низкое по отношению к негиперметилированной форме из нормальных клеток (patent US 6492144, Dec. 10, 2002).
Задачей предлагаемого способа диагностики онкологических заболеваний является повышение надежности выявления опухолей, определение остающихся в организме опухолевых клеток после операционного удаления опухоли или других видов лечения, мониторинга онкологических заболеваний и ранняя оценка эффективности проводимого лечения, а также прогноз эффективности средств химиотерапии и других видов лечения.
В результате использования предлагаемого способа диагностики онкологических заболеваний увеличивается выживаемость онкологических больных за счет повышения точности диагностики, своевременной диагностики и повышения эффективности лечения, анализ одновременно статуса метилирования нескольких генов увеличивает вероятность обнаружения опухоли, а дополнительная реакция гнездовой ПЦР (нестед ПЦР) позволяет определять гиперметилированные формы гена р16 при низком соотношении ДНК опухолевого происхождения по отношению к ДНК из неопухолевых клеток, а также появляется возможность оценить динамику заболевания, то есть наличие опухолевых клеток после оперативного или иного лечения, рано предвидеть рецедивы или распространение (метастазирование) заболевания и осуществить раннюю оценку эффективности лечения, для возможности перехода и более подходящих в конкретном случае химиопрепаратов или иных путей лечения.
Результат достигается тем, что в предлагаемом способе диагностики онкологических заболеваний путем оценки метилирования генов, участвующих в регуляции клеточного обмена, одновременно измеряют статус метилирования трех генов р16, E-cadherin и GSTP1 в любых биологических образцах человека, взятых из плазмы крови, мочи, лимфоузлов, опухолевой ткани, межтканевой жидкости, асцитной жидкости, клеток крови и буккального эпителия и других, анализируют ДНК, в которой присутствуют модифицированные гены опухолевого происхождения в любых образцах, в которые могут попадать опухолевые клетки или их компоненты, содержащие дефектные гены, причем анализ осуществляют путем экстрагирования и очистки ДНК из биологических образцов с последующей бисульфитной обработкой этой ДНК для модификации незащищенных цитозиновых оснований при сохранении 5-метилцитозина, представляющего собой защищенное цитозиновое основание, последующего ПЦР анализа обработанных и необработанных бисульфитом исследуемых генов, и при обнаружении изменений, полученных по результату электрофореза ПЦР амплификатов, путем выявления различия в числе и электрофоретической подвижности соответствующих фракций при сопоставлении с контрольными метилированными и неметилированными образцами, содержащими нормальные и гиперметилированные формы генов, диагностируют онкологические заболевания.
Для контрольных метилированных и неметилированных образцов используется ДНК из культур ткани человека, содержащая нормальные или гиперметилированные формы генов р16, E-cadherin и GSTP1.
Биологические образцы могут быть получены от лиц, обследуемых для выявления онкологических заболеваний или с установленным онкологическим заболеванием до лечения, в процессе лечения до и после операционного вмешательства, химиотерапии, лучевой терапии, биотерапии и других.
Извлечение ДНК осуществляют из различных биологических образцов, проводят очистку, бисульфитную модификацию и далее амплификацию этой ДНК для определения статуса метилирования генов ДНК путем сравнительного анализа исследуемых образцов лица, подвергшегося диагностике с контрольными образцами, отрицательными контролями, ДНК от здоровых лиц и известных культур ткани человека с нормальным статусом метилирования исследуемых генов, а также положительным контролем ДНК культур ткани человека, где имеет место нарушение в статусе метилирования. Различные примеси при извлечении и очистке ДНК мешают последующему статусу метилирования, так как экранируют неметилированные основания цитозина и при реакции бисульфитной модификации они узнаются как 5-метилцитозины (метилированные основания цитозина), что ведет к ложно положительньм диагнозам (Ehrlich M. DNA methylation: normal development, inherited diseases, and cancer. J Clin Ligand Assay 2000; 23: 144-8).
Для извлечения ДНК в предлагаемом изобретении используют модифицированные для некоторых видов биологических образцов методики извлечения, заключающиеся в изменении концентрации протеиназы К, рН буферной системы и числе повторных фенольных экстракций и использовании для осаждения ДНК в образцах с малой концентрацией ДНК (например, плазмы крови) линейного полимера полиакриламида.
Способ осуществляют следующим образом.
9 мл крови берут из локтевой вены одноразовьм шприцом и переносят в полипропиленовую пробирку объемом 15 мл (фирма Финбио или аналогичные пробирки), содержащую 1 мл 1%-ного ЭДТА-антикоагулянтного изотонического раствора. Второй вариант: Забор крови осуществляют также при использовании разовой вакуумной системы с ЭДТА - Monovette фирмы Sarstedt, Германия (разрешение на использование - МЗ РФ №2000/403 от 14.08.2000 г.).
Первое центрифугирование осуществляют в мягких условиях при ускорении 315g для максимального сохранения целостности ядросодержащих клеток 15 мин при 4°С. Используется центрифуга 5804R с бакетротором фирмы Эппендорф (Германия). Для данной центрифуги такое ускорение обеспечивается при 1500 об/мин, или может быть использована другая центрифуга с аналогичными условиями центрифугирования. Переносят плазму с взвесью ядросодержащих клеток в новую пробирку, стараясь не захватывать осевшие эритроциты, центрифугируют при 1260g (3000 об/мин, 15 мин, 4°С, центрифуга 5804R с бакетротором фирмы Eppendorf, Германия) для осаждения ядросодержащих клеток. Затем переносят бесклеточную плазму в новую пробирку, оставив около 150-200 мкл с осадком. Осадок ядросодержащих элементов крови ресуспендируют в оставшемся количестве плазмы, переносят в микропробирку типа Eppendorf 1,5 мл. Центрифугируют пробирку с плазмой при 3500g (5000 об/мин, 15 мин, 4°С) для полного осаждения оставшихся единичных клеток. Плазму переносят в новую пробирку и используют для дальнейшей работы или сохраняют при -80°С.
Выделение ДНК из биологических образцов
Выделение ДНК из клеток крови фенольным методом с предварительной обработкой протеиназой К. (тот же метод используется при выделении ДНК из осадка клеток мочи, клеточных культур).
Осадок ядросодержащих клеток, перенесенный в микропробирку типа Eppendorf 1,5 мл осаждают в миницентрифуге Microspine фирмы Эппендорф (12000 об/мин (8000g), 1 мин) и сохраняют до выделения ДНК при -80°С. Осадок клеток ресуспендируют в 200 мкл лизирующего буфера (10 мМ Трис (рН 8,0), 25 мМ ЭДТА (рН 8,0), 0,5% SDS). Ресуспендируют и осаждают коротким центрифугированием. Добавляют 20 мкл раствора протеиназы К (100 мкг/мл), перемешивают и инкубируют ночь при 56°С. Проводят экстракцию белков из лизата фенолом, уравновешенным буфером (50 мМ Трис, рН 8,0, 10 мМ EDTA). Центрифугируют 5 мин на максимальных оборотах (Eppendorf Minispin), верхнюю (водную) фазу переносят в новую пробирку. Затем проводят экстракцию водной фазы (п.5) смесью “фенол - хлороформ” с соотношением фенола к хлороформу 10:1.
Центрифугируют 5 мин на максимальных оборотах, переносят верхнюю (водную) фазу в новую пробирку и добавляют равный объем хлороформа. Встряхивают и центрифугируют 5 мин на максимальных оборотах. Верхнюю фазу переносят в новую пробирку. Добавляют 1/10 объема раствора 3 М ацетата натрия, рН 5,3, и 2 объема охлаждееного до -20°С холодного 96%-этанола. Встряхивают, выдерживают 2 часа при -20°С. Центрифугируют при +4°С 15 мин на максимальных оборотах. Осторожно удаляют супернатант, избегая лабилизации осадка ДНК. Стенки пробирки промывают 70%-ным этанолом, при необходимости центрифугируют (в случае лабилизации осадка), спирт удаляют, осадок подсушивают на воздухе. Для хранения выделенную ДНК растворяют в воде или ТЕ-буфере, хранят при -80°С.
Выделение ДНК из тканей, фиксированных в парафине
Приготавливают 8-15 мкм срезы из биоптатов, заключенных в парафинированные блоки. Далее срезы тканей, фиксированных в парафине, помещают в микропробирку типа Eppendorf 1,5 мл, добавляют 1 мл ксилола и осторожно встряхивают (переворачивание пробирки вверх-вниз несколько раз). Затем центрифугируют 5 мин на максимальных оборотах, комн. температура. Удаляют надосадочную жидкость пипеткой. При необходимости депарафинизацию ксилолом повторяют. Добавляют 1 мл 96%-ного этанола для удаления остатков ксилола и осторожно перемешивают (переворачивание пробирки вверх-вниз несколько раз). Спирт удаляют и повторяют промывание спиртом еще раз. Добавляют к осадку ТЕ буфер, сразу же, чтобы не успели из срезов элюироваться фрагменты ДНК, центрифугируют и удаляют надосадочную жидкость.
Ресуспендируют осадок в лизирующем буфере (100 мМ NaCl, 10 мМ Трис (рН 8,0), 25 мМ ЭДТА (рН 8,0), 1,5% SDS), на 3 среза 300 мкл. Добавляют протеиназу К из расчета 50 мкг на 100 мкл буфера (обычно протеиназа хранится в стоковом растворе 20 мкг/мкл). Инкубируют при 55°С в течение 24-48 часов до полного лизиса тканей при периодическом перемешивании. Если после 24-часового инкубирования ткани полностью не лизировались, то добавить еще столько же раствора протеиназы.
Белки экстрагируют фенолом. При этом фенольная фракция остается в нижней фазе у дна пробирки. После этого центрифугируют 5 мин на максимальной скорости. Водную фазу переносят в новую пробирку, а фенольную фазу (нижнюю) утилизируют. Проводят экстракцию смесью “фенол-хлороформ” с соотношением фенола к хлороформу 10:1. Центрифугируют 5 мин на максимальных оборотах, водную фазу переносят в новую пробирку, и добавляют к ней равный объем хлороформа. Перемешивают, центрифугируют 5 мин на максимальных оборотах. Водную фазу переносят в новую пробирку, нижнюю фазу утилизируют. К водной фазе добавляют 1/10 объема раствора 3 М натрия ацетата, рН 5,2, и 2 объема холодного 96%-ного этанола (2 объема, учитывая объем раствора соли). Перемешивают, выдерживают 2 часа на - 20°С.
Центрифугируют при +4°С 30 мин на максимальных оборотах (центрифуга Eppendorf Minispin, 13400 об/мин (10000g).
Осторожно удаляют супернатант, избегая лабилизации осадка ДНК. Стенки пробирки промывают 70%-ным этанолом, при необходимости центрифугируют (в случае лабилизации осадка), спирт удаляют, осадок подсушивают на воздухе. Используют. Для хранения растворяют в воде или ТЕ-буфере, хранят в холодильнике при - 80°С.
Выделение ДНК из плазмы крови.
ДНК из плазмы выделяли фенольным методом, после предварительной обработки протеиназой К. Предварительно добавляли к плазме одну часть двукратного лизирующего буфера (1% додецилсульфат натрия, 500 мМ Трис-Cl, рН 8.0, 20 мМ EDTA, рН 8.0, 10 мМ NaCl) и протеиназу К до концентрации 500 мкг/мл, затем выдерживали в течение ночи при 55°С. Для экстракции белков добавляли равный объем фенола, уравновешенного буфером (50 мМ Трис-Cl, рН 8.0, 10 мМ EDTA, рН 8.0). Встряхивали 5-10 мин и центрифугировали 10 мин при 3500g при +4°С. Собирали верхнюю фазу, содержащую ДНК, и следующую стадию депротеинизации проводили равным объемом смеси фенол-хлороформ, встряхивая смесь 5-10 мин, и цетрифугировали 10 мин в тех же условиях. Третью депротеинизацию проводили аналогично второй, но использовали чистый хлороформ. Для осаждения ДНК к водной фазе добавляли 10 М раствор ацетата аммония в соотношении 1:5, а в качестве соосадителя использовали линейный полиакриламид, очищенный двукратным переосаждением в этаноле, в конечной концентрации 25 мкг/мл, и проводили спиртовое осаждение ДНК, добавляя 2 объема 96%-ного этанола и выдерживая смесь при -20°С в течение 2 часов. Осадок ДНК собирали центрифугированием в течение 30 мин.
Далее осадок промывали 1 мл 70%-ного этанола и после центрифугирования подсушивали в вакууме в концентраторе фирмы Эппендорф (модель 5301). Далее растворяли осадок в 50 мкл ТЕ буфера (50 мМ Трис-Cl, рН 8.0, 10 мМ EDTA, рН 8.0) и хранили на - 80°С.
Бисульфитная модификация ДНК из биологических образцов для последующих метилспецифической ПЦР генов р16, E-cadherin, GSTP1.
Принцип метода метилспецифической полимеразной реакции.
В основе метода МС-ПЦР лежит бисульфитная обработка анализируемой ДНК, приводящая к конверсии незащищенных оснований цитозина в урацил и сохранении защищенного метильной группой 5-метилцитозина с последующей ПЦР со специфичными к модифицированной последовательности праймерами. (Singal, R., and Ginder, Ginder, G.D. DNA methylation. Blood, 93: 4059-4070, 1999). Учитывая что белки могут экранировать основания цитозина и препятствовать бисульфитной конверсии цитозина в урацил, использовали только препараты ДНК, выделенные с применением протеиназы К для исключения ложно-положительных результатов.
Бисульфитная обработка и очистка модифицированной ДНК.
Реакция бисульфитирования проходит только на однонитевых фрагментах ДНК, для этого ДНК денатурируют в щелочной среде. Образец ДНК, разведенный в 18 мкл деионизованной воды, денатурировали добавлением 2 мкл 3 М NaOH. Инкубировали при 37°С, 30 минут (конечная концентрация NaOH - 0,3 М).
Бисульфитную конверсию проводили добавлением 208 мкл 2 М метабисульфита натрия (NаНСО3), рН 5.0 и 12 мкл 10 мМ гидрохинона. Смесь инкубируют 16 ч при 50°С. Далее очистку модифицированной ДНК проводили сорбцией на мелкопористом стеклянном порошке фирмы Sigma. Для этого вначале добавляли 2 объема лизирующего буфера 6 М гуанидинизотиоционат, 0,05 М трис НСl рН 5,0, тщательно встряхивая пробирку на вортексе. Добавляли 10 мкл 10% суспензии сорбента (перед добавлением сорбент тщательно ресуспендируют). Оставляют пробирку при комнатной температуре на 10 мин, регулярно переворачивая пробирку в течение этого времени этого времени каждые 2 мин для предотвращения оседания сорбента. Осаждают сорбент кратковременным (30 сек) центрифугированием при 100 об/мин, как можно тщательнее отбирают супернатант. Добавляют 200 мкл 70%-ного этанола, встряхивают для перемешивания или пептируют до образования равномерной взвеси. Осаждают сорбент кратковременным (30 сек) центрифугированием при 1000 об/мин, как можно тщательнее отбирают супернатант.
Добавляют к осадку 200 мкл 70%-ного этанола для промывки и суспендируют осадок до гомогенного состояния. Осаждают сорбент кратковременным (30 сек) центрифугированием при 1000 об/мин, как можно тщательнее отбирают супернатант. После последней промывки просушивают осадок на воздухе в течение 10 мин. Добавляют к осадку 50 мкл ТЕ буфера, перемешивают и инкубируют 10 мин при 56°С. Осаждают сорбент продолжительным (4 мин) центрифугированием при 10000 об/мин. Переносят супернатант, содержащий препарат ДНК, в другую пробирку.
Далее освобождаются от сульфонатов в образце ДНК. Для этого добавляют 3 М NaOH, инкубируют 15 мин при 37°С. Добавляют 20 мкл раствора 10 М раствора ацетата аммония с рН 7,0, 1 мкл раствора 0,2%-ного гликогена и 200 мкл 96%-ного этанола. Помещают пробирку на 1-2 часа на -20°С. Затем центрифугируют 15 мин при максимальных оборотах. Отбирают надосадочную жидкость. Промывают осадок 200 мкл 70%-ного этанола, подсушивают при комнатной температуре и растворяют в 50 мкл ТЕ буфера.
Пробы сразу используют для проведения ПЦР или сохраняют при -80°С до анализа. Проводят одновременно оценку гиперметилирования 3 генов из одного образца ДНК после бисульфитной модификации. Для анализа каждого гена используют по 3 мкл ДНК в реакционную смесь конечным объемом 25 мкл.
Метилспецифическая полимеразная цепная реакция (МС-ПЦР).
МС-ПЦР использовали для амплификации анализируемых последовательностей генов р16, E-cadherin и GSTP1. ПЦР проводили в аппарате Eppendorf Mastercycler no следующей общей схеме: К 3 мкл ДНК добавляли 22 мкл буфера для ПЦР, содержащего по 1 мкл 200 мкМ каждого дезоксирибонуклеотидтрифосфата, по 3 мкл раствора каждого олигонуклеотида-праймера, 2 мкл 20 mM MgCl2, 10 ед. термофильной ДНК-полимеразы в 2 мкл, 5 мкл 5х, буфера, 6 мкл деионизованной воды (Herman, J.G., Graff, J.R., Myohanen, S., Nelkin, B.D., and Baylin, S.B. Methylation - specific PCR: a novel PCR assay for methylation status of CpG islands. Proc. Natl. Acad.Sci USA, 93: 9821-9826, 1996).
Далее режимы ПЦР и праймеры, используемые для метилированной и неметилированной формы каждого анализируемого гена, являются индивидуальными.
Анализ статуса метилирования гена р16 с помощью МС-ПЦР.
В реакции используется ПЦР для анализа модифицированной бисульфитом ДНК на присутствие метилированной и неметилированной аллелей гена p16INK4a. Последовательности праймеров для анализа гиперметилирования гена р 16
При анализе гена р16 образца анализируемой ДНК берут две пробирки объемом 0,5 мл для проведения ПЦР и в каждой по 3 мкл раствора и ДНК исследуемой. В одну пробирку добавляют 22 мкл реакционной смеси, как указано выше, для амплификации метилированной последовательности, содержащей 15 пМ праймера р16Ма в 3 мкл, 15 пМ праймера р16Мb обратного праймера в 3 мкл, в другую 18 мкл реакционной смеси для амплификации неметилированной последовательности (3 мкл праймера р16Ua, 3 мкл - 15 пМ праймера р16Ub - обратного праймера).
Встряхивают пробирки на вортексе и осаждают кратковременным центрифугированием, добавляют по одной капле минерального масла и помещают в термоциклер для проведения ПЦР по следующим программам:
Для метилированной последовательности:
1. 94°С 5 мин
3. 65°С 3 мин
4. 72°С 5 мин
Для неметилированной последовательности:
1. 94°С 5 мин
3. 57°С 3 мин
4. 72°С 5 мин
Смешивают образцы после амплификации с краской для электрофореза и наносят на 10% полиакриламидный гель, проводят электрофорез до достижения лидирующим красителем нижнего края геля. Окрашивают гель бромистым этидием в течение 15 мин и оценивают результат просматриванием геля на трансиллюминаторе. При этом размер амплификата метилированного гена составляет 150 пар нуклеотидов (п.н.), а размер амплификата неметилированного гена 151 п.н.
Для проверки биологического образца для анализа проводили ПЦР до бисульфитной конверсии ДНК с праймерами p16Wa и p16Wb, что подтверждает пригодность образца для ПЦР анализа в таких же условиях. ПЦР-амплификат размером 140 п.н.
В случае оценки выявления гиперметилированной формы гена р16 в образце ДНК из плазмы крови, где она может быть представлена в малых количествах на ранних стадиях онкологического заболевания используют нестед-ПЦР (гнездовой ПЦР) с ДНК после бисульфитной конверсии с праймерами p16Nb, 273 п.н., а далее 3 мкл амплификата вносили как обычно для второй ПЦР с праймерами р16Ма и р16Мb, как указано выше (150 п.н.).
Анализ статуса метилирования гена Е-кадхерина (E-cadherine)
В реакции используется ПЦР для анализа модифицированной бисульфитом ДНК на присутствие метилированной и неметилированной аллелей гена E-cadherine. Последовательности праймеров для анализа гиперметилирования гена E-cadherine
Е-Ма ggT gAA TTT TTA gTT AAT TAg Cgg TAC
E-Mb CAT FFC TAA CCg AAA ACg CCg
Продукт - 204 bp
E-Ua ggT Agg TgA ATT TTT AgT TAA TTA gTg gTA
E-Ub ACC CAT AAC TAA CCA AAA ACA CCA
Продукт - 211 bp
При анализе гена E-cadherine образца анализируемой ДНК берут две пробирки объемом 0,5 мл для проведения ПЦР и в каждой по 3 мкл раствора и ДНК исследуемой. В одну пробирку добавляют 22 мкл реакционной смеси, как указано выше, для амплификации метилированной последовательности, содержащей 15 пМ праймера Е-Ма, 15 пМ праймера E-Mb обратного праймера, в другую 18 мкл реакционной смеси для амплификации неметилированной последовательности (15 пМ праймера E-Ua, 15 пМ праймера Е Ub - обратного праймера).
Встряхивают пробирки на вортексе и осаждают кратковременным центрифугированием, добавляют по одной капле минерального масла и помещают в термоциклер для проведения ПЦР по следующим программам:
Отжиг праймеров - 57°С - 40 секунд
Элонгация - 72°С - 40 секунд
Денатурация - 95°С - 50 секунд
35 циклов
Смешивают образцы после амплификации с краской для электрофореза и наносят на 10% полиакриламидный гель, проводят электрофорез до достижения лидирующим красителем нижнего края геля. Окрашивают гель бромистым этидием в течение 15 мин и оценивают результат просматриванием геля на трансиллюминаторе. При этом размер амплификата метилированного гена составляет 204 пар нуклеотидов (п.н.), а размер амплификата неметилированного гена 211 п.н.
Анализ гиперметилирования гена GSTP1 (глутатион-S-трансферазы Р1)
Анализ гиперметилирования проводится с использованием праймеров предложенных Геслом и др. (Goessi et al., 2001).
В предлагаемом способе определяют оптимальные условия проведения МС-ПЦР и исключают возможность ложноположительных результатов, учитывая перспективность исследования плазмы крови и клеточного осадка мочи больных для дифференциальной диагностики аденомы и аденокарциномы предстательной железы, а в ряде случаев также при оценке онкологических процессов при гепатомах, опухолях молочной железы и других.
В качестве положительного контроля - источника ДНК с гиперметилированной формой гена GSTP1 использовали линию клеток человека LnСар, где ген находится в гиперметилированной форме, а в качестве отрицательного контроля - линию клеток человека Du 145, где имеется нормальный статус метилирования (Hidefumi Kinoshita, Yan Shi, Carol Sandefur, Lorraine F.Meisner, Chawnshang Chang Methylation of the Androgen Receptor Minimal Promoter Silences Transcription in Human Prostate Cancer (Cancer Res 60, 3623-3630, July 1, 2000). Кроме того, в качестве положительного контроля использовали образцы ДНК больных аденокарциномой предстательной железы с выявленным присутствием гиперметилированной формы гена GSTP1, предоставленные профессором Мюллером (Свободный Берлинский Университет).
Последовательность времени и температур: для гена GSTP1.
1. Активация полимеразы 94°С (3 мин)
2. Отжиг праймеров
(специфическая гибридизация с последовательностью
ДНК матрицы). 59°С (30 сек)
2.1. Синтез цепей. Элонгация 72°С (30 сек)
2.2. Плавление. 94°С (30 сек)
3. Избыточный отжиг 59°С (30 сек)
3.1 Избыточный синтез. 72°С (30 сек)
Праймеры к последовательности дикого типа немодифицированной ДНК.
GWS 5’ - GACGCCCGGGGTGCAGCGGCCGCC 3’ - SENSE
GWA 5’ - CCGCCCCAGTGCTGAGTCACGGCG 3’ - ANTISENSE
Праймеры к неметилированной последовательности модифицированной ДНК.
GUS 5’ - GATGTTTGGGGTGTAGTGGTTGTT 3’ – SENSE
GUA 5’ - CCACCCCAATACTAAATCACAACA 3’ - ANTISENSE
Праймеры к метилированной последовательности модифицированной ДНК.
GMS 5’ - TTCGGGGTGTAGCGGTCGTC 3’ – SENSE
GMA 5’ - GCCCCAATACTAAATCACGACG 3’ - ANTISENSE
Электрофорез продуктов амплификации гена GSTP1
Электрофорез продуктов амплификации проводили в 10% полиакриламидном геле, в вертикальном аппарате, в условиях как описано выше. Был использован маркер длины фрагментов ДНК (MB - 50-Base Pair Ladder 1 mg/ml (с шагом 50 пар нуклеотидов) в лунке.
Электрофорез проводили при постоянной силе тока 20 мА. Для визуализации фрагментов ДНК в геле выдерживали гель в водном растворе бромистого этидия (Sigma, Molecular Biology Grade) (10 мкл этидия бромида (10 мг/мл) в 100 мл дистиллированной воды). Затем просматривали гель на трансиллюминаторе и переносили данные на компьютер при помощи видеосистемы GeneScan (DNA-Technology).
Диагностику осуществляют следующим образом.
Если ДНК биологического образца содержит гиперметилированную форму одного из трех генов, двух из трех генов или всех трех генов, то этот биологический образец возможно имеет опухолевое происхождение.
Если ДНК из клеток крови не содержит гиперметилированных форм одного из трех генов, двух из трех генов или всех трех генов, а ДНК из плазмы крови содержит гиперметилированную форму одного из трех генов, двух из трех генов или всех трех генов, то это обозначает присутствие опухоли в организме.
Если ДНК из плазмы крови содержит гиперметилированную форму одного из трех генов, двух из трех генов или всех трех генов, то это обозначает присутствие опухоли в организме.
Если ДНК из опухоли содержит гиперметилированные формы одного из грех генов, двух из трех генов или всех трех генов, а ДНК из плазмы крови и не содержит гиперметилированную форму одного из трех генов, двух из трех генов или всех трех генов, после оперативного удаления опухоли или иного лечения, то это означает отсутствие или присутствие очень малого числа оставшихся опухолевых клеток в организме.
Если ДНК из опухоли содержит гиперметилированные формы одного из трех генов, двух из трех генов или всех трех генов, и ДНК из плазмы крови содержит гиперметилированную форму тех же генов, после оперативного удаления опухоли или иного лечения, то это означает присутствие оставшихся опухолевых клеток в организме.
Если ДНК из опухоли содержит гиперметилированные формы одного из трех генов, двух из трех генов или всех трех генов, то это обозначает функциональную неполноценность соответствующего гена, что учитывается при назначении лечебных средств, эффективность которых зависит от состояния перечисленных генов.
Если ДНК из клеток крови содержит гиперметилированные формы одного из трех генов, двух из трех генов или всех трех генов, и ДНК из плазмы крови содержит гиперметилированную форму одного из трех генов, двух из трех генов или всех трех генов, то это обозначает возможность онкогематологического заболевания.
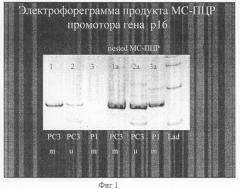
На фиг.1 представлена электрофореграмма продукта МЦ-ПЦР промотра гена р16. Использование нестед-ПЦР для усиления МС-ПЦР гиперметилированной формы гена р16 в ДНК биологических образцов. (ДНК плазмы крови от больной с 1 стадией опухоли молочной железы - T1N0M0).
1 - амплификат ДНК из культуры клеток человека РС3 (гиперметилированные по одному аллелю гена р16), при использовании праймеров для гиперметилированных генов;
2 - амплификат ДНК из культуры клеток человека РС3 (гиперметилированные по одному аллелю гена р16), при использовании праймеров для гена р16 с нормальным статусом метилирования;
3 - амплификат ДНК плазмы крови больной с опухолью молочной железы гиперметилирования не выявляется при использовании праймеров для гиперметилированных генов;
1а - амплификат ДНК из культуры клеток человека РС3 (гиперметилированные по одному аллелю гена р16), при использовании праймеров для гиперметилированных генов после предварительного обогащения нестед ПЦР;
2а - амплификат ДНК из культуры клеток человека РС3 (гиперметилированные по одному аллелю гена р16), при использовании праймеров для гена р16 с нормальным статусом метилирования после предварительного обогащения нестед ПЦР;
3а - амплификат ДНК плазмы крови больной с опухолью молочной железы выявляется гиперметилирование при использовании праймеров для гиперметилированных генов после предварительного обогащения нестед ПЦР;
Lad - маркеры размера ДНК.
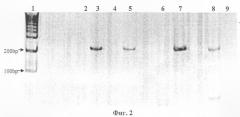
На фиг.2 представлена электрофореграмма продукта амплификации гена Е-cadherine.
Продукты амплификации гена E-cadherine после МС-ПЦР.
1 - маркеры размера ДНК, bр-пар нуклеотидов.
2, 3 - образцы ДНК клеток крови больного раком легких, с праймерами к метилированной (2) и неметилированной (3) последовательности ДНК соответственно.
4, 5 - образцы с ДНК из культуры клеток РС3 с нормальными аллелями, с праймерами к метилированной (4) и неметилированной (5) последовательности ДНК соответственно.
6, 7 - образцы с ДНК из культуры клеток MSF7 с нормальными аллелями, с праймерами к метилированной (6) и неметилированной (7) последовательности ДНК соответственно.
Выявлены гиперметилированные (дорожка 4) и нормальные (дорожка 3) формы гена Е-cadherine.
8-9 - образцы ДНК плазмы крови больного раком легких, с праймерами к метилированной (8) и неметилированной (9) последовательности ДНК соответственно.
Обнаружено гиперметилирование.
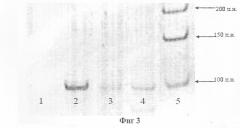
На фиг.3 представлена электрофореграмма продукта амплификации гена GSTP1.
1, 2 - образцы с ДНК клеточной линии LnCap (с гиперметилированным геном GSTP1 в обоих аллелях), с праймерами к неметилированной и метилированной последовательности ДНК соответственно.
3, 4 - образцы с ДНК клеточного осадка мочи больного с аденокарциномой предстательной железы, с праймерами к метилированной и неметилированной последовательности ДНК соответственно. Выявлены гиперметилированные (дорожка 4) и нормальные (дорожка 3) формы гена GSTP1.
5 - маркеры размера ДНК.
Конкретные примеры выполнения способа диагностики онкологических заболеваний.
Пример 1.
Больная А. с кистостозно-фиброзной мастопатией обратилась для диагностики возможной опухоли по анализу гиперметилированных генов опухолевого происхождения. При выполнении анализа статуса метилирования гена р16 было выявлено, что в условиях предварительного обогащения нестед ПЦР в образце ДНК из плазмы крови выявляется гиперметилированная форма гена р16 (фиг.1). При дальнейшем клиническом обследовании, биопсии и последующей операции морфологически установлено наличие аденокарциномы молочной железы в 1-й стадии, что подтверждает возможность диагностики.
Пример 2.
У больного Д. с жалобами на длительный период кашля и небольшое повышение температуры по вечерам, а также признаками гепатита в плазме крови обнаружена гиперметилированная форма гена E-cadherine, а в клетках крови не обнаружено гена Е-cadherine (фиг.2). При дальнейшем обследовании в плазме крови обнаружено стократное превышение концентрации ракового антигена, а клинически по компьютерной томографии грудной клетки обнаружена опухоль легкого. Далее установлено наличие отдаленных метастазов в печени. Оказалось, что больной имеет уже четвертую стадию онкологического заболевания с отдаленными метастазами.
Пример 3.
Больной В. с аденомой предстательной железы был проанализирован на наличие гиперметилированной формы гена GSTP1 в ДНК из клеточного осадка мочи. Обнаружено наличие гиперметилированной и нормальной формы гена GSTP1 в этом образце. Последующая биопсия в нескольких точках позволила морфологически обнаружить очаг аденокарциномы предстательной железы в аденоме (фиг.3).
Пример 4.
Больная Ф. с кистозно-фиброзной мастопатией была проанализирована на наличие гиперметилированных форм перечисленных трех генов. Выявлено наличие гиперметилированных форм гена р16 и GSTP1 в ДНК плазмы крови. Не выявлено гиперметилированной формы гена E-cadherine. В клетках крови гиперметилированных форм указанных трех генов не найдено. В последующем наличие опухоли молочной железы подтверждено клинически проведенной биопсией. В удаленной опухолевой ткани также выявлены гиперметилированные формы гена р 16 и GSTP1, но не E-cadherine.
Предлагаемым способом было исследовано около 200 образцов, более чем в 95% случаев диагнозы были подтверждены известным решением в случае положительного анализа.
Полученные нами результаты свидетельствуют о возможности использования предлагаемого способа диагностики онкологических заболеваний в диагностических лабораториях с повышением точности и удешевления диагностики с использованием отечественных реактивов для проведения модификации ДНК и перспективности исследования ДНК биологических образцов на оценку статуса метилирования трех перечисленных генов.
Способ диагностики онкологических заболеваний, характеризующийся тем, что одновременно измеряют статус метилирования трех генов р16, Е-cadherine и GSTP1 в любых биологических образцах человека, взятых из плазмы крови, мочи, лимфоузлов, опухолевой ткани, межтканевой жидкости, асцитной жидкости, клеток крови и буккального эпителия, анализируют ДНК, в которой присутствуют модифицированные гены опухолевого происхождения в любых образцах, в которые могут попадать опухолевые клетки или их компоненты, содержащие дефектные гены, причем анализ осуществляют путем экстрагирования и очистки ДНК из биологических образцов с последующей бисульфитной обработкой этой ДНК для модификации незащищенных цитозиновых оснований при сохранении 5-метилцитозина, представляющего собой защищенное цитозиновое основание, последующего ПЦР анализа обработанных и необработанных бисульфитом исследуемых генов и при обнаружении изменений, полученных по результату электрофореза ПЦР амплификатов, путем выявления различия в числе и электрофоретической подвижности соответствующих фракций при сопоставлении с контрольными метилированными и неметилированными образцами, содержащими нормальные и гиперметилированные формы генов, диагностируют онкологические заболевания.