Антигенные препараты
Иллюстрации
Показать всеИзобретение относится к медицине и ветеринарии. Способы получения антигенных препаратов заключаются в том, что их получают из кератинофильных грибов рода Trichophiton или Microsporum или дрожжей рода Candida методами щелочного гидролиза. Полученные антигенные препараты могут быть использованы в качестве фармацевтических средств, в том числе вакцин, а также для лечения аллергии и модуляции иммунного ответа. 5 с. и 12 з.п.ф-лы, 4 ил., 12 табл.
Реферат
Настоящее изобретение относится к антигенным препаратам, включающим полисахариды и/или гликопептиды, получаемым из кератинофильных грибов, а также дрожжей, способам получения этих антигенных препаратов, их применению в качестве фармацевтических средств, так же, как к их применению в качестве вакцин, в том числе, но не ограничиваясь этим, для профилактики и лечения аллергии, а также для модуляции иммунного ответа.
Аллергия в той или иной форме поражает более 20% населения, и угрожающее возрастание ее распространения, заболеваемости и смертности за последнее десятилетие привело к тому, что аллергию стали считать болезнью номер один, связанной с окружающей средой (Sutton и Gould, Nature 1993, 366, стр.421-428). Люди и животные поражаются аллергией в одинаковой степени.
Ключевую роль в развитии аллергии играют иммунологические реакции (Paul, William Е. (редактор), Фундаментальная иммунология, Raven Press Books Ltd., Нью-Йорк, 1984). В принципе описаны два различных типа аллергических реакций. Один из них является аллергической реакцией немедленного типа (АРНТ), для которой максимальный аллергический ответ на аллерген наблюдается от минут до часов. Второй тип является аллергической реакцией замедленного типа (АРЗТ). В случае АРЗТ аллергический ответ на аллерген достигает своего максимума после 24 и до 48 часов. Скорее всего АРНТ опосредуется преимущественно через метаболизм IgE, в то время, как АРЗТ является более сложной. Похоже, что в развитие АРЗТ вовлечены другие опосредствованные клетками ответы (то-есть, В- и Т-лимфоцитами). Например, после переноса лимфоцитов и антител от животных-доноров с аллергией животным-реципиентам без аллергии у реципиентов развивалась АРЗТ (Askenase, P.W. (1973), J. exp. Med., 138, стр.1144-1155).
Вследствие непосредственного воздействия антигенов окружающей среды, тканями, наиболее подверженными аллергии, являются эпителиальные ткани, особенно кожа. Например, в клинике кожных болезней острый аллергический контактный дерматит и хроническая аллергическая контактная экзема составляют до 15% от всех кожных болезней. Аллергическая астма составляет 20% от всех случаев астмы у людей.
Аллергическими заболеваниями, которые могут быть классифицированы как АРНТ, являются, например, аллергическая экзема, аллергическая бронхиальная астма, поллиноз, ринит, конъюнктивит. Эти заболевания могут также развиться в хронические формы и их не следует рассматривать как исключительно зависимые от IgE реакции. Примерами АРЗТ являются острый аллергический дерматит как следствие контакта и хроническая аллергическая экзема в результате определенного контакта, которые далее могут быть классифицированы как АРЗТ (тип IV) с эпидермальным поражением. Такой пациент мог ранее стать чувствительным при контакте с аллергеном, и у него развилась повышенная чувствительность. Возобновленный контакт с аллергеном приводит к острому, подострому или хроническому воспалительному контактному дерматиту.
Примером аллергического дерматита по данным ветеринарной клиники является летняя экзема, называемая также "сладкий зуд" или "зуд после укуса маток пчел". Летняя экзема является аллергическим дерматитом лошадей, относящимся к атопической форме аллергических заболеваний (включающих реакции типа I и IV). Летняя экзема вызывается укусом мелких двукрылых насекомых семейств Culicidae и Ceratopgonidae и характеризуется повреждениями кожи с постоянными эрозиями и экссудатами, главным образом в районе гривы, хвоста и живота. У пораженных животных наблюдается сильная чувствительность кожи по отношению к раздражениям, то есть прикосновению, дождю, ветру и т.д., ухудшение их общего здоровья и активности. Что касается других видов аллергии, считают, что на развитие этого заболевания также влияют факторы, связанные с питанием. Симптомы этого заболевания наблюдаются только с марта до сентября, в то время как индуцируемая аллергеном чувствительность кожи наблюдается в течение всего года. Летняя экзема представляет интересную общую модельную систему для изучения аллергии и для разработки антиаллергических веществ.
В зависимости от клинической картины было предложено много вариантов лечения аллергии. Для лечения острого аллергического контактного дерматита, хронической аллергической контактной экземы и/или атопической экземы обычно применяются липофильные кремы, включающие глюкокортикостероиды, противомикробные вещества, противовоспалительные лекарства и/или кальций. Для лечения летней экземы различные соединения применяли местно или парентерально, например, стероидные препараты, инсектициды, различные галеновые лекарственные формы, салицилаты, масла или пептиды, выделенные из микроорганизмов. Все вышеупомянутые варианты лечения действуют только на симптомы, а не на причины аллергии.
Ослабленный иммунный ответ или иммунодефицитное состояние часто играет важную роль в развитии аллергии. Поэтому для лечения экземы, атопической экземы, кожных абсцессов, а также аутоиммунных заболеваний были использованы также иммунотерапевтические методы, например, введение иммуностимуляторов, как Bacille Calmette Guerin (BCG), левамизола и других стимуляторов (А.М.Чернуха (редактор), Коша, изд. "Медицина", 1982, Москва).
Для лечения красновато-коричневого аллергического дерматита было успешно применено введение производных от антител пептидов (английская заявка на патент №8913737). Для лечения атонической экземы с относительно хорошими результатами была также применена десенсибилизация (А.М.Чернуха (редактор), Коша, изд. "Медицина", 1982, Москва).
Несмотря на различные подходы к лечению аллергии, насколько нам известно, антигенные соединения, полученные из кератинофильных грибов или дрожжей, не применялись для лечения аллергии.
В контексте настоящего изобретения термин "растворимый" или "нерастворимый" относится к растворимости в водном растворе. Термин "антигенный препарат" относится к веществу любого состава, способному вызвать антигенный или иммуногенный ответ. Термин "модуляция иммунного ответа" относится к способности антигенных препаратов настоящего изобретения стимулировать или повысить иммунный ответ, например, как продемонстрировано их способностью стимулировать пролиферацию лимфоцитов в культуре клеток (подробный обзор можно найти у Strube и др. (1989) Vet. Med. Rev., 60, стр.3-15, у Buttner M. (1993) Соmр. Immun. Microbiol. Infect. Dis., 16, №1, стр.1-10).
Неожиданно недавно было обнаружено, что антигенные препараты, полученные из кератинофильных грибов или дрожжей, могут быть применены для профилактики и лечения аллергии, а также для модуляции иммунного ответа, в частности, у млекопитающих.
Разработаны способы получения антигенного материала из кератинофильных грибов, а также из дрожжей. Антигенные препараты, приготовленные в соответствии с этими способами, включают полисахариды и/или гликопептиды. Антигенные препараты могут быть использованы в виде фармацевтических композиций, а также в виде вакцин для лечения животных и людей, особенно для лечения аллергии и для модуляции иммунного ответа. Следует учитывать, что фармацевтические композиции данного изобретения могут быть полезны как иммунологически, так и фармакологически.
Антигенный материал согласно данному изобретению может также быть получен из производного от кератинофильных грибов или дрожжей материала, например, из клеточных стенок грибов или дрожжей.
Для получения антигенных препаратов согласно настоящему изобретению было разработано три различных способа. В соответствии с этими способами из кератинофильных грибов, а также дрожжей могут быть получены три различные антигенные фракции (ASMP, ANMP или АЕМР), которые в дальнейшем упоминаются как "фракции". На антигенные препараты, включающие более чем одну фракцию, в дальнейшем ссылаются как на "комплексный препарат" или сокращенно "комплекс".
Способ 1: Фракция, получаемая согласно этому способу, состоит из антигенного растворимого материала, включающего полисахарид и/или гликопептиды (ASMP). Кратко, этот способ, который подробно иллюстрируется примером 1, состоит в следующем.
Кератинофильные грибы или дрожжи культивируют на планшетах с агаром, например, как описано в европейском патенте 0564620. Предпочтительной средой является, например, агар с экстрактом солода фирмы Оксоид. Также могут быть использованы другие среды, обеспечивающие рост кератинофильных грибов или дрожжей. Получающуюся в результате грибковую биомассу извлекают и обрабатывают водным раствором щелочи. Предпочтительными водными щелочными растворами являются растворы едкого натра или едкого кали в предпочтительных концентрациях 0,1-5% (в/о). Щелочную обработку проводят предпочтительно при температуре от 20 до 150°С в течение времени до 30 часов. После обработки в водных щелочных условиях разделяют твердую и жидкую фазы препарата, например, путем центрифугирования, фильтрации или седиментации. Предпочтительно разделение осуществляют путем центрифугирования, которое обеспечивает хорошее отделение остатков грибковых клеток, например, при ускорениях около 3500 g. Обработку в водных щелочных условиях, а также стадию разделения можно повторять несколько раз.
После щелочной обработки образующуюся в результате надосадочную жидкость обрабатывают в кислых водных условиях, например, 0,2-1,5 М органической кислотой или 0,05-1 М минеральной кислотой. К примеру, могут быть использованы соляная кислота или уксусная кислота, предпочтительно при значениях рН между 2,5 и 4,5. Предпочтительно обработку в водных кислых условиях проводят от 2 до 4 часов при температуре от 4 до 8°С, после чего проводят разделение твердых и жидких слоев. Обработку в водных кислых условиях, а также стадию разделения можно повторять несколько раз, предпочтительно в условиях, указанных выше. Затем из надосадочной жидкости от стадии разделения осаждают нужный материал. Предпочтительно осаждение осуществляют при прибавлении подходящего органического растворителя, например спирта, как, например, низший алканол, к надосадочной жидкости, примерами таких спиртов являются метанол или этанол. При отношении 1 объем надосадочной жидкости к 2-5 объемам спирта достигается хорошее осаждение антигенного материала. Могут также быть применены другие методики осаждения без использования спирта, известные специалистам в этой области, например, осаждение с помощью сернокислого аммония или другой соли может также привести в результате к осаждению антигенного материала. Твердую фазу затем подвергают дальнейшей стадии разделения, предпочтительно в описанных выше условиях. Полученную в результате твердую фазу выделяют и, если это желательно, растворяют в водном растворе, предпочтительно в дистиллированной воде, обычно используют от 25 до 100 мл воды. Наконец, препарат ASMP может быть лиофилизован, а затем может храниться в течение продолжительного времени в безводных условиях.
Способ 2: Фракция, получаемая согласно этому способу, состоит из антигенного нерастворимого материала, включающего полисахарид и/или гликопептиды (ANMP). Кратко, этот способ, который подробно иллюстрируется примером 2, состоит в следующем.
Кератинофильные грибы или дрожжи культивируют на планшетах с агаром, например, как описано в европейском патенте 0564620. Предпочтительной средой является, например, агар с экстрактом солода фирмы Оксоид. Также могут быть использованы другие среды, которые обеспечивают рост кератинофильных грибов или дрожжей. Получающуюся в результате грибковую биомассу извлекают и обрабатывают водным раствором щелочи. Предпочтительными водными щелочными растворами являются растворы едкого натра и едкого кали в предпочтительных концентрациях 0,1-5% (в/о). Щелочную обработку осуществляют предпочтительно при 20-150°С в течение времени до 30 часов. После обработки в водных щелочных условиях разделяют твердую и жидкую фазы препарата, например, путем центрифугирования, фильтрации или седиментации. Предпочтительно разделение осуществляют при центрифугировании, которое обеспечивает хорошее отделение остатков клеток грибов, например, при ускорениях около 3500 g. Обработку в водных щелочных условиях, как и стадию разделения, можно повторять несколько раз. После щелочной обработки твердую фазу обрабатывают минеральными или органическими кислотами. Предпочтительно к твердой фазе прибавляют 0,2-1,5 М уксусную кислоту или 0,05-1 М соляную кислоту в течение от 0,5 часа до 3 часов при температуре от 70 до 100°С. После кислотной обработки твердую фазу промывают водным раствором, предпочтительно дистиллированной водой. Полезно повторять промывку около пяти раз. В заключении твердую фазу суспендируют в дистиллированной воде.
Способ 3: Фракция, получаемая согласно этому способу, состоит из антигенного экзогенного материала, включающего полисахарид и/или гликопептиды (АЕМР). Кратко этот способ, который подробно иллюстрируется примером 3, состоит в следующем.
Кератинофильные грибы или дрожжи инкубируют в водном растворе или культивируют в жидкой среде в течение определенного времени, вплоть до 240 часов (объем раствора или культуры обозначается здесь как первоначальный объем /ПО/). Можно использовать дистилированную воду (см. пример 3.1.) так же, как и среды, описанные в европейском патенте 0564620. После инкубирования или культивирования клетки грибов отделяют, например, путем центрифугирования, фильтрации или седиментации, предпочтительно при центрифугировании в условиях, описанных выше. Полученную в результате надосадочную жидкость затем подвергают лиофилизации и затем вещество после лиофилизации растворяют в воде.
Предпочтительно объем воды составляет от 0,1 до 0,2 объема от ПО. Полученный в результате раствор подвергают процессу осаждения. Предпочтительно осаждение осуществляют путем прибавления к отстоявшейся жидкости подходящего органического растворителя, например, спирта, такого как низший алканол, например, метанол или этанол. Отношение одного объема отстоявшейся жидкости к 2-5 объемам спирта приводит к хорошему осаждению антигенного материала. Специалистам известно, что могут быть также применены другие методики осаждения без использования спирта, например, осаждение с помощью сернокислого аммония или другой соли также может привести к отделению антигенного материала. Полученный в результате осадок отделяют и, если желательно, растворяют в водном растворителе, предпочтительно в дистиллированной воде. Предпочтительно растворяют от 0,5 до 50 мг осадка в 1 мл водного растворителя. Наконец, раствор АЕМР может быть лиофилизован и храниться в течение продолжительных периодов в безводных условиях, преимущественно при температуре от 2 до 10°С.
Предпочтительными родами грибов, из которых получают обозначенные выше фракции, являются роды Trichophyton, Microsporum или Candida. Предпочтительными видами являются:
Trichophyton equinum,
Trichophyton mentagrophytes,
Trichophyton sarkisovii,
Trichophyton verrucosum,
Microsporum canis,
Microsporum gypseum или
Candida albicans.
Предпочтительными штаммами вышеупомянутых видов являются:
Trichophyton equinum "Немецкой Коллекции Микроорганизмов и Клеточных Культур ГмбХ" (НКМ) №7276,
Trichophyton mentagrophytes HKM №7279,
Trichophyton sarkisovii HKM №7278,
Trichophyton verrucosum HKM №7277,
Microsporum canis HKM №7281,
Microsporum canis var. obesum HKM №7280,
Microsporum canis var. distortum HKM №7275,
Microsporum gypseum HKM №7274 или
Candida albicans HKM №9656.
Все вышеупомянутые штаммы были депонированы заявителем в НКМ (Mascheroder Weg 1B, D-38124 Брауншвейг, Германия) согласно постановлениям Будапештского Договора о депонировании микроорганизмов. Все штаммы, кроме Candida albicans HKM №9656, были описаны ранее в заявке на патент СССР №5006861, поданной 21.10.1991, и соответствующих заявках, т.е. в опубликованной заявке на европейский патент 0564620, поданной 17.10.1992.
В зависимости от видов, из которых могут быть получены фракции, последние обозначаются в соответствии с нижеследующим:
Фракции, полученные из:
(i) Trichophyton equinum, обозначаются как ASMP-TE, ANMP-TE или АЕМР-ТЕ,
(ii) Trichophyton mentagrophytes, обозначаются как ASMP-TM, ANMP-TM или АЕМР-ТМ,
(iii) Trichophyton sarkisovii, обозначаются как ASMP-TS, ANMP-TS или AEMP-TS,
(iv) Trichophyton verrucosum, обозначаются как ASMP-TV, ANMP-TV или AEMP-TV,
(v) Microsporum canis, обозначаются как ASMP-MC, ANMP-MC или АЕМР-МС,
(vi) Microsporum gypseum, обозначаются как ASMP-MG, ANMP-MG или AEMP-MG или
(vii) Candida albicans, обозначаются как ASMP-CA, ANMP-CA или АЕМР-СА.
Там, где дается информация относительно специфического штамма, вслед за аббревиатурой для штаммов приводятся номера специального депозита НКМ, например, АЕМР-СА9656 относится к фракции АЕМР, получаемой из штамма Candida albicans НКМ №9656.
Фракции, получаемые, как указано в любом из вышеописанных способов (1-3), включают, как минимум, один простой антиген, приготавливаемый из, как минимум, одного гриба, на которые ссылаются выше. Антигенные препараты настоящего изобретения включают, как минимум, одну из обозначенных выше фракций или их комбинаций.
Антигенные препараты (ASMP и АЕМР), как описано в примерах 1 и 3:
1) включают моносахариды, аминокислоты и нуклеотиды, которые в большой степени соединяются в полимерные структуры и в меньшей степени присутствуют в виде свободных мономеров.
2) в основном состоят из отдельных моносахаридных элементов: маннозы, галактозы, глюкозы и ксилозы и других в различных относительных количествах.
3) содержат смесь полимерных структур, образованных значительным количеством этих моносахаридов. Молекулярные массы значительной части этих полимерных структур более 20000 кДа.
4) содержат небольшие количества свободных или связанных аминокислот.
5) содержат небольшие количества молекул ДНК, которые, как показано, подвергаются ферментативному гидролизу дезоксирибонуклеазой I.
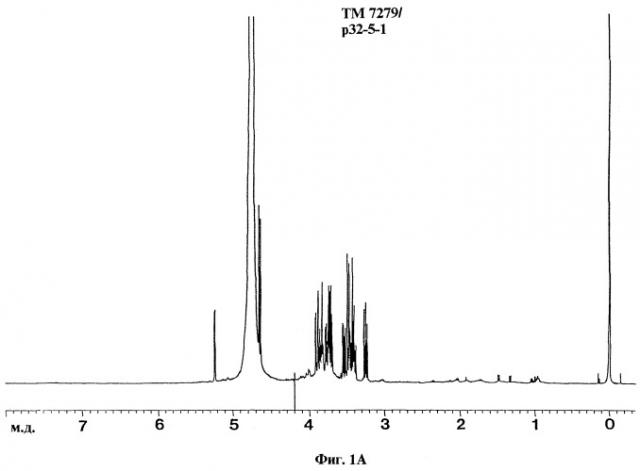
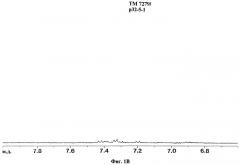
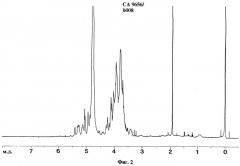
При ЯМР-спектроскопии антигенных препаратов ASMP и АЕМР получают спектрограммы ЯМР, представленные на фиг.1-4.
Химические сдвиги и мультиплетности сигналов (просуммированы в таблице 12) находятся в соответствии с литературными данными для углеводов и аминокислот.
Для фракций АЕМР и ASMP, например, MG 7274, ТМ 7279 и СА 9656, сигналы протонов углеводов находятся в области от 3,2 м.д. до 5,5 м.д., сигналы протонов аминокислот в области от 0,75 м.д. до 3,45 м.д. (без α-протонов).
Для ASMP также наблюдают типичные сигналы при 1,92 м.д. для протонов метильной группы ацетата.
Для фракций АЕМР также наблюдают типичные сигналы для протонов дисахаридов и аминокислот. Например, в спектре ТМ 7279 наблюдают сигналы протонов ароматических аминокислот, как фенилаланин, тирозин и триптофан, в области 7,15-7,9 м.д.
Что касается отдельных фракций ASMP или АЕМР, то предпочтительны концентрации от 0,1 до 50 мг/мл. В случае отдельных фракций ANMP предпочтительны концентрации от 0,1 до 5% (о/о).
В предпочтительных вариантах осуществления изобретения антигенные препараты настоящего изобретения включают, например, следующие комбинации фракций (комплексы):
Комплекс 1 включает ASMP-TM и ASMP-MG, и ASMP-CA. Предпочтительно концентрация каждой фракции составляет от 0,1 до 50 мг/мл. Высокопредпочтительным вариантом осуществления изобретения в отношении комплекса 1 является комбинация ASMP-ТМ 7279, ASMP-MG7274 и ASMP-CA9656.
Комплекс 1.1 включает ASMP-MG и ASMP-CA. Предпочтительно концентрация каждой фракции составляет от 0,1 до 50 мг/мл. Высокопредпочтительным вариантом осуществления изобретения в отношении комплекса 1.1 является комбинация ASMP-MG7274 и ASMP-CA9656.
Комплекс 2 включает ANMP-TM и ANMP-MG, и ANMP-CA. Предпочтительно концентрация каждой фракции составляет от 0,1 до 5% (о/о). Высокопредпочтительным вариантом осуществления изобретения в отношении комплекса 2 является комбинация ANMP-TM7279, ANMP-MG7274 и ANMP-CA9656.
Комплекс 3 включает АЕМР-ТМ и AEMP-MG, и АЕМР-СА. Предпочтительно концентрация каждой фракции составляет от 0,1 до 50 мг/мл. Высокопредпочтительным вариантом осуществления изобретения в отношении комплекса 3 является комбинация АЕМР-ТМ7279, AEMP-MG7274 и АЕМР-СА9656.
Комплекс 4 включает ANMP и АЕМР. Предпочтительны следующие комбинации фракций: (1) ANMP-CA и АЕМР-ТМ или (2) ANMP-MG, ANMP-TM и АЕМР-ТМ. Предпочтительно концентрация ANMP составляет от 0,1 до 5% (о/о), а концентрация АЕМР от 0,1 до 50 мг/мл. Высокопредпочтительными вариантами осуществления изобретения в отношении комплекса 4 являются следующие комбинации:
4.1 ANMP-CA9656 и АЕМР-ТМ7279;
4.2 ANMP-MG7274 и ANMP-TM7279, и АЕМР-ТМ7279.
Комплекс 5 включает ANMP и ASMP. Предпочтительной является комбинация ANMP-MG и ANMP-TM, и ASMP-CA. Предпочтительно концентрация индивидуальных фракций ANMP составляет от 0,1 до 5% (о/о), а концентрация индивидуальных фракций ASMP составляет от 0,1 до 50 мг/мл. Высокопредпочтительной является комбинация ANMP-MG7274 и ANMP-TM7279, и ASMP-CA9656.
Другие предпочтительные антигенные комплексы согласно настоящему изобретению включают, например, ASMP и АЕМР или ASMP и АЕМР, и ANMP в концентрациях для ASMP и АЕМР от 0,1 до 50 мг/ мл, а для ANMP от 0,1 до 5% (о/о).
Антигенные препараты настоящего изобретения могут быть применены вместе с подходящими физиологически приемлемыми носителями, которые не вызывают нежелательные физиологические побочные эффекты и включают буферы, растворы или адъюванты, например, растворы солей, растворы лактата или раствор Рингера. Предпочтительными носителями являются, например: носитель А: водный раствор, включающий 0,85% (в/о) хлористого натрия; носитель Б: водный раствор, включающий 5% (в/о) глюкозы, 0,3% (в/о) мясного экстракта "lab-lemco" (Оксоид) и 0,1% (в/о) дрожжевого экстракта (Оксоид); носитель В: среда RPMI 1640 (приобретена в фирме Серва, каталожный №12-702).
Антигенные препараты настоящего изобретения могут быть применены в чистом виде сами по себе или в виде растворов для инъекций, кремов, распыляемых растворов, аэрозолей, таблеток или других форм, известных специалистам в этой области. Антигенные препараты настоящего изобретения могут быть далее использованы для получения высокоэффективных вакцин.
Антигенные препараты настоящего изобретения способны стимулировать пролиферацию клеток иммунной системы и, таким образом, способны модулировать иммунный ответ. Антигенные препараты настоящего изобретения далее способны ингибировать пролиферацию человеческих кератиноцитов.
Антигенные препараты настоящего изобретения могут придавать высокую степень резистентности против аллергических реакций, в частности, эпителиальных тканей и особенно кожи. Они представляют интерес для предотвращения и лечения аллергии и, как показал наш опыт, не оказывают неблагоприятных побочных эффектов, как продемонстрировано in vivo на лабораторных животных (т.е. морских свинках и белых мышах) и лошадях (т.е. на первом поколении от скрещивания различных пород и на исландских лошадях).
В частности, острый аллергический дерматит и поражения кожи могут эффективно лечиться без побочных эффектов путем введения антигенного препарата по настоящему изобретению, т.е., путем вакцинации. После внутримышечной инъекции (инъекций) антигенных препаратов настоящего изобретения могут исчезнуть симптомы аллергического воспаления кожи, зуд и чувствительность кожи пациентов, пораженных аллергическим дерматитом. Полное освобождение от всех аллергических симптомов достигалось в течение 2-8 недель после последней инъекции, исчезала вызванная аллергеном чувствительность кожи к раздражителям. Далее, в течение 1-6 недель после последней инъекции зуд мог быть прекращен.
В предпочтительном варианте осуществления изобретения антигенные препараты согласно настоящему изобретению обеспечивают защиту и лечение от так называемой летней экземы лошадей, особенно исландских лошадей. После 1-3 внутримышечных или интрадермальных инъекций антигенных препаратов настоящего изобретения лошади, пораженные летней экземой, могут быть вылечены или предохранены от летней экземы, предпочтительными являются комплексы 1 и 1.1.
В другом предпочтительном варианте осуществления изобретения антигенные препараты данного изобретения обеспечивают защиту и лечение при алопеции у млекопитающих. После 1-3 внутримышечных или интрадермальных инъекций антигенных препаратов согласно данному изобретению млекопитающие, пораженные алопецией, могут быть вылечены или предохранены от нее, предпочтительны комплексы 1 или 1.1.
В другом предпочтительном варианте осуществления изобретения антигенные препараты по данному изобретению улучшают состояние волос и сезонную смену покрова млекопитающих. После 1-3 внутримышечных или интрадермальных инъекций может быть значительно улучшен покров, и у отдельных особей с неполной сменой покрова может происходить полная смена покрова до нормального, соответствующего сезону, предпочтительными являются комплексы 1 или 1.1.
По другому предпочтительному варианту осуществления изобретения антигенные препараты настоящего изобретения обеспечивают предохранение от экземы и лечение экземы. После 1-3 интрадермальных или внутримышечных инъекций антигенных препаратов по данному изобретению или после местного лечения указанными антигенными препаратами млекопитающие, т.е. люди, пораженные экземой, могут быть вылечены или предохранены от экземы, предпочтительными являются фракции ASMP-MG, ASMP-CA и ASMP-TM, т.е., ASMP-MG7274, ASMP-CA9656 и ASMP-TM7279 или комплексы 1 и 1.1.
Далее в предпочтительном варианте осуществления изобретения антигенные препараты данного изобретения обеспечивают предохранение и лечение от нейродермита. После топического лечения антигенными препаратами данного изобретения млекопитающие, т.е. люди, пораженные нейродермитом, могут быть вылечены или предохранены от него, предпочтительными являются фракции ASMP-MG, ASMP-CA и ASMP-TM, т.е., ASMP-MG7274, ASMP-CA9656 и ASMP-TM7279 или комплексы 1 и 1.1.
Антигенные препараты представленного изобретения могут быть использованы для лечения при многих показаниях, таких как описанные в книге "Клиническая иммунология", Peter, H.H. (редактор), опубликованной в 1991 году Urban & Schwarzenberg, Мюнхен, Германия, например:
1. аллергические заболевания дыхательных путей
1.1. аллергический ринит и конъюнктивит
1.1.1. сезонный рино-конъюнктивит
1.1.2. многолетний ринит
1.2. бронхиальная астма
1.3. астматическое состояние
1.4. астма у детей
1.4.1. обструктивное заболевание легких после инфекционного бронхиолита
1.4.2. слабая эпизодическая или слабая многолетняя бронхиальная астма
1.4.3 сильная многолетняя бронхиальная астма
2. аллергический бронхолегочный аспергиллез
3. пищевые аллергии
3.1. опосредствованная IgE пищевая аллергия
3.1.1. опосредствованная IgE пищевая аллергия младенцев
3.1.2. опосредствованная IgE пищевая аллергия подростков и взрослых
3.2. опосредствованная IgG и Т-клетками пищевая аллергия
3.3. непереносимость коровьего молока
3.4. синдром Хейнера
3.5. эозинофильная гастроэнтеропатия
3.6. брюшное заболевание
4. аллергия с чувством жжения в результате укуса насекомого
5. крапивница всех видов
5.1. крапивница от контакта
5.2. крапивница, сопутствующая аллергическим реакциям
5.3. крапивница, сопутствующая непереносимости примесей и ингибиторов синтеза простагландина (псевдоаллергия)
5.4. соматическая крапивница
5.4.1. дермографизм (крапивница искусственная)
5.4.2. холинергическая и адренергическая крапивница
5.4.3. крапивница, вызванная холодом
5.4.4. крапивница от света
5.4.5. крапивница от давления
5.4.6. другие редкие формы соматической крапивницы
5.5. относящийся к крапивнице васкулит
5.6. лаброцитоз и относящаяся к крапивнице пигментация
5.7. крапивница, сопутствующая инфекционным заболеваниям
5.8. крапивница, сопутствующая иммунотиреоидиту
5.9. крапивница и амилоидоз
6. ангионевротический отек
6.1. наследственный ангионевротический отек (HANE)
6.2. приобретенный ангионевротический отек
7. атонический дерматит, атоническая экзема
8. лекарственная аллергия
| Таблица 1Свойства и характеристики Candida albicans HKM №9656 | ||
| Свойства и характеристики штамма | HKM №9656 | Эпидемический штамм №008 |
| Описание культуры | 10-дневная колония на агаре Сабуро является однородной кремовой, пастообразной, блестящей и возвышающейся, с центральной впадиной, край колонии нормальный, с диаметром 18-22 мм | 10-дневная колония на агаре Сабуро является однородной кремовой, пастообразной и блестящей со складчатыми сегментами, край колонии неправильной формы, с диаметром 15-18 мм |
| Морфологические характеристики | сферические овальные бластоспоры размером 3,5-5×5-8 мкм, псевдогифы шириной 5-8 мкм, гифы шириной 2-3 мкм. Хламидоспоры на рисовом агаре размером 13-16 мкм в диаметре | сферические овальные бластоспоры размером 3,5-5×5-8 мкм, псевдогифы шириной 5-8 мкм, гифы шириной 2-3 мкм. Хламидоспоры на рисовом агаре размером 13-16 мкм в диаметре |
| Патогенные характеристики | через 30 дней после внутрибрюшинной инъекции 10-100 миллионов грибковых клеток белым мышам у 80% животных имелись абдоминальные гранулемы, летальных эффектов не наблюдали | через 30 дней после внутрибрюшинной инъекции 10 100 миллионов грибковых клеток белым мышам у 80% животных имелись абдоминальные гранулемы, 40% животных погибли |
Настоящее изобретение далее относится к штамму Candida albicans HKM №9656, который был получен путем направленной селекции, основывающейся на стабилизации культуральных морфологических характеристик и аттенуации эпидемического штамма №008, который был выделен у человека в 1990 г.
Биологические свойства штамма Candida albicans HKM №9656 описываются в таблице 1.
Штамм Candida albicans HKM №9656 отличается далее от эпидемического штамма стабильностью популяции, морфологическими характеристиками при длительном пассаже через питательные среды и более низкой вирулентностью. Следуя указаниям для получения антигенных препаратов представленного изобретения, из этого штамма могут быть приготовлены высокоэффективные и безопасные антигенные препараты.
Специалист в данной области сразу оценит, что настоящее изобретение хорошо подходит для осуществления определенных задач и достижения конечных результатов, и оценит упомянутые и присущие этому изобретению преимущества. Описанные здесь соединения, методики и техника в данном случае представляют предпочтительные варианты осуществления изобретения, они приводятся в качестве примеров и не являются лимитирующими в определенных пределах.
После описания в общих чертах представленное изобретение будет еще более понятно, если обратиться к нижеследующим примерам, которые иллюстрируют настоящее изобретение, но не ограничивают его определенными рамками.
Примеры
Во всех примерах центрифугирование проводили при ускорениях между 3000 g и 3500 g в течение 30-50 минут. Среды были приобретены у фирмы Оксоид (Унипас ГмбХ, Am Lippeglacis 6-8, 46483 Весел, Германия) или Серва (Серва Файнбиокемика ГмбХ & Ко. КГ, Саrl-Benz-Str., 7, 69115 Гейдельберг, Германия). Если не указано иначе, грибы культивировали, как описано в каталоге Оксоида "5. Современное немецкое издание" или в европейском патенте 0564620. Штаммы грибов, используемые для приготовления антигенных препаратов согласно настоящему изобретению, получали при селекции и аттенуации штаммов грибов, как описано в книге Н.В.Мацкевича, 1981, "Спонтанная изменчивость и кариология несовершенных грибов", опубликованной издательством "Наука", Москва, и Ивановой Л.Г., 1992, "Систематика, морфологическая характеристика, биологические свойства возбудителей дерматофитозов, общих для животных и человека", Москва, Библиотека Московского Университета. Основные способы культивирования клеточных культур млекопитающих можно легко найти в книге Doyle, Griffiths и Newell (редакторы), Клетка & Культура клеток ткани: Лабораторные методики, John Wiley & Sons (1995). Для опытов с кератиноцитами использовали клетки НаСаТ (Boukamp и др. (1988), J. Cell Biol., 106, стр. 761-771, и Ryle и др. (1989), Differentiation, 40, стр.42-54), также могут быть использованы изолированные кератиноциты или другие клеточные линии кератиноцитов. Лимфоциты лошади выделяли и культивировали, как описано в книге Friemel, Н., " Иммунологические способы исследований", опубликованной VEB Gustav Fisher Verlag, Иена, 1984; или в книге Paul E., "Фундаментальная иммунология", опубликованной Raven Press, Нью-Йорк, 1984. Ауторадиографические исследования были в основном проведены, как описано в статье Boehncke и др., 1994, Scand. J. Immunol. 39, стр.327-332, ссылки здесь приводятся. Едкий натр, едкое кали, соляная кислота и уксусная кислота были приготовлены в виде водных растворов. Если не указано иначе, термин растворимый относится к растворимости в водном растворе. Примерами физиологически приемлемых носителей, используемых в описанных далее экспериментах, являются: носитель А: водный раствор, включающий 0,85% (в/о) хлористого натрия; носитель Б: водный раствор, включающий 5% (в/о) глюкозы, 0,3% (в/о) мясного экстракта "lab-lemco" (Оксоид) и 0,1% (в/ о) дрожжевого экстракта (Оксоид); носитель В: среда RPMI 1640 (Серва).
Пример 1
Антигенный растворимый материал, включающий полисахарид и/или гликопептиды (ASMP), был получен из:
Trichophyton mentagrophytes (ASMP-TM), Microsporum gypseum (ASMP-MG) или Candida albicans (ASMP-CA) согласно следующим методикам:
Грибы культивировали на пластинках с агаром, как описано в европейском патенте 0564620. Грибковую биомассу вынимали и для получения:
I. ASMP-TM:
(i) биомассу Trichophyton mentagrophytes обрабатывали 4,5% (в/о) раствором едкого натра при температуре около 140°С в течение 1 часа, затем центрифугировали в течение 45 минут. К надосадочной жидкости прибавляли 4 М раствор уксусной кислоты до достижения конечного значения рН 3,5. Через 2 часа отстой отделяли при центрифугировании и прибавляли 3 объема этилового спирта к 1 объему надосадочной жидкости. Осадок, выпавший в результате осаждения спиртом, подвергали седиментации при центрифугировании и растворяли в дистиллированной воде. В конце концов индивидуальные препараты ASMP подвергали лиофилизации.
(ii) биомассу Trichophyton mentagrophytes обрабатывали 0,2% (в/о) раствором едкого кали при температуре около 140°С в течение 1 часа, а затем центрифугировали. Надосадочную жидкость обрабатывали 1 М раствором соляной кислоты до конечного рН 3,5 в течение 4 часов при 4-10°С. Осадок затем отделяли при центрифугировании и прибавляли 2 объема этилового спирта к 1 объему надосадочной жидкости. Осадок, образовавшийся в результате прибавления спирта, осаждали при центрифугировании и растворяли в дистиллированной воде. Затем индивидуальные препараты ASMP подвергали лиофилизации.
II. ASMP-MG:
(i) биомассу Microsporum gypseum обрабатывали 0,2% (в/о) раствором едкого натра при температуре около 140°С в течение 2 часов, а затем центрифугировали. Осадок опять обрабатывали 0,2% (в/о) раствором едкого натра при температуре около 140°С в течение 2 часов, затем центрифугировали и методику повторяли третий раз. Конечную надосадочную жидкость затем обрабатывали 8 М раствором уксусной кислоты до конечного рН 3,5 в течение 3 часов при 18-20°С. Осадок затем отделяли при центрифугировании и прибавляли 3 объема этилового спирта к 1 объему надосадочной жидкости. Осадок, выделившийся в результате прибавления спирта, осаждали при центрифугировании и растворяли в дистиллированной воде. В конце индивидуальные препараты ASMP подвергали лиофилизации.
(ii) биомассу Microsporum gypseum обрабатывали также 3% (в/о) раствором едкого кали при температуре около 75°С в течение 6 часов, а затем центрифугировали. Осадок опять обрабатывали 3% (в/о) раствором едкого натра при температуре около 75°С в течение 6 часов, а затем центрифугировали. Конечную надосадочную жидкость затем обрабатывали 0,5 М раствором соляной кислоты до окончательного рН 3,5 в течение 4 часов при 4-10°С. Осадок затем отделяли при центрифугировании и прибавляли 3 объема метилового спирта к 1 объему надосадочной жидкости. Осадок, выпавший в результате прибавления спирта, отделяли при центрифугировании и растворяли в дистиллированной воде. В конце индивидуальные препараты ASMP подвергали лиофилизации.
III. ASMP-CA:
(i) биомассу Candida albicans обрабатывали 3,0% (в/о) раствором едкого натра при температуре 75°С в течение 6 часов, а затем центрифугировали. Осадок опять обрабатывали 3,0% (в/о) раствором едкого натра при 75°C в течение 6 часов с последующим центрифугированием. Конечную надосадочную жидкость затем обрабатывали 12 М раствором уксусной кислоты до окончательного рН 3,5 в течение 2 часов при 4-10°С. Осадок затем отделяли при центрифугировании и прибавляли 2 объема метилового спирта к 1 объему надосадочной жидкости. Осадок, выпавший в результате осаждения спиртом, отделяли при центрифугировании и растворяли в дистиллированной воде. Затем индивидуальные препараты ASMP подвергали лиофилизации.
(ii) биомассу Candida albicans обрабатывали 4,5% (в/о) раствором едкого