Усовершенствованное раневое покрытие для улучшения заживления ран
Иллюстрации
Показать всеГруппа из 5 изобретений относится к медицине, в частности к травматологии, и касается улучшения заживления ран. С этой целью используют композицию (включающую липосомы, содержащие генные конструкции, кодирующие факторы роста), которую используют для инъекций в рану и пропитывания материалов для покрытия или закрытия ран с последующим покрытием или закрытием ран указанными материалами. Предлагают усовершенствованную повязку для ран, включающую материал для покрытия ран и указанные липосомы. Внесение липосомных генных конструкций непосредственно в раны обеспечивает их ускоренное заживление. Усовершенствованные материалы для покрытия и закрытия ран имеют преимущества над материалами, лишенными липосомной генной конструкции, и представляют эффективный и безопасный подход лечению ран. 5 с. и 26 з.п. ф-лы, 4 табл., 13 ил.
Реферат
Предпосылки изобретения
Область техники, к которой относится изобретение
Настоящее изобретение в целом касается области травматологии и лечения ран. Более конкретно настоящее изобретение касается способов улучшения заживления ран и усовершенствованных материалов для раневых покрытий.
Описание области техники
Ожоговые повреждения представляют собой одну из наиболее тяжелых форм травм. Чем сильнее повреждение от ожога, тем более тяжелыми являются последствия и выше вероятность неблагоприятных исходов и смерти. Ежегодно число пациентов с ожогами превышает 2 миллиона человек, а стоимость лечения превосходит один миллиард долларов в год. Огневые и ожоговые повреждения являются третьими в списке причин повреждений и смерти детей в возрасте от 1 до 18 лет. В последнее десятилетие смертность от ожогов снижалась в основном благодаря ранней и адекватной реанимационной инфузионной терапии, раннему и насильному искусственному питанию, улучшенной борьбе с инфекциями, улучшенным обработке и заживлению ран и гормональной модуляции.
Заживление ран является наиболее важным в излечении ожоговых больных и, следовательно, для результатов лечения. Было показано, что раннее иссечение раны и пересадка тканей улучшают гиперметаболический ответ и повышают выживаемость после ожоговых повреждений. Для пересадки на место иссеченной раны может быть использована собственная кожа (донорский сайт), однако, такой путь лечения неэффективен у больных с большой поверхностью ожога. В таких случаях используют синтетические кожные материалы или трупную кожу.
Покрытие раны необходимо отличать от закрытия раны. Материалы для закрытия ран являются биологически приемлемыми для раневого ложа и постепенно включаются в заживающую раневую область. С другой стороны, материалы для раневого покрытия основаны на включении в раневой коагулят и врастании гранулезных тканей с целью прикрепления: такое явление типично для многих материалов для покрытия ран. Материал для покрытия ран обычно не является биологически разрушаемым и, следовательно, может являться лишь временным замещением эпидермиса. Материалы для покрытия ран, следовательно, должны быть заменены на кожу пациента в результате либо реэпителизации, либо пересадки кожи. В случае использования временного покрытия рана не должна быть обсеменена бактериями и должна быть достаточно неглубокой, чтобы можно было ожидать ее полного заживления в течение 3 недель. Эпителиальные клетки из эпидермальных дериватов растут и замещают разрушенный эпидермис, и постепенно материал раневого покрытия вытесняется. Следовательно, исходной целью использования материалов для покрытия ран в случае неглубоких ожогов второй степени является сокращение микробного обсеменения раневого ложа (создание микробного барьера), обеспечивающее предотвращение инфекции, а также сокращение доступа воздуха, что тем самым ослабляет боль.
Материалы для покрытия ран также используют для глубоких повреждений второй степени или третьей степени перед окончательным закрытием раны собственной кожей больных с обширными ожоговыми повреждениями. Оптимальный материал раневого покрытия пока не установлен. Однако требования к материалам для закрытия ран связаны с имитацией нормальных дермы и эпидермиса. В частности, требования к современному материалу для закрытия ран таковы: (а) создать нетоксичный, антисептический, невоспалительный и неантигенный барьер для бактерий и других микробов; (b) обеспечить нормальную передачу тепла и воды; (с) обеспечить непосредственное, однообразное и плотное прикрепление к раневому ложу; (d) обеспечить поддержание механизмов нормального местного иммунитета и заживления раны; (e) поддержать эластичность и долговременную прочность; (f) сохранить возможность к росту; и (g) выполнить долговременные механические и косметические функции наряду с контрактурными свойствами раневой области, сравнимые с таковыми у полнослойного трансплантата.
Очень хорошие параметры биологической совместимости и заживления демонстрируют INTEGRA™, ALLODERM™ или BIOBRANE™. Однако указанные материалы очень дороги, что ограничивает их широкое применение. Трупная кожа является относительно эффективным и дешевым материалом для покрытия ран. Однако существенным оказывается риск переноса ВИЧ, ЦМВ, вируса простого герпеса и гепатита: следовательно, это ограничивает использование трупной кожи.
Плодные оболочки характеризуются многими преимущественными свойствами, которые делают такой материал применимым в качестве материала для раневого покрытия, включая: (а) низкую иммуногенность; (b) нетоксичность, антисептичность и невоспалительность; (с) отсутствие инфицированности ВИЧ, вирусом простого герпеса или ЦМВ; (d) неограниченное количество (что, следовательно, делает плодную оболочечную ткань недорогой альтернативой для существующих коже заменителей); (е) варьирование длины, диаметра и толщины; и (f) присутствие эндогенных механических компонентов, таких как коллаген, ламинин и фибронектин, что гарантирует механическую стабильность, поддержку роста и потенциальное сходство с таковыми признаками нормальной человеческой кожи.
С биохимической точки зрения тепловые повреждения представляют собой особенно тяжелую форму травмы, сопровождающуюся гиперметаболическим ответом, отличающимся высоким минутным сердечным выбросом, повышенным потреблением кислорода, нарушенным иммунным ответом и белковым и жировым катаболизмом [34]. Ожоговая рана поддерживает такое уязвимое гиперметаболическое состояние за счет выработки и секреции тромбоксана и провоспалительных цитокинов [35-37]. Следовательно, заживление раны важно для выживаемости и выздоровления ожоговых больных [22, 38-39]. Как было показано, анаболические средства, такие как гормон роста и инсулиноподобный фактор-1 роста, ослабляют гиперметаболический ответ и улучшают заживление раны [35, 39-41].
Инсулиноподобный фактор-1 роста (IGF-I) - небольшой полипептид с молекулярной массой примерно 7,5 кД - является анаболическим агентом, для которого было продемонстрировано улучшение метаболизма [35], функции слизистой кишечника [42] и белковых потерь [43] после теплового повреждения. IGF-I опосредует активности гормона роста при гиперметаболическом состоянии за счет ослабления потерь безжировой массы тела, нарушенного иммунного ответа, острой фазы ответа и за счет улучшения заживления раны [35, 38, 44-47]. Обработка IGF-I улучшает заживление раны за счет стимуляции образования коллагена и митогенной активности фибробластов и кератиноцитов [40, 41, 48]. Имеются неблагоприятные побочные эффекты, такие как гипогликемия, изменения психического состояния, отек, утомление и головные боли, которые ограничивают терапевтическое применение IGF-I в лечении ожогов [49, 50]. Указанные неблагоприятные побочные проявления наиболее вероятно обусловливаются сверхфизиологическими дозами свободного IGF-I, которые необходимы для достижения биологической эффективности [49, 50].
Первостепенным является выбор подходящей системы для доставки гена [1, 2]. В качестве ген-доставочных систем были использованы вирусы, в частности, аденовирусы благодаря их способности к специфичной трансфекции [1-3]. Однако вирусы проявляют связанные с вирусной инфекцией токсичность, нарушение иммунитета и вероятные мутагенные или канцерогенные эффекты, что делает данный подход потенциально опасным [1]. Таким образом, использование липосом в качестве доставочной системы становится привлекательной моделью благодаря их невирусному составу, стабильности и способности взаимодействовать с клеточной мембраной [4]. Добавление катионных свойств к стандартной липосомной структуре и включение холестерина наряду с использованием цитомегаловирусных (ЦМВ) промоторов в кДНК-конструкциях, используемых для переноса генов, повышает эффективность и уровни экспрессии трансгенов равным образом с теми, которые достигаются с использованием аденовирусных конструкций [4, 5].
В известном уровне техники имеется недостаток способов улучшения заживления ран и усовершенствованных материалов для раневых покрытий. Настоящее изобретение восполняет указанную, существовавшую в течение длительного времени потребность и необходимость в данной области техники.
Краткое содержание изобретения
Настоящее изобретение описывает способ улучшения заживления ран с использованием липосом, несущих гены, которые кодируют факторы усиления роста. Кроме того, настоящее изобретение описывает усовершенствованный материал для покрытия ран, пропитанный липосомами, несущими гены, которые экспрессируют факторы роста, для целей улучшения заживления ран. Объектом настоящего изобретения является снижение гиперметаболического ответа и, соответственно, улучшение результатов лечения и повышение выживаемости после травм, в частности, тепловых повреждений.
Настоящее изобретение описывает внесение липосомных генных конструкций непосредственно в рану и/или в материал покрытия для улучшения заживления раны и усиления функциональности материала для раневого покрытия. Также настоящее изобретение описывает применение усовершенствованной плодной человеческой амниотической оболочки в сочетании с липосомно-генными конструкциями, экспрессирующими факторы роста в качестве непостоянного материала для раневого покрытия при полнослойном заживлении ран. Плодная оболочка обладает преимуществами по сравнению с используемыми в настоящее время материалами, такими как Integra™, Biobrane™, Alloderm™, и определяет эффективный и безопасный способ для улучшения результатов лечения.
Одним из объектов настоящего изобретения является представление способов улучшения заживления ран, способов усовершенствования материала для раневого покрытия и усовершенствованного материала для раневого покрытия.
В варианте настоящего изобретения предусматривается способ улучшения заживления ран, включающий стадию инъецирования в рану липосомы, причем липосома включает по крайней мере один ген, кодирующий фактор усиления роста.
В другом варианте настоящего изобретения предусматривается способ улучшения заживления ран, включающий стадии: покрытия раны материалом для раневого покрытия, причем материал для раневого покрытия пропитан липосомами, причем липосомы включают по крайней мере один ген, который кодирует фактор усиления роста.
Еще в одном варианте настоящего изобретения предусматривается способ улучшения заживления ран, включающий стадии: покрытия раны материалом для закрытия ран, причем материал для закрытия ран пропитан липосомами, причем липосомы включают по крайней мере один ген, который кодирует фактор усиления роста.
В следующем варианте настоящего изобретения предусматривается усовершенствованный материал для перевязывания ран, включающий: материал для раневого покрытия и липосому, содержащую по крайней мере один ген, который кодирует фактор усиления роста.
В другом варианте настоящего изобретения предусматривается композиция для улучшения заживления ран, содержащая: липосому, причем липосома содержит по крайней мере один ген, который кодирует фактор усиления роста, и фармацевтически приемлемый носитель.
Другие и последующие аспекты, свойства и преимущества настоящего изобретения будут ясны из нижеследующего описания предпочтительных путей воплощения настоящего изобретения. Указанные варианты воплощения приведены для целей описания.
Краткое описание чертежей
Прилагающиеся чертежи включены здесь для того, чтобы указывавшиеся выше свойства, преимущества и объекты изобретения стали бы ясными и могли быть поняты в деталях. Указанные чертежи образуют часть настоящей заявки. Необходимо отметить, однако, что прилагающиеся чертежи иллюстрируют предпочтительные варианты воплощения изобретения и не должны рассматриваться как ограничивающие объем настоящего изобретения.
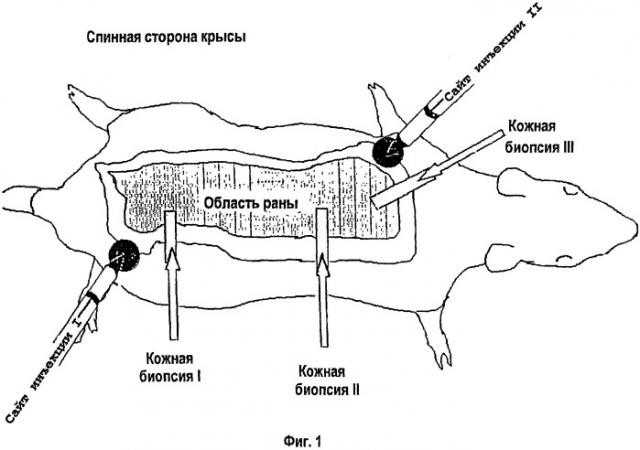
На фигуре 1 схематически показан эскиз мест проведения инъекций. Животные с одним местом для инъекций получали инъекцию только по сайту I, в то время как животные с двумя инъекциями получали инъекции по инъекционным сайгам I и II. Кожные биопсии I, II и III были взяты для анализа через 33 дня после ожога.
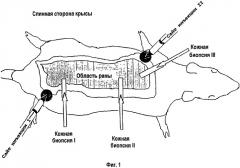
На фигуре 2 схематически показана плазмида с кДНК IGF-I (pcDNA3) под контролем промотора CMV. Структурно сходную плазмиду для β-галактозидазы (ген lacZ) упаковывали в ту же липосому.
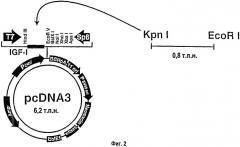
На фигуре 3 отображены процентные изменения массы тела, определенные в течение 7-дневного анализа. *- Статистически достоверное различие между группами при р<0,05. Данные выражены как среднее ± s.e.m.
На фигуре 4 изображены гистологические срезы кожи после гистохимической реакции на активность β-галактозидазы с усиливающим окрашиванием эозином. (4А). Тонкогранулярный зелено-голубой продукт реакции присутствует внутри многих миофибробластов и гистиоцитозных клеток в гранулярной ткани, подстилающей ожоговую рану. Увеличение 380х. (4В). В инъецированной физиологическим раствором (контрольной) кожной ткани, подстилающей поврежденную кожу рядом с ожоговой раной, продукта реакции не выявлено. Увеличение 380х.
На фигуре 5 показано присутствие мРНК IGF-I в коже после трансфекции, липокоплексами, содержащими кДНК, которая кодирует IGF-I. Не было выявлено мРНК IGF-I в кожных биопсийных пробах, взятых у крыс, трансфицированных “чистыми” липосомами или физиологическим раствором (дорожки А и В). Имелось существенное количество мРНК IGF-I в кожных биопсиях от крыс, трансфицированных кДНК IGF-I (дорожка С). Показан репрезентативный образец.
На фигуре 6 показаны концентрации сывороточного трансферрина в ходе 7-дневного периода исследований. После ожогового повреждения сывороточный трансферрин снижался. Липосомы ослабляли это уменьшение на 2-й и 5-й дни после ожога. * - Статистически значимое различие между группами: р<0,05. Данные приведены как среднее ± s.e.m. (Нормальный уровень сывороточного трансферрина: >72 мг/дл).
На фигуре 7 показан сывороточный кислый α1-гликопротеин с 1-го по 7-й день после теплового повреждения. * - Статистически значимое различие между вариантами физиологического раствора и липосом при р<0,05. Данные приведены как среднее ± s.e.m. (Нормальный уровень сывороточного кислого α1-гликопротеина: 55-70 пкг/мл).
На фигуре 8 показан сывороточный TNF-α с 1-го по 7-й день после теплового повреждения. * - Статистически значимое различие между вариантами физиологического раствора и липосом при р<0,05. Данные приведены как среднее ± s.e.m. (Нормальный уровень сывороточного TNF-α: 1-10 пкг/мл).
На фигуре 9 показан сывороточный IL-1β с 1-го по 7-й день после теплового повреждения. *- Статистически значимое различие между вариантами физиологического раствора и липосом при р<0,05. Данные приведены как среднее ± s.e.m. (Нормальный уровень сывороточного IL-1β: 4-20 пкг/мл).
На фигуре 10 показаны результаты планиметрического измерения области реэпителизации раны. Крысы, получавшие упакованные конструкции кДНК IGF-I, проявили наивысший процент реэпителизации за время анализа по сравнению с группами липосом или физиологического раствора. *- Липосомы-кДНК против липосомы и физиологического раствора: р<0,05. Данные приведены как среднее ± s.e.m.
На фигуре 11 показаны результаты планиметрического измерения области реэпителизации раны. Крысы, получавшие множественные инъекции упакованных конструкций кДНК IGF-I, проявили наивысший процент реэпителизации за время анализа по сравнению с однократными инъекциями. * - Множественные инъекции кДНК IGF-I против однократных инъекций: р<0,05. Данные приведены как среднее ± s.e.m.
На фигуре 12 показано, что присутствие β-галактозидазного белка было выявлено с помощью теста на хемолюминесценцию репортерного гена в кожных биопсиях I, II и III. (12A). Крысы, получавшие однократную инъекцию кДНК-конструкции, проявили существенное снижение экспрессии β-галактозидазы вдоль края раны. *- Статистически значимое различие между кожными биопсиями I и III: p<0,05. (12В). Крысы, получавшие множественные инъекции, показали существенно повышенные уровни экспрессии β-галактозидазы. Различия между кожными биопсиями I, II или III отсутствовали. Данные приведены как среднее ± s.e.m.
На фигуре 13 показана концентрация белка IGF-I в кожных биопсиях I, II и III, которая была измерена с помощью РИА. (13А). Крысы, получавшие однократную инъекцию, показали снижение концентрации IGF-I от I-й к III-й биопсии. * - Статистически значимое различие между кожными биопсиями I и III: p<0,05. (13В). Животные, получавшие множественные инъекции, показали стабильно высокие уровни IGF-I. Данные приведены как среднее ± s.e.m.
Подробное описание изобретения
Настоящее изобретение демонстрирует преимущества использования доставочных на основе липосом векторов, экспрессирующих факторы усиления роста, в отношении травматических ран, в частности, тепловых повреждений, у крыс. Кроме того, в настоящем изобретении сравнивается функциональность различных материалов для раневого покрытия, таких как плодная оболочка, человеческая кожа и некоторые имеющиеся в продаже синтетические материалы, у свиней миниатюрной йоркширской породы.
Более конкретно, настоящее изобретение описывает внесение липосомных генных конструкций, кодирующих факторы усиления роста, например, инсулиноподобный фактор-1 роста (IGF-I) или фактор роста кератиноцитов (KGF), непосредственно в раневое ложе или в материал для покрытия раны, и анализ эффективности по сравнению с ранами, не обрабатывавшимися липосомами. Эффективность липосомной генотерапии оценивают путем измерения скорости восприятия и времени заживления, анализа сужения раны гистологическими методами и иммунных маркеров отторжения покрывающего материала и степени гиперметаболического ответа с недельными интервалами в течение 4-месячного периода.
Основываясь на описанных здесь данных, генотерапия, в которой один или большее число генов, экспрессирующих фактор(ы) роста, доставляют с помощью липосомных систем, инъецированных непосредственно в рану или внесенных в материал для покрытия ран, который после этого применяют на рану, сможет реформировать и улучшить текущее лечение тепловых повреждений, кожных язв и процедур кожной трансплантации.
Настоящее изобретение направлено на способы улучшения заживления ран и усовершенствованные материалы для раневого покрытия.
Также настоящее изобретение нацелено на способ улучшения заживления ран, включающий стадию инъецирования в рану липосомы, причем липосома включает по крайней мере один ген, кодирующий фактор усиления роста.
Кроме того, настоящее изобретение направлено на способ улучшения заживления ран, включающий стадии: покрытие раны материалом для раневого покрытия, причем материал для раневого покрытия пропитан липосомами, причем липосома включает по крайней мере один ген, кодирующий фактор усиления роста.
Еще в одном аспекте настоящее изобретение также нацелено на способ улучшения заживления ран, включающий стадии: покрытие раны материалом для закрытия ран, причем материал для закрытия ран пропитан липосомами, причем липосома включает по крайней мере один ген, кодирующий фактор усиления роста.
В следующем аспекте настоящее изобретение также направлено на усовершенствованный материал для перевязывания ран, содержащий: материал для раневого покрытия и липосому, включающую по крайней мере один ген, который кодирует фактор усиления роста. Обычно липосому, включающую фактор усиления роста, вносят в материал для покрытия ран с помощью инъекции, что может быть сделано до или после применения на рану материала для раневого покрытия.
Еще в одном аспекте настоящее изобретение направлено на композицию для улучшения заживления ран, содержащую: липосому, причем липосома включает по крайней мере один ген, кодирующий фактор усиления роста, и фармацевтически приемлемый носитель. Композиция по данному варианту воплощения может быть упакована таким образом, чтобы композицию можно было легко набрать в шприц, или, как альтернатива, она может быть упакована непосредственно в шприц.
В указанных вариантах воплощения характерными ранами, которые можно лечить с использованием композиций и способов по настоящему изобретению, являются тепловая травма, химическая травма, резаная рана, хирургическая травма или ссадина. Предпочтительными липосомами являются холестерин-содержащие катионные липосомы. В целом, факторами усиления роста являются гормон роста, инсулиноподобный фактор-1 роста, фактор роста кератиноцитов, фактор роста фибробластов, эпидермальный фактор роста, тромбоцитарный фактор роста или трансформирующий β-фактор роста. Предпочтительно фактором усиления роста является инсулиноподобный фактор-1 роста (IGF-I), а концентрация гена, кодирующего IGF-I в липосоме, составляет примерно 2,2 мкг на 1 мл липосом.
Характерными материалами для раневого покрытия являются человеческая плодная амниотическая оболочка, человеческий плодный хорион, трупная человеческая кожа, синтетическая кожа и другие материалы, известные специалистам в данной области техники. Характерными материалами для закрытия ран являются человеческая плодная амниотическая оболочка, человеческий плодный хорион, сингенная кожа человека, аллогенная человеческая кожа и другие материалы, хорошо известные специалистам в данной области техники.
В соответствии с настоящим изобретением могут быть использованы стандартные методы молекулярной биологии, микробиологии и рекомбинантных ДНК, известные специалистам в данной области техники. Такие методы полно представлены в научной литературе: см., например, Sambrook, Fritsch & Maniatis, 1982, "Molecular Cloning: A Laboratory Manual"; "DNA Cloning: A Practical Approach", Volumes I & II (ed. D.N.Glover), 1985; "Oligonucleotide Synthesis" (ed. M.J.Gait), 1984; "Nucleic Acid Hybridization" (eds. B.D.Hames & S.J.Higgins), 1985; "Transcription and Translation" (eds. B.D.Hames & S.J.Higgins), 1984; "Animal Cell Culture" (ed. R.I.Freshney), 1986; "Immobilized Cells and Enzymes" (IRL Press), 1986; B. Perbal, 1984, "A Practical Guide to Molecular Cloning". Следовательно, следующие термины, используемые в настоящем описании, должны быть определены в соответствии с приведенным далее.
“Молекула ДНК” обозначает полимерную форму дезоксирибонуклеотидов (аденина, гуанина, тимина или цитозина) либо в одноцепочечной форме, либо в форме двухцепочечной спирали. Данный термин относится исключительно к первичной и вторичной структуре молекулы и не ограничивает ее какими-либо конкретными пространственными формами. Таким образом, данный термин охватывает двухцепочечную ДНК, выявляемую, помимо прочего, в линейных молекулах ДНК (например, рестрикционных фрагментах), вирусах, плазмидах и хромосомах. При обсуждении структуры в данном тексте в соответствии с принятым стандартом указывается только последовательность в направлении 5’→3’ по не транскрибируемой цепи ДНК (т.е. цепи, имеющей последовательность, гомологичную мРНК).
“Вектор” представляет собой репликон, такой как плазмида, фаг или космида, к которому может быть присоединен другой сегмент ДНК таким образом, чтобы осуществлялась репликация присоединенного сегмента. “Репликоном” является любой генетический элемент (например, плазмида, хромосома, вирус), который функционирует в качестве автономной единицы репликации ДНК in vivo, т.е. он способен реплицироваться под своим собственным контролем. “Сайт (точка) начала репликации” относится к тем последовательностям ДНК, которые участвуют в синтезе ДНК. “Последовательностью-регулятором экспрессии” является последовательность ДНК, которая контролирует и регулирует транскрипцию и трансляцию другой последовательности ДНК. Кодирующая последовательность “функционально присоединена” и “находится под контролем” последовательностей транскрипционных и трансляционных регуляторов в клетке тогда, когда РНК-полимераза транскрибирует кодирующую последовательность с образованием мРНК, которая затем транслируется в белок, кодируемый данной кодирующей последовательностью.
В целом, экспрессирующие векторы, включающие промоторные последовательности, которые обеспечивают эффективную транскрипцию и трансляцию встроенного ДНК-фрагмента, используют в сочетании с организмом-хозяином. Обычно экспрессирующий вектор включает сайт начала репликации, промотор(ы), терминатор(ы), а также конкретные гены, которые способны обеспечивать отбор трансформированных клеток по фенотипу. Трансформированные организмы-хозяева могут быть подвергнуты ферментированию и культивированию с применением методов, известных в данной области техники, с достижением оптимального роста клеток.
“Кодирующей последовательностью” ДНК является двухцепочечная последовательность ДНК, которая транскрибируется и транслируется в полипептид in vivo тогда, когда она помещена под контроль соответствующих регуляторных последовательностей. Границы кодирующей последовательности определяются старт-кодоном с 5’-(N-) конца и стоп-кодоном трансляции с 3’-(С-) конца. Кодирующая последовательность может включать, тем самым не ограничиваясь, прокариотические последовательности, кДНК на матрице эукариотической мРНК, последовательности геномной ДНК эукариот (например, млекопитающие) и даже синтетические последовательности ДНК. Сигнал полиаденилирования и транскрипционный терминатор обычно должны быть расположены с 3’-конца кодирующей последовательности. Термин “кДНК” определяет ДНК-копию или комплементарную ДНК, которая является продуктом реакции обратной транскрипции на матрице мРНК-транскрипта. “Экзон” обозначает экспрессированную последовательность, транскрибированную с генного локуса, в то время как “интрон” является неэкспрессированной последовательностью из состава генного локуса.
Последовательностями транскрипционных и трансляционных регуляторов являются регуляторные ДНК-последовательности, такие как промоторы, энхансеры, сигналы полиаденилирования, терминаторы и подобное, которые обеспечивают экспрессию кодирующей последовательности в клетке-хозяине. “Цис-элементом” является нуклеотидная последовательность, также обозначаемая как “консенсусная последовательность” или “мотив”, которая взаимодействует с другими белками, способными позитивно регулировать или негативно регулировать (усиливать или ослаблять) экспрессию конкретного генного локуса. Также в состав кодирующей последовательности может быть включена “сигнальная последовательность”. Такая последовательность кодирует сигнальный пептид, находящийся с N-конца полипептида, который сигнализирует клетке-хозяину и направляет полипептид в соответствующий клеточный сайт. Сигнальные последовательности можно найти в связи с различными белками, нативными для прокариот и эукариот.
“Промоторной последовательностью” является ДНК-регуляторный сегмент, способный связывать РНК-полимеразу в клетке и инициировать транскрипцию расположенной далее (в направлении 3’) кодирующей последовательности. Для целей определения настоящего изобретения промоторная последовательность ограничена по своему 3’-концу сайтом инициации транскрипции и продолжается вверх (в направлении 5’) так, чтобы включить минимальное количество нуклеотидов или элементов, необходимых для инициации транскрипции на уровнях, выявляемо превышающих фоновый уровень. В составе промоторной последовательности должен находиться сайт инициации транскрипции, а также домены связывания белков (консенсусные последовательности), ответственные за связывание РНК-полимеразы. Часто, но не всегда, эукариотические промоторы включают боксы ТАТА и боксы CAT. Прокариотические промоторы включают последовательности Шайна-Дальгарно в дополнение к консенсусным последовательностям в положениях [-10] и [-35].
В целом, термин “ген” призван охватить промотор и регуляторные элементы, функционально присоединенные к кодирующей последовательности. Такие промоторные последовательности и регуляторные элементы могут являться нативными для гена промотором и/или регуляторными элементами или могут быть гетерологичными.
“Гетерологичным” участком является идентифицируемый сегмент ДНК в пределах более крупной молекулы ДНК, который не обнаруживается в связи с такой более крупной молекулой в природе. Так, когда гетерологичный участок кодирует ген млекопитающего, ген обычно должен быть фланкирован (например, промоторными последовательностями и/или регуляторными элементами) такой ДНК, которая не фланкирует геномную ДНК млекопитающего в геноме организма-источника. В другом примере кодирующей последовательностью является конструкция, в которой кодирующая последовательность сама по себе в природе не обнаруживается (например, кДНК, в которой геномная кодирующая последовательность включает интроны, или синтетические последовательности, включающие кодоны, которые отличаются от таковых в составе нативного гена). В соответствии с определенным здесь аллельные варианты или встречающиеся в естественных условиях мутационные события не приводят к образованию гетерологичного участка ДНК.
“Технология рекомбинантных ДНК” указывает на методы объединения двух гетерологичных молекул ДНК, обычно в результате лигирования in vitro ДНК от разных организмов. Молекулы рекомбинантной ДНК обычно получают экспериментально методами генетической инженерии. Терминами-синонимами являются “сплайсинг генов”, “молекулярное клонирование” и “генетическая инженерия”. Продуктом таких манипуляций является “рекомбинант” или “рекомбинантная молекула”.
Клетка считается “трансформированной” или “трансфицированной” экзогенной или гетерологичной ДНК тогда, когда такая ДНК была внесена внутрь клетки. Трансформирующая ДНК может быть или может не быть встроена (путем ковалентного присоединения) в геном клетки. У прокариот, дрожжей и клеток млекопитающих, например, трансформирующую ДНК можно поддерживать в виде эписомного элемента, такого как вектор или плазмида. В отношении эукариотических клеток стабильно трансформированной клеткой является клетка, в которой трансформирующая ДНК была встроена в хромосому таким образом, что она наследуется дочерними клетками в результате репликации хромосом. Такая стабильность демонстрируется способностью эукариотической клетки формировать клеточные линии или клоны, составляющие популяцию дочерних клеток, несущих трансформирующую ДНК. “Клоном” является популяция клеток производных от единственной клетки или предка в результате митозов. “Клеточной линией” является клон первичной клетки, который способен стабильно расти in vitro в течение многих поколений. Организм, такой как растение или животное, который был трансформирован экзогенной ДНК, называют “трансгенным”.
По использованию в данном тексте термин “амниотическая оболочка” обозначает тонкую экстраэмбриональную оболочку, окружающую эмбрион и производную от эктодермальных и мезодермальных тканей.
По использованию в данном тексте термин “хорион” обозначает наиболее внешнюю экстраэмбриональную оболочку, которая в конечном счете является частью плаценты, в которой она в дополнение к дыхательным функциям доставляет пищевые компоненты и выводит шлаки.
По использованию в данном тексте термин “липосома” обозначает маленький пузырек, окруженный двухслойной липидной мембраной и искусственно полученный из фосфолипидов. ДНК, белки и другие материалы могут быть упакованы внутрь липосомы и внесены в клетки животного путем слияния с плазматической мембраной. По использованию в данном тексте термин “холестериновая катионная липосома” обозначает непосредственно холестеринсодержащую липосому.
По использованию в данном тексте “термин фактор усиления роста” обозначает соединения, которые стимулируют рост.
По использованию в данном тексте термин “скорость восприятия” обозначает “скорость заживления” или “скорость принятия” донорской ткани на ткани реципиента.
В частности, предусматривается, что фармацевтические композиции могут быть приготовлены с использованием липосом, описанных в настоящем изобретении. В таком случае фармацевтическая композиция содержит ген, кодирующий фактор роста, липосому по настоящему изобретению и фармацевтически приемлемый носитель. Для специалиста в данной области техники не составит труда без дополнительных экспериментов определить соответствующие дозировки и пути введения липосомы по настоящему изобретению. При использовании для лечения больного липосомный носитель, описанный в настоящем изобретении, вводят больному или животному в терапевтически эффективных количествах, т.е. количествах, которые эффективно доставляют соответствующие количества ДНК, кодирующей фактор усиления роста. Обычным будет введение инъецируемой формы в рану или в материал для раневого покрытия, хотя и другие пути введения можно использовать в качестве подходящих. Доза и режим введения будут зависеть от природы раны (тяжести повреждения тканей) и ее размера, анамнеза больного и других факторов. Количество вводимых липосом будет в основном определяться площадью раны при введении липосом примерно 4 см/часть. Противодействуя отрицательным последствиям лечения, лечение может быть продолжено для достижения оптимальной эффективности: см. Remington’s Pharmaceutical Science, 17th ed., 1990, Mark Publ. Co., Easton, PA; и Goodman & Gilman’s "The Pharmacological Basis of Therapeutics" 8th ed., 1990, Pergamon Press: включены здесь для сведения в виде библиографических ссылок. Для местного применения липосомы наиболее обычно приготавливают в виде стандартной дозы инъецируемой формы (раствора, суспензии, эмульсии) в сочетании с фармацевтически приемлемым носителем. Такой носитель предпочтительно нетоксичен и не обладает лечебными свойствами. Примерами таких носителей являются вода, физиологический раствор, раствор Рингера, раствор декстрозы и 5%-ный человеческий сывороточный альбумин. Также можно использовать неводные носители, такие как фиксированные масла и этилолеат. Носитель может включать небольшие количества добавок, таких как вещества, которые усиливают изотоничность и химическую стабильность, например, буферы и консерванты. Обычно липосомы нужно приготавливать в таких носителях в концентрации примерно 1-10 мкг.
Нижеследующие примеры даны для цели иллюстрирования различных вариантов воплощения изобретения и не призваны в чем бы то ни было ограничить настоящее изобретение.
Пример 1
Экспериментальные животные – крысы
Взрослых самцов крыс линии Sprague-Dawley (350-375 г) помещали в садки с проволочным дном и выдерживали в помещении с контролируемой температурой при 12-часовом световом дне. Животных акклимировали к соответствующей среде в течение 7 дней перед началом слепого анализа. Все они получали равные количества жидкого рациона от Sustacal (Mead Johnson Nutritionals, Evansville, IN, США) и воду без ограничений на протяжении всего эксперимента. Каждая крыса получала полнослойный паровой ожог 60% от общей площади поверхности тела (ОППТ). Затем крыс с тепловым повреждением случайным образом разделяли на:
(a) 2 группы получали инъекции холестерин-содержащих катионных липосом (20 мкл липосом в 180 мкл физиологического раствора: n=28) или физиологического раствора (контроль, 200 мкл: n=28);
(b) 2 группы получали еженедельные подкожные инъекции липосом (10 мкл липосом в 180 мкл физиологического раствора), включающих 2,2 мкг конструкции кДНК IGF-I, и 0,2 мкг конструкции кДНК репортерного гена β-галактозидазы lacZ под контролем промотора CMV (n=12) в одном сайте инъекции по краю ожоговой раны (фиг.1), или еженедельные подкожные инъекции липосом (10 мкл липосом в 180 мкл физиологического раствора), содержащих 2,2 мкг конструкции кДНК IGF-I под контролем цитомегаловируса и 0,2 мкг репортерного гена β-галактозидазы, кДНК lacZ (n=12), в двух сайтах инъекции по краю ожоговой раны (фиг.1); или
(с) 3 группы получали еженедельные подкожные инъекции физиологического раствора (200 мкл нормального физиологического раствора: n=10); еженедельные подкожные инъекции липосом (10 мкл липосом в 180 мкл физиологического раствора), включающих 0,2 мкг конструкции кДНК репортерного гена β-галактозидазы lacZ (n=10); или еженедельные подкожные инъекции липосом (10 мкл липосом в 180 мкл физиологического раствора), содержащих 2,2 мкг конструкции кДНК IGF-I и 0,2 мкг конструкции кДНК репортерного гена β-галактозидазы lacZ (n