Способ диагностики злокачественных новообразований органов малого таза
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к онкологии. Способ позволяет повысить точность диагностики злокачественных новообразований органов малого таза посредством двукратного сканирования методом позитронной эмиссионной томографии с 18F-фтордезоксиглюкозой и определения величины ее накопления в очаге, при этом после первого сканирования больному устанавливают мочевой катетер, а второе выполняют не ранее чем через 4 часа после введения 18F-фтордезоксиглюкозы и при увеличении значения стандартизированного показателя накопления 18F-фтордезоксиглюкозы в обнаруженных очагах после второго сканирования более чем на 10% по сравнению с результатами первого сканирования диагностируют злокачественное новообразование. 6 ил.
Реферат
Изобретение относится к медицине, точнее к онкологии, и может найти применение в диагностике и лечении злокачественных опухолей органов малого таза.
К новообразованиям органов малого таза относятся злокачественные опухоли яичников, рак шейки матки, рак эндометрия, рак простаты, злокачественные новообразования прямой кишки, рак мочевого пузыря.
Одной из наиболее распространенных форм новообразований в настоящее время является рак шейки матки. Он занимает 7-е место среди всех злокачественных новообразований и 3-е - в структуре опухолевых заболеваний у женщин (после рака молочной железы и толстой кишки). В последние годы отмечено значительное увеличение частоты выявления различных форм рака шейки матки у женщин молодого возраста (до 40 лет). К числу основных факторов, определяющих прогноз больных раком шейки матки, относятся характер и степень распространения опухолевого процесса, а также морфологическое строение опухоли. При экзофитных формах, а также при смешанном и эндофитном росте опухоли отмечается высокая частота лимфогенного метастазирования, влагалищный вариант распространения характеризуется более низким метастазированием. Для железистого рака характерно раннее метастазирование и рецидивирование (до 12 месяцев), а для плоскоклеточного неороговевающего рака генерализация возможна на протяжении 36 месяцев.
Диагностика рака шейки матки достаточно проста и основана на данных осмотра, цитологического и гистологического исследования. В то же время оценка распространенности опухолевого процесса, а также распознавание местного рецидива заболевания в большинстве случаев являются далеко не решенной проблемой в онкогинекологии. Лучевая диагностика опухолей шейки матки базируется в основном на данных ультразвукового исследования (УЗИ), компьютерной томографии (КТ) и магнитно-резонансной томографии (МРТ). С помощью УЗИ удается определить локализацию опухоли, ее величину, форму, структуру, а также взаимоотношение с другими органами малого таза. Использование внутривлагалищных и внутриматочных датчиков значительно повышает информативность метода.
КТ позволяет визуализировать первичную опухоль только в поздние стадии заболевания, определять ее инфильтрацию в соседние органы, а также выявлять отдаленные метастазы. Однако на ранних этапах заболевания КТ является относительно малоинформативным методом диагностики.
Информативным методом диагностики рака шейки матки является МРТ, которая позволяет определять не только злокачественную опухоль, но и визуализировать регионарные и отдаленные метастазы.
Основными недостатками всех вышеперечисленных лучевых методов являются сложность дифференциальной диагностики выявленных объемных образований, а также оценка истинных размеров образования, особенно в посттерапевтическом периоде.
В последнее десятилетие отмечается неуклонный рост заболеваемости раком эндометрия. В развитых странах, таких как Швеция и США, рак эндометрия по частоте вышел на первое место. В России ежегодно заболевает более 14000 женщин. Вероятность возникновения лимфогенных метастазов во многом определяется глубиной инвазии опухоли. При локализации злокачественного новообразования в пределах слизистой оболочки или поверхностной инвазии миометрия, не превышающей 5 мм, метастазы выявляются у 2,5% больных. При увеличении глубины инвазии более чем на 1 см частота метастатического поражения возрастает до 46,1%. Рецидивирование и метастазирование опухоли у 75% больных возникают в течение 3 лет после первичного лечения. Наиболее часто выявляют рецидивы во влагалище, в лимфатических узлах малого таза, в теле матки, нередки и отдаленные метастазы.
Диагноз рака тела матки обычно устанавливается путем морфологического исследования материала из полости матки и цервикального канала, полученного путем аспирации или раздельного диагностического выскабливания. Роль традиционных методов исследования, которые длительное время применялись в гинекологии (гистеросальпингография, пневмопельвиография, ангиография, лимфография) в настоящее время ограничена, поэтому к основным методам лучевой визуализации относятся УЗИ, КТ и МРТ. УЗИ с использованием внутривлагалищных и внутриматочных датчиков является эффективным методом диагностики опухолей матки. Чувствительность УЗИ достигает 70-80%. При этом с помощью эхографии можно визуализировать опухоли диаметром лишь более 1,0 см. Некоторые авторы указывают на возможность использования УЗИ для планирования внутриполостной терапии, а также оценки эффективности проводимой терапии. КТ также широко применяется в диагностике рака тела матки и позволяет высказаться о распространенности опухолевого процесса. Однако КТ является малоэффективной при ранних этапах заболевания.
Благодаря хорошей визуализации эндометрия более информативным методом в диагностике рака матки считается МРТ. Она позволяет выявлять первичный опухолевый очаг уже на ранних стадиях опухолевого заболевания. Получение изображений в трех проекциях и высокая тканевая специфичность позволяют четко визуализировать контуры первичной опухоли и ее взаимоотношение с окружающими органами и сосудами, состояние регионарных лимфоузлов. Однако чувствительность метода невысока по сравнению с его специфичностью и диагностической точностью (чувствительность - 68,5%, специфичность - 92,8%, диагностическая точность - 89,2%).
Для уточнения зон регионарного метастазирования используют рентгеноконтрастную лимфографию. Ее диагностическая точность достигает 85%. Однако пожилой возраст больных, наличие тяжелой сопутствующей патологии, эндокринные нарушения зачастую являются препятствием к проведению прямой лимфографии.
Несмотря на большой арсенал диагностических мероприятий, выполняемых больным с раком тела матки, дифференциальная диагностика и определение стадии заболевания остается актуальной проблемой и требует дальнейшего усовершенствования методов визуализации.
Рак яичников отличается, как правило, неудовлетворительными результатами лечения, что обусловлено бессимптомным течением заболевания и, как следствие, поздней диагностикой. Для рака яичников характерны быстрый рост с последующим прорастанием в соседние органы, диссеминация по органам малого таза и брюшной полости, обширное лимфогенное и гематогенное метастазирование. Вероятность рецидивирования опухолевого процесса при 3-4 стадии достигает 96% случаев в сроки от 6 месяцев до 2 лет после окончания первичного лечения.
Обследование больной с подозрением на рак яичников начинается с внутреннего гинекологического исследования с одновременным осмотром в зеркалах влагалища, шейки матки. Для получения информации о стадии заболевания обычно выполняют рентгенографию грудной клетки, УЗИ органов малого таза, брюшной полости и забрюшинного пространства, а также рентгенологическое и эндоскопическое исследование желудка, тонкой и толстой кишки. Необходимым является цитологическое исследование выпота и смывов из брюшной и плевральной полостей, аспирата из полости матки. Из лучевых методов также применяются КТ и МРТ, но только как дополнительные, вследствие того, что их эффективность увеличивается вместе со стадией заболевания. Они позволяют высказаться о размере образования, его сообщении с соседними органами, а также распространенности опухолевого процесса. Диагностическая ценность этих методов визуализации приблизительно такая же, как и при опухолях шейки матки и раке эндометрия.
В последние годы отмечается устойчивая тенденция к увеличению заболеваемости раком прямой кишки. По разным статистическим данным удельный вес рака прямой кишки среди злокачественных опухолей человека составляет 2-10%, а среди опухолей толстой кишки - 70%-80%. Метастазирование рака прямой кишки происходит преимущественно лимфогенным путем в трех направлениях: восходящем, латеральном и нисходящем. Восходящее метастазирование охватывает параректальные, верхние ректальные и нижние брыжеечные, латеральное распространение затрагивает средние ректальные, запирательные, внутренние подвздошные и общие подвздошные, при нисходящем поражаются паховые лимфатические узлы. Метастатическое поражение лимфоузлов значительно ухудшает прогноз для больного. По данным некоторых авторов, до 55% метастазов в лимфатические узлы остаются не выявленными, что приводит к ухудшению отдаленных результатов лечения.
Традиционное контрастное рентгенологическое исследование органов желудочно-кишечного тракта (ЖКТ) наряду с эндоскопическими методами до настоящего времени относится к числу ведущих методов диагностики опухолей данной локализации. В настоящее время в диагностике опухолей толстой кишки достаточно широко используется УЗИ с трансабдоминальным датчиком. Но чувствительность данной методики в выявлении опухолевых образований толстой кишки составляет около 48%. Весьма перспективно применение эндоскопической сонографии, особенно при опухолях, расположенных в так называемых переходных отделах ЖКТ (кардиоэзофагеального, дуоденоеюнального, ректосигмоидного). КТ в диагностике опухолей ЖКТ используется в качестве дополнительного метода исследования, для определения инфильтрации опухолью окружающих тканей, а также для уточнения распространенности. Имеются единичные сообщения о применении при новообразованиях толстой кишки магнитно-резонансной томографии. Однако перестальтика кишечника и наличие свободного газа в полости кишки резко снижают визуализацию опухолевого очага, что приводит к снижению диагностической ценности метода.
Таким образом, остается множество нерешенных проблем, касающихся диагностики первичного образования толстой кишки, оценки распространенности опухолевого процесса, а также выявление местного рецидива заболевания в короткие сроки после оперативного лечения.
В настоящее время большой интерес для онкологов представляет проблема рака мочевого пузыря (РМП), который в 2000 г. занимал 8-е место в структуре онкологической заболеваемости населения России у мужчин и 17-18-е место у женщин. Прогноз для больного определяется степенью инвазии стенки мочевого пузыря (МП) и окружающих тканей первичной опухолью, а также наличием регионарных и отдаленных метастазов. В зависимости от клинического течения заболевания РМП различают 2 варианта опухолей: поверхностный рак и инвазивный. Последний характеризуется частым метастазированием в региональные лимфатические узлы (обтураторные, внутренние и наружные подвздошные). Отдаленными метастазами РМП чаще поражаются лимфоузлы, легкие, печень и кости.
В диагностике опухолевых поражений мочевого пузыря основное место занимает эндоскопическое исследование с биопсией. Однако этот метод не позволяет определить глубину инвазии, а также не позволяет выявлять опухоли подслизистого слоя. В связи с этим широко используется УЗИ, при этом наиболее эффективным является применение сочетанного исследования (внутриполостного и наружного) с использованием различных датчиков. КТ также занимает важное место в диагностике рака мочевого пузыря. С помощью этого метода удается получить высококонтрастное изображение мочевого пузыря и перивезикальной клетчатки, четко визуализировать контуры патологического образования на фоне жидкостного содержимого полости, выявить увеличение лимфатических узлов и прорастание в соседние органы и ткани. Применение болюсного контрастного усиления повышает эффективность диагностики. Следует отметить, что КТ более информативна при поздних стадиях заболевания, а также при локализации патологических изменений в теле мочевого пузыря. Более эффективным методом оценки распространенности рака мочевого пузыря и регионарных метастазов является МРТ. В то же время информативность метода снижается при локализованных и минимально выраженной инфильтрации стенки мочевого пузыря. Использование контрастного усиления увеличивает диагностическую точность МРТ за счет более отчетливой визуализации новообразования.
Вопросы диагностики и лечения рака предстательной железы (РПЖ) также продолжают оставаться актуальной проблемой современной онкоурологии. РПЖ является наиболее часто встречающимся новообразованием у мужчин среднего и пожилого возраста. В некоторых странах мира (США, Швеции, Германии) РПЖ прочно занимает второе место среди онкоурологических заболеваний у мужчин. В настоящее время наблюдается тенденция к увеличению частоты этого заболевания в структуре онкологической и онкоурологической заболеваемости в России и странах СНГ. Следует отметить, что выявляемость РПЖ при профилактических осмотрах в целом по России чрезвычайно низка и составляет, по различным данным, 2,6-3,6%. Это связано с тем, что в повседневной клинической практике ранние стадии заболевания, как правило, не диагностируются. Вследствие этого летальность на первом году жизни после установления диагноза составляет около 32%. В связи с особенностями клинического течения и трудностями диагностики примерно у 60% больных на момент начала лечения имеется метастатическое поражение лимфатических узлов и/или костей.
В настоящее время для скрининговой диагностики РПЖ широко используются стандартное УЗИ. В то же время выявление тонких изменений внутренней структуры железы и характера патологических изменений возможно только при использовании трансректального датчика. Эта методика позволяет определить размер и симметричность железы, оценить состояние капсулы, установить объем остаточной мочи, а также выявить злокачественное новообразование. Сведения о перфузии можно получить при проведении цветной допплерографии. При этом трехмерная реконструкция обеспечивает уникальную возможность получения информации о пространственном распределении сосудов в опухоли и степени ее васкуляризации. Применение эхоконтрастных препаратов увеличивает информативность исследования. КТ считается малоинформативной при небольших размерах (менее 2 см) опухолевых образований предстательной железы. Кроме того, недостаточный мягкотканый контраст, отсутствие возможности дифференцировать зональную структуру предстательной железы и лучевая нагрузка ограничивает возможности метода при начальных стадиях РПЖ. При более поздних стадиях заболевания КТ позволяет оценить распространенность патологического процесса, наличие или отсутствие инфильтрации опухолевой тканью мочевого пузыря и прямой кишки, а также диагностировать регионарные и отдаленные метастазы. Магнитно-резонансная томография предстательной железы имеет ряд преимуществ по сравнению с КТ и трансректальной эхографией. В частности, данный метод визуализации вследствие возможности получения изображений в трех пространственных измерениях с высокой точностью отражает размер предстательной железы, ее контуры, топографо-анатомические соотношения железы с перипростатическими органами и тканями. Однако диагностика с использованием вышеназванных методов все же недостаточно эффективна вследствие того, что МРТ и КТ позволяют судить о поражении лимфоузлов только при увеличении их размеров, и, как следствие, метастазы менее 2 см в диаметре остаются недиагностированными.
Подводя итоги, следует отметить, что используемые в настоящее время методы диагностики злокачественных новообразований органов малого таза базируются в основном на выявлении морфологических изменений, которые возникают, как правило, в более поздние сроки заболевания, что делает диагностику недостаточно эффективной. В то же время известно, что морфологическим изменениям предшествуют биохимические нарушения, выявление которых стало возможно с появлением нового поколения радиодиагностической техники и новых радиофармацевтических препаратов (РФП).
Особое место занимает новый метод лучевой диагностики - позитронная эмиссионная томография (ПЭТ). В основе диагностики новообразований методом ПЭТ лежат особенности метаболизма злокачественных клеток. Эта методика дает возможность определять распространенность злокачественного процесса и имеет большое значение в корректном стадировании опухолей, выборе адекватного метода лечения. Проведение ПЭТ с 18F-фтордезоксиглюкозой (18F-ФДГ) с этой целью возможно при любой локализации опухоли.
Следует отметить важную роль ПЭТ с 18F-ФДГ в оценке результатов лучевого, хирургического и химиотерапевтического лечения, особенно в сложных клинических ситуациях: высокий уровень опухолевых маркеров, трудности в дифференциальной диагностике между рубцовой тканью и продолженным ростом, постлучевым некрозом и рецидивом опухоли. Уже через 2-3 недели после окончания курса лечения ПЭТ с 18F-ФДГ дает возможность оценить его эффективность.
Сопоставление значений накопления 18F-ФДГ в патологических очагах на различных этапах исследования позволяет не только диагностировать злокачественное новообразование, но и количественно оценить метаболические изменения в опухоли, происходящие в процессе терапии. Полученные данные позволят клиницисту получить полное представление о заболевании, его стадии, а также оценить эффективность и радикальность различных методов лечения.
К настоящему времени в медицине накоплен большой опыт по применению ПЭТ с 18F-ФДГ для диагностики первичных опухолей различных локализаций, определения распространенности метастатического поражения и оценки эффективности проводимого лечения.
Наиболее близким к предлагаемому является способ диагностики злокачественных опухолей органов малого таза посредством ПЭТ с 18F-фтордезоксиглюкозой (18F-ФДГ), описанный в статье Kaziio Kubota, Masatoshi Itoh, Kaoru Ozaki et al Advantage of delayed whole-body FDG-PET imaging for tumour detection // Eur.J. Nuclear Medicine, Vol. 28, N.6, June 2001. Он заключается в последовательном сканировании одинаковых по размеру анатомических зон с последующим соединением их в единое изображение всего тела.
ПЭТ проводилась натощак, последний прием пищи рекомендовался за 5 часов до исследования. 18F-ФДГ вводилась внутривенно в дозе 100 МБк. Через 60 минут после внутривенного введения 18F-ФДГ пациенту выполнялось первое сканирование методом позитронной эмиссионной томографии. Каждому эмиссионному сканированию одной анатомической области предшествовала трансмиссия с использованием 68Ge/68Ga источников для коррекции рассеиванию излучения, что способствует уменьшению количества артефактов. После завершения реконструкции отдельных анатомических областей автоматически производилось их соединение с формированием изображения всего тела.
Для математического анализа захвата и выведения 18F-ФДГ в опухолевых очагах вычислялся стандартизованный показатель захвата - полуколичественного показателя, представляющего собой отношение удельной радиоактивности в зоне интереса к удельной введенной радиоактивности (на массу тела больного) с учетом фактора калибровки томографа, который рассчитывается программным комплексом автоматически.
Через 2 часа после введения РФП ПЭТ исследование больному повторялось по вышеуказанной методике. Диагностическим критерием злокачественного новообразования являлось увеличение значений стандартизированного захвата в опухолевых очагах при втором ПЭТ сканировании по сравнению с первым.
Авторы статьи считают, что проведение отсроченного сканирования увеличивает диагностическую точность ПЭТ с 18F-ФДГ. Это было отмечено ими при раке легкого, метастазах в шейные, подмышечные и медиастинальные лимфатические узлы, так как через 2 часа после введения увеличивается накопление РФП в патологических очагах, что повышает контрастность изображения. Однако при воспалительных заболеваниях, в частности при саркоидозе, при проведении отсроченного сканирования ими также наблюдалось увеличение накопления 18F-ФДГ на отсроченных сканах, что снижало ценность методики для дифференциальной диагностики очагов воспалительной и опухолевой природы. Кроме того, при изучении клиренса 18F-ФДГ из органов и тканей малого таза через 2 часа отмечалось повышение захвата РФП в мочевом пузыре и мочеточниках, что создавало высокое фоновое накопление в окружающих тканях и повлекло за собой появление ошибок в расчете значений стандартизированного захвата. По результатам данного исследования авторами сделан вывод о недостаточной точности использования ПЭТ с 18F-ФДГ для диагностики злокачественных новообразований малого таза, что совпадало с мнением целого ряда других авторов.
Технический результат настоящего изобретения состоит в повышении точности ПЭТ диагностики злокачественных опухолей органов малого таза за счет дифференцирования их от доброкачественных опухолей и воспалительных заболеваний.
Этот результат достигается тем, что пациенту после первого ПЭТ сканирования с 18F-ФДГ устанавливают мочевой катетер и не ранее чем через 4 часа после введения РФП выполняют второе ПЭТ сканирование и при увеличении значения стандартизированного показателя накопления 18F-ФДГ в обнаруженных очагах после второго сканирования более чем на 10% по сравнению с результатами первого сканирования диагностируют злокачественное новообразование.
Занимаясь профессионально в течение ряда лет ПЭТ для исследования злокачественных новообразований различной локализации, мы отметили ее высокую эффективность в выявлении опухолевого процесса, определении его распространенности и оценки результатов проводимого лечения. В основе захвата 18F-ФДГ опухолевой тканью лежит более интенсивный гликолиз в опухолевых клетках по сравнению с интактной тканью, обусловленный увеличением числа переносчиков глюкозы в клеточной мембране и активностью основных ферментов гликолитического каскада. Продолжительный период полураспада радионуклида 18F (109 минут) и длительная ретенция 18F-ФДГ в тканях позволяют проводить исследования всего тела ("Whole body"). Однако при исследовании опухолей органов малого таза мы отметили трудности выявления последних ввиду низкой контрастности изображений, а также в связи с высоким фоновым накоплением РФП в неизмененных органах и тканях (мочевой пузырь, мочеточники, петли кишечника). Это согласуется с известными литературными данными о сложности ПЭТ-диагностики злокачественных новообразований органов малого таза. Кроме того, известно, что 18F-ФДГ может использоваться для выявления воспалительных процессов, так как РФП активно захватывается гранулоцитами и макрофагами в очагах воспаления. Поскольку опухолевые заболевания мочеполовой системы нередко сопровождаются воспалительными явлениями, дифференцировать их с помощью ПЭТ оказывается еще более затруднительным. В связи с вышеизложенным использование метода ПЭТ с 18F-ФДГ для диагностики новообразований органов малого таза, по мнению многих авторов, считается нецелесообразным.
Одним из аспектов нашей научной работы было изучение скорости выведения 18F-ФДГ из различных органов и тканей, в том числе из очагов воспаления после инъекции РФП. Для улучшения визуализации органов малого таза и определения временного промежутка, когда в мочевом пузыре полностью отсутствовала остаточная радиактивность, всем пациентам мы устанавливали мочевой катетер и неоднократно повторяли ПЭТ-сканирование с определением при этом стандартизированного показателя захвата 18F-ФДГ. Мы обнаружили, что через 4 часа после введения РФП значение стандартизованного показателя захвата 18F-ФДГ уменьшалось в нормальных органах и тканях, но повышалось в опухолях, и это значительно улучшало их визуализацию. Причем при наличии злокачественных опухолей значение этого показателя повышалось более чем на 10% по сравнению с исходным, а в очагах воспаления уменьшалось, не изменялось или увеличивалось не более чем на 10% (в зависимости от вида воспаления: серозное, гнойное, грануломатозное). Этот неожиданный факт, проверенный нами при обследовании больных с верифицированными диагнозами, позволил нам предложить такую методику в качестве диагностики злокачественных новообразований органов малого таза, которые посредством ПЭТ нередко выявить не удается, а также для дифференцирования их от доброкачественных опухолей и воспалительных заболеваний, которые очень часто их сопровождают.
Сущность способа заключается в следующем.
Исследование выполняется натощак, через 6 часов после приема пищи. Первое ПЭТ-сканирование с 18F-ФДГ осуществляется через 1,5 часа после внутривенного введения РФП в дозе из расчета 220 МБк/м2 (площадь поверхности тела (м2). За час до исследования пациенту предлагается выпить 0,75 литра дистиллированной воды для быстрой экскреции остаточной радиактивности из кровяного пула. Непосредственно перед первым ПЭТ-сканированием пациенту предлагается опорожнить мочевой пузырь. ПЭТ-исследование выполняется в горизонтальном положении, первой анатомической зоной сканирования является область малого таза с последующим передвижением кровати томографа в краниальном направлении. Длительность трансмиссионного сканирования одной анатомической области составляет 3 минуты, за которым следует эмиссионное сканирование этой же анатомической области длительностью 7 минут. Поле зрения одной анатомической зоны составляет 14 см, поэтому длительность всего исследования зависит от роста пациента. Реконструкция исходных данных выполняется в on-line режиме с использованием Zoom 1,5 и фильтра "Back projection". По завершении сбора данных и их реконструкции автоматически осуществляется соединение отдельных анатомических зон с формированием изображения всего тела.
Для математического анализа захвата и выведения 18F-ФДГ в опухолевых очагах вычисляется стандартизованный показатель захвата (SUV).
Непосредственно после выполнения первого ПЭТ-сканирования пациенту устанавливается мочевой катетер для выведения остаточной мочи, и второе ПЭТ-сканирование осуществляют не ранее чем через 4 часа после введения 18F-ФДГ. При увеличении значения SUV в исходном очаге гиперфиксации РФП при повторном сканировании более чем на 10% по сравнению с исходным значением диагностируется злокачественная природа новообразования.
Сущность метода поясняется следующими примерами:
Пример 1. Больная А., 1955 года рождения, обследована амбулаторно 15.07.2003.
Из анамнеза: в апреле 2002 года больная самостоятельно определила увеличенный паховый лимфоузел справа. За медицинской помощью обратилась к хирургу в поликлинике по месту жительства, который направил ее к онкологу. При цитологическом исследовании пунктата из пахового лимфатического узла были обнаружены атипичные клетки, характерные для светлоклеточного рака. Ультразвуковое исследование органов брюшной полости и малого таза позволило диагностировать кистозное образование правого яичника, при этом патология других органов не определялась. Пациентке была выполнена надвлагалищная ампутация матки с придатками. При экспресс-биопсии препарата правого яичника атипичные клетки выявлены не были. Интраоперационная ревизия полости малого таза не определила наличие метастазов в лимфоузлы и клетчатку. При последующем гистологическом исследовании операционного материала опухолевые клетки не были обнаружены. Пациентке было выполнено повторное ультразвуковое исследование органов малого таза и выявлены незначительно увеличенные паравазальные лимфатические узлы и патологическое увеличение лимфоузла в правой паховой области. При компьютерно-томографическом (КТ) исследовании в полости малого таза в проекции удаленной матки выявлялась патологическая ткань, однако четко провести дифференциальную диагностику между опухолевой тканью и послеоперационным спаечным процессом на момент исследования не представлялось возможным. Увеличенные паравазальные лимфатические узлы при КТ исследовании не определялись. С диагнозом злокачественная опухоль неясной локализации, метастазы в правый паховый лимфоузел пациентка была направлена на исследование в ЦНИРРИ МЗ РФ.
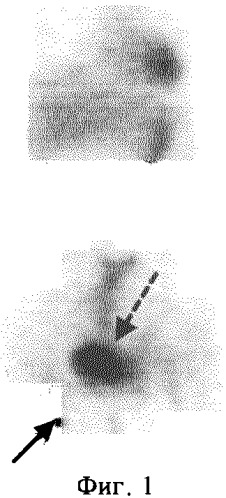
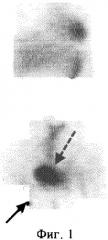
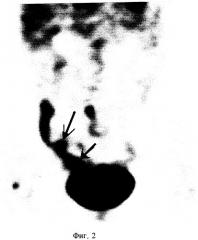
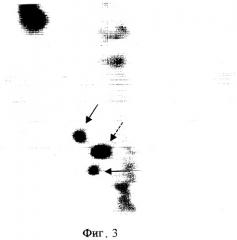
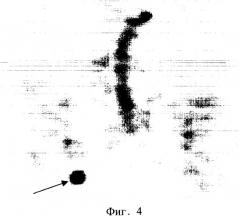
ПЭТ-исследование было выполнено 15.07.2003 г на позитронном томографе “High Resolution+” через 1,5 часа после введения 385 МБк РФП. За 1 час до исследования пациентке было предложено выпить 0,75 л дистиллированной воды, а непосредственно перед ним опорожнить мочевой пузырь. В протокол ПЭТ-сканирования входило исследование 6 анатомических областей (3-минутная трансмиссия и 7-минутная эмиссия на одну анатомическую зону). Сбор данных начинался с области малого таза с последующим движением кровати томографа в краниальном направлении. Реконструкция исходных данных выполнялась в on-line режиме с использованием Zoom 1,5 и фильтра "Back projection". По завершении сбора данных и их реконструкции автоматически осуществлялось соединение отдельных анатомических зон с формированием изображения всего тела. На серии томограмм всего тела с толщиной среза 0,75 см при исследовании метаболизма глюкозы на одном из срезов в паховой области справа определялся очаг патологической гиперфиксации РФП со значением SUV=2,8 (фиг.1), который на основе гистологического исследования был верифицирован как метастаз (указан стрелкой). Из-за большого объема остаточной мочи в мочевом пузыре (стрелка-пунктир на фиг.1) и физиологического накопления в петлях кишечника вследствие перистальтики визуализация органов малого таза была неудовлетворительной. Над мочевым пузырем справа определялись 2 очага повышенного накопления РФП (фиг.2) со значением SUV 4,4 и 3,1, однако они имели нечеткие границы, частично экранированы мочевым пузырем, и данные очаги можно было ошибочно расценить как петли кишечника. Для эвакуации остаточной мочи из мочевого пузыря пациентке был поставлен мочевой катетер, и повторное ПЭТ-сканирование было проведено через 4 часа после инъекции РФП. На томограммах органов малого таза, выполненных через 4 часа после введения РФП, над мочевым пузырем справа определялись 2 очага повышенного накопления РФП с четкими контурами, в которых значение SUV увеличилось на 73,5% (SUV=6,9 против 4,4) и 35,4% (SUV=4,2 против 3,1) (фиг.3). За мочевым пузырем справа визуализировался очаг патологического накопления РФП со значением SUV=5,0 (стрелка-пунктир), который не определялся при первичном сканировании. В очаге, выявленном в паховой области, при отсроченном сканировании отмечалось увеличение показателя накопления на 14,3% (SUV=3,2) (фиг.4). Полученные ПЭТ-данные свидетельствовали о злокачественном поражении органов малого таза и пахового лимфоузла, который был гистологически верифицирован как метастаз. Больной был проведен курс комбинированной лучевой и полихимиотерапии. При повторном ПЭТ-исследовании с 18F-ФДГ от 19.11.2003, которое было выполнено через 4 часа после введения РФП с предварительной катетеризацией мочевого пузыря, отмечалась положительная динамика: уменьшение количества очагов патологической гиперфиксации в малом тазу, исчез очаг в паховой области.
Пример 2. Пациент Б., 1927 года рождения, история болезни N 2736, поступил в ЦНИРРИ в урологическое отделение с диагнозом рак мочевого пузыря.
Из анамнеза: В начале сентября 2003 года у больного был эпизод макрогематурии в течение 2-х дней. При ультразвуковом исследовании органов малого таза в мочевом пузыре было выявлено объемное образование размерами 3,2×4,2 см без признаков прорастания в стенку, которое трактовалось как экзофитный рак или полип мочевого пузыря. Поражение регионарных лимфатических узлов при УЗИ не выявлено. Для оценки распространенности опухолевого процесса пациенту была выполнена КТ органов малого таза. При КТ органов малого таза по задне-правой стенке мочевого пузыря, на уровне шейки, определялось патологическое образование, растущее экзофитно, без четких контуров.
Также при исследовании в костном режиме, в головке левой бедренной кости определялся участок уплотнения костной структуры неясной природы размером 0,8 см. Для исключения метастатической природы, выявленного при КТ очага пациенту была проведена сцинтиграфия костей, результаты которой также не позволяли четко высказаться о природе очага. Для уточнения природы очага в головке левой бедренной кости пациенту была выполнена ПЭТ всего тела с 18F-ФДГ. ПЭТ-исследование проводилось по аналогичной предыдущей методике через 1,5 часа после введения 451 МБк РФП. Первичный опухолевый очаг не визуализировался из-за большого объема остаточной радиактивной мочи в мочевом пузыре. Гиперфиксация РФП в головке левой бедренной кости при первичном сканировании не отмечалась. Пациенту был поставлен мочевой катетер, и повторное ПЭТ-сканирование было проведено через 4 часа после инъекции РФП. Непосредственно перед исследованием мочевой пузырь через катетер был наполнен 400 мл раствора фурациллина для улучшения визуализации его стенок. На томограммах органов малого таза в проекции правой боковой стенки мочевого пузыря дорзально определялся очаг повышенного накопления РФП со значением SUV=11,5, что свидетельствовало о его злокачественной природе.
Больному была выполнена цистоскопия с прицельной биопсией и последующей гистологической оценкой полученного материала. Диагностирован папиллярный переходно-клеточный рак мочевого пузыря T1N0M0.
Пример 3. Пациент В., 1932 г.р., обследован в отделении ПЭТ ЦНИРРИ с диагнозом: объемное образование предстательной железы.
Из анамнеза: При ежегодном профилактическом осмотре урологом обнаружено объемное образование правой доли предстательной железы. Трансректальное ультразвуковое исследование подтвердило наличие опухолевого образования в правой доле предстательной железы. Пункционная биопсия образования определила наличие умеренно дифференцированной аденокарциномы. Отмечался повышенный уровень онкомаркера PSA в плазме крови=98 нг/мл. Для оценки распространенности опухолевого процесса пациенту была выполнена ПЭТ всего тела с 18F-ФДГ. ПЭТ-исследование проводилось через 1,5 часа после введения 467 МБк РФП. Визуализация первичного очага оказалась неудовлетворительной из-за высокого накопления РФП в мочевом пузыре и “слиянием” первичного очага с его задней стенкой. Значение SUV в первичном очаге составило 3,8. Пациенту был установлен мочевой катетер. Через 4 часа 05 минут после введения РФП было выполнено отсроченное ПЭТ-сканирование. На томограммах органов малого таза в проекции предстательной железы стал визуализироваться очаг патологической гиперфиксации со значением SUV=4,7 (увеличение накопления на 23,7%), что позволило установить диагноз: злокачественная опухоль предстательной железы, отсутствие регионарных и отдаленных метастазов. На основании клиники и результатов ПЭТ пациенту была установлена стадия заболевания T2bN0M0 и определена тактика дальнейшего лечения.
Больному проведено комбинированное лечение, включавшее в себя лучевую терапию и гормонотерапию. При контрольном ТРУЗИ сохранялось объемное образование правой доли предстательной железы, однако отмечалось уменьшение его размера (с 1,9 см по наибольшему измерению до 1,4 см по наибольшему измерению). Однако для корректной оценки эффективности проведенного лечения было необходимо определение опухолевых клеток в сохраняющемся образовании. Учитывая преклонный возраст пациента (70 лет), возможные осложнения при пункционной биопсии, которая является инвазивным методом и зачастую низко информативна, так как точная пункция опухолевого очага не всегда осуществима, для выявления жизнеспособных опухолевых клеток в данном образовании пациенту было проведено повторное ПЭТ-исследование с 18F-ФДГ. Первичное ПЭТ-сканирование через 1,5 часа и отсроченное сканирование через 4 часа после введения РФП не определили наличие очагов патологического накопления РФП, что подтвердило отсутствие жизнеспособных опухолевых клеток в очаге, выявленном при УЗИ, и выраженный положительный эффект проводимого лечения. Последующее наблюдение в течение 8 месяцев за клиническим состоянием пациента и уровнем PSA, который является маркером прогрессирования заболевания, позволили установить состояние ремиссии до настоящего времени.
Пример 4. Пациент П. 1960 г.р., обследован в отделении ПЭТ ЦНИРРИ с диагнозом: злокачественное новообразование неясной локализации, множественные м