Соединения, активные при новом сайте на оперируемых рецептором кальциевых каналах, применимые для лечения неврологических нарушений
Иллюстрации
Показать всеИзобретение относится к области неврологии. Описаны арилалкиламины, специфически действующие на определенные типы оперируемых рецепторами Са2+-каналов, их применение и фармацевтические композиции для лечения неврологических расстройств или заболеваний. 6 н. и 49 з.п. ф-лы, 11 табл.
Реферат
Данная заявка является частичным продолжением находящейся на одновременном рассмотрении заявки U.S. Serial No. 08/485038, поданной 7 июня 1995 года, которая является частичным продолжением одновременно рассматриваемой Международной патентной публикации No. PCT/US94/12293, поданной 26 октября 1994 года, которая является частичным продолжением одновременно рассматриваемой заявки U.S. Serial No. 08/288688, поданной 9 августа 1994 года, которая является частичным продолжением ожидающей одновременного рассмотрения заявки U.S. Serial No. 08/194210, поданной 8 февраля 1994 года, которая является частичным продолжением U.S. Serial No. 08/014813, поданной 8 февраля 1993 года, в настоящее время абандонированной. Все они включены здесь в качестве ссылок во всей их полноте.
Область изобретения
Данное изобретение относится к соединениям, которые могут использоваться в качестве нейропротекторов, антиконвульсивных средств, транквилизаторов, аналгетиков, миорелаксантов или адъювантов для общих анестетиков. Данное изобретение относится также к способам, которые могут использоваться для лечения неврологических нарушений и заболеваний, в том числе, но не только, общего и очагового ишемического и геморрагического удара (внезапного приступа), повреждения спинного мозга, индуцированного гипоксией повреждения нервных клеток, такого как остановка сердца или неонатальный дистресс, эпилепсии, состояния тревоги и нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Хангтингтона, болезнь Паркинсона и боковой амиотрофический склероз (ALS). Данное изобретение относится также к способам скрининга на соединения, активные при новом сайте на оперируемых рецепторами кальциевых каналах и вследствие этого имеющие терапевтическую применимость в качестве нейропротекторов, антиконвульсивных средств, транквилизаторов, аналгетиков и/или имеющие потенциальную терапевтическую применимость для лечения неврологических нарушений и заболеваний, описанных выше.
Предпосылки изобретения
Далее следует описание родственной области знаний, причем ни один из приводимых примеров не является прототипом пунктов формулы изобретения.
Глутамат представляет собой основной нейротрансмиттер (нейромедиатор) возбуждения в мозгу млекопитающего. Глутамат связывается или взаимодействует с одним или несколькими рецепторами глутамата, которые можно дифференцировать фармакологически на несколько подтипов. В центральной нервной системе млекопитающего (ЦНС) имеется три основных подтипа ионотропных рецепторов глутамата, определяемых фармакологически при помощи селективных агонистов N-метил-D-аспартата (NMDA), каината (КА) и α -амино-3-гидрокси-5-метилизоксазол-4-пропионовой кислоты (АМРА). Считалось, что NMDA-рецептор принимает участие во многих неврологических патологиях, в том числе во внезапном приступе (инсульте), травме головы, повреждении спинного мозга, эпилепсии, состоянии тревоги и нейродегенеративных заболеваниях, таких как болезнь Альцгеймера (Watkins and Collingridge. The NMDA Receptor, Oxford: IRL Press, 1989). Роль рецепторов NMDA в восприятии боли и аналгезии была также хорошо постулирована (Dickenson, A cure for wind-up: NMDA receptor antagonists as potential analgesics. Trends Pharmacol. Sci. 11: 307, 1990). Более недавно широко исследовались АМРА-рецепторы на их возможное участие в таких нейрологических патологиях (Fischer and Bogousslavsky, Evolving toward effective therapy for acute ischemic stroke. J. Amer. Med. Assoc. 270: 360, 1993; Yamaguchi et al., Anticonvulsant activity of AMPA/kainate antagonists: Comparison of GYKI 52466 and NBQX in maximal electroshok and chemoconvulsant seizure models. Epilepsy Res. 15: 179, 1993).
При активации глутаматом эндогенный нейротрансмиттер, рецептор NMDA, делает возможным приток внеклеточного кальция (Са2+) и натрия (Na+) через ассоциированный ионный канал. NMDA-рецептор делает возможным значительно больший приток Са2+, чем каинатный или АМРА-рецепторы (см. ниже), и является примером оперируемого рецептором Са2+-канала. В норме этот канал является открытым только недолго, позволяя локализованное и временное увеличение концентрации внутриклеточного Са2+ ([Са2+]), которая, в свою очередь, изменяет функциональную активность этой клетки. Однако пролонгированные увеличения [Са2+]i, происходящие из-за хронической стимуляции NMDA-рецептора, являются токсическими для клетки и приводят к гибели клетки. Считают, что хроническое повышение [Ca2+]i, происходящее в результате стимуляции NMDA-рецепторов, является первичной причиной дегенерации нейронов после инсульта (удара) (Choi, Glutamate neurotoxicity and diseases of the nervous system. Neuron 1: 623, 1988). Считают также, что сверхстимуляция NMDA-рецепторов участвует в патогенезе некоторых форм эпилепсии (Dingledine et al., Excitatory amino acid receptors in epilepsy. Trends Pharmacol. Sci. 11:334, 1990), состоянии тревоги (Wiley and Dalster, Preclinical evaluation of N-methyl-D-aspartate antagonists for antianxiety effects: A review. In: Multiple Sigma and PCP Receptor Ligands: Mechanisms for Neuromodulation and Neuroprotection? NPP Books, Ann Arbor, Michigan, pp.801-815, 1992), нейродегенеративных заболеваний (Meldrum and Garthwaite, Excitatory amino acid neurotoxicity and neurodegenerative disease. Trends Pharmacol. Sci. 11: 379, 1990) и гипералгезических состояниях (повышенной болевой чувствительности) (Dickenson, A cure for wind-up: NMDA receptor antagonists as potential analgesics. Trends Pharmacol. Sci. 11: 307, 1990).
Активность комплекса NMDA-рецептор-ионофор регулируется множеством модуляторных сайтов, на которые могут быть нацелены селективные антагонисты. Конкурентные антагонисты, такие как фосфонат АР5, действуют при глутаматсвязывающем сайте, тогда как неконкурентные антагонисты, такие как фенциклидин (РСР), МК-801 или магний (Mg2+), действуют внутри ассоциированного ионного канала (ионофора). Имеется также сайт связывания глицина, который может селективно блокироваться такими соединениями, как 7-хлоркинуреновая кислота. Имеется доказательство, предполагающее, что глицин действует как коагонист, так что как глутамат, так и глицин являются необходимыми для индукции полных опосредованных NMDA-рецептором ответных реакций. Другие потенциальные сайты модулирования функции NMDA-рецептора включают цинк (Zn2+)-связывающий сайт и сигма-лигандсвязывающий сайт. Кроме того, считают, что эндогенные полиамины, такие как спермин, связываются со специфическим сайтом и таким образом усиливают функцию NMDA-рецептора (Ransom and Stec, Cooperative modulation [3H]MK-801 binding to the NMDA receptorion channel complex by glutamate, glycine and polyamines. J. Neurochem. 51:830, 1988). Потенциирующий эффект полиаминов на функцию NMDA-рецептора может быть опосредован через специфический рецепторный сайт для полиаминов; были описаны полиамины, демонстрирующие агонистическую, антагонистическую и обращенную агонистическую активность (Reynolds, Arcaine is a competitive antagonist of the polyamine site on the NMDA receptor. Europ. J. Pharmacol. 177: 215, 1990; Williams et al., Characterization of polyamines having agonist, antagonist, and inverse agonist effects at the polyamine recognition site of the NMDA receptor. Neuron 5: 199, 1990). Исследования связывания радиолиганда продемонстрировали дополнительно, что более высокие концентрации полиаминов ингибируют функцию NMDA-рецептора (Reynolds and Miller, Ifenprodil is a novel type of NMDA receptor antagonist: Interaction with polyamines. Molec. Pharmacol. 36: 758, 1989; Williams et al., Effects of polyamines on the binding of [3H]MK-801 to the NMDA receptor: Pharmacological evidence for the existence of a polyamine recognition site. Molec. Pharmacol. 36: 575, 1989; Sacaan and Johnson, Characterization of the stimulatory and inhibitory effects of polyamines on [3H]TCP binding to the NMDA receptor-ionophore complex. Molec. Pharmacol. 37: 572, 1990). Это ингибиторное действие полиаминов на NMDA-рецепторы является, возможно, неспецифическим эффектом (т.е. не медиированным через рецептор полиамина), поскольку электрофизиологические исследования (пэтч-кламп, patch-clamp)) показали, что это ингибирование осуществляется соединениями, которые, как показано ранее, действуют при рецепторе полиамина либо как агонисты, либо как антагонисты (Donevan et al., Arcaine Blocks N-Methyl-D-Aspartate Receptor Responses by an Open Channel Mechanism: Whole-Cell and Single-Channel Recording Studies in Cultured Hippocampal Neurons. Molec. Pharmacol. 41: 727, 1992; Rock and Macdonald, Spermine and Related Polyamines Produce a Voltage-Dependent Reduction of NMDA Receptor Single-Channel Conductance. Volec. Pharmacol. 42: 157, 1992).
Недавние исследования показали молекулярное разнообразие рецепторов глутамата (описанных в обзоре Nakanishi, Molecular Diversity of Glutamate Receptors and Implications for Brain Function. Science 258: 597, 1992). К настоящему времени были идентифицированы по меньшей мере пять отличающихся субъединиц NMDA-рецептора (NMDAR1 и NMDAR2A - NMDAR2D), каждая из которых кодируется отдельным геном. Также в NMDAR1 альтернативный сплайсинг дает по меньшей мере шесть дополнительных изоформ. По-видимому, NMDAR1 является необходимой субъединицей и комбинирование NMDAR1 с различными членами форм NMDAR2 образует полностью функциональный комплекс NMDA-рецептор-ионофор. Комплекс NMDA-рецептор-ионофор, таким образом, может быть определен как гетероолигомерная структура, состоящая по меньшей мере из субъединиц NMDAR1 и NMDAR2; существование дополнительных, еще не идентифицированных, субъединиц не исключается этим определением. Было показано, что NMDAR1 обладает сайтами связывания для глутамата, глицина, Мg2+, МК-801 и Zn2+. Сайты связывания для сигма-лигандов и полиаминов не были еще определены на субъединицах NMDA-рецептора, хотя недавно сообщалось, что ифенпродил является более сильным при субъединице NMDAR2B, чем при субъединице NMDAR2A (Williams, Ifenprodil discriminates subtypes of the N-methyl-D-aspartate receptor: selectivity and mechanisms at recombinant heteromeric receptors. Mol. Pharmacol. 44: 851, 1993).
Несколько отдельных подтипов АМРА- и каинатных рецепторов также были клонированы (обзор Nakanishi, Molecular diversity of glutamate receptors and implications for brain function. Science 258: 597, 1992). Особое отношение к данному вопросу имеют АМРА-рецепторы, названные GluR1, GluR2, GluR3 и GluR4 (также называемые GluRA-GluRD), каждый из которых существует в одной из двух форм, названных flip и flop, которые возникают в результате альтернативного сплайсинга РНК. GluR1, GluR3 и GluR4 при экспрессии в виде гомомерных или гетеромерных рецепторов являются проницаемыми для Са2+, и, следовательно, они являются примерами оперируемых рецепторами Са2+-каналов. Экспрессия только GluR2 одного или в комбинации с другими субъединицами приводит к рецептору, который является в большей мере непроницаемым для Сa2+. Поскольку наиболее нативные АМРА-рецепторы, изученные in situ, являются непроницаемыми для Са2, считают, что такие рецепторы in situ обладают по меньшей мере одной субъединицей GluR2.
Кроме того, высказывается гипотеза, что субъединица GluR2 является функционально отличающейся, благодаря тому факту, что она содержит остаток аргинина в вероятном образующем пору трансмембранном районе II; GluR1, GluR3 и Glu4 содержат (все) остаток глутамина в этом решающем районе (названный сайтом Q/R, где Q и R являются буквенными обозначениями для глутамина и аргинина соответственно). Активность АМРА-рецептора регулируется рядом модуляторных сайтов, на которые могут быть нацелены селективные антагонисты (Honore et al., Quinoxalinediones: potent competitive non-NMDA glutamate receptor antagonists. Science 241: 701, 1988; Donevan and Rogawski, GYKI 52466, a 2,3-benzodiazepine, is a highly selective, noncompetitive antagonist of AMPA/kainate receptor responses. Neuron 10: 51, 1993). Конкурентные антагонисты, такие как NBQX, действуют при сайте связывания глутамата, тогда как такие соединения, как GYKI 52466, действуют, по-видимому, неконкурентно при ассоциированном с ними аллостерическом сайте.
Сообщается, что соединения, действующие как конкурентные или неконкурентные антагонисты при NMDA-рецепторе, являются эффективными в предотвращении гибели нервных клеток в различных тестах нейротоксичности in vitro (Meldrum and Garthwaite, Excitatory amino acid neurotoxicity and neurodegenerative disease. Trends Pharmacol. Sci. 11: 379, 1990) и в моделях in vivo удара (острого внезапного приступа) (Scatton, Therapeutic potential of NMDA-receptor antagonists in ischemic cerebro-vascular disease in Drug Strategies in the Prevention and Treatment of Stroke, IBC Technical Services Ltd., 1990). Такие соединения являются также эффективными противосудорожными средствами (Meldrum, Excitatory amino acid neurotransmission in epilepsy and anticonvulsant therapy in Excitatory Amino Acids. Meldrum, Moroni, Simon, and Woods (Eds.), New York: Raven Press, p.655, 1991), транквилизаторами (Wiley and Balster, Preclinical evaluation of N-methyl-D-aspartate antagonists for antianxiety effects: A review. In: Multiple Sigma and PCP Receptor Ligands: Mechanisms for Neuromodulation and Neuroprotection? NPP Books, Ann Arbor, Michigan, pp.801-815, 1992), и аналгетиками (Dickenson, A cure for wind-up: NMDA receptor antagonists as potential analgesics. Trends Pharmacol. Sci. 11: 307, 1990), и некоторые антагонисты NMDA-рецептора могут ослаблять деменцию, связанную с болезнью Альцгеймера (Hughes, Merz's novel approach to the treatment of dementia. Script No. 1666: 24, 1991).
Подобным образом, антагонисты АМРА-рецептора были подвергнуты интенсивному критическому изучению в качестве потенциальных терапевтических агентов для лечения таких неврологических нарушений и заболеваний. Было показано, что антагонисты АМРА-рецепторов обладают нейропротекторной (Fischer and Bogousslavsky, Evolving toward effective therapy for acute ischemic stroke. J. Amer. Med. Assoc. 270: 360, 1993), противосудорожной (Yamaguchi et al., Anticonvulsant activity of AMPA/kainate antagonists: comparison of GYKI 52466 and NBQX in maximal electroshock and chemoconvulsant seizure models. Epilepsy Res. 15: 179, 1993) активностью в моделях животных ишемического удара и эпилепсии соответственно.
Никотиновый холинергический рецептор, присутствующий в ЦНС млекопитающих, является другим примером оперируемого рецептором Са2+-канала (Deneris et al., Pharmacological and functional diversity of neuronal nicotinic acetylcholine receptors. Trends Pharmacol. Sci. 12: 34, 1991). Были клонированы отличающиеся субъединицы рецептора, и эти субъединицы могут экспрессироваться, например, в ооцитах Xenopus с образованием функциональных рецепторов с их катионными каналами. Высказывается гипотеза, что такие комплексы рецептор-ионофор являются гетеропентамерными структурами. Возможная роль оперируемых рецепторами Са2+-каналов в патологии неврологических нарушений и заболеваний, таких как ишемический удар, эпилепсия и нейродегенеративные заболевания, в большой степени остается невыясненной.
Ранее было показано, что некоторые яды пауков и ос содержат арилалкиламиновые токсины (также называемые полиаминовыми токсинами, ариламиновыми токсинами, ацилполиаминовыми токсинами или полиаминамидными токсинами) с активностью против рецепторов глутамата в ЦНС млекопитающих (в качестве обзоров см. Jackson and Usherwood, Spider toxines as tools for dissecting elements of excitatory amino acid transmission. Trends Neurosci. 11: 278, 1988; Jackson and Parks, Spider Toxins: Recent Applications in Neurobiology. Annu. Rev. Neurosci. 12: 405, 1989; Saccomano et al., Polyamine spider toxins: Unique pharmacological tools. Annu. Rep. Med. Chem: 24: 287, 1989; Usherwood and Bladbrough, Spider Toxines Affecting Glutamate Receptors: Polyamines in Therapeutic Neurochemistry, Pharmacol. Therap. 52:245, 1991: Kawai, Neuroactive Toxins of Spider Venoms. J. Toxicol. Toxin Rev. 10: 131, 1991). Вначале сообщалось, что арилалкиламиновые токсины являются селективными антагонистами АМРА/каинатных подтипов глутаматных рецепторов в ЦНС млекопитающих (Kawai et al., Effect of a spider toxin on glutaminergic synapses in the mammalian brain. Biomed. Res. 3: 353, 1982; Saito et al., Spider Toxin (JSTX) blocks glutamate synapse in hippocampal pyramidal neurons. Brain Res. 346: 397, 1985; Saito et al., Effects of a spider toxin (JSTX) on hippocampal CA1 neurons in vitro. Brain Res. 481: 16, 1989; Akaike et al., Spider toxin blocks excitatory amino acid responses in isolated hippocampal pyramidal neurons. Neurosci. Lett. 79: 326, 1987; Ashe et al., Argiotoxin-636 blocks excitatory synaptic transmission in rat hippocampal CA1 pyramidal neurons. Res. 480: 234, 1988; Jones et al., Philanthotoxin blocks quisqualate-induced, AMPA-induced and kainate-induced, but not NMDA-induced excitation of rat brainstem neurons in vivo. Br. J. Pharmacol. 101: 968, 1990). Последующие исследования показали, что, хотя некоторые арилалкиламиновые токсины являются не сильнодействующими и неселективными при различных глутаматных рецепторах, другие арилалкиламины являются очень сильнодействующими и селективными при антагонистических ответах, опосредованных активацией NMDA-рецепторов в ЦНС млекопитающих (Mueller et al., Effects of polyamine spider toxines on NMDA receptor-mediated transmission in rat hippocampus in vitro. Soc. Neurosci. Abstr. 15: 945, 1989; Mueller et al., Arylaminefepider toxins antagonize NMDA receptor-mediated synaptic transmission in rat hippocampal slices. Synapse 9: 244, 1991; Parke et al., Polyamine spider toxins block NMDA receptor-mediated increases in cytosolic calcium in cerebellar granule neurons. Soc. Neurosci. Abst. 15: 1169, 1989; Parks et al., Arylamine toxins from funnel-web spider (Agelenopsis aperta) venom antagonize N-methyl-D-aspartate receptor function in mammalian brain. J. Biol. Chem. 266: 21523, 1991; Priestley et al., Antagonism of responses to excitatory amino acids on rat cortical neurones by the spider toxin, argiotoxin-636. Br. J. Pharmacol. 97: 1315, 1989; Draguhn et al., Argiotoxin-636 inhibits NMDA-activated ion channels expressed in Xenopus oocytes. Neurosci. Lett. 132: 187, 1991; Kiskin et al., A highly potent and selective N-methyl-D-aspartate receptor antagonist from the venom of the Agelenopsis aperta spider, Neuroscience 51: 11, 1992: Brackley et al., Selective antagonism of native and cloned kainate and NMDA receptors by polyamine-containing toxins. J. Pharmacol. Exp. Therap. 266: 1573, 1993; Williaiya, Effects of Agelenopsis aperta toxins in the N-methyl-D-aspartate receptor: Polyamine-like and high-affinity antagonist actions. J. Pharmacol. Exp. Therap. 266: 231, 1993). Также сообщалось ингибирование никотиновых холинергических рецепторов арилалкиламиновым токсином филантотоксином (Rozental et al., Allosteric inhibition of nicotinic acetylcholine receptors of vertebrates and insects by philanthotoxin. J. Pharmacol. Exp. Therap. 249: 123, 1989). Parks et al. (Arylamine toxins from funnel-web spider (Agelenopsis aperta) venom antagonize N-methyl-D-aspartate receptor function in mammalian brain. J. Biol. Chem. 266: 21523, 1991) описывают арилалкиламиновые токсины паука (α -агатоксины), которые являются антагонистами функции NMDA-рецептора в мозгу млекопитающих. Эти авторы обсуждают механизм действия арилалкиламиновых токсинов и показывают, что оперируемый NMDA-рецепторами ионный канал является возможным сайтом действия α -агатоксинов и, наиболее вероятно, арилалкиламинов яда других пауков. Они утверждают:
"Открытие, что эндогенные полиамины в мозгу позвоночных модулируют функцию NMDA-рецепторов, предполагает, что ариламиновые токсины могут осуществлять их антагонизм через полиамин-связывающий сайт на глутаматных рецепторах. Brackly et al. исследовали действия спермина и филантотоксина 433 на ответные реакции, индуцируемые применением возбуждающих аминокислот в ооцитах Xenopus, инъецированных мРНК из мозга крысы или цыпленка. Эти авторы сообщили, что при концентрации, более низкой, чем концентрация, являющаяся антагонистической для глутамат-рецепторной функции, как спермин, так и филантотоксин потенциируют действия передающих возбуждение аминокислот и некоторых других нейротрансмиттеров. На основании этих и других данных Brackley et al. предположили, что ариламиновые токсины могут путем неспецифического связывания с мембранами возбуждаемых клеток уменьшать текучесть мембран и изменять функцию рецептора. Обоснованность этой интригующей идеи для функции NMDA-рецептора не находит хорошего подтверждения в двух недавних исследованиях по связыванию. Reynolds сообщил, что аргиотоксин 636 ингибирует связывание [3H]MK-801 с мембранами мозга крысы способом, который является нечувствительным к глутамату, глицину или спермидину. Этот автор сделал вывод, что аргиотоксин 636 проявляет новое ингибиторное действие на комплекс NMDA-рецептора путем связывания с одним из сайтов Мg2+, локализованных в ионном канале с NMDA-воротами. Данные по связыванию, сообщенные Williams et al., поддерживают вывод, что аргиотоксин 636 не действует первично в модуляторном сайте полиамина на NMDA-рецепторе, а скорее действует непосредственно путем образования зависимого от активности блока ионного канала. Уже известно, что такие соединения, как фенциклидин и кетамин, могут блокировать ионные каналы, связанные с мышечными глутаматными рецепторами членистоногих и NMDA-рецепторами млекопитающих. Таким образом, представляется возможным, что глутаматные рецепторы позвоночных и беспозвоночных имеют общие дополнительные сайты связывания для аллостерических модуляторов функции рецептора, возможно, родственные сайтам связывания двухвалентных катионов. Понятно, что необходимы значительные дополнительные исследования для определения, определяют ли ариламины такой новый регуляторный сайт".
Usherwood and Blagbrough (Spider Toxins Affecting Glutamate Receptors: Polyaminesin Therapeutic Neurochemistry. Pharmacol. Therap. 52: 245, 1991) описывают предполагаемый внутриклеточный сайт связывания для арилалкиламиновых токсинов (полиаминамидных токсинов), расположенный в поле мембранного потенциала, называемом фильтром селективности QUIS-R-канала. Эти авторы постулируют, что сайт связывания для полиаминамидных токсинов может встречаться вблизи внутреннего входа канала с воротами QUIS-R мышцы саранчи. Авторы также отмечают, что один такой токсин, аргиотоксин-636, является селективным антагонистом NMDA-рецептора в культивируемых кортикальных нейронах крысы.
Gullak et al. (CNS binding sites of the novel NMDA-antagonist Arg-636. Soc. Neurosci. Abst. 15: 1168, 1989) описывают аргиотоксин-636 (Arg-636) как полиаминовый (арилалкил-аминовый) компонент токсина яда паука. Указывается, что этот токсин ингибирует индуцируемое NMDA повышение цГМФ неконкурентным способом. Авторы утверждают, что:
"[125I]Аrg-636 связывался с мембранами переднего мозга крысы с величинами Kd и Вmах 11,25 мкМ и 28,95 пмоль/мг белка (со специфичностью 80%). Способность других известных полиаминов и недавно обнаруженных полиаминов из Agelenopsis aperta ингибировать связывание соответствовала нейроактивности функциональных антагонистов NMDA. Никакие другие испытанные соединения не были способны ингибировать специфическое связывание".
Затем эти авторы утверждают, что полиамины (арилалкил-амины) могут быть антагонистами в отношении ответов на NMDA посредством взаимодействия с мембранными ионными каналами.
Seymour and Mena (In vivo NMDA antagonist activity of the polyamine spider venom component, argiotoxm-636. Soc. Neurosci. Abst. 15: 1168, 1989) описывают исследования, которые должны были показать, что аргиотоксин-636 не влияет значительно на локомоторную активность при дозах, которые являются эффективными против аудиосенсорных эпилептических припадков у мышей DBA/2, и что он значительно противодействует NMDA-индуцируемым приступам эпилепсии с минимальной эффективной дозой 32 мг/кг, вводимой подкожно (s.c.).
Herold and Yakash (Anesthesia and muscle relaxation with intrathecal injections of AR636 and AG489, two acylpolyamine spider toxins, in rats. Anesthesiology 77: 507, 1992) описывают исследования, которые показывают, что арилалкиламиновый аргиотоксин-636 (ARG636), но не агатоксин-489 (AG489) производит миорелаксацию и анестезию после внутриоболочечного введения в крыс.
Williams (Effects of Agelenopsis aperta toxins on the N-methyl-D-aspartate receptor: Polyamine-like and high-affinity antagonist actions. J. Pharmacol. Exp. Therap. 266: 231, 1993) сообщает, что α -агатоксины (арилалкиламины) Agel-489 и Agel-505 усиливают связывание [3H]MK-801 с NMDA-рецепторами на мембранах, полученных из мозга крысы, посредством действия при стимуляторном полиаминовом рецепторе; агонисты полиаминового рецептора устраняли стимуляторные действия Agel-489 и Agel-505, а антагонисты полиаминового рецептора ингибировали стимуляторное действие Agel-505. Более высокие концентрации Agel-489 и Agel-505 и аргиотоксин-636 при всех испытанных концентрациях проявляли ингибирующие действия на связывание [3H]MK-801. В ооцитах Xenopus с зажимами с напряжением при -70 мВ Agel-505 ингибировал ответы на NMDA с IC50 13 нМ; это действие Agel-505 имело место при концентрациях, приблизительно в 10000 раз более низких, чем концентрации, влияющие на связывание [3H]MK-801. Ответные реакции на каинат ингибировались только на 11% 30 нМ Agel-505. Антагонизм Agel-505 в отношении NMDA-индуцируемых токов сильно зависел от напряжения, что согласуется с ингибирующим действием на открытые каналы этого токсина. Williams утверждает:
"Хотя α -агатоксины могут взаимодействовать при положительном аллостерическом сайте полиамина на NMDA-рецепторе, стимулирующие действия, производимые этим взаимодействием, могут маскироваться в функциональных тестах вследствие отдельного действия этих токсинов в качестве высокоаффинных, неконкурентных антагонистов этого рецептора".
Brackley et al. (Selective antagonism of native and cloned kainate and NMDA-receptors by polyamine-containing toxins, J. Pharmacol. Exp. Therap. 266: 1573, 1993) сообщили, что полиаминсодержащие токсины (арилалкиламины) филантотоксин-343 (PhTX-343) и аргиотоксин-636 (Arg-636) производят обратимое, неконкурентное, частично потенциал-зависимое антагонистическое действие на индуцируемые каинатом и NMDA токи в ооцитах Xenopus, инъецированных РНК мозга крысы. Было показано, что Arg-636 является селективным для индуцируемых NMDA ответов (IС50=0,7 мкМ), тогда как PhTX-343 был селективным для индуцируемых каинатом ответов (IC50=0,12 мкМ) по сравнению с NMDA-индуцируемыми ответами (IС50=2,5 мкМ). Аrg-636 более сильно противодействовал ответам на NMDA в ооцитах Xenopus, экспрессирующих клонированные субъединицы NMDAR1 (IC50=0,05 мкМ), чем ответам на каинат в ооцитах, экспрессирующих клонированные субъединицы GluR1 (IС50=3,4 мкМ) или субъединицы GluR1+GluR2 (IC50=300 мкМ). РhТХ-343, с другой стороны, был эквипотентным при противодействии NMDAR1 (IС50=2,19 мкМ) и GluR1 (IC50=2,8 мкМ), но гораздо менее сильным против субъединиц GluR1+GluR2 (IС50=270 мкМ).
Raditsch et al. (Subunit-specific block of cloned NMDA receptors by argiotoxin-636. FEBS Lett. 324: 63, 1993) сообщили, что Arg-636 более сильно противодействует ответам в ооцитах Xenopus, экспрессирующих субъединицы NMDAR1+NMDAR2A (IС50=9 нМ) или субъединицы NMDAR1+NMDAR2 С (IС50=460 нМ), даже хотя все эти субъединицы рецептора содержат остаток аспарагина в вероятном образующим пору трансмембранном районе II (сайте Q/R, обсужденном выше). Авторы утверждают, что большое различие в чувствительности к Arg-636 между каналами NMDAR1+NMDAR2A и NMDAR1+NMDAR2C "должно создаваться другими структурными детерминантами".
Herlitz et al. (Argiotoxin detects molecular differences in AMPA receptor channels. Neuron 10: 1131, 1993) сообщают, что Arg-636 является антагонистом подтипов АМРА-рецепторов с потенциал-зависимым и зависимым от использования действием, что согласуется с ингибированием открытых каналов. Arg-636 сильно противодействует проницаемым для Са2+ АМРА-рецепторам состоящим из субъединиц GluRAi (Ki =0,35 мкМ), GluRCi (Ki=0,23 мкМ) или GluRDi (Ki=0,43 мкМ), хотя является по существу неэффективным против непроницаемых для Са2+ субъединиц GluRBi при концентрациях до 11 мкМ. Другие данные, сообщаемые этими исследователями, убедительно подтверждают предположение, что сайт Q/R в предполагаемом образующем пору трансмембранном районе II имеет первичное значение в определении силы Аrg-636 и проникаемости Са2+.
Blaschke et al. (A single amino acid determines the subunit-specific spider toxin block of α -amino-3-hydroxy-5-methylisoxasol-4-propionate/kainate receptor channels. Proc. Natl. Acad. Sci. USA 90: 6528, 1993) сообщают, что арилалкиламин JSTX-3 сильно противодействует ответам на каинат в ооцитах Xenopus, экспрессирующих субъединицы GluR1 (IC50=0,04 мкМ) или GluR3 (IC50=0,03 мкМ), но на экспрессируемые рецепторы, в которых присутствует субъединица GluR2, по существу не действует этот токсин. Исследования с сайт-направленным мутагенезом дают убедительные указания на то, что сайт Q/R является первичным сайтом, влияющим на силу токсина.
Nakanishi et al. (Bioorganic studies of transmitter receptors with philanthotoxin analogs. Pure Appl. Chem., in press) синтезировали ряд очень сильнодействующих фотоаффинно меченных аналогов филантотоксина (PhTX). Такие аналоги исследовались на экспрессируемых никотиновых холинергических рецепторах в качестве модельной системы для оперируемых рецепторами кальциевых каналов. Эти исследователи предполагают, что эти аналоги PhTX блокируют ионный канал гидрофобным головным участком токсина, связывающимся с сайтом вблизи цитоплазматической поверхности, тогда как полиаминовый хвост простирается в ионный канал со стороны цитоплазмы.
Сущность изобретения
Заявителем были исследованы разнообразные по структуре и биологической активности арилалкиламины (иногда называемые ариламиновыми токсинами, полиаминовыми токсинами, ацилполиаминовыми токсинами или полиаминамидными токсинами) в яде пауков и ос и обнаружено, что некоторые из арилалкиламинов, присутствующих в этих ядах, действуют как сильные неконкурентные антагонисты оперируемых глутаматным рецептором Са2+-каналов в центральной системе млекопитающих. Хотя эти арилалкиламиновые соединения содержат в их структуре полиаминовую часть, они не похожи на другие известные простые полиамины в связи с тем, что они обладают чрезвычайно сильными и специфическими действиями на определенные типы оперируемых рецепторами Са2+-каналов.
С использованием нативных арилалкиламинов в качестве ведущих (основных) структур синтезировали и испытали ряд аналогов. Первоначальные открытия на арилалкиламинах, выделенных и очищенных из яда, были подтверждены с применением синтетических арилалкиламинов. Эти соединения являются небольшими молекулами (мол. масса < 800) с продемонстрированной эффективностью в моделях in vivo ишемического удара и эпилепсии. В качестве модели оперируемых рецепторами Са2+-каналов использовали комплекс NMDA-рецептор-ионофор. Было показано, что выбранные арилалкиламины ингибируют опосредованные NMDA-рецептором ответы по новому механизму. Кроме того, уникальный поведенческий фармакологический профиль этих соединений предполагает, что они вряд ли индуцируют РСР-подобную психодисплетическую (галлюциногенную) активность и нарушение познавательной способности, которые характеризуют другие ингибиторы NMDA-рецептора. Наконец, арилалкиламины являются уникальными среди антагонистов NMDA-рецептора в том смысле, что они способны противодействовать определенным подтипам клонированных и экспрессированных АМРА-рецепторов, а именно тем, которые проницаемы для Са2+. Следовательно, арилалкиламины являются единственным известным классом соединений, способных противодействовать опосредованным глутаматным рецептором увеличениям цитозольного Са2+, независимо от фармакологического определения подтипа рецептора. Кроме того, арилалкиламины ингибируют оперируемый другим рецептором Са2+-канал никотиновым холинергическим рецептором. Если избыточные и пролонгированные увеличения количества цитозольного Са2+ связывали с этиологией нескольких неврологических нарушений и заболеваний, такие арилалкиламины являются ценными, являющимися маленькими молекулами, исходными материалами для разработки новых терапевтических средств для различных неврологических нарушений и заболеваний.
Заявитель определил, что выбранные арилалкиламины связываются с высокой аффинностью при новом сайте на комплексе NMDA-рецептор-ионофор, который до настоящего времени не был идентифицирован, и что арилалкиламины не связываются с высокой аффинностью при любых известных сайтах (глутаматсвязывающем сайте, глицинсвязывающем сайте, МК-801-связывающем сайте, Мg2+-связываюшем сайте, Zn2+-связывающем сайте, полиаминсвязывающем сайте, сигма-связывающем сайте) на комплексе NMDA-рецептор-ионофор. Это определение позволило заявителю разработать способы и протоколы, при помощи которых могут быть идентифицированы соединения, которые обеспечивают как терапевтически применимые соединения, так и исходные соединения для разработки других терапевтически применимых соединений. Эти соединения могут быть идентифицированы при помощи скрининга на соединения, которые связываются при новом сайте связывания арилалкиламина, и путем определения, имеет ли такое соединение требующиеся биологические, фармакологические и физиологические свойства.
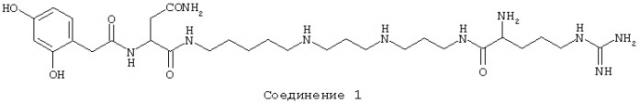
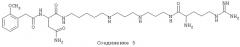
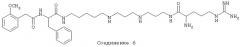
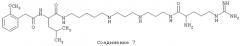
Способ включает стадию идентификации соединения, которое связывается с оперируемым рецептором Са2+-каналом при сайте, связываемом арилалкиламиновыми соединениями, названными здесь как соединение 1, соединение 2 или соединение 3 и имеющими структуру, показанную ниже.
Под "терапевтически применимым соединением" имеют в виду соединение, которое потенциально применимо в лечении нарушения или патологического состояния. Соединение, обнаруживаемое этим способом скрининга, характеризуется как имеющее потенциальную терапевтическую применимость в лечении, поскольку еще не были проведены клинические тесты для определения действительной терапевтической применимости.
Под "неврологическим нарушением или заболеванием" имеют в виду нарушение или заболевание нервной системы, в том числе (но не только) глобальный или очаговый ишемический или геморрагический удар, травму головы, повреждение спинного мозга, ишемию спинного мозга, индуцированное ишемией или гипоксией повреждение нервных клеток, вызываемое гипоксией повреждение нервных клеток, например, при остановке сердца или неонатальном дистрессе, эпилепсию, состояние тревоги, нейропсихиатрические заболевания или нарушения познавательной способности вследствие ишемии или гипоксии, такие как нарушения, которые часто встречаются как следствие хирургии сердца при экстракорпоральном (искусственном) кровообращении, и нейродегенеративное заболевание. Под "неврологическим нарушением или заболеванием" подразумевают также такие болезни и состояния, при которых могут быть показаны, полезны, рекомендованы или предписаны нейропротекторы, антиконвульсивные средства, транквилизаторы, аналгетики, миорелаксанты и/или вспомогательные средства в общей анестезии.
Под "нейродегенеративным заболеванием" подразумевают заболевания, включающие (но не только) болезнь Альцгеймера, болезнь Хантингтона, болезнь Паркинсона и боковой амиотрофический склероз (ALS).
"Под "нейропротектором" имеют в виду соединение, способное предотвращать повреждение или гибель нейронов, связанные с неврологическим нарушением или заболеванием.
Под "противосудорожным средством" подразумевают соединение, способное к уменьшению судорог, вызываемых такими состояниями, как простые парциальные эпилептические припадки, сложные парциальные эпилептические припадки, эпилептический статус и вызванные травмой эпилептические припадки, которые встречаются после повреждения головы, в том числе хирургии головы.
Под "трансквилизатором" подразумевают соединение, способное облегчать боль путем изменения восприятия болевых стимулов, без индуцирования анестезии или потери сознания.
Под " миорелаксантом" имеют в виду соединение, которое уменьшает мышечное напряжение.
Под "вспомогательным средством в общей анестезии" имеют в виду соединение, применимое в соединении с анестезирующими агентами, в индуцировании потери способности воспринимать боль, связанной с потерей сознания.
Под "сильнодействующим" или "активным" имеют в виду, что соединение имеет активность при оперируемых рецепторами кальциевых каналах, в том числе NMDA-рецепторах, Са2+-проникаемых АМРА-рецепторах и никотиновых холинергических рецепторах, с величиной IС50 менее 10 мкМ, более предпочтительно менее 100 нМ и даже более предпочтительно менее 1 нМ.
Под термином "селективный" имеют в виду, что соединение является сильнодействующим при оперируемых рецепторами кальциевых каналах, как описано выше, но является в 10 раз менее сильнодействующим, более предпочтительно в 50 раз и даже более предпочтительно в 100 раз менее сильнодействующим при других нейротрансмиттерных рецепторах, оперируемых нейротрансмиттерными рецепторами ионных каналах или потенциалзависимых ионных каналах.
Под "биохимическими и электрофизиологическими тестами функции оперируемых рецепторами кальциевых каналов" имеют в виду тесты, предназначенные для обнаружения биохимическими или электрофизиологическими средствами функциональной активности оперируемых рецепторами кальциевых каналов. Примеры таких тестов включают, но не только, fura-2-флуорометрический тест для цитозольного кальция в культивируемых зернистых клетках мозжечков крыс (см. пример 1 и пример. 2), электрофизиологические тесты (patch сlаmр="пэтч-кламп") (см. пример 3 и пример 27), тесты синаптической передачи возбуждения на срезах гиппокампа (см. пример 5), тесты связывания радиолигандов (см. пример 4, пример 24, пример 25 и пример 26) и нейропротекторные тесты in vitro (см. пример 6).
Под "эффективностью" подразумевают, что с выбранным соединением детектируется значимый уровень желаемой активности; под "значимым" имеют в виду статистическую значимость при уровне р<0,05.
Под "нейропротекторной активностью" подразумевают эффективность в лечении неврологических нарушений или заболеваний, в том числе, но не только, глобального и очагового ишемического и геморрагического удара, травмы головы, повреждения спинного мозга, ишемии спинного мозга, индуцируемого ишемией или гипоксией повреждения нервных клеток, индуцируемого гипоксией повреждения нервных клеток, например, при остановке сердца или неонатальном дистрессе, нейропсихиатрических нарушений или нарушений познавательной способности вследствие ишемии или гипоксии, таких как нарушения, которые часто встречаются как следствие хирургии сердца при экстракорпоральном кровоснабжении, и нейродегенеративные заболевания, такие как болезнь Альцгеймера, болезнь Хантингтона, болезнь Паркинсона и боковой амиотрофический склероз (ALS) (см. примеры 7 и 8 ниже).
Под "антисудорожной активностью" имеют в виду эффективность в уменьшении судорог, вызываемых такими состояниями, как простой парциальный эпилептический припадок, сложный парциальный эпилептический припадок, эпилептический статус и индуцируемый травмой эпилептический припадок, такой как встречающийся после повреждения головы, в том числе при хирургии головы (см. примеры 9 и 10 ниже).
Под "анксиолитической" активностью имеют в виду, что соединение уменьшает чувство страха, неопределенности и тревоги, которые характерны для состояния тревоги.
Под ″ аналгезирующей активностью (болеутоляющей)" имеют в виду, что соединение вызывает отсутствие боли в ответ на стимул, который в норме был бы болезненным. Такая активность могла бы использоваться в клинических состояниях, таких как острая и хроническая боль, в том числе, но не только, для преразгрузочной предоперативной аналгезии; для периферических невропа