Полипептид, расщепляющий полисахарид, содержащий сульфатированную фукозу, кодирующая его днк, способ его получения, экспрессирующий вектор, способ получения трансформированной e.coli
Иллюстрации
Показать всеИзобретение относится к области генной инженерии и биотехнологии и может быть использовано в медико-биологической и фармацевтической промышленности. Из клеток штамма р. Alteromonas, продуцирующего фермент, который расщепляет полисахарид, включающий сульфатированную фукозу, выделен ген, кодирующий указанный фермент. Установлено наличие двух открытых рамок считывания (ORF-1 и ORF-2) и определены их последовательности. Путем экспрессии этих последовательностей в E.coli получены активные рекомбинантные формы фермента, способного эффективно гидролизовать полисахарид, содержащий сульфатированную фукозу, который не расщепляется под действием фукоиданазы, продуцируемой Flavobacterium sp. SA-0082 (FERM ВР-5402). Применение изобретения обеспечивает возможность получения больших количеств качественного сырья для фармацевтических препаратов. 5 с. и 1 з.п.ф-лы, 5 ил., 2 табл.
Реферат
Область техники
Настоящее изобретение относится к гену, который кодирует полипептид, обладающий расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу, применимый для структурного анализа полисахарида, содержащего сульфатированную фукозу, а также для получения продуктов разрушения указанного полисахарида; к способу получения указанного полипептида методами генной инженерии; к полипептиду, полученному указанным способом.
Уровень техники
Полисахарид, содержащий сульфатированную фукозу, полученный из морских водорослей, который называют фукоидан, является смесью сульфатированных полисахаридов, в основном состоящей из фукозы, и который также содержит галактозу, глюкуроновую кислоту, ксилозу, маннозу, глюкозу и т.д. Типы и число таких составляющих сахаров изменяются в зависимости от вида морских водорослей, используемых в качестве исходного материала. Например, есть данные, в соответствии с которыми комерческий фукоидан, производимый Sigma, подразделяется более чем на 13 молекулярных разновидностей [Carbohydrate Research, 255, 213-224 (1994)]. Предварительно их классифицируют на два типа, в одном из которых уроновая кислота, по существу не содержится, а основным составляющим сахаром является фукоза, а другой содержит уроновую кислоту, но в качестве составляющих сахаров содержатся фукоза и манноза.
Относительно биологических активностей полисахарида, содержащего сульфатированную фукозу, сообщалось о различных активностях, таких как потенцирование макрофагальной активности, ингибирование метастазирования злокачественных опухолей и антикоагуляционная активность крови. Однако поскольку полисахарид, содержащий сульфатированную фукозу, представлен несколькими молекулярными разновидностями после выделения и очистки полисахарида, содержащего сульфатированную фукозу, необходимо исследовать, какая его молекулярная разновидность действительно обладает активностью. Однако стандартными методами невозможно провести разделение достаточно эффективно, и поэтому трудно получить большое количество продукта, применимого в качестве фармацевтического препарата. Кроме того, полисахарид, содержащий сульфатированную фукозу, является сульфатированным полисахаридом, имеющим большую молекулярную массу, и при применении его в качестве фармацевтического препарата в неизмененном виде, возникают проблемы с точки зрения антигенности, гомогенности, антикоагулянтной активности и т.д., вследствие чего считается необходимым расщепление полисахарида, содержащего сульфатированную фукозу, в определенной степени.
Способ, в котором полисахарид, содержащий сульфатированную фукозу, расщепляется ферментативно для получения низкомолекулярных продуктов, является выгодным, поскольку реакцию можно проводить в мягких условиях и получать однородные продукты расщепления соответственно субстратной специфичности фермента. Уже имеются данные, что awabi (морское ушко), гребешок, морской еж, морские микроорганизмы и т.д. продуцируют фермент, разрушающий полисахарид, содержащий сульфатированную фукозу. Однако такой фермент, как правило, содержится в живых организмах лишь в небольших количествах, и, кроме того, имеется множество ферментов, разрушающих полисахарид, содержащий сульфатированную фукозу, вследствие чего необходимо проводить различные стадии очистки для получения отдельного фермента. Более того, аминокислотные последовательности и генетические структуры данных ферментов полностью до сих пор не ясны.
Проблемы, решаемые изобретением
Целью настоящего изобретения является обеспечение гена, кодирующего полипептид, имеющий расщепляющую активность по отношению к полисахариду, содержащему сульфатированную фукозу, применимый для получения и структурного анализа полисахарида, содержащего сульфатированную фукозу, а также для получения расщепленного полисахарида, содержащего сульфатированную фукозу. Настоящее изобретение также призвано обеспечить полипептид, который можно получать методами генной инженерии, применяя указанный ген, и обладающий расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу.
Способы решения проблем
Авторы настоящего изобретения провели интенсивное исследование гена микроорганизмов, которые продуцируют ферменты, расщепляющие полисахарид, содержащий сульфатированную фукозу, для того чтобы выяснить аминокислотную последовательность полипептида, обладающего расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу, и кодирующую его нуклеотидную последовательность. В результате они выяснили, что существует по два типа гена, кодирующего полипептид, обладающий расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу, полученный из бактерий, принадлежащих к родам Alteromonas и Flavobacterium соответственно, определили их полную нуклеотидную последовательность, выяснили аминокислотную последовательность указанного полипептида и разработали способ промышленно выгодного получения полипептида, обладающего расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу, применяя указанный ген, таким образом осуществив настоящее изобретение.
Суть настоящего изобретения такова, что первый аспект настоящего изобретения относится к выделенному гену, содержащему последовательность ДНК, кодирующую полипептид, обладающий расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу, или имеющий функционально идентичную активность, как сказано выше.
Второй аспект настоящего изобретения относится к рекомбинантной ДНК, содержащей ген, описанный в первом аспекте настоящего изобретения.
Третий аспект настоящего изобретения относится к экспрессирующему вектору, где рекомбинантная ДНК, описанная во втором аспекте настоящего изобретения, встроена в микроорганизмы, животные клетки или растительные клетки, применяемые в качестве клеток-хозяев.
Четвертый аспект настоящего изобретения относится к трансформанту, который трансформирован экспрессирующим вектором, представленным в третьем аспекте настоящего изобретения.
Пятый аспект настоящего изобретения относится к способу получения полипептида, обладающего расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу, или имеющего функционально идентичную активность, который характеризуется тем, что трансформант согласно четвертому аспекту настоящего изобретения инкубируют и полипептид, обладающий расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу, или имеющий функционально идентичную активность, выделяют из продукта инкубации.
Шестой аспект настоящего изобретения относится к полипептиду, имеющему аминокислотную последовательность, представленную в любой из SEQ ID NO: 1 до NO: 4 в списке последовательностей, и имеющему расщепляющую активность по отношению к полисахариду, содержащему сульфатированную фукозу, или к полипептиду, имеющему функционально идентичную ему активность.
Краткое пояснение чертежей
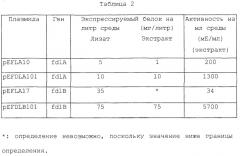
На фиг.1 показаны положения ORF-1 и ORF-2.
На фиг.2 показан коэффициент преципитации полисахарида, содержащего сульфатированную фукозу.
На фиг.3 показано положение fdlA.
На фиг.4 показано положение fdlB.
Фиг.5 представляет собой хроматограмму, полученную с использованием DEAE-сефарозы FF.
Осуществление изобретения
Настоящее изобретение будет конкретно проиллюстрировано ниже.
Настоящее изобретение относится к гену, кодирующему полипептид, обладающий расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу. Примером полипептида, кодируемого указаннутым геном, является полипептид, имеющий эндо-расщепляющую активность по отношению к полисахариду, содержащему сульфатированную фукозу, полученный из бактерий рода Alteromonas, что показано далее в (1):
(1) действие на полисахарид, содержащий сульфатированную фукозу, имеющий следующие физико-химические свойства (в дальнейшем называемый "полисахарид-F, содержащий сульфатированную фукозу") и расщепление указанного полисахарида, содержащего сульфатированную фукозу:
(а) составляющие сахариды: по существу не содержащие уроновую кислоту и
(б) по существу не способный расщепляться под действием фукоиданазы, продуцируемой Flavobacterium sp. SA-0082 (FERM BP-5402).
Что касается полипептида, обладающего расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу, существует фермент, эндо-расщепляющий полисахарид, содержащий сульфатированную фукозу, продуцируемый штаммом Alteromonas sp. SN-1009, и указанный фермент может быть получен способом, упомянутым в ссылочном примере 1-(3).
Полисахарид-F, содержащий сульфатированную фукозу, может быть получен, как описано в ссылочном примере 1.
Фукоиданаза, продуцируемая штаммом Flavobacterium sp. SA-0082 (FERM BP-5402), может быть получена, как описано в ссылочном примере 5.
Относительно других полипептидов, имеющих расщепляющую активность по отношению к полисахариду, содержащему сульфатированную фукозу, в пример можно привести полипептид, обладающий расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу, как показано ниже в (2), полученный из бактерий рода Flavobacterium:
(2) действие на полисахарид, содержащий сульфатированную фукозу, имеющий следующие физико-химические свойства (в дальнейшем называемый "полисахарид-U, содержащий сульфатированную фукозу") и расщепление указанного полисахарида, содержащего сульфатированную фукозу, посредством чего высвобождается одно из соединений нижеприведенных формул [I], [II], [III] и [IV].
(в) составляющие сахариды: содержащие уроновую кислоту и
(г) способный расщепляться под действием фукоиданазы, продуцируемой Flavobacterium sp. SA-0082 (FERM BP-5402).
Примером полипептида, обладающего расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу, является фукоиданаза, продуцируемая штаммом Flavobacterium sp. SA-802, и указанная фукоиданаза может быть получена способом, описанным в ссылочном примере 5.
В дальнейшем смесь полисахарида-F, содержащего сульфатированную фукозу, и полисахарида-U, содержащего сульфатированную фукозу, будет называться смесью полисахаридов, содержащих сульфатированную фукозу.
Полипептид, обладающий расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу, в настоящем изобретении означает не только фермент, расщепляющий полисахарид, содержащий сульфатированную фукозу, природного типа, но также полипептид, аминокислотная последовательность которого модифицирована делецией, замещением, вставкой, добавлением и т.д. аминокислот в аминокислотной последовательности природного типа до тех пор, пока данный полипептид будет иметь расщепляющую активность по отношению к полисахариду, содержащему сульфатированную фукозу.
В данном случае примером фермента природного типа, расщепляющего полисахарид, содержащий сульфатированную фукозу, могут служить ферменты, полученные из бактерий рода Alteromonas и бактерий рода Flavobacterium. Однако настоящее изобретение не ограничивается ими и, разумеется, охватывает ферменты, полученные из других бактерий, микроорганизмов, таких как дрожжи, плесневые грибы, Ascomycetes, Ваsidiomycetes и т.д., и из организмов, таких как растения и животные.
В настоящем изобретении значение термина полипептид, имеющий функционально идентичную активность, рассмотрено ниже.
В природных белках помимо полиморфизма и мутации гена, кодирующего указанный белок, возможны такие мутации как делеция, добавление, вставка, замещение и т.д. аминокислотных остатков аминокислотной последовательности являются результатом реакции модификации белка после продукции in vivo или в ходе очистки, но вопреки этому известно, что некоторые из них имеют по существу такую же физиологическую и биологическую активность, как и белок, не претерпевший мутаций. Таким образом, вещество, имеющее структурное различие, но не имеющее большого различия с точки зрения их функции, будет называться полипептидом, имеющим функционально идентичную активность.
Употребление данного термина справедливо и в случае, когда указанные мутации искусственно введены в аминокислотную последовательность белка, и в таком случае можно получить гораздо больше вариантов. Однако такой вариант может быть интерпретирован как полипептид, имеющий функционально идентичную активность, поскольку он проявляет по существу такую же физиологическую активность, как и полипептид без мутаций.
Например, считается, что остаток метионина, находящийся на N-конце белка, экспрессируемого Escherichia coli, во многих случаях удаляется действием метионинаминопептидазы, но в зависимости от типа белка продуцируются как продукт, содержащий, так и не содержащий метиониновый остаток. Однако наличие или отсутствие метионинового остатка обычно не влияет на активность белка. Также известно, что полипептид, в котором определенный цистеиновый остаток в аминокислотной последовательности человеческого интерлейкина-2 (IL-2) замещен серином, сохраняет активность интерлейкина-2 [Science, 224, 1431, (1984)].
Кроме того, когда продукцию белка выполняют методами генной инженерии, это часто делают для экспрессия гибридного белка. Например, N-конец белка, полученного из другого белка, присоединяют к N-концу желаемого белка для того, чтобы увеличить количество экспрессируемого желаемого белка, или присоединяют подходящую пептидную цепь и экспрессируют на N-конце или С-конце желаемого белка таким образом, что очистить желаемый белок становится легче, используя носитель, имеющий сродство к указанной присоединенной пептидной цепи.
Более того, часто замечается, что полипептид, в котором проведена, по крайней мере, одна делеция, добавление, вставка, замещение одного или более аминокислотных остатков в аминокислотной последовательности желаемого белка, имеет функционально идентичную активность с таковой желаемого белка. Такие полипептид и ген, который кодирует указанный полипептид, также охватываются настоящим изобретением независимо от того, является ли указанный полипептид природным и выделенным или искусственно полученным.
Известно, что обычно существует от 1 до 6 типов кодонов (комбинация из трех нуклеотидов), которые кодируют аминокислоту в гене для каждого типа аминокислоты. Соответственно ген, который кодирует аминокислотную последовательность, находится в избытке, что обусловлено особенностями аминокислотной последовательности. Ген никогда не присутствует в стабильном состоянии в природе, а наблюдаемые изменения в нуклеиновой кислоте являются нередкими. В некоторых случаях изменения, происходящие в гене, не влияют на аминокислотную последовательность, кодируемую им (что называется молчащей мутацией), и в таком случае продуцируются различные гены, кодирующие одну и ту же аминокислотную последовательность. Соответственно даже если выделить ген, который кодирует конкретную аминокислотную последовательность, возможно, что в течение серии пассажей в живых организмах, содержащих данный ген, производится множество типов генов, кодирующих одинаковую аминокислотную последовательность.
Далее, не трудно искусственно получить множество типов генов, кодирующих одинаковую аминокислотную последовательность при условии применения различных методов генной инженерии.
Например, в некоторых случаях продукция экспрессируемого белка является низкой, что обеспечивается методами генной инженерии, в которых используемый кодон родительского гена, кодирующего желаемый белок, встречается в клетке-хозяине с низкой частотой. В этом случае была сделана попытка увеличения экспрессии желаемого белка с помощью искусственного превращения кодона в такой, который часто встречается в клетках-хозяевах, без изменения кодируемой аминокислотной последовательности. И это, не говоря о том, что подобным образом может быть искусственно получено множество типов гена, кодирующего конкретную аминокислотную последовательность. Соответственно такой искусственно полученный и многообразный полинуклеотид также охватывается настоящим изобретением, поскольку кодирует аминокислотную последовательность, которая раскрыта в настоящем изобретении.
Кроме того, во многих случаях гены, кодирующие полипептиды, имеющие функционально идентичную активность, имеют гомологию. Поэтому ген, который способен к гибридизации в жестких условиях с геном, применяемым по настоящему изобретению, и кодирующий полипептид, обладающий расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу, также охватывается данным изобретением.
Ниже настоящее изобретение будет конкретно проиллюстрировано на примере штамма Alteromonas sp. SN-1009 и штамма Flavobacterium sp. SA-0082.
Штамм Alteromonas sp. SN-1009 депонирован в National Institute of Bioscience and Human-Technology, Agency of Industrial Science and Technology (1-3, Higashi 1-chome, Tsukuba, Ibaraki, 305-8566 JAPAN) 13 февраля 1996 года (дата первоначального поступления) под номером доступа FERM ВР-5747 в качестве международного поступления. Штамм Flavobacterium sp. SA-0082 депонирован в National Institute of Bioscience and Human-Technology, Agency of Industrial Science and Technology 29 марта 1995 года (дата первоначального поступления) под номером доступа FERM ВР-5402 в качестве международного поступления.
Для того чтобы получить ген, кодирующий полипептид, обладающий расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу, продуцируемому штаммом Alteromonas sp. SN-1009 или штаммом Flavobacterium sp. SA-0082, например, можно использовать метод гибридизации, метод ПЦР или их комбинацию. В данных методах необходим зонд, который способен гибридизоваться с указанным геном, или праймер, который пригоден для амплификации указанного гена или его части методом ПЦР, но поскольку совершенно не известны аминокислотная последовательность и структура гена полипептида, обладающего расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу, продуцируемого этими штаммами, невозможно получить синтетический олигонуклеотид, который мог бы служить зондом или праймером. Поэтому в первую очередь исследуют частичную аминокислотную последовательность фермента, расщепляющего полисахарид, содержащий сульфатированную фукозу, продуцируемого указанными микроорганизмами, и получение синтетического олигонуклеотида, применимого в качестве зонда или праймера.
Сначала культивируют штамм Alteromonas sp. SN-1009 или штамм Flavobacterium sp. SA-0082 и затем каждый из продуцируемых ферментов, расщепляющих полисахарид, содержащий сульфатированную фукозу, выделяют из среды и очищают.
Далее получают информацию, касающуюся частичной аминокислотной последовательности каждого из выделенных ферментов, расщепляющих полисахарид, содержащий сульфатированную фукозу. Для того чтобы определить частичную аминокислотную последовательность, фермент, расщепляющий полисахарид, содержащий сульфатированную фукозу, например, подвергают анализу аминокислотной последовательности по Эдману в соответствии со стандартной методикой (например, можно использовать Protein Sequencer 476A, производимый Applied Biosys-tems), посредством чего может быть определена аминокислотная последовательность N-конца фермента, расщепляющего полисахарид, содержащий сульфатированную фукозу. Альтернативно, очищенный фермент, расщепляющий полисахарид, содержащий сульфатированную фукозу, подвергают ограниченному гидролизу, используя протеолитический фермент, имеющий высокую субстратную специфичность, такой как протеаза I Achromobacter, трипсин, обработанный N-тозил-L-фенилаланилхлорметилкетоном (ТРСК) и т.д., выделяют полученные пептидные фрагменты и очищают с помощью обратнофазовой ЖХВД, а очищенные пептидные фрагменты подвергают анализу аминокислотной последовательности, вследствие чего получают информацию об аминокислотной последовательности.
Полученная подобным способом информация, касающаяся частичной аминокислотной последовательности, конкретной для фермента, расщепляющего полисахарид, содержащий сульфатированную фукозу, выделяется и, основываясь на указанной информации, получают вырожденный олигонуклеотид со сконструированной и синтезированной последовательностью нуклеотидов. В то же время необходимо синтезировать длинный олигонуклеотид, имеющий низкую степень вырожденности, или, другими словами, олигонуклеотид, обладающий высокой специфичностью к гену, кодирующему полипептид, обладающий расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу. Конструкция олигонулеотида является важным показателем для аналога гена, кодирующего полипептид, обладающий расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу.
Далее, необходимо подобрать условия специфической гибридизации синтетического олигонуклеотида с геном, кодирующим полипептид, обладающий расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу, методом Саузерн-гибридизации.
Например, геномную ДНК штамма Alteromonas sp. SN-1009 или штамма Flavobacterium sp. SA-0082 полностью расщепляют подходящей рестриктазой, разделяют с помощью электрофореза в агарозном геле и подвергают блоттингу на нейлоновую мембрану или подобную стандартным методом. При проведении гибридизации нейлоновую мембрану сначала выдерживают при 65°С в течение нескольких часов в гибридизационном буфере, содержащем 6xSSC (1x SSC означает продукт, полученный путем растворения 8,77 г хлорида натрия и 4,41 г цитрата натрия в одном литре воды), 1% додецилсульфат натрия (SDS), 100 мкг/мл ДНК спермы лосося и 5х раствор Денхардта (содержащий 0,1% бычий сывороточный альбумин, поливинилпирролидон и фиколл), затем туда добавляют синтетический олигонуклеотид, меченный 32P и т.п., и смесь выдерживают при 42°С в течение ночи. Данную нейлоновую мембрану отмывают 1 хSSC, содержащим 0,1% SDS, при 42°С в течение 30 минут и подвергают авторадиографии для определения фрагментов ДНК, гибридизовавшихся с синтетическим олигонуклеотидным зондом. Для эффективности необходимо подобрать оптимальные условия, исследуя температуру инкубации, концентрацию соли в отмывающем буфере и т.д., принимая во внимание длину применяемого синтетического олигонуклеотида и комплементарность с геном, кодирующим полипептид, обладающий расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу.
Для получения фрагментов ДНК, определяемых подобным образом, содержащих ген, кодирующий полипептид с расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу, может быть использован способ, в котором фрагменты ДНК, соответствующие положению непосредственно определяемых полос, экстрагируют из геля и очищают, и библиотека, где фрагменты интегрируют в вектор из обычно используемой системы хозяин-вектор, и проводят вертикальную или горизонтальную гибридизацию в условиях, аналогичных таковым при Саузерн-гибридизации, для отбора и выделения клона, содержащего желаемые фрагменты ДНК. Альтернативно, геномную ДНК штамма Alteromonas sp. SN-1009 или штамма Flavobacterium sp. SA-0082 непосредственно расщепляют с помощью подходящей рестриктазы, создают библиотеку, где фрагменты интегрируют в вектор из обычно используемой системы хозяин-вектор и гибридизацию проводят аналогичным способом, вследствие чего отбирают и выделяют клон, содержащий желаемые фрагменты ДНК.
По отношению к системе хозяин-вектор, используемой здесь, может быть использована любая известная система, и ее примерами могут служить плазмидные векторы, такие как pUC18 и pUC19, при использовании в качестве хозяина Escherichia coli, или фаговой вектор, такой как фаг лямбда, хотя настоящее изобретение этим не ограничивается.
Относительно типа и управления такими системами хозяин-вектор могут быть использованы обычно применяемый тип и методика, упоминаемые, например, в "Molecular Cloning A Laboratory Manual", Second Edition, by J. Sambrook, et al., (published by Cold Spring Harbor Laboratory, 1989).
Когда можно выделить вектор, содержащий желаемые фрагменты ДНК, нуклеотидная последовательность желаемых фрагментов ДНК, встроенных в вектор, может быть определена в соответствии с традиционной методикой, такой как дидезокси-метод [Proceedings of the National Academy of Science, USA, 74, 5463 (1977)]. После сравнения определяемой нуклеотидной последовательности с данными N-концевого анализа, частичной аминокислотной последовательностью, молекулярной массой и т.д. фермента, расщепляющего полисахарид, содержащий сульфатированную фукозу, стало возможно узнать структуру гена в полученном фрагменте ДНК а также аминокислотную последовательность полипептида, который кодируется указанным геном.
Кроме того, может быть применен метод ПЦР как способ получения гена, кодирующего полипептид, обладающий расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу, используя олигонуклеотид, полученный на основе частичной аминокислотной последовательности указанного выше фермента, расщепляющего полисахарид, содержащий сульфатированную фукозу. Между тем, метод ПЦР с применением кассетной ДНК представляет собой метод, в котором фрагменты желаемого гена, применимые для гибридизационного метода, могут быть получены за короткое время с аминокислотной последовательности, содержащей небольшую информацию.
Например, геномную ДНК, выделенную стандартным методом из культуры клеток Flavobacterium sp. SA-0082, обрабатывают подходящей рестриктазой и лигируют с синтетической ДНК (кассетной ДНК), имеющей известную последовательность. Полученную конструкцию применяют как матрицу и ПЦР проводят, используя указанный геноспецифический олигонуклеотидный праймер, который сконструирован на основании информации об указанной выше частичной аминокислотной последовательности, и олигонуклеотидный праймер (кассетный праймер), комплементарный кассетной ДНК, посредством чего может быть проведена амплификация желаемых фрагментов ДНК. Относительно кассетной ДНК и кассетного праймера могут быть использованы, например, таковые, произведенные Takara Shuzo. Предпочтительно, чтобы кассетная ДНК содержала последовательность, соответствующую двум типам кассетных праймеров, и эффективнее, если сначала первую ПЦР проводят, используя праймер, находящийся далеко от сшивки по сайту рестрикции, и вторую ПЦР проводят, используя часть указанного реакционного раствора как матрицу и применяя внутренний праймер. Далее, относительно указанного геноспецифического олигонуклеотидного праймера, специфичность указанного гена становится выше, и возможность специфической амплификации желаемых фрагментов ДНК становится выше, когда конструктируют и параллельно синтезируют два типа праймеров, и верхний праймер применяется при первой ПЦР, а нижний праймер используется при второй ПЦР.
Однако поскольку нуклеотидная последовательность желаемого гена остается невыясненной, не всегда верно, что сайт рестрикции, используемый для сшивки кассетной ДНК, расположен в положении, подходящем для амплификации при ПЦР области, кодирующей частичную аминокислотную последовательность. Поэтому необходимо использовать различные типы рестриктаз кассетных ДНК. Кроме того, хотя ПЦР может проводиться в обычно применяемых условиях, как описано, например, в "PCR Technology" (edited by H.A.Eriich, published by Stockton Press, 1989), необходимо подобрать оптимальные условия для минимизации неспецифических полос амплификации с помощью выбора температуры отжига, числа циклов, концентрации ионов магния, концентрации термостабильной полимеразы и т.д., учитывая зависимость от длины используемого синтетического олигонуклеотида и комплементарности к гену, кодирующему полипептид, обладающий расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу.
ПЦР-смесь подвергают электрофорезу, например, в агарозном геле, для подтверждения наличия амплифицированных фрагментов ДНК. Эти фрагменты экстрагируют и очищают стандартным способом и встраивают в обычно применяемый в клонировании вектор, такой как pUC18 или pUC19, и их нуклеотидная последовательность может быть проанализирована, например, с использованием дидезоксиметода. Альтернативно, выделенные амплифицированные фрагменты ДНК могут быть подвергнуты прямому определению нуклеотидной последовательности с использованием кассетного праймера, применяемого при ПЦР. Когда в результате получают последовательность, кодирующую уже установленную частичную аминокислотную последовательность фермента, расщепляющего полисахарид, содержащий сульфатированную фукозу, и дополняющую последовательность праймера, делают вывод о том, что может быть получен ген, кодирующий указанный фермент, или фрагменты гена, гомологичные ему.
Когда фрагменты ДНК, полученные с помощью Саузерн-гибридизации или метода ПЦР, являются частью гена, кодирующего желаемый фермент, проводят скрининг геномной библиотеки с помощью гибридизации, применяя указанные фрагменты ДНК в качестве зонда, или с помощью ПЦР, используя в качестве праймера олигонуклеотид, полученный на основании нуклеотидной последовательности указанных фрагментов ДНК, посредством чего могут быть получены фрагменты ДНК, содержащие полную длину гена, кодирующего желаемый фермент.
Далее, когда геномную ДНК штамма Alteromonas sp. SN-1009 или штамма Flavobacterium sp. SA-0082 анализируют с помощью Саузерн-гибридизации, применяя ген фермента, расщепляющего полисахарид, содержащий сульфатированную фукозу, полученный, как описано выше, или часть гена фермента, по положению определяемой полосы возможно получить информацию о размере рестрикционных фрагментов геномной ДНК штамма Alteromonas sp. SN-1009 или штамма Flavobacterium sp. SA-0082, содержащих ген, кодирующий полипептид, обладающий расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу. Более того, можно сделать предположение о числе генов, кодирующих полипептид с расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу, а также о числе генов, комплементарных им, и фрагменты ДНК, содержащие эти гены, могут быть выделены с помощью уже описанного метода.
Факт, что фрагменты ДНК, полученные таким образом, содержат ген, кодирующий желаемый фермент, может быть подтвержден созданием экспрессирующего вектора, содержащего указанный фрагмент ДНК, выделенный на конечном этапе, проведением трансформации клетки-хозяина указанным вектором, культивированием указанного трансформанта и измерением расщепляющей активности экспрессированного полипептида по отношению к полисахариду, содержащему сульфатированную фукозу.
В настоящем изобретении ген, имеющий аминокислотную последовательность, представленную в списке последовательностей SEQ ID NO: 1 и NO: 2, и имеющий нуклеотидную последовательность, кодирующую полипептид, обладающий расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу, был получен из штамма Alteromonas sp. SN-1009. Примеры нуклеотидной последовательности, кодирующей полипептид, имеющий аминокислотную последовательность, представленную SEQ ID NO: 1 и NO: 2, показаны соответственно в SEQ ID NO: 5 и NO: 6 в списке последовательностей.
Далее ген с нуклеотидной последовательностью, кодирующей полипептид, имеющий аминокислотную последовательность, представленную SEQ ID NO: 3 и NO: 4 в списке последовательностей, и обладающий расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу, был выделен из штамма Flavobacterium sp. SA-0082. Примеры нуклеотидной последовательности, кодирующей полипептид с аминокислотной последовательностью SEQ ID NO: 3 и NO: 4, показаны в SEQ ID NO: 7 и NO: 8 в списке последовательностей соответственно.
Относительно способа получения гена, кодирующего полипептид, обладающего расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу, или имеющего функционально идентичную активность с применением нуклеотидной последовательности гена по настоящему изобретению, может быть применен, например, следующий метод.
Во-первых, хромосомную ДНК, получаемую из источника, содержащего желаемый ген, или кДНК, полученную с мРНК с помощью обратной транскриптазы, вводят в клетку-хозяин стандартным методом при помощи лигирования с плазмидой или фаговым вектором для получения библиотеки. Библиотеку культивируют на чашке, а выросшие колонии или бляшки переносят на нитроцеллюлозу или нейлоновую мембрану и денатурируют для фиксирования ДНК на мембране. Данную мембрану инкубируют в гибридизационном буфере, содержащем зонд, меченный, например, 32P (относительно зонда, применяемого здесь, может быть использована любая аминокислотная последовательность, представленная SEQ ID NO: 1 до NO: 4 в списке последовательностей, или последовательность нуклеотидов, кодирующая его часть, и, например, может быть использована нуклеотидная последовательность, представленная любой из SEQ ID NO: 5 до NO: 8 в списке последовательностей или ее часть), вследствие чего формируют гибрид между зондом и ДНК на мембране. Например, мембрану с фиксированной ДНК подвергают гибридизации с зондом при температуре 65°С в течение 20 часов в гибридизационном буфере, содержащем 6х SSC, 1% додецилсульфат натрия (SDS), 100 мкг/мл ДНК спермы лосося и 5х раствор Денхардта. После гибридизации отмывают неспецифически адсорбировавшийся зонд и идентифицируют клон, который связался с зондом, например, посредством авторадиографии. Данную процедуру повторяют до тех пор, пока связавшийся с зондом клон не остается единственным. В клон, полученный подобным образом, встраивают ген, кодирующий желаемый полипептид.
Нуклеотидную последовательность полученного гена определяют, например, следующим способом и подтверждают факт, что полученный ген является геном, кодирующим полипептид, обладающий желаемой расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу, или имеющий функционально идентичную активность.
Когда трансформантом является Escherichia coli, которую трансформируют плазмидой, определение нуклеотидной последовательности проводят путем ее культивирования в пробирке и тому подобном и выделения плазмиды стандартным методом. То есть вырезанный рестриктазой, встроенный фрагмент высвобождается и субклонируется в фаговый вектор М13, и нуклеотидную последовательность определяют дидезоксиметодом. Когда для рекомбинанта применяют фаговый вектор, последовательность нуклеотидов также может быть определена в основном этими же стадиями. Относительно основных экспериментальных методов от культивирования до определения нуклеотидной последовательности, существует описание, например, в "Molecular Cloning A Laboratory Manual", second edition, by J. Sambrook, et al., (published by Cold Spring Harbor Laboratory, 1989).
Для того чтобы подтвердить, является ли полученный ген геном, кодирующим полипептид, обладающий желаемой расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу, или обладающий функционально идентичной активностью, определенную нуклеотидную последовательность или кодируемую ей аминокислотную последовательность сравнивают с нуклеотидной последовательностью, представленной в любой из SEQ ID NO: 5 до NO: 8 в списке последовательностей или сравнивают с аминокислотной последовательностью, представленной любой из SEQ ID NO: 1 до NO: 4 в списке последовательностей настоящего изобретения.
Если полученный ген не содержит всю область, кодирующую полипептид, обладающий расщепляющей активностью по отношению к полисахариду, содержащему сульфатированную фукозу, или имеющий функционально идентичную активность, синтетическую библиотеку ДНК формируют на основании полученного гена, затем недостающую область амплифицируют с помощью ПЦР или фрагменты полученного гена применяют в качестве зонда для дальнейшего скрининга библиотеки ДНК или библиотеки кДНК, посредством чего может быть определена нуклеотидная последоват