Медицинское применение селективного модулятора рецепторов эстрогенов в комбинации с предшественниками половых стероидных гормонов
Иллюстрации
Показать всеИзобретение относится к способам медицинского лечения и/или ингибирования развития остеопороза, рака молочной железы, гиперхолестеринемии, гиперлипидемии или атеросклероза у чувствительных теплокровных животных, включая человека, включающие введение селективного модулятора половых стероидных гормонов, в частности соединения общей формулы (I) и количества предшественника половых стероидных гормонов, выбранного из группы, состоящей из дегидроэпиандростерона, дегидроэпиандростеронсульфата, андрост-5-ен-3β,17β-диола и соединений, превращаемых in vivo в один из вышеуказанных предшественников. Дополнительное введение бисфосфонатов в сочетании с селективными модуляторами рецепторов эстрогенов и/или предшественником половых стероидных гормонов раскрывается для медицинского лечения и/или ингибирования развития остеопороза. Изобретение также относится к фармацевтическим композициям для доставки активного(ых) ингредиента(ов) и наборам, их содержащим. Изобретение эффективно в отношении указанных способов лечения, сводя до минимума нежелательные побочные эффекты. 5 н. и 36 з.п. ф-лы, 13 ил., 4 табл.
Реферат
Область изобретения
Настоящее изобретение относится к способу лечения или снижения вероятности приобретения остеопороза, гиперхолестеринемии, гиперлипидемии или атеросклероза с применением новой комбинированной терапии на чувствительных теплокровных животных, включая человека. В частности, комбинация включает введение селективного модулятора рецепторов эстрогенов (SERM) и повышение у пациента уровня предшественника половых стероидных гормонов, причем указанный предшественник выбран из группы, состоящей из дегидроэпиандростерона (DHEA), дегидроэпиандростеронсульфата (DHEA-S) и андрост-5-ен-3β ,17β -диола (5-диола). Изобретение относится также к наборам и фармацевтической композиции для использования на практике вышеуказанной комбинации.
Предшествующий уровень техники
Человек, наряду с некоторыми другими приматами, является уникальным в том, что имеет надпочечники, которые секретируют большие количества предшественников стероидов дегидроэпиандростеронсульфата (DHEA-S) и дегидроэпиандростерона (DHEA), которые превращаются в андростендион (4-дион) и затем в активные андрогены и/или эстрогены в периферических тканях (Labrie et al., In: Important Advances in Oncology. Edited by V.T. de Vita, S. Hellman, S.A. Rosenberg, J.B. Lippincott, Philadelphia, 193-217, 1985; Labrie, Mol. Cell. Endocrinol., 78: C113-C118, 1991; Labrie et al., In Signal Transduction in Testicular Cells. Ernst Schering Research Foundation Workshop, Edited by V.Hansson, F.O. Levy, K. Tasken. Springer-Verlag, Berlin-New York (Suppl. 2), pp. 185-218, 1996; Labrie et al., Steroids, 62: 148-158, 1997). В недавней работе (Labrie et al., J.Clin. Endocrinol. Metab., 82: 2403-2409, 1997), заявители описали существенное падение уровней циркулирующих дегидроэпиандростерона (DHEA), DHEA-сульфата (DHEA-S), андрост-5-ен-3β ,17β -диола (5-диола), 5-диол-S (5-диолсульфата), эфиров 5-диола и жирных кислот и андростендиона у мужчин и женщин в возрасте от 20 до 80 лет.
Несмотря на заметное снижение эндогенных андрогенов у женщин с возрастом, применение андрогенов в период постменопаузы у женщин ограничено из-за опасения повышенного риска возникновения сердечно-сосудистого заболевания, что основано на результатах более ранних исследований, показывающих неблагоприятный липидный профиль с андрогенами. Однако в недавних исследованиях не было показано значительного воздействия комбинированной терапии эстрогенами и андрогенами на сывороточный уровень холестерина, триглицеридов, ЛПВП (HDL), ЛПНП (LDL) и на соотношение ЛПВП/ЛПНП по сравнению с одними эстрогенами (Sherwin et al., Am. J. Obstet. Gynecol., 156: 414-419, 1987). В соответствии с этими наблюдениями заявители показали, что DHEA, соединение, обладающее преимущественно андрогенным влиянием, явно не оказывает пагубного влияния на профиль сывороточных липидов (Diamond et al., J. Endocrinol., 150: S43-S50, 1996). Аналогично не наблюдали изменения в концентрации холестерина, его субфракций или триглицеридов во время обработки одним эстрадиолом через 6 месяцев лечения имплантантами эстрадиол + тестостерон (Burger et al., Br. Med. J. Clin. Res. Ed., 294: 936-937, 1987). Следует отметить, что исследование на людях показало обратную корреляцию между сывороточным DHEA-S и липопротеидами низкой плотности (Parker et al., Science, 208: 512-514, 1980). Позднее установили корреляцию между низким уровнем тестостерона и DHEA в сыворотке крови и повышенным внутренним жиром, параметром повышенного риска для сердечно-сосудистой системы (Tchernof et al., Metabolism, 44: 513-519, 1995).
5-диол является соединением, биосинтезируемым из DHEA при участии восстанавливающего 17β -гидроксистероида дегидрогеназы (17β -HSD) и является слабым эстрогеном. Он имеет аффинность в 85 раз ниже, чем 17β -эстрадиол (Е2) для рецептора эстрогенов у крысы в цитозоле передней части гипофиза (Simard and Labrie, J. Steroid Biochem., 26: 539-546, 1987), дополнительно подтверждая данные, полученные с этим же параметром в миометрии человека и раковой ткани молочной железы (Kreitmann and Bayard, J. Steroid Biochem., 11: 1589-1595, 1979; Adams et al., Cancer Res., 41: 4720-4926, 1981;
Poulin and Labrie, Cancer Res., 46: 4933-4937, 1986). Однако при концентрациях, находящихся в пределах уровней в плазме крови, установленных у взрослых женщин, 5-диол увеличивает клеточную пролиферацию и уровни рецепторов прогестерона в опухолевых клетках ZR-75-1 молочной железы человека (Poulin and Labrie, Cancer Res., 46: 4933-4937, 1986) и усиливает зависимый от эстрогенов синтез гликопротеида размером 52 кДа в клетках MCF-7 (Adams et al., Cancer Res., 41: 4720-4926, 1981).
Как упоминалось выше, известно, что уровни DHEA, DHEA-S и 5-диола в сыворотке крови уменьшаются с возрастом и, соответственно, имеется существенное, зависимое от возраста снижение образования андрогенов и эстрогенов в периферических тканях-мишенях. Подобные изменения в секреции DHEA-S и DHEA приводят к заметному снижению биохимических и клеточных функций, стимулируемых половыми стероидными гормонами. В результате недавно DHEA и DHEA-S использовали для лечения разнообразных заболеваний, связанных с уменьшением и/или нарушением равновесия уровней половых стероидных гормонов.
Остеопороз, заболевание, которое поражает мужчин и женщщин, и связано со снижением уровня андрогенов и эстрогенов. Было показано, что эстрогены снижают скорость деградации костей, в то время как андрогены способствуют построению костной массы. Однако для заместительной терапии эстрогенами, обычно используемой при остеопорозе, необходимо добавление прогестинов для предупреждения пролиферации эндометрия и риска возникновения рака эндометрия, индуцируемого эстрогенами. Кроме того, поскольку полагается, что как эстрогены, так и прогестины увеличивают риск рака молочной железы (Bardon et al., J. Clin. Endocrinol. Metab., 60: 692-697, 1985; Colditz et al., N. Engl. J. Med., 332: 1589-1593, 1995) применение заместительной терапии эстрогенами-прогестинами допускается у ограниченного числа женщин и, обычно в течение очень короткого периода времени.
На основе нескольких исследований было высказано предположение, что остеопороз является клиническим проявлением недостатка андрогенов у мужчин (Baran et al., Calcif. Tissue Res. 26: 103-106, 1978; Odell and Swerdloff, West J. Med. 124: 446-475, 1976; Smith and Walker, Calif. Tissue Res. 22 (Suppl.): 225-228, 1976). Было установлено при наблюдении с нандролондеканоатом, что лечение андрогенами увеличивает минеральную плотность костей позвонков у женщин в период постменопаузы (Need et al., Arch. Intern. Med., 149: 57-60, 1989). Лечение женщин в постменопаузе нандролоном повысило содержание минеральных веществ в кортикальном слое костей (Need et al., Clin. Orthop. 225: 273-278, 1987). Однако побочные эффекты в результате применения андрогенов были зарегистрированы у 50% пациентов. Подобные данные представляют интерес, поскольку в то время, как все существующие виды терапии ограничиваются уменьшением потери костей, при применении анаболического стероида нандролона было обнаружено увеличение костной массы. Было высказано предположение о подобной стимуляции формирования костей под действием андрогенов у мужчин с гипогонадизмом (Baran et al., Calcif. Tissue Res. 26: 103, 1978). Labrie et al. сообщают о стимуляции формирования костей у женщин в постменопаузе при лечении DHEA в течение 12 месяцев (J. Clin. Endocrinol. 82: 3498-3505, 1997).
DHEA (450 мг/кг массы тела, 3 раза в неделю) заметно снижал появление рака молочной железы у мышей С3Н, которые имеют генетическую предрасположенность к развитию рака молочной железы (Schwartz, Cancer Res. 39: 1129-1132, 1979). Кроме того, было установлено, что риск развития рака мочевого пузыря увеличивается у мужчин, имеющих низкие уровни DHEA в сыворотке крови (Gordon et al., Cancer Res. 51: 1366-1369, 1991).
Патентная заявка США 5550107 относится к способу лечения рака молочной железы и эндометрия у чувствительных теплокровных животных, который может включать ингибирование гормональной секреции яичников хирургическими способами (овариэктомия) или химическими способами (применение агониста LHRH, например, [D-Trр6, дес-Gly-NН
| 10 |
| 2 |
Кроме того, сердечно-сосудистые заболевания связаны с пониженными сывороточными уровнями DHEA и DHEA-S, и как DHEA, так и DHEA-S были предложены для профилактики и лечения этих заболеваний (Barrett-Connor et al., N. Engl. J. Med. 315:1519-1524, 1986).
У взрослых крыс Sprague-Dawley, Schwartz (in Kent, Geriatrics 37: 157-160, 1982) наблюдал, что масса тела снижалась с 600 до 550 г под действием DHEA без влияния на потребление корма. Schwartz (Cancer 39: 1129-1132, 1979) наблюдал, что у мышей С3Н, которым вводили DHEA (450 мг/кг, 3 раза в день), значительно снизились прибавки в весе, они росли быстрее по сравнению с контрольными животными, имели меньшее количество жира в организме и были более активны. Снижение массы тела достигалось без потери аппетита или ограничения в корме. Кроме того, DHEA может предупреждать прибавки в весе у животных, выращиваемых для проявления ожирения в половозрелом возрасте (in Kent, Geriatrics 37: 157-160, 1982).
Введение DHEA истощенным крысам Zucher привело к снижению прибавок в весе, несмотря на повышенное потребление корма. У обработанных животных были меньшие жировые скопления, на основании чего в целом можно предположить, что DHEA усиливает метаболизм кормов, приводя к более низким прибавкам в весе и накоплению жира (Svec et al., Proc. 2nd Int. Conf. Cortisol and Anti-Cortisols, Las Vegas, Nevada, USA, p.56 abst., 1997).
Было установлено, что ожирение лечится у мышей-мутантов Аvy (Yen et al., Lipids 12: 409-413, 1977) и у крыс Zucher (Cleary and Zisk, Fed. Proc. 42: 536, 1983). Обработанные DHEA мыши С3Н выглядели моложе по сравнению с контрольными животными (Schwartz, Cancer Res. 39: 1129-1132, 1979).
DHEA снижал частоту появления атеросклероза у кроликов, которым скармливали холестерин (Gordon et al., J.Clin. Invest. 82: 712-720, 1988; Arad et al., Arteriosclerosis 9: 159-166, 1989). Кроме того, было сообщение о том, что высокие концентрации DHEA-S в сыворотке крови защищают от смерти в результате сердечно-сосудистых заболеваний у людей (Barrett-Connor et al., N.Engl. J.Med. 315: 1519-1524, 1986). Было установлено, что уровни циркулирующих DHEA и DHEA-S обратно коррелируют со смертностью в результате сердечно-сосудистого заболевания (Barrett-Connor et al., N. Engl. J. Med. 315: 1519-1524, 1986) и снижаются параллельно с подавлением иммунной системы (Thoman and Weigle, Adv. Immunol. 46: 221-222, 1989). Исследование на человеке показало наличие обратной корреляции между уровнем DHEA-S в фетальной сыворотке и уровнем липопротеидов низкой плотности (ЛПНП) (Parker et al., Science 208: 512, 1980).
Применение DHEA, а также положительные эффекты лечения андрогенами и эстрогенами обсуждаются в публикации международного патента WO 94/16709.
На основании корреляций, наблюдаемых в предыдущем уровне техники, нельзя было предположить способы лечения или профилактики, которые эффективны или не обладают нежелательными побочными эффектами, такие, как комбинированная терапия, раскрытая здесь.
Краткое описание изобретения
Следовательно, целью настоящего изобретения является обеспечение эффективных способов лечения остеопороза, гиперхолестеринемии, гиперлипидемии, атеросклероза, рака молочной железы, рака эндометрия, рака яичников и рака матки, в то же время сводя до минимума нежелательные побочные эффекты.
Другой целью является обеспечение способов снижения риска приобретения вышеуказанных заболеваний.
Другой целью является обеспечение наборов и фармацевтических композиций, пригодных для применения в вышеуказанных способах.
В одном воплощении изобретение относится к способу лечения или снижения риска приобретения остеопороза, включающему повышение уровней предшественника половых стероидных гормонов, выбранного из группы, состоящей из дегидроэпиандростерона (DHEA), дегидроэпиандростеронсульфата (DHEA-S) и андрост-5-ен-3β ,17β -диола(5-диола), у пациента, нуждающегося в указанном лечении или указанном снижении, и далее включающему введение указанному пациенту терапевтически эффективного количества селективного модулятора рецепторов эстрогенов (SERM), как части комбинированной терапии.
В другом воплощении изобретение обеспечивает способ лечения или снижения риска приобретения гиперхолестеринемии, включающий повышение уровней предшественника половых стероидных гормонов, выбранного из группы, состоящей из дегидроэпиандростерона, дегидроэпиандростеронсульфата и андрост-5-ен-3β ,17β -диола, у пациента, нуждающегося в указанном лечении или указанном снижении, и далее включающий введение указанному пациенту терапевтически эффективного количества селективного модулятора рецепторов эстрогенов, как части комбинированной терапии.
В другом воплощении изобретение обеспечивает способ лечения или снижения риска приобретения гиперлипидемии, включающий повышение уровней предшественника половых стероидных гормонов, выбранного из группы, состоящей из дегидроэпиандростерона, дегидроэпиандростеронсульфата и андрост-5-ен-3β ,17β -диола, у пациента, нуждающегося в указанном лечении или указанном снижении, и далее включающий введение указанному пациенту терапевтически эффективного количества селективного модулятора рецепторов эстрогенов, как части комбинированной терапии.
В другом воплощении изобретение обеспечивает способ лечения или снижения риска приобретения атеросклероза, включающий увеличение уровней предшественника половых гормонов, выбранного из группы, состоящей из дегидроэпиандростерона, дегидроэпиандростеронсульфата и андрост-5-ен-3β ,17β -диола, у пациента, нуждающегося в указанном лечении или указанном снижении, и далее включающий введение указанному пациенту терапевтически эффективного количества селективного модулятора рецепторов эстрогенов, как части комбинированной терапии.
В другом воплощении изобретение обеспечивает способ лечения или снижения риска приобретения рака молочной железы, включающий увеличение уровней предшественника половых стероидных гормонов, выбранного из группы, состоящей из дегидроэпиандростерона, дегидроэпиандростеронсульфата и андрост-5-ен-3β ,17β -диола, у пациента, нуждающегося в указанном лечении или указанном снижении, и далее включающий введение указанному пациенту терапевтически эффективного количества селективного модулятора рецепторов эстрогенов, как части комбинированной терапии.
В другом воплощении изобретение обеспечивает способ лечения или снижения риска приобретения рака эндометрия, включающий повышение уровней предшественника половых стероидных гормонов, выбранного из группы, состоящей из дегидроэпиандростерона, дегидроэпиандростеронсульфата и андрост-5-ен-3β ,17β -диола, у пациента, нуждающегося в указанном лечении или указанном снижении, и далее включающий введение указанному пациенту терапевтически эффективного количества селективного модулятора рецепторов эстрогенов, как части комбинированной терапии.
В другом воплощении изобретение обеспечивает способ лечения или снижения риска приобретения рака матки, включающий увеличение уровней предшественника половых стероидных гормонов, выбранного из группы, состоящей из дегидроэпиандростерона, дегидроэпиандростеронсульфата и андрост-5-ен-3β ,17β -диола, у пациента, нуждающегося в указанном лечении или указанном снижении, и далее включающий введение указанному пациенту терапевтически эффективного количества селективного модулятора рецепторов эстрогенов, как части комбинированной терапии.
В другом воплощении изобретение обеспечивает способ лечения или снижения риска приобретения рака яичников, включающий увеличение уровней предшественника половых стероидных гормонов, выбранного из группы, состоящей из дегидроэпиандростерона, дегидроэпиандростеронсульфата и андрост-5-ен-3β ,17β -диола, у пациента, нуждающегося в указанном лечении или указанном снижении, и далее включающий введение указанному пациенту терапевтически эффективного количества селективного модулятора рецепторов эстрогенов, как части комбинированной терапии.
В другом воплощении изобретение обеспечивает набор, включающий первый контейнер, содержащий терапевтически эффективное количество по меньшей мере одного предшественника половых стероидных гормонов, выбранного из группы, состоящей из дегидроэпиандростерона, дегидроэпиандростеронсульфата и андрост-5-ен-3β ,17β -диола, и любого пролекарства, которое in vivo превращается в любой из вышеуказанных предшественников; и далее включающий второй контейнер, содержащий терапевтически эффективное количество по меньшей мере одного селективного модулятора рецепторов эстрогенов.
В другом воплощении изобретение обеспечивает фармацевтическую композицию, включающую: а) фармацевтически приемлемый эксципиент, разбавитель или носитель; b) терапевтически эффективное количество по меньшей мере одного предшественника половых стероидных гормонов, выбранного из группы, состоящей из дегидроэпиандростерона, дегидроэпиандростеронсульфата и андрост-5-ен-3β ,17β -диола, и пролекарство, которое in vivo превращается в любой из вышеуказанных предшественников половых стероидных гормонов; и с) терапевтически эффективное количество по меньшей мере одного селективного модулятора рецепторов эстрогенов.
В другом воплощении изобретение обеспечивает способ снижения риска приобретения рака молочной железы, включающий введение пациенту, нуждающемуся в таком снижении, профилактически эффективного количества селективного модулятора рецепторов эстрогенов.
В одном воплощении снижения вероятности приобретения рака молочной железы, желательно объединить введение SERM с введением предшественника половых стероидных гормонов. Однако изобретение также включает введение одного SERM, которое показано, например, на фигурах 1 и 2, для обеспечения значительного профилактического эффекта, даже при отсутствии назначаемых предшественников. Предпочтительные SERM для этой цели являются такими же, как обсуждались здесь для других применений. Предпочтительные дозировки и способы введения также являются такими же.
Как здесь использовано, селективный модулятор рецепторов эстрогенов (SERM) является соединением, которое либо непосредственно, либо через его активный метаболит действует в качестве антагониста рецепторов эстрогенов (“антиэстроген”) в ткани молочной железы, и еще обеспечивает эстрогенный или эстрогенподобный эффект на костную ткань и на уровень холестерина в сыворотке крови (т.е. снижая сывороточный холестерин). Нестероидные соединения, которые действуют в качестве антагонистов рецепторов эстрогенов in vitro или в ткани молочной железы человека или крысы (особенно, если соединение ведет себя в качестве антиэстрогена в отношении раковых клеток молочной железы человека), вероятно, функционируют в качестве SERM. Напротив, стероидные антиэстрогены не имеют тенденции действовать в качестве SERM потому, что они не имеют тенденции проявлять какое-либо положительное действие на уровень холестерина в сыворотке крови. Заявители тестировали нестероидные антиэстрогены и установили, что они функционируют в качестве SERM, включая ЕМ-800, ЕМ-01538, ралоксифен, тамоксифен и дролоксифен. Заявители тестировали стероидный антиэстроген ICI 182780 и установили, что он не функционирует в качестве SERM. SERM по изобретению можно вводить в той же дозе, известной в данной области, когда указанные соединения применяются в качестве антиэстрогенов.
Заявители также отметили наличие корреляции между положительными эффектами SERM на уровень холестерина в сыворотке крови и положительными эстроген- и эстроген-подобными эффектами на кости и сывороточные липиды. В исследовании заявителей SERM, показали себя, как действующие положительно на все параметры, включая массу костей, уровни холестерина и триглицеридов. Не намереваясь быть связанными теорией, полагается, что SERM, многие из которых предпочтительно имеют два ароматических кольца, связанных одним-двумя атомами углерода, взаимодействуют, как ожидается, с рецептором эстрогенов через вышеуказанную часть молекулы, которая лучше всего распознается рецептором. Предпочтительные SERM имеют боковые цепи, которые могут избирательно вызвать антагонистические свойства в ткани молочной железы без проявления значительных антагонистических свойств в других тканях. Таким образом, SERM могут функционировать в желаемом направлении в качестве антиэстрогенов в молочной железе, в то же время удивительно функционируя в желаемом направлении в качестве эстрогенов (или обеспечивая эстрогенподобную активность) в костях и в крови (где они положительно влияют на концентрацию липидов или холестерина). Благоприятное действие на холестерин и липиды передается на благоприятное действие против атеросклероза, на развитие которого, как известно, отрицательно действуют несвойственные уровни холестерина и липидов.
Все заболевания, поддающиеся лечению по изобретению, обсуждаемому здесь, положительно реагируют на андрогены. В большей степени, чем применение андрогенов самих по себе, заявители используют предшественники половых стероидных гормонов такие, как DHEA, DHEA-S, 5-диол, или пролекарства, превращаемые в любые такие предшественники половых стероидных гормонов. In vivo DHEA-S превращается в DHEA, который в свою очередь, превращается в 5-диол. Полагается, что любая ткань, положительно реагирующая на один, вероятно, будет положительно реагировать на другие. Пролекарственные формы активных метаболитов хорошо известны в этой области. Смотри, например, H.Bundgaard “Design and Application of Prodrugs” (In.: A Textbook of Drug Design and Development. Edited by H.Bundgaard and P.Krogsgaard-Larsen; Harwook Academic Publishers GmfH, Chur: Switzerland, 1991), содержание которого включено здесь в качестве ссылки. В частности, смотри страницы 154-155, где описываются различные функциональные группы активных метаболитов и соответствующие группы пролекарств, которые превращаются in vivo в каждую функциональную группу. В случаях, когда уровень предшественников половых стероидных гормонов у пациентов повышается в соответствии с изобретением, этого обычно можно достичь при введении такого предшественника или при введении пролекарства такого предшественника. При применении предшественников вместо андрогенов снижается нежелательная андрогенная активность в тканях иных, чем мишеневая. Ткани превращают предшественники такие, как DHEA, в андрогены только посредством естественного и более регулируемого процесса. Большой процент андрогенов продуцируется локально в периферических тканях и в различных тканях в различной степени.
Виды рака, поддающиеся лечению в соответствии с изобретением, неблагоприятно отвечают на эстрогенную активность. С другой стороны, остеопороз, гиперхолестеринемия, гиперлипидемия и атеросклероз положительно отвечают на эстрогенную или эстрогенподобную активность. Используя SERM в соответствии с изобретением, желаемые эффекты обеспечиваются в тканях-мишенях без нежелательных эффектов в некоторых других тканях. Например, SERM могут обладать положительным эстрогенным действием в кости (или на липиды и холестерин), в то же время у них отсутствует неблагоприятный эстрогенный эффект в отношении молочной железы.
Следовательно, как предшественник, так и SERM, обеспечивают положительное действие в отношении тканей-мишеней, в то же время сводя до минимума неблагоприятные эффекты в некоторых других тканях. Более того, наблюдается существенный синергизм при использовании двух вместе в соответствии с изобретением. Например, эстрогены и андрогены обеспечивают положительное действие против остеопороза различными механизмами (эстроген-снижающим резорбцию костей, андроген-повышающим формирование костей). Комбинация по настоящему изобретению обеспечивает кость положительным эстрогенным или эстрогенподобным действием через активность SERM, и также обеспечивает положительным андрогенным действием через локальное превращение предшественника в андроген в кости. Предполагается, что предшественник также обеспечивает эстроген. То же самое справедливо в отношении регуляции липидов или холестерина (пригодной для лечения или профилактики атеросклероза). Аналогичный синергизм обеспечивается против рака молочной железы, эндометрия яичников или матки, где SERM обеспечивает желаемый антиэстрогенный эффект, а предшественник обеспечивает желаемый андрогенный эффект (при любом побочном превращении предшественника в эстроген, будучи смягченным антиэстрогеном). Нежелательные эффекты также ослабляются синергическим путем комбинацией, использованной по изобретению.
Для всех заболеваний, обсуждаемых здесь, любое другое действие на ткани молочной железы, которое может иначе возникнуть от эстрогенов, образовавшихся из предшественника (когда используется предшественник для обеспечения андрогенных эффектов по изобретению), ослабляется антиэстрогенным действием SERM в ткани молочной железы.
В некоторых воплощениях изобретения добавляются прогестины для обеспечения дополнительного андрогенного эффекта. Прогестины можно применять в низких дозах, известных в этой области, без отрицательного влияния на иные рецепторы, чем рецепторы андрогенов (например, рецепторы глюкокортикоидов).
Они также относительно свободны от нежелательных андрогенных побочных эффектов (таких, как рост волос на лице у женщин).
Предпочтительные SERM, обсуждаемые здесь, относятся 1) ко всем заболеваниям, указанным, как чувствительные к изобретению); 2) как к терапевтическим, так и профилактическим применениям и 3) к предпочтительным фармацевтическим композициям и наборам.
В одном воплощении предшественником является DHEA.
В другом воплощении предшественником является DHEA-S. В другом воплощении предшественником является 5-диол.
Пациентом, нуждающимся в лечении или снижении риска начала данного заболевания является субъект, которому либо был поставлен диагноз такого заболевания, либо субъект, который является чувствительным к приобретению такого заболевания.
За исключением, когда указано иное, предпочтительная доза активных соединений (концентрации и способы введения) по изобретению является одинаковой для терапевтических и профилактических целей. Дозировка каждого активного компонента, обсуждаемого здесь, является одной и той же независимо от заболевания, которое лечится (или заболевания, вероятность начала которого снижается).
За исключением, когда отмечено иное или когда это очевидно из контекста, дозы здесь относятся к весу активных соединений, не подвергающихся влиянию фармацевтических эксципиентов, разбавителей, носителей или других ингредиентов, хотя, желательно включать такие дополнительные ингредиенты, как показано здесь в примерах. Любая лекарственная форма (капсула, таблетка, инъекция или тому подобное), обычно используемая в фармацевтической промышленности, подходит здесь для применения, и термины “эксципиент”, “разбавитель” или “носитель” включают такие неактивные ингредиенты, которые обычно включаются вместе с активными ингредиентами в подобных лекарственных формах в промышленности. Например, могут быть включены обычные капсулы, пилюли, кишечные оболочки, твердые или жидкие разбавители или эксципиенты, ароматизаторы, консерванты и тому подобное.
Все из активных ингредиентов, использованных в любом из обсуждаемых здесь лечений, можно включить в состав фармацевтических композиций, которые также включают один или более других активных ингредиентов. Альтернативно каждый из них можно вводить по отдельности, но в достаточной мере одновременно так, чтобы у пациента в конечном итоге повысились уровни в крови, или иначе было получено положительное воздействие каждого из активных ингредиентов (или стратегий) одновременно. В некоторых предпочтительных воплощениях изобретения, например, один или более активных ингредиентов должны быть включены в состав одной фармацевтической композиции. В других воплощениях изобретения обеспечивается набор, который включает по меньшей мере два отдельных контейнера, где содержимое по меньшей мере одного контейнера отличается в целом или частично от содержимого по меньшей мере одного другого контейнера в отношении активных ингредиентов, содержащихся там.
Комбинированная терапия, обсуждаемая здесь, также включает применение одного активного ингредиента (из комбинации) в производстве лекарственного препарата для лечения (или снижения риска) данного заболевания, где лечение или профилактика дополнительно включает другой активный ингредиент комбинации по изобретению. Например, в одном воплощении изобретение обеспечивает применение SERM для получения лекарственного препарата для применения в комбинации с предшественником половых стероидных гормонов, выбранным из группы, состоящей из DHEA, DHEA-S, 5-диола, и пролекарствами, превращаемыми в любой из вышеуказанных предшественников половых стероидных гормонов in vivo, при лечении любого из заболеваний, для которых, как полагается, эффективна настоящая комбинированная терапия (т.е. рак молочной железы, рак эндометрия, рак матки, рак яичников, остеопороз, гиперхолестеринемия, гиперлипидемия и атеросклероз). В другом воплощении изобретение обеспечивает применение предшественника половых стероидных гормонов, выбранного из группы, состоящей из DHEA, DHEA-S, 5-диола, и пролекарств, превращаемых в любой из вышеуказанных предшественников половых стероидных гормонов in vivo, для получения лекарственного препарата для применения в комбинации с SERM при лечении любого из этих же заболеваний.
В одном воплощении изобретения DHEA не используется в качестве предшественника. В другом воплощении ЕМ-800 не используется в качестве SERM. В другом воплощении не используется комбинация DHEA с ЕМ-800.
В предпочтительном воплощении DHEA используется в сочетании с ЕМ-1538.
Краткое описание чертежей
На фигуре 1 показано влияние обработки DHEA (10 мг чрескожно, один раз в день) или ЕМ-800 (75 мкг перорально, один раз в день) по отдельности или в комбинации в течение 9 месяцев на частоту индуцируемой DMBA карциномы молочной железы у крыс в течение 279-дневного периода наблюдения. Данные выражаются в виде процента от общего числа животных в каждой группе.
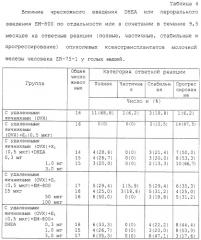
На фигуре 2 показано влияние обработки DHEA (10 мг чрескожно, один раз в день) или ЕМ-800 (75 мкг перорально, один раз в день) по отдельности или в комбинации в течение 9 месяцев на среднее число опухолей у животных-опухоленосителей (А) и на средний размер опухолей на крысу-опухоленоситель (В) в течение 279-дневного периода наблюдения. Данные выражаются в виде средних значений ± средняя ошибка среднего значения.
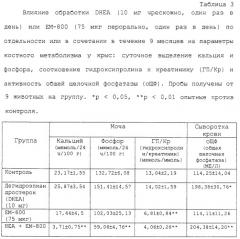
На фигуре 3 показано влияние обработки DHEA (10 мг чрескожно, один раз в день) или ЕМ-800 (75 мкг перорально, один раз в день) по отдельности или в комбинации в течение 9 месяцев на уровни триглицеридов (А) и холестерина (В) в сыворотке крови крыс. Данные выражаются в виде средних значений ± средняя ошибка среднего значения. * * : р&λτ; 0,01 опытные против соответствующего контроля.
На фигуре 4 показано: А) влияние возрастающих доз DHEA (0,3 мг, 1,0 мг или 3,0 мг), вводимых чрескожно, дважды в день, на средний размер опухолей ZR-75-1 у голых мышей с удаленными яичниками (OVX), обработанных эстроном. Контрольных OVX мышей, получавших один носитель, использовали в качестве дополнительного контроля. Первоначальный размер опухолей был принят за 100%. DHEA вводили чрескожно (ч.к.) в 0,02 мл раствора 50% этанол, 50% пропиленгликоль на кожу спины. В) влияние лечения возрастающими дозами DHEA или ЕМ-800 по отдельности или в комбинации в течение 9,5 месяцев на вес опухолей ZR-75-1 у OVX голых мышей, обработанных эстроном. * * : р&λτ; 0,01, обработанные против контрольных OVX мышей с добавлением эстрона.
На фигуре 5 показано влияние возрастающих пероральных доз антиэстрогена ЕМ-800 (15 мкг, 50 мкг или 100 мкг) (А) или чрескожного введения в возрастающих дозах DHEA (0,3, 1,0 или 3,0 мг) в сочетании с ЕМ-800 (15 мкг) или одного ЕМ-800 (В) в течение 9,5 месяцев на средний размер опухолей ZR-75-1 у голых мышей с удаленными яичниками (OVX), обработанных эстроном. Первоначальный размер опухолей был принят за 100%. Контрольных OVX мышей, получавших один носитель, использовали в качестве дополнительного контроля. Эстрон вводили подкожно в дозе 0,5 мкг, один раз в день, в то время как DHEA растворяли в смеси 50% этанол, 50% припиленгликоль и наносили на кожу спины дважды в день в объеме 0,02 мл. Сравнение также проводили с OVX животными, получавшими один носитель.
На фигуре 6 показано влияние 12-месячной обработки только дегидроэпиандростероном (DHEA) или в комбинации с флутамидом или ЕМ-800 на объем губчатого вещества костей у крыс с удаленными яичниками. Интактные животные были добавлены в качестве дополнительного контроля. Данные представляются в виде средних значений ± средняя ошибка среднего значения. * * р&λτ; 0,01 против OVX контроля.
На фигуре 7 показано влияние 12-месячной обработки только дегидроэпиандростероном (DHEA) или в комбинации с флутамидом или ЕМ-800 на число трабекул у крыс с удаленными яичниками. Интактные животные были добавлены в качестве дополнительного контроля. Данные выражаются в виде средних значений ± средняя ошибка среднего значения. * * р&λτ; 0,01 против OVX контроля.
На фигуре 8 показаны метафизы в проксимальной части большеберцовой кости от интактных контрольных животных (А), контрольных крыс с удаленными яичниками (В) и у крыс с удаленными яичниками, обработанными одним DHEA (С) или в сочетании с флутамидом (D) или ЕМ-800 (Е). Отмечается пониженное количество губчатого вещества костей (Т) у контрольных животных с удаленными яичниками (В) и значительное повышение объема губчатого вещества костей (Т), индуцированного после введения DHEA (С). Добавление флутамида к DHEA частично блокировало действие DHEA в отношении объема губчатого вещества костей (D), в то время как сочетание DHEA и ЕМ-800 обеспечило полную защиту от потери кости, связанной с овариэктомией. Модицифированный трехцветный Masson-GoIdner, увеличение × 80. Т-губчатое вещество; GP-ростовая пластинка.
На фигуре 9 показано влияние возрастающих доз (0,01, 0,03, 0,1, 0,3 и 1 мг/кг) ЕМ-800, ЕМ-1538 и ралоксифена (ЕМ-1105), вводимых перорально ежедневно в течение 4 дней на уровень холестерина у крыс с удаленными яичниками.
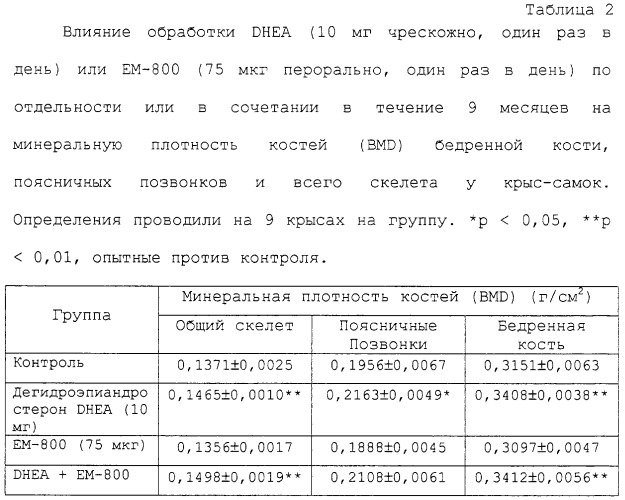
На фигуре 10 показано влияние 34-недельного введения только дегидроэпиандростерона (DHEA) или в комбинации с ЕМ-1538 (ЕМ-652· НСl) на минеральную плотность костей (BMD) в поясничных позвонках у крыс с удаленными яичниками. Интактные животные были добавлены в качестве дополнительного контроля. Данные выражаются в виде среднего значения±средняя ошибка среднего значения. * * р&λτ; 0,01 против OVX контроля.
На фигуре 11 показано комбинированное влияние SERM (ЕМ-652) и DHEA на параметры менопаузы. Отрицательного действия не предполагается.
На фигуре 12 показана концентрация DHEA в плазме крови (нг/мл) (ось Y) как функция от времени (ось X) после однократного перорального введения предпочтительных предшественников половых стероидных гормонов по изобретению (150 мкмоль/крысу) у крыс-самцов. В прямоугольнике представлены AUC DHEA за 24 ч, индуцированного этими соединениями.
ЕМ-760 дегидроэпиандростерон
ЕМ-900 андрост-5-ен-3β ,17β -диол
ЕМ-1304 андрост-5-ен-3β ,17β -диол 3-ацетат
EM-1305-CS андрост-5-ен-3β ,17β -диол диацетат
ЕМ-1397 андрост-5-ен-3β ,17β -диол 3-ацетат 17-бензоат
ЕМ-1400 андрост-5-ен-3β ,17β -диол дибензоат
ЕМ-1410 андрост-5-ен-3β ,17β -диол дипропионат
EM-1474-D андрост-5-ен-3β ,17β -диол дигемисукцинат
На фигуре 13 показана концентрация в плазме крови андрост-5-ен-3β ,17β -диола (нг/мл) (ось Y), как функция от времени (ось X), после однократного перорального введения предшественника половых стероидных гормонов по изобретению (150 мкмоль/крысу) у крыс-самцов. В прямоугольнике представлена AUC андрост-5-ен-3β ,17β -диола за 24 ч, индуцированного этими соединениями.
ЕМ-760 дегидроэпиандростерон
ЕМ-900 андрост-5-ен-3β ,17β -диол
ЕМ-1304 андрост-5-ен-3β ,17β -диол 3-ацетат
EM-1305-CS андрост-5-ен-3β ,17β -диол диацетат
ЕМ-1397 андрост-5-ен-3β ,17β -диол 3-ацетат 17-бензоат
ЕМ-1400 андрост-5-ен-3β ,17β -диол дибензоат
ЕМ-1410 андрост-5-ен-3β ,17β -диол дипропионат
EM-1474-D андрост-5-ен-3β ,17β -диол дигемисукцинат.
Детальное описание изобретения
Хорошо известно, что эстрогены стимулируют пролиферацию эпителиальных клеток молочной железы, и предлагается, что сама по себе пролиферация клеток увеличивает риск возникновения рака при накоплении случайных генетических ошибок, к