Применение ксенона для лечения нейроинтоксикаций
Иллюстрации
Показать всеИзобретение относится к области медицины и может быть использовано для лечения нейроинтоксикаций. Предлагается применять ксенон в тех случаях, когда нейроинтоксикация вызвана избытком нейромедиаторов. Ксенон может уменьшить высвобождение нейромедиаторов, прежде всего допамина, которое вызывается, например, условиями гипоксии, такими как апоплексия или черепно-мозговая травма. Композиция, содержащая ксенон, также может применяться в качестве терапевтического агента для лечения депрессий, шизофрении и болезни Паркинсона, при которых нарушено равновесие нейромедиаторов. Введение путем ингаляции является простым, а безвредность ксенона уже доказана, поскольку он используется в качестве анестезирующего средства. Изобретение расширяет арсенал средств для лечения нейроинтоксикаций. 2 с. и 15 з.п. ф-лы, 2 ил.
Реферат
Настоящее изобретение относится к применению ксенона для лечения нейроинтоксикаций. В частности, настоящее изобретение относится к применению ксенона в тех случаях, когда нейроинтоксикация вызвана избытком нейромедиатора.
Неконтролируемое высвобождение нейромедиаторов, прежде всего глутамата, норадреналина и допамина, обусловливает многие острые и хронические интоксикации головного мозга, которые называются нейроинтоксикациями или отравлениями нервных клеток. Эти нейромедиаторы приводят к гибели пораженных нейронов или путем индукции апоптоза (контролируемая гибель клеток) и/или косвенным образом, поскольку при их метаболизме образуются кислородные радикалы, которые в свою очередь обладают токсичными действиями. Неконтролируемое высвобождение нейромедиаторов, которое приводит к существенному увеличению концентрации нейротоксинов в пораженной ткани, может быть обусловлено различными эндогенными или экзогенными факторами. Например, увеличенное высвобождение глутамата или допамина может являться результатом острой черепно-мозговой травмы. Установлено, что увеличение высвобождения нейромедиаторов может вызываться также дефицитом кислорода в головном мозге, например, в случае апоплексии (ишемия) или в случае других видов гипоксии, в частности при рождении ребенка. Злоупотребление лекарственными средствами представляет собой другую причину нарушения высвобождения нейромедиаторов. При определенных формах шизофрении индуцированные стрессом рецидивы шизофрении (острые приступы) также сопровождаются увеличенным высвобождением нейромедиаторов. Наконец, в случае болезни Паркинсона в различных областях головного мозга также наблюдаются хронические сдвиги баланса нейромедиаторов, в частности, баланса допамина. В данном случае также имеет место увеличенное высвобождение допамина и последующее образование свободных радикалов. Различные исследования, проведенные на культурах клеток, и эксперименты на животных позволили установить, что высвобождение нейромедиаторов происходит, в частности, в результате дефицита кислорода.
Например, можно показать, что у крыс, которым производили одностороннюю инфузию допаминового нейротоксина, т.е. 6-гидроксидопамина, в черное вещество, что обусловливало одностороннее уменьшение уровня допамина в ипсилатеральном полосатом теле, индуцируемая экспериментальным путем ишемия в областях с пониженным уровнем допамина приводила к меньшему повреждению, чем в других областях головного мозга. Эти результаты свидетельствуют о том, что допамин играет определенную роль в индуцируемой ишемией гибели клеток полосатого тела (Clemens и Phebus, Life Science, том 42, стр.707 и далее, 1988).
Было также установлено, что допамин высвобождается в больших количествах из полосатого тела при ишемии головного мозга (Kahn и др., Anest.-Analg., том 80, стр.1116 и далее, 1995).
Высвобождение нейромедиаторов при ишемии головного мозга было подробно исследовано и было установлено, что оно имеет решающее значение для эксцитотоксичной гибели нейронов. Например, у Kondoh и др., Neurosurgery, том 35, стр.278 и далее, 1994, описано, что изменения в уровне высвобождения нейромедиаторов и их метаболизм могут сопровождаться изменениями клеточного метаболизма при ишемии. В экспериментах на животных, у которых экспериментальным путем вызывались апоплексии, было также выявлено увеличение внеклеточных концентраций допамина в полосатом теле.
Степень воздействия избытка допамина на повреждения нейронов может быть оценена по способности антагонистов допамина осуществлять защиту нейронов в моделях ишемии (Werling и др., Brain Research, том 606, стр.99 и далее, 1993). В клеточной культуре допамин вызывает первичный апоптоз нейронов полосатого тела, не сопровождающийся повреждением клеток в результате негативного воздействия окислительного фосфорилирования (соотношение АТФ/АДФ не изменяется). Однако, если это действие объединяется с минимальным ингибированием митохондриальных функций, то нейротоксичное действие допамина существенно возрастает (McLaughlin и др., Journal of Neurochemistry, том 70, стр.2406 и далее, 1998).
В дополнение к непосредственному токсичному действию в отношении нейронов в результате гипоксии стресс, индуцируемый дефицитом кислорода, прежде всего при рождении, вызывает увеличенное высвобождение допамина, которое приводит к негативным условиям функционирования головного мозга с точки зрения допаминергических регуляций. Это означает, что даже дети, которые, по-видимому, пережили фазу гипоксии при рождении без повреждений, сохраняют предрасположенность к судорогам и эпилептическим состояниям в старшем возрасте.
Другим случаем нарушения высвобождения нейромедиаторов является зависимость от наркотических средств. В частности, если принимаются специально изготовленные наркотические средства (например, "наркотические средства для удовольствия" и т.д.) или героин, и если превышена доза амфетаминов, то у пациентов появляются признаки интоксикации, а также часто спазмофилии, обусловленные увеличенным высвобождением нейромедиаторов.
Приступы шизофрении обусловлены также комплексом расстройств регуляции нейромедиаторов. Пациенты, страдающие шизофренией, часто не имеют симптомов болезни в течение продолжительного периода времени, однако они предрасположены к спонтанным приступам шизофрении, которые, по-видимому, вызываются индуцируемым стрессом высвобождением допамина даже в условиях небольшого стресса. В данном случае речь идет о кататонической шизофрении. Другими нейропсихиатрическими болезнями, обусловленными увеличенным высвобождением нейромедиаторов, являются депрессии и синдром Жиль де ла Туретта (расстройство в форме тика, "maladie de tics").
Наконец, в настоящее время считается, что одной из причин болезни Паркинсона являются модуляция допамина и метаболизм допамина. При болезни Паркинсона повреждены допаминергические нейроны в полосатой ткани. Имеются публикации, в которых описано, что болезнь Паркинсона обусловлена избытком допамина в пораженной области заднебокового отдела гипоталамуса и черного вещества. Установлено, что многие нейроны в этой области теряют свою функциональную способность, но не теряют своей жизнеспособности. Такие нейроны, которые называют "орфановыми нейронами", непрерывно высвобождают нейромедиаторы в таких количествах, которые вызывают патологические воздействия.
За исключением болезни Паркинсона, где используются предшественники допамина в качестве лекарственных средств, и прежде всего шизофрении, до сих пор не применяются терапевтические подходы, основанные на уменьшении концентрации допамина в окружении пораженных клеток.
Таким образом, существует потребность в разработке лекарственного средства, которое позволяет уменьшать или предотвращать повреждения, вызванные неконтролируемым высвобождением из нейронов нейромедиаторов, например, допамина, глутамина или норадреналина. Объектом настоящего изобретения является разработка такого лекарственного средства, которое может использоваться в указаных выше и ниже областях применения.
Эта задача решается с помощью объектов изобретения, указанных в п.п.1, 15 и 17 формулы изобретения. Другие предпочтительные варианты осуществления и объекты настоящего изобретения представлены в зависимых пунктах формулы изобретения, описании и на прилагаемых чертежах.
Было установлено, что благородный газ ксенон неожиданно обратимым образом ингибирует высвобождение нейромедиаторов, прежде всего допамина и глутамата. Это неожиданное открытие делает возможным получение лекарственных средств, предназначенных для лечения повреждения клеток и соответственно болезней, которые вызываются увеличенным высвобождением нейромедиаторов, прежде всего высвобождением допамина или высвобождением глутамата.
В соответствии с этим целью настоящего изобретения в целом является применение ксенона для лечения нейроинтоксикаций и соответственно получение композиции, содержащей ксенон, предназначенной для лечения нейроинтоксикаций. Изобретение относится также к самой композиции и к способу ее получения. Указанные нейроинтоксикаций в основном связаны с избытком нейромедиаторов. Изобретение основано главным образом на том факте, что ксенон уменьшает высвобождение допамина и/или глутамата.
В контексте изобретения понятие "нейроинтоксикаций" обозначает острое или хроническое "состояние отравления" ЦНС, прежде всего головного мозга, которое в большинстве случаев приводит к серьезным симптомам дефицита в пораженных областях. Эти состояния отравления вызываются избытком нейромедиаторов, прежде всего глутамата, норадреналина и/или допамина, который может быть обусловлен различными причинами. В этой связи следует отметить такие болезни, как апоплексия, гипоксия, дефицит кислорода при рождении, болезнь Паркинсона, черепно-мозговая травма, злоупотребление лекарственными средствами, шизофрения, депрессивные состояния и синдром Жиль де ла Туретта. Заявителями также установлено, что пациенты, которые подсоединены к аппарату искусственного кровообращения, часто страдают от церебральных симптомов дефицита, обусловленных избытком нейромедиаторов, вызванных гипоксией. Например, применение аппарата искусственного кровообращения может вызвать неидентифицируемую во многих случаях нейротоксичность, которая значительно замедляет восстановление пациента. Было также установлено, что любые применяемые в течение продолжительного периода времени искусственные методы респирации могут приводить к нежелательным побочным действиям, таким как нейротоксичность. В проведенных заявителями в последнее время исследованиях было установлено, что потеря слуха (например, в результате действия повышенного уровня шума, пребайкоза, тиннитуса, внезапной глухоты) также может вызываться нейроинтоксикацией. Избыток высвобождения нейромедиаторов, прежде всего высвобождения избыточного количества глутамата и допамина, которое может быть связано с повреждениями организма, например, в результате акустической травмы или ишемии, вызывает острое разрушение нервных окончаний и последующую гибель соответствующих нервов в органах слуха. Мигрень следует рассматривать в качестве другой болезни, которая по всей вероятности зависит от баланса допамина и, таким образом, участвует в интоксикации.
Обнаружение того, что ксенон может влиять на высвобождение нейромедиаторов, открывает новую область применения этого благородного газа, который до настоящего времени применялся во все возрастающем объеме в качестве анестезирующего агента для анестезии. Лечение различных болезней головного мозга, связанных с избытком перечисленных выше, а также других нейромедиаторов, может осуществляться согласно настоящему изобретению с помощью простой ингаляционной терапии. Уже доказано, что ксенон может использоваться в качестве анестезирующего агента при введении в дыхательную систему и для транспорта в головной мозг. Можно также предполагать, что применение ксенона не сопровождается действиями, направленными на разрушение организма, поскольку уже имеется богатый опыт применения его в качестве анестезирующего агента. Ксенон может вводиться различными путями, которые могут быть выбраны в зависимости от мишени действия. Например, при клиническом лечении могут использоваться устройства для ингаляции, которые также применяются при анестезии с помощью ингаляции. В случае применения аппарата искусственного кровообращения или других устройств искусственного дыхания ксенон может вводиться непосредственно в устройство и его применение не требует использования дополнительных приспособлений. Поэтому обычное введение ксенона может предотвращать возникновение нейроинтоксикаций в рассматриваемом модельном случае (профилактика) или уменьшать симптомы, связанные с дефицитом. В случае амбулаторного лечения, например, в случае первичного лечения пострадавших от несчастного случая, можно применять простые ингаляторы, в которых при ингаляции происходит смешение ксенона с воздухом окружающей среды. В этом случае также можно простым образом, удобным для терапевтического применения, адаптировать концентрацию ксенона и зависимость введения ксенона от времени. Например, предпочтительно использовать смеси ксенона с другими газами, например, смеси ксенона с кислородом, азотом, воздухом или другими газами, безвредными для людей.
У пациентов, перенесших серьезную черепно-мозговую травму, ингаляция ксенон-кислородсодержащей смесью, также применяющейся при анестезии, может препятствовать, по крайней мере уменьшать высвобождение допамина и таким образом предупреждать нейротоксичные действия, связанные с травмой. В этих случаях желательным является дополнительное анестезирующее действие, так как при этом пациент может освободиться от боли.
Важной особенностью острой ишемии в головном мозге являются вторичные нейротоксичные действия, которые возникают при увеличении высвобождения нейромедиаторов и которые обусловливают гибель нейронов в пораженных ишемией областях. Хотя непосредственное лечение ксеноном, например, врачом, осуществляющим экстренную медицинскую помощь в случае пациента, подвергшегося апоплексическому приступу, не может предупредить возникновение ишемии, оно может по крайней мере уменьшить или даже предупредить нейротоксичность, вызванную вторично высвобождаемыми нейромедиаторами. В результате этого может быть уменьшено часто встречающееся при апоплексии повреждение. Такое же лечение может быть применено в случае симптомов, которые возникают в результате злоупотребления лекарствами и при потере слуха или в случае приступа мигрени.
В случае дефицита кислорода при рождении, например, при вхождении в акушерский канал, или в случае проблем, связанных с пупочным канатиком, респирация матери с использованием ксенона (кислорода) и соответственно респирация ребенка сразу же после рождения могут предотвратить негативные последствия увеличенного высвобождения допамина в условиях дефицита кислорода.
У пациентов, страдающих от периодических приступов шизофрении (кататония), развитие болезни происходит очень быстро, течение болезни характеризуется выраженными симптомами, при которых происходит смена картин болезни и присутствуют бред и галлюцинации. Часто фаза исчезает так же быстро, как и наступила. Такие фазы или приступы могут вызываться спонтанно стрессовыми ситуациями. Быстрое вдыхание газообразной смеси, содержащей ксенон, во время состояния стресса может по крайней мере уменьшить интенсивность приступа. Очевидно, что для таких случаев необходимо снабдить пациентов ингаляторами ксенона, позволяющими осуществлять самолечение. Для этого можно использовать баллоны, которые аналогично противоастматическим спреям заполнены ксеноном, высвобождающимся при нажатии клапана. Такое же применение может быть рекомендовано в случае лечения страдающих депрессией пациентов, настроение которых изменяется почти ежедневно, в результате чего они нуждаются в зависящем от состояния лечении.
Хроническая болезнь Паркинсона сопровождается прогрессирующими симптомами. Соответствующее лечение с использованием ксенона уменьшает высвобождение нейромедиаторов и замедляет развитие болезни или даже приводит к ее стабилизации. В этом случае показаны периодические обработки, при которых пациент вдыхает ксенон с определенными интервалами. Такое лечение можно применять и для пациентов, страдающих синдромом Жиль де ла Туретта. У этих пациентов тики проявляются все более и более явственно по мере прогресса болезни.
В случае состояний, подлежащих экстренному лечению, таких как черепно-мозговая травма или ишемия, предпочтительно следует осуществлять вдыхание смеси ксенон-кислород в соотношении 90:10 (об.%), предпочтительно в соотношении 80:20 (об.%), наиболее предпочтительно в соотношении 75-70:25-30 (об.%), в течение промежутка времени от нескольких часов до одного дня. При хроническом развитии болезни можно рассматривать применение смеси ксенон-воздух, в которой содержится сравнительно малое количество ксенона, например, 5-30%, предпочтительно 10-20%.
Для ингаляции ксенона, соответственно ксенонсодержащих смесей, в зависимости от цели могут использоваться различные методы. В клинических условиях можно применять аппаратуру для анестезии, с помощью которой заранее приготовленные ксенон-кислородные смеси могут быть введены с помощью соответствующих входных устройств анестезирующего аппарата.
После этого респирацию осуществляют согласно процедуре, описанной для такого аппарата. Такую процедуру применяют аналогично процедуре с использованием аппарата искусственного кровообращения.
В альтернативном варианте ксенон в экстренных случаях может быть смешан с окружающим воздухом вместо кислорода, что вследствие недостаточного размера потребных баллонов с необходимым давлением требует повышенной мобильности технических устройств. Например, можно использовать ингалятор, который подает ксенон от баллона, находящегося под давлением, и который с помощью подложки, несущей баллон, соединен со смесительной камерой. Эта смесительная камера, с одной стороны, включает мундштук для ингаляции ксенона, а с другой стороны, где подается ксенон в смесительную камеру, включает по крайней мере один дополнительный контрольный клапан, через который проходит воздух из окружающей среды. Контейнер, в котором находится ксенон, может быть снабжен понижающим давление клапаном, например, который уменьшает количество газообразного ксенона, доставляемого к соответствующему клапану. Когда пациент производит вдох, он вдыхает воздух из воздушных клапанов. В смесительной камере этот воздух смешивается в заданном соотношении с поступающим туда ксеноном и вдыхается пациентом. Предпочтительные конструкции ингалятора для применения в экстренных случаях и подачи ингалируемого ксенона и его смесей описаны, например, в ЕР-В-0560928.
В другом упрощенном варианте осуществления, предназначенном, например, для самолечения, мундштук соединен непосредственно с контейнером, содержащим ксенон под давлением. При ингаляции пациент открывает клапан давления и вдыхает ксенон одновременно с воздухом из окружающей среды. Когда он делает выдох, он выпускает клапан, так что в мундштук ксенон больше не поступает. Таким образом оказывается возможным по крайней мере грубо регулировать количество вдыхаемого ксенона.
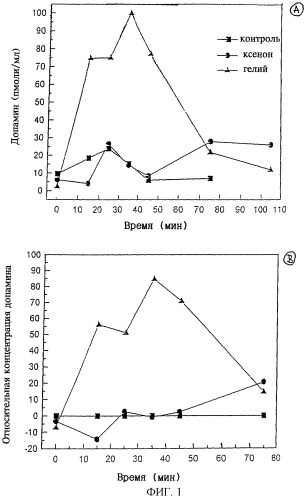
Ниже изобретение пояснено более подробно со сылкой на чертежи 1 и 2, на которых показано высвобождение допамина в клеточных культурах, подвергнутых гипоксическому шоку.
Преимущества изобретения могут быть пояснены на следующих примерах.
Пример 1
В данном примере описаны эксперименты in vitro, проведенные на клетках линии РС12. Клетки линии РС12 получали из феохромоцитомы крыс. В данном случае исследовали катехоламинпродуцирующую опухоль коры надпочечников, злокачественная форма которой непрерывно высвобождает допамин. Клетки линии РС12 могут непрерывно продуцироваться in vitro. После добавления "фактора роста нерва" они начинают дифференцироваться и превращаются в нейроны, которые во многих отношениях обладают свойствами нейронов in vivo, прежде всего свойствами, связанными с высвобождением нейромедиаторов. Клетки линии РС12 используются в качестве модели нейронов.
Для дифференцированных таким образом клеток линии РС12 создавали условия гипоксии, после чего они высвобождали допамин. Такие условия гипоксии представляют собой искусственно созданное для клеток состояние стресса, в котором, например, поступление кислорода снижается или задерживается. Если клетки в этих условиях гипоксии обрабатывают ксеноном в определенных концентрациях в течение такого же периода времени, то высвобождение нейромедиаторов должно уменьшиться. На фиг.1 в качестве примера приведена зависимость от времени, полученная в таком эксперименте. Зависимость для контролей, не подвергнутых стрессу, обозначенная черными квадратами, свидетельствует о низкой концентрации допамина в течение всего времени, при этом она характеризуется определенными флуктуациями. Если условия гипоксии инициируются путем добавления гелия вместо кислорода, то реализуется зависимость концентрации допамина, обозначенная черными треугольниками. Видно, что концентрация допамина достигает максимума приблизительно через 40 мин. Однако, если в условиях гипоксии подают ксенон, то рассматриваемые зависимости, обозначенные на графике черными кружками, практически не отличаются от соответствующих зависимостей, полученных для контрольной популяции клеток. Зависимости относительной концентрации допамина, показанные на фиг.1Б, свидетельствуют о том, что высвобождение допамина снижается до значений, соответствующих контрольным клеткам. В этой связи было установлено, что действие ксенона является полностью обратимым, так что обработанные им клетки после удаления ксенона, не могут быть отличены от необработанных клеток. В описанном выше эксперименте используемые газы подавали к клеткам путем смешения их с буфером для роста клеток. Таким образом, каждый раз использовали насыщенные газом буферные растворы.
Пример 2
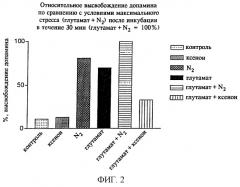
Дифференцированные клетки линии РС12, описанные в примере 1, вносили в различные сосуды и содержали в различных условиях. Результаты приведены на фиг.2.
Контроль: инкубация в обычной атмосфере (окружающий воздух)
N2: инкубация в атмосфере (N2) в течение 30 мин (гипоксия)
Ксенон: инкубация в ксеноне в течение 30 мин
Glu: добавление 10 мкМ глутамата в течение 30 мин при инкубации в обычной атмосфере
Glu + N2: добавление 10 мкМ глутамата в течение 30 мин при инкубации в атмосфере N2
Glu + Хе: добавление 10 мкМ глутамата в течение 30 мин при инкубации в ксеноне
Клетки, инкубируемые в атмосфере азота (группа: N2) находились в условиях гипоксии, что приводило к увеличенному высвобождению допамина. Высвобождение допамина даже возрастало, если в дополнение к атмосфере азота подавали глутамат, который представляет собой нейромедиатор и в больших дозах оказывает нейротоксичное действие (группа: Glu+N2). Однако, если 10 мкМ глутамат подавали одновременно с ксеноном (группа: Glu+Xe), то, хотя имело место небольшое увеличение высвобождения допамина, но оно было меньше на две трети по сравнению с соответствующими величинами, полученными в эксперименте с использованием глутамата + N2.
Результаты, представленные на фиг.2, свидетельствуют о том, что в условиях стресса, таких как гипоксия, в больших количествах высвобождаются нейромедиаторы глутамат и допамин. Это приводит к а) непосредственному повреждению нейронов в соседних тканях, прежде всего в результате индукции апоптоза, и б) к повреждению косвенным образом в результате дополнительного высвобождения других нейрометиаторов. Так, добавление к клеткам глутамата приводит к увеличению высвобождения допамина, прежде всего в том случае, когда клетки содержатся в условиях гипоксии. Нежелательное высвобождение нейромедиаторов может быть уменьшено во много раз путем одновременной подачи ксенона.
В целом в настоящем изобретении установлено, что с помощью ксенона можно быстро и без других побочных действий временно прекратить высвобождение нейромедиаторов. Из этого следует, что ксенон может применяться в определенных концентрациях для получения терапевтически полезного действия при всех патологических состояниях, характеризующихся нарушением регуляции высвобождения нейромедиаторов. Простота введения. путем ингаляции и безвредность ксенона делает такую терапию особенно привлекательной.
1. Применение ксенона или газовых смесей, содержащих ксенон, для лечения нейроинтоксикаций.
2. Применение по п.1, отличающееся тем, что нейроинтоксикация вызывается избытком нейромедиаторов.
3. Применение по п.1 или 2, отличающееся тем, что ксенон уменьшает высвобождение допамина, глутамата и/или норадреналина.
4. Применение по любому из пп.1-3, отличающееся тем, что нейроинтоксикация вызывается апоплексией.
5. Применение по любому из пп.1-3, отличающееся тем, что нейроинтоксикация вызывается злоупотреблением лекарственными средствами.
6. Применение по любому из пп.1-3, отличающееся тем, что нейроинтоксикация вызывается дефицитом кислорода при рождении.
7. Применение по любому из пп.1-3, отличающееся тем, что нейроинтоксикация связана с болезнью Паркинсона, шизофренией или синдромом Жиль де ла Туретта.
8. Применение по любому из пп.1-3, отличающееся тем, что нейроинтоксикация вызывается черепно-мозговой травмой.
9. Применение по любому из пп.1-3, отличающееся тем, что ксенон или газообразная смесь, содержащая ксенон, используются в аппарате искусственного кровообращения.
10. Применение по любому из пп.1-3, отличающееся тем, что нейроинтоксикация вызывает потерю слуха.
11. Применение по любому из пп.1-3, отличающееся тем, что нейроинтоксикация вызывается мигренью.
12. Применение по любому из пп.1-10, отличающееся тем, что вводимая для осуществления терапевтического лечения композиция содержит 5-90 об.% ксенона.
13. Применение по п.12, отличающееся тем, что композиция содержит 5-30 об.% ксенона.
14. Применение по любому из пп.1-13, отличающееся тем, что вводимая для осуществления терапевтического лечения композиция дополнительно содержит кислород, и/или, азот, и/или воздух.
15. Применение по п.12, отличающееся тем, что соотношение ксенона и кислорода в композиции составляет 80-20 об.%.
16. Композиция, включающая ксенон или газообразную смесь, содержащую ксенон, предназначенная для лечения нейроинтоксикаций.
17. Композиция по п.13, включающая ксенон или газообразную смесь, содержащую кислород.