Способ профилактики постспленэктомического синдрома в эксперименте
Иллюстрации
Показать всеИзобретение относится к медицине, к хирургии и трансплантологии и может быть использовано для профилактики постспленэктомического синдрома. Осуществляют забор селезенки у эмбриона, которую отмывают в питательной среде №199, помещают в свежую среду №199, и получают гомогенат в тефлоновом гомогенизаторе, который подвергают центрифугированию; выделяют верхний, средний и нижний слои; отсасывают средний слой и верхнюю часть нижнего слоя; полученную смесь клеток разводят в питательной среде №199, которую затем вводят инъекционно в брыжейку тонкой кишки или прямую мышцу живота. Данное изобретение способствует активизации иммунной системы у больных, подвергшихся операции спленэктомиии, и у больных с хирургическим иммунодефицитным состоянием за счет высокой функциональной и регенерирующей активности пересаженных клеток селезенки эмбриона. 6 ил., 2 табл.
Реферат
Предлагаемое изобретение относится к медицине, в частности к хирургии и трансплантологии, и может быть использовано при оперативном лечении заболеваний и повреждений селезенки для профилактики возникновения постспленэктомического синдрома и в отдаленном периоде после спленэктомии.
Прототипом предлагаемого изобретения является способ аутотрансплантации селезеночной ткани (Мироненко О.Н с соавтор. Морфологическое обоснование к аутотрансплантации ткани селезенки //Врачебное дело. - 1985. - №11. - С.71-74). По данному способу осуществляется аутотопическая пересадка селезеночной ткани в брыжейку тонкой кишки или карман большого сальника в виде кусочков размерами до 5 мм или фарша. Недостатками данного способа являются низкая функциональная активность пересаженной ткани, возможность гнойно-воспалительных осложнений, некоторые противопоказания к применению данной методики (разлитой перитонит, массивное кровотечение). Кроме того, данный метод применим лишь интраоперационно, при вынужденных спленэктомиях.
Технический результат, достигаемый при использовании изобретения, - улучшение функционального состояния иммунной системы у спленэктомированных больных, а также у пациентов с хирургическими иммунодефицитными состояниями (сепсис).
Указанный технический результат достигается тем, что осуществляют забор селезенки эмбриона крысы линии “Вистар”, которую отмывают в питательной среде №199, затем помещают в свежую среду №199, получают гомогенат в тефлоновом гомогенизаторе, подвергают его центрифугированию, выделяют верхний, средний, нижний слои, отсасывают средний слой и верхнюю часть нижнего слоя, разводят в питательной среде №199, затем полученный гомогенат вводят инъекционно в брыжейку тонкой кишки или в прямую мышцу живота.
Способ восстановления селезеночной ткани осуществляется следующим образом. Путем лапаротомии осуществляют забор зародыша, извлекают селезенку зародыша, отмывают питательной средой №199, затем помещают в свежую питательную среду №199, с целью получения однородной массы путем механического перетирания в гомогенизаторе получают гомогенат, который разливают в две одинаковые пробирки с равным количеством содержимого. Затем данные пробирки подвергают центрифугированию. После чего содержимое пробирок разделяется на три слоя: верхний, средний, нижний. Каждый слой подвергается тщательному морфологическому исследованию на предмет изучения качественного, количественного состава слоев, жизнеспособности и функциональной активности клеточных структур в них. Отсасывают средний слой и верхнюю часть нижнего слоя, разводят в питательной среде №199, вводят инъекционно в брыжейку тонкой кишки или в прямую мышцу живота взрослой крысе.
Пример. Было выделено 5 селезенок эмбриона от одной самки. После механической очистки селезеночная ткань была отмыта в питательной среде №199 и помещена в свежую среду №199 (5 мл). Гомогенат был получен в тефлоновом гомогенизаторе. Полученный субстрат был отцентрифугирован в 2-х мензурках по 2,5 мл в течение 30 минут на скорости 1500 об/мин. После чего гомогенезат разделился на 3 слоя. Каждый слой выделен в отдельную колбу и окрашен 1) по Романовскому-Гимзе, 2) трипановым синим (краситель, выявляющий погибшие клетки) в концентрации 0,4% раствора. Морфологическое исследование показало, что в верхнем (2,5 мл) слое практически отсутствуют клетки или клеточные структуры, в среднем (1 мл) - основное количество живых спленоцитов (90-95%) и в небольшом количестве (5-10%) клеточные структуры, лимфоциты, макрофаги и др., в нижнем (0,5 мл) - лимфоциты, макрофаги, клеточные структуры и в небольшом количестве спленоциты.
Эксперимент проведен на 35 взрослых белых крысах (m=250-320 г). Под эфирным наркозом производилась верхне-срединная лапаротомия. В брыжейку тонкой кишки (медленно, инсулиновым шприцем) вводили 0,5-0,8 мл раствора полученного гомогената. Место инъекции маркировали узловой лигатурой. После манипуляции производили послойное ушивание.
При введении гомогената в прямую мышцу живота на передней брюшной стенке выстригали площадку по парамедиальной линии в средней части живота. Затем в подготовленной области производили инъекцию до 1 мл в прямую мышцу живота.
В послеоперационном периоде летальных исходов не отмечено. Животные начинали питаться с первых суток после операции, были активными, летальных исходов не было.
Прооперированные животные были подразделены на 3 группы: первую группу забивали через 10, вторую - через 20, третью - через 30 суток после трансплантации. Для оценки морфофункционального состояния пересаженной ткани проведены гистологические и гистохимические исследования. Из зоны трансплантации удаляли кусочки тканей размерами 1×1 см. Взятые кусочки фиксировали в 10% растворе формалина и после соответствующей гистологической проводки и приготовления срезов толщиной 7 мкм окрашивали гематоксилин-эозином. Всего приготовлено 350 микропрепаратов. Фильтрующую функцию трансплантированной селезеночной ткани оценивали реакцией Перлса, которая выявляет присутствие гемосидерина, являющегося промежуточным продуктом элиминации эритроцитов. Из кусочков трансплантата в криостате при температуре -20°С приготовлено 60 препаратов толщиной 7 мкм.
Исследование морфологических препаратов иллюстрируется следующими рисунками:
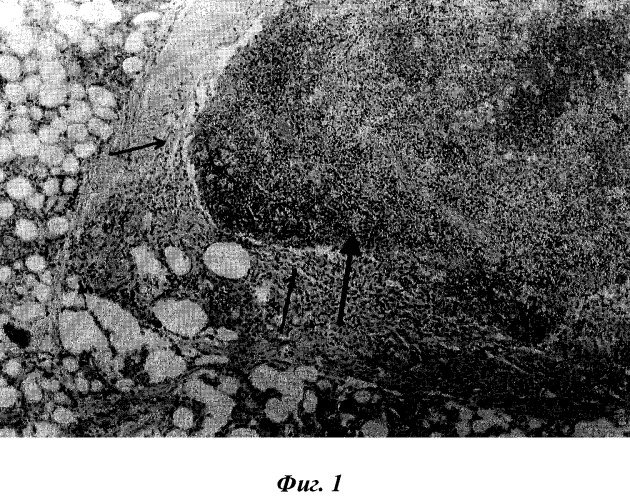
Фиг.1. Фрагмент селезеночной ткани через 10 суток после трансплантации в брыжейку тонкого кишечника. Окраска гематоксилин-эозином. Микрофото. Ок. 10,об.20.
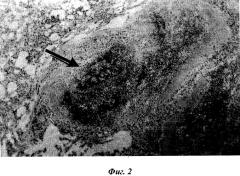
Фиг.2. Белая пульпа трансплантата селезенки через 20 суток после пересадки эмбриональной ткани. Окраска гематоксилин-эозином. Микрофото. Ок.7, об. 20.
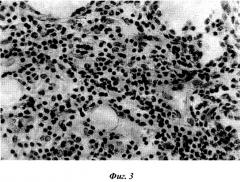
Фиг.3. Увеличение количества лимфоидных клеток в красной пульпе через 20 суток после пересадки эмбриональной ткани. Окраска гематоксилин-эозином. Микрофото. Ок. 10, об. 40.
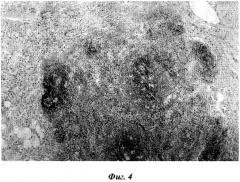
Фиг.4. Трансплантат селезенки через 30 суток после эксперимента. Окраска гематоксилин-эозином. Микрофото. Ок. 7, об. 20.
Фиг.5. Сидеробласты трансплантата через 30 суток после эксперимента. Реакция Перлса. Микрофото. Ок. 10, об. 40.
Фиг.6. Лимфоидные фолликулы (белая пульпа селезенки) в поперечно-полосатой мышечной ткани через 10 суток после трансплантации. Окраска гематоксилин-эозином. Микрофото. Ок. 10, об. 20.
Через 10 суток после трансплантации селезеночной ткани в брыжейке тонкого кишечника на ощупь определялось плотное образование темно-красного цвета, визуальных признаков воспалительных процессов не отмечено.
В рыхлой соединительной ткани, прежде всего, определяется довольно большого размера скопления лимфоидной ткани, соответствующей белой пульпе селезенки. Она представлена лимфатическими узелками, периартериальными лимфатическими влагалищами и маргинальной зоной. Лимфатические фолликулы располагаются по периферии периартериального лимфатического влагалища. Периартериальное лимфатическое влагалище окружает центральную артерию. В состав этой лимфоидной ткани трансплантата входят лимфоциты, макрофаги и ретикулярные клетки (фиг.1). Маргинальная зона представляет собой узкий слой лимфоцитов вокруг узелков и периартериальных лимфатических влагалищ.
Красная пульпа представлена венозными сосудами и селезеночными тяжами, где в небольшом количестве встречаются эритроциты. Лимфоидная ткань, расположенная в петлях ретикулярной ткани, занимает гораздо большие пространства. Вокруг красной и белой пульпы селезенки в окружающей рыхлой соединительной ткани разбросаны небольшого размера скопления лимфоидной ткани, все они округлой или овальной формы. Некоторые скопления лимфоидных клеток могут располагаться в непосредственной близости от кровеносных сосудов между липоцитами и от крупных лимфоидных образований. Вокруг небольших скоплений лимфоидных клеток, среди фибробластов и липоцитов располагаются одиночно расположенные лимфоциты и макрофаги.
Через 20 суток после трансплантации селезеночной ткани также определяются все структурные образования селезенки. Белая пульпа состоит из лимфатических узелков, периартериальных лимфатических влагалищ и маргинальной зоны. Определяется эксцентрично расположенная центральная артерия. Клетки лимфоидной ткани белой пульпы селезенки распределяются равномерно, однако в лимфатических узелках центры размножения не выявляются. Красная пульпа характеризуется увеличением количества лимфоидных клеток, расположенных между ретикулярными клетками, однако ретикулярные клетки имеют распластанный вид (фиг.2). В окружающей соединительной ткани вокруг белой и красной пульпы разбросаны лимфоидные скопления разнообразной формы и размера. Встречаются скопления крупного размера и много одиночно расположенных лимфоидных клеток. Вокруг трансплантата хорошо развита сеть кровеносных сосудов, как капилляры, так и более крупные кровеносные сосуды умеренного кровенаполнения (фиг.3).
Через 30 суток после эксперимента в трансплантате также определяется наличие белой и красной пульпы. Белая пульпа состоит из лимфатических фолликулов, а в красной пульпе много лимфоцитов и макрофагов, расположенных среди “распластанных” ретикулярных клеток. Вокруг белой и красной пульпы трансплантата селезенки, в окружающей рыхлой соединительной ткани много различного размера лимфатических фолликулов. Некоторые из них располагаются в непосредственной близости от крупных кровеносных сосудов. Одновременно определяется диффузное распространение лимфоидных клеток как из белой и красной пульпы, так и из формирующихся очагов лимфоидной ткани, расположенных в рыхлой соединительной ткани (фиг.4). Это одиночно расположенные лимфоидные клетки среди фибробластов и липоцитов. Динамика и характер появления очагов лимфоидной ткани вокруг трансплантата представлены в таблице 1.
В различные сроки после трансплантации эмбриональной селезеночной ткани в брыжейку тонкой кишки определяется различной интенсивности реакция на железо в макрофагах красной пульпы. Макрофаги располагались небольшими группами или диффузно. Белая пульпа трансплантата оставалась интактной к железу. Гемосидерин определялся в виде гранул различного количества и размеров (фиг.5). В подавляющем большинстве случаев гранулы гемосидерина в цитоплазме сидеробластов распределялись равномерно, однако встречались макрофаги с крупными гранулами.
Через 10 суток после введения селезеночной ткани в прямую мышцу живота среди волокон поперечно-полосатой мышечной ткани передней стенки живота определяется округлой формы скопление лимфоидной ткани, состоящей из лимфоцитов и макрофагов, расположенных среди ретикулярных клеток (фиг.6). Лимфоидные клетки имеют плотное расположение, определяется наличие центральной артерии. Вокруг большого скопления лимфоидных клеток находятся свободно расположенные лимфоидные клетки. Они простираются по ходу мышечных волокон в перимизий передней мышцы живота. Встречаются небольшого размера скопления лимфоидных клеток. Все вышеперечисленные структуры не имеют признаков воспалительного процесса.
Через 20 и 30 суток определяется наличие большого размера лимфоидных узелков, состоящих из лимфоцитов и макрофагов. Вокруг лимфоидных узелков в рыхлой соединительной ткани между мышечными волокнами достаточно часто встречаются различного размера лимфоидные скопления. При этом лимфоциты и макрофаги располагаются плотно. Все клетки имеют четкие контуры ядра и оболочки. Хроматин клеток очень плотный, цитоплазма клеток базофильна. Свободно расположенные лимфоидные клетки проникают достаточно далеко от основного очага лимфоидной ткани, клетки проникают между мышечными волокнами в перимизий.
Вполне допустимо, что образование новых очагов кроветворения вокруг трансплантата и активное функционирование клеток трансплантата происходит под влиянием стимуляторов лимфоидных узелков трансплантата селезенки.
В пересаженной селезеночной ткани определяется функциональная активность макрофагов красной пульпы, выполняющих фильтрационную функцию, поглощая поврежденные эритроциты. Данный факт может служить подтверждением возможности выполнения трансплантированной селезеночной тканью обезвреживающей функции. Однако нельзя исключить возможность миграции макрофагов из прилегающих тканей донора и поступление продуктов распада гемоглобина из сети сосудов, расположенных вокруг трансплантата.
Для определения функциональной активности пересаженной селезеночной ткани нами были проведены иммунологические исследования. Исследования способности к синтезу гемаглютинирующих антител, отражающих защитную функцию организма, проводили в течение 2-3 месяцев после операции, по данным литературных источников, к данному сроку активность адекватных иммунокомпетентных реакций восстанавливается полностью. Для достоверности исследования крысам, которым производили трансплантацию селезеночной ткани, на операции одновременно производили спленэктомию.
После проведения 3-кратной иммунизации оперированных крыс определяли показатели иммунного ответа путем титрования гемаглютининов ксеногенными эритроцитами. При этом определялась способность иммунокомпетентных клеток к синтезу гемаглютинирующих антител. Иммунизацию проводили по схеме; 1-ая иммунизация через 2 недели после операции; 2-я иммунизация через 1 неделю после 1-ой иммунизации, 3-я иммунизация через 3 недели после 2-ой иммунизации. Данные исследований приведены в табл. 2. Для сравнения взята группа животных после лапаротомии и спленэктомии.
Как видно из полученных результатов, уже после первой иммунизации намечались достоверные различия (р<0,05) в показателях иммунного ответа на введение антигена у всех групп животных. После 2-ой, особенно после 3-ей, иммунизации у животных, перенесших лапаротомию, титр гемаглютининов значительно нарастает, достигая максимальной величины к концу 4-ой недели. Титр гемаглютининов у животных после трансплантации селезеночной ткани и спленэктомии был относительно ниже, чем у животных после лапаротомии на протяжении всего периода исследования. Тем не менее необходимо отметить достоверную разницу в динамике нарастания титра антител у крыс с трансплантированной селезеночной тканью и полностью удаленной селезенкой (р<0,05). Следовательно, антителообразующая функция страдает меньше у крыс после трансплантации селезеночной ткани по сравнению с крысами после спленэктомии.
Были проведены эксперименты на 35 крысах. По сравнению с прототипом в предлагаемом изобретении обеспечивается высокая функциональная активность пересаженных клеток, их высокая регенерирующая способность, отмечаются все признаки появления новых очагов кроветворения. Кроме того, снижается риск иммуноконфликта за счет неполной иммунной дифференцировки эмбриональной ткани. На период эмбрионального развития приходится "пик" активации так называемого фактора роста, ускоряющего функциональные свойства спленоцитов. Проведенные иммунологические исследования продемонстрировали значительную компенсацию иммунологических возможностей животных с трансплантированной селезеночной тканью по сравнению со спленэктомированными животными. Техника операции является несложной, не требует специального инструментария, предварительной специальной подготовки медицинского персонала, способ может применяться не только в специализированных, но и в общехирургических отделениях.
| Таблица 1.Динамика количества и размеров лимфоидной ткани в брыжейке тонкого кишечника. | |||
| Сроки исследования (суток) | Размеры скопления лимфоидной ткани вокруг трансплантата | ||
| Мелкие | Средние | Крупные | |
| 10 | Редкие скопления (1-2-3 очага) | - | - |
| 20 | 3-4 очага | 3-4 очага | 1-3 очага |
| 30 | 5-7 очагов | 5-6 очагов | 3-5 очагов |
| Таблица.2.Титр антител оперированных крыс после операций (в М_+m) (титр до операции 1:32+1:1280) | |||
| Сроки наблюдения | Сравнимые группы животных | ||
| лапаротомия | спленэктомия | после трансплантации | |
| 1-ая неделя после 1-ой иммунизации | 1:220-1:1600 | 1:58-1:268 | 1:120-1:110 |
| 1-ая неделя после 2-ой иммунизации | 1:1022-1200 | 1:240-1:1800 | 1:240-1:180 |
| 2-ая неделя после 2-ой иммунизации | 1:1200-1:18110 | 1:560-1:141001 | 1:830-1:215 |
| 3-яя неделя после 2-ой иммунизации | 1:2350-1:18120 | 1:560-5-1:123340 | 1:950-1:170 |
| 1-ая неделя после 3-й иммунизации | 1:8200-1:24600 | 1:980-1:19300 | 1:1660-1:22 |
| прод. табл.2 | |||
| 2-ая неделя после 3-й иммунизации | 1:10220-1:2470 | 1:1034-1:22200 | 1:2380-1:20 |
| 3-яя неделя после 3-й иммунизации | 1:10220-1:3240 | 1:1840-1:18110 | 1:4092-1:22 |
| 4-ая неделя после 3-й иммунизации | 1:16350-1:4820 | 1:4086-1:48600 | 1:4100-1:17 |
| 8-ая неделя после 3-й иммунизации | 1:8186-1:4220 | 1:2400-1:19220 | 1:2400-1:19 |
Способ профилактики постспленэктомического синдрома путем пересадки селезеночной ткани в брыжейку тонкой кишки, отличающийся тем, что осуществляют забор селезенки у эмбриона, которую отмывают в питательной среде №199, затем помещают в свежую среду №199, получают гомогенат в тефлоновом гомогенизаторе, подвергают его центрифугированию, выделяют верхний, средний и нижний слои, отсасывают средний слой и верхнюю часть нижнего слоя, разводят в питательной среде №199, вводят инъекционно в брыжейку тонкой кишки или прямую мышцу живота.