Трифенилалкеновые производные и их применение в качестве селективных модуляторов рецепторов эстрогена
Иллюстрации
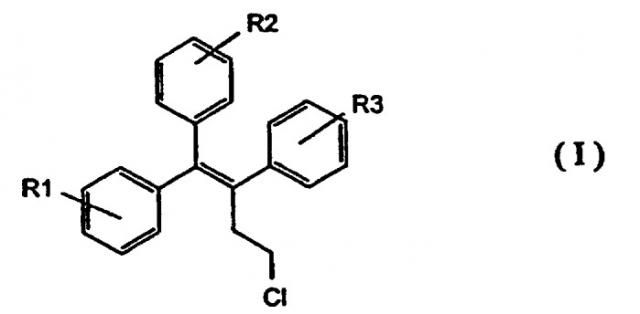
Показать всеИзобретение относится к органической химии, в частности к соединениям общей формулы (I):
где R1 означает Н, галоген, ОСН3, ОН; R2 означает (а)
где i) X означает NH или S; n означает целое число от 1 до 4 и R4 и R5, которые одинаковы или различны, означают алкил с 1-4 атомами углерода, Н, -СН2С=СН или -СН2СН2OH; либо R4 и R5 образуют N-содержащий пяти- или шестичленный цикл или гетероароматический цикл; или где ii) Х означает О; n означает целое число от 1 до 4 и один из R4 и R5 означает -СН2С=СН или -СН2СН2OH, а другой представляет Н или C1-C4 алкил; или R4 и R5 образуют цикл имидазола, N-содержащий шестичленный цикл или гетероароматический цикл; либо R2 означает (b) -Y-(CH2)nCH2-O-R6, где i) Y означает О, n означает целое число от 1 до 4 и R6 означает -СН2СН2OH или -СН2СН2Cl; или где ii) Y означает NH или S, n означает целое число от 1 до 4 и R6 означает Н, -СН2СН2OH или -СН2СН2Cl; или R2 означает c) 2,3-дигидроксипропокси, 2-метилсульфамилэтокси, 2-хлорэтокси, 1-этил-2-гидроксиэтокси или 2,2-диэтил-2-гидрокси-этокси; R3 означает Н, галоген, ОН или -ОСН3, которые являются новыми селективными модуляторами рецепторов эстрогенов (SERMs). Также описана фармацевтическая композиция и способ продуцирования тканеспецифического эстрогенного и/или антиэстрогенного эффекта у пациента, для которого указанное действие является желательным. 3 с. и 16 з.п. ф-лы, 7 табл.
Реферат
Область изобретения
Настоящее изобретение касается производных трифенилалкена и их использования в качестве селективных модуляторов рецепторов эстрогенов (SERMs-СЭРМов).
Обоснование изобретения
Публикации и другие материалы, используемые для освещения обоснования создания изобретения, и, в частности, описания случаев, дающих дополнительные подробности, касающиеся практического применения, включены здесь в качестве ссылок.
Эстрогены известны как женские половые гормоны. Однако позднее были описаны многие тканеспецифические характеристики эстрогенов в органах, которые по классическим представлениям не считаются эстроген-чувствительными или эстроген-реагирующими. Во время менопаузы секреция эстрогенов резко снижается. Впоследствии у пожилых женщин развиваются обычно климактерические симптомы, включающие приливы, потливость, бессонницу, депрессию, головную боль, вагинальную сухость, сердечно-сосудистые симптомы, недержание мочи, ощущение набухания, болезненности молочных желез и утомляемость. Длительный дефицит эстрогенов вызывает сердечно-сосудистые расстройства и остеопороз, который повышает риск переломов костей и госпитализаций, которые очень дорогостоящи для общества. Для лечения климактерических симптомов все в большей мере используют эстрогены. Но, с другой стороны, эстрогены повышают риск рака матки и молочных желез (Lobo, 1995). Показано, что эстрогены полезны также для профилактики болезни Альцгеймера (Henderson, 1997) и для снижения LDL-показателей холестерина и тем самым предупреждения сердечно-сосудистых заболеваний (Grodstein & Stampfer, 1998). Необходимы новые терапевтические способы, которые имели бы преимущества эстрогенов, но без риска возникновения рака. Были разработаны селективные модуляторы рецепторов эстрогенов (СЭРМы), полностью удовлетворяющие указанным требованиям (Масgrеgоr & Jordan, 1998). Однако используемые в настоящее время СЭРМы обладают свойствами, которые далеки от оптимальных. Например, применение ралоксифена ограничено из-за его сильных антиэстрогенных свойств, которые вызывают и усугубляют климактерические симптомы, при благоприятном воздействии на кости (Khovidhunkit & Shoback, 1999). Особенно желательно получить тканеспецифические эстрогены, которые можно было бы использовать для лечения климактерических симптомов у женщин, остеопороза, болезни Альцгеймера и/или сердечно-сосудистых заболеваний без риска возникновения рака. В оптимальном случае новые СЭРМы можно будет давать мужчинам для предупреждения остеопороза, сердечно-сосудистых заболеваний и болезни Альцгеймера без проявления вредных влияний эстрогенов (гинекомастия, снижение полового влечения и т.д.).
Цель и краткое описание изобретения
Одна из целей настоящего изобретения состоит в создании новых селективных модуляторов рецепторов эстрогенов.
Другой целью настоящего изобретения является создание фармацевтической композиции, включающей эффективное для получения тканеспецифического эстрогенного и/или анти-эстрогенного действия количество указанного нового селективного модулятора эстрогеновых рецепторов - соединения или его нетоксической фармацевтически приемлемой соли и фармацевтически совместимого приемлемого носителя.
Другая цель настоящего изобретения состоит в разработке способа продуцирования тканеспецифического эстрогенного и/или антиэстрогенного эффекта у пациента, для которого указанный эффект является желательным, включающего введение указанному пациенту указанного нового селективного модулятора рецепторов эстрогена - соединения или его нетоксической фармацевтически приемлемой соли, в количестве, достаточном для создания требуемого действия.
Итак, согласно одному из аспектов настоящее изобретение касается новых соединений - селективных модуляторов рецепторов эстрогена, общей формулы:
где R1 и R2, которые одинаковы или различны и означают
a) Н, галоген, ОСН3, ОН или
b)
где Х означает О, NH или S; а n означает целое число
от 1 до 4; и
R4 и R5, которые одинаковы или различны и означают алкил с 1-4 атомами углерода, Н, -CH2CCH или -СН2СH2ОН;
либо
R4 и R5 образуют N-содержащий пяти- или шестичленный цикл или гетероароматический цикл; или
с) -Y-(CH2)nCH2-O-R6,
где Y означает О, NH или S и n означает целое число от 1 до 4; и
R6 означает Н, -СН2СH2ОН или -CH2CH2Cl; или d) 2, 3-дигидроксипропокси, 2-метилсульфамилэтокси, 2-хлорэтокси, 1-этил-2-гидроксиэтокси, 2,2-диэтил-2-гидрокси-этокси или карбоксиметокси, и
R3 означает Н, галоген, ОН или -ОСН3; и
их нетоксических, фармацевтически приемлемых солей и сложных эфиров, и их смесей,
при условии, что
a) когда R2 означает
в 4-положении фенила,
где R4 и R5
i) одинаковые, либо метил, либо этил; или
ii) образуют N-содержащий пятичленный цикл;
то R1 и R3 не могут одноврменно означать Н; и
b) когда R2 означает
в 4-положении фенила,
где R4 и R5 одинаковы или различны и означают метил
или Н; или
когда R2 означает -O-СН2СН2-ОН или -O-СН2СООН в 4-положении фенила,
то R1 и R3 не могут одновременно означать Н или ОН в 4-положении фенила; и
если R1 означает ОН в 4-положении фенила, R3 не может означать Н.
Согласно другому аспекту изобретение касается фармацевтической композиции, включающей эффективное для получения тканеспецифического эстрогенного и/или антиэстрогенного эффекта количество указанного нового селективного модулятора рецепторов эстрогена - соединения или его нетоксической фармацевтически приемлемой соли, и фармацевтически совместимого приемлемого носителя.
Еще один аспект изобретения касается способа продуцирования тканеспецифического эстрогенного и/или антиэстрогенного эффекта у пациента, для которого указанный эффект является желательным, включающего введение указанному пациенту указанного нового селективного модулятора рецепторов эстрогена - соединения или его нетоксической фармацевтически приемлемой соли, в количестве, достаточном для создания требуемого действия.
Подробное описание изобретения
Настоящее изобретение касается применения новых селективных модуляторов рецепторов эстрогена (СЭРМов) и их фармацевтических препаратов мужчинами и женщинами для лечения дегенеративных заболеваний и симптомов, вызванных дефицитом эстрогена. Обычно СЭРМы действуют как эстрогены в кости и сердечно-сосудистой системе, тогда как они являются антиэстрогенными в ткани молочной железы. СЭРМы могут обладать агонистическими и антагонистическими эффектами также и в других тканях. В зависимости от их химической структуры и гормональных характеристик некоторые соединения могут в особенности подходить для пожилых женщин с целью предупреждения остеопороза, тогда как другие (не феминизирующие эстрогены) могут также быть использованы мужчинами для предупреждения остеопороза, сердечно-сосудистых заболеваний и болезни Альцгеймера. Некоторые соединения в особенности подходят для лечения климактерических симптомов у женщин в период менопаузы. Общая характеристика вышеуказанных соединений состоит в том, что они являются антиэстрогенными в молочной железе и препятствуют разрастанию раковых клеток молочной железы. Они являются слабыми эстрогенами в матке и не вызывают раковых опухолей матки (побочное действие хорошо известного СЭРМа, тамоксифена).
Новые СЭРМы по настоящему изобретению, таким образом, обладают тканеспецифическими эстрогенным и/или антиэстрогенным эффектами in vitro и in vivo и полезны для предупреждения и лечения остеопороза, сердечно-сосудистых заболеваний и болезни Альцгеймера у мужчин и женщин, а также для лечения климактерических симптомов и рака молочной железы у женщин.
Соединения формулы (I) могут быть получены способом, который включает взаимодействие соединения формулы
где R7 имеет те же значения, что указаны выше для R1 или R2, или является защищенной указанной группой, R3’ означает вышеуказанный R3 или защищенный ОН, R8 означает бензил или тетрагидропиранил, с металлоорганическим соединением формулы
где R9 означает Н, вышеуказанные R1 и R2 или является защищенной указанной группой, и М означает -Мg-галоген или Li, с получением соединения формулы
где r3’, R7, R8 и R9 принимают вышеуказанные значения. R8 означает тетрагидропиранил, когда R7 или R9 означает -X-(CH2)nCH2-OR6, где Х и n принимают значения, указанные для (I).
Соединение (IV) дегидратируют с помощью подходящего кислотного катализатора, предпочтительно с уксусным ангидридом/ацетилхлоридом, получая производное трифенилэтилена формулы
где R8’ означает Н или бензил, R7’ и R9’ означают R1 и R2 или бензил-защищенный ОН, или бензил-защищенный -XCH2CH2OR6. Возможные защитные тетрагидропиранильные группы в R3, R7, R8 и R9 удаляют указанным способом, получая радикалы R3, R7’, R8’ и R9’.
Удаление возможной бензильной группы R8’ может быть осуществлено обработкой Zn и ацетилхлоридом в толуоле, что дает трифенилбутенол формулы
Гидроксисоединение (VI) может быть превращено в соответствующий хлорид обработкой тионилхлоридом или трифенил-фосфин-четыреххлористым углеродом в органическом растворителе с получением формулы
Заявленные соединения (I) получают из соединений формулы (VII), где R7’ и/или R9’ означают бензил-защищенный -XCH2CH2OR6, обработкой Zn и ацетилхлоридом в органическом растворителе или путем каталитического гидрирования.
Другой способ получения соединений формулы (IV) представляет реакцию гидроалюминирования производного “стирола” формулы
где R10 означает -СНО, -СН2OН, -СООН или соответствующий сложный эфир и R3 принимает вышеуказанные значения, с производным бензофенона формулы
Еще один способ получения соединений по изобретению включает O-алкилирование соединения формулы (V), где R7’ и/или r9’ означают ОН, алкилгалогенидным производным формулы
где m означает целое число от 1 до 5 и R11 означает галоген, или -OR6’,
где R6’ означает R6 или защищенный R6, или -COOR,
с образованием соединения формулы
Соединение формулы (XI), где R11 означает галоген, подвергают взаимодействию с амином формулы , получая соединение формулы
Еще один способ получения соединений формулы (VII) включает реакцию Мак-Марри (McMurry) взаимодействия производного бензофенона формулы
где R7’ и R8’ принимают вышеуказанные значения, с производным 3-хлорпропиофенона формулы
где R3 принимает вышеуказанные значения.
Заявленное соединение формулы (I), где R1 или R2 означает 2,2-диэтил-2-гидроксиэтокси, может быть получено взаимодействием соединения формулы (XI), где m равно 1 и R11 означает -COOR, с этилмагнийбромидом.
Заявленное соединение формулы (I), где R1 или R2 означает 1-этил-2-гидроксиэтокси, может быть получено O-алкилированием соединения формулы (V), где R7’ или R9’ означает ОН, этил-α-бромбутиратом и восстановлением полученного сложного эфира литийалюмогидридом.
Экспериментальная часть
Методики
Оценка эстрогенных и антиэстрогенных свойств соединений в экспериментах по росту клеток MCF-7 in vitro
Эстроген-чувствительные человеческие раковые клетки молочной железы, MCF-7 (McGrath clone), хранят в RPMI-1640 среде, дополненной 10% околоплодной сывороткой теленка, 2 мМ L-глутамина, 10 мкг/мл инсулина и 10 мкг/мл гентамицина. Клетки выращивают как однослойные культуры в 75 см2 пластиковой колбе для тканевых культур (Nunc, Roskilde, Denmark) в 25 мл среды при 37°С в атмосфере 95% воздуха, 5% CO2 и пассивируют два раза в неделю.
Для экспериментов, включающих обработку гормоном или антигормоном, клетки на экспоненциальной фазе роста прекультивируют в отсутствие эстрадиола один день. Клетки высевают на чашки при плотности 3,5×103 клетки/лунку в 96-луночные пластины для микротитрования (Nunclon, Roskilde, Denmark) и инкубируют в течение 24 часов при 37°С, 95% воздуха, 5% CO2, среда RPMI-1640 (L-глутамин и гентамицин как указано выше) с 5% околоплодной сыворотки теленка (дважды десорбирована углем, покрытым слоем декстрана, для удаления стероидов) и в отсутствие фенолового красного. По завершении периода инкубирования удаляют среду. Экспозицию для изучения лекарственных средств начинают тотчас же, добавляя свежую среду с 5% десорбированной сывороткой. Половину клеток выращивают с эстрадиолом, половину - без эстрадиола. Добавляют изучаемые соединения (растворенные в этаноле при концентрации 0,01 М и соответственно разбавленные питательной средой). Конечные концентрации соединений равны 1, 10 и 100 нМ, и 1 и 10 мкМ. Клетки инкубируют в течение четырех дней.
Количество живых клеток определяют через 4 дня с помощью люминометра на основании количества АТФ и взаимодействия люциферазы, как описано Kangas’ом et al, 1984. Указанный способ позволяет проводить оценку экстрогенности на основании способности соединений стимулировать рост эстроген-зависимых клеток в отсутствие эстрадиола. Эстрогенность оценивают, сравнивая максимальный стимул роста (при любой концентрации) для изучаемого соединения как процент от стимула роста под воздействием эстрадиола (100% стимул). В настоящем исследовании антагонизм оценивают при концентрации 1 мкмоль/л как процент от теоретически полного (100%) антагонизма, означающего полное ингибирование эстрадиол-стимула. При высоких концентрациях молекулы также могут проявлять токсичность. Токсичность оценивают как фракцию мертвых клеток (т.е. 100% означает, что все клетки при экспозиции погибли). Результаты представлены в таблице 2.
Оценка эстрогенности и антиэстрогенности in vivo
Классический способ оценки эстрогенного и антиэстрогенного действия представляет использование недоразвитых маток мышей или крыс (Terenius, 1971). Животных в возрасте 18 дней подвергают воздействию исследуемых соединений в течение 3 дней. На четвертый день вызывают асфиксию животных с помощью СO2 и регистрируют массу тела и массу матки. Эстрогены увеличивают размер и массу маток (гистеротропный эффект), тогда как антиэстрогены ингибируют указанное действие. Соединения, таким образом, дают в отдельности или с эстрадиолом с целью оценки как агонистического, так и антагонистического действий. Оба результата приведены в таблице 3 в виде процента от стимуляции эстрогеном (100%) и как ингибирование действия эстрогена (полное ингибирование равно 100%). Значения даны при двух уровнях доз, низком, т.е. 3-5 мг/кг, и высоком, т.е. 10-50 мг/кг. Эстрогенная активность может также быть оценена после 4-недельного лечения подвергнутых овариэктомии крыс на основании размера матки. Указанное испытание осуществляют с соединениями структур, указанных в таблице 4.
Оценка влияний на холестерин и кости
Соединения дают р.о. (per os) - п.о. самкам крыс в течение 4 или 5 недель ежедневно. По окончании отбирают пробу крови. Сыворотку отделяют центрифугированием и замораживают до анализа на общее количество холестерина. Образцы кости берут из позвоночника и большой берцовой кости. Физическую прочность костей изучают, как описано Peng’ом et аl, 1994. Оценка кости включает:
Зольную массу большеберцового эпифиза
Эпифиз одной большой берцовой кости осторожно отделяют и сжигают. Пробы сжигают для удаления воды и органического материала. Зольная масса соответствует минеральному содержанию кости. Кроме того, берут пробы кости для изучения гистоморфометрии. В некоторых случаях остеогенез изучают путем впрыскивания тетрациклина (50 мг/кг i.р.(в.б.) за 10 дней до аутопсии) и кальцеина (20 мг/кг в. б. за 3 дня до аутопсии). Способ основан на необратимом связывании тетрациклина растущей костью и его определении по флуоресценции (Peng et al, 1994).
Механическое тестирование костей
Механическое тестирование костей осуществляют с помощью аппарата для тестирования материала, сконструированного в Университете Oulu (Технический вспомогательный отдел при медицинском факультете). Тестирующий аппарат основан на принципе плеча рычага. Один конец стального рычага фиксирован. Прессующий стержень и мотор с приводом связаны с плечом рычага при соотношении моментов 12,5 см/50 см = 1/4. В качестве мотора с приводом для достижения постоянного вертикального движения (0,62 см/с) применяют линейный механизм (SEY 10 Magnetic Elektromotoren AG, Switzerland). На прессующий стержень устанавливают взаимозаменяемую компрессионную насадку для различных испытаний, передающую сжимающее усилие образцу и движущуюся с постоянной скоростью 0,155 мм/с до максимальной полной нагрузки 1200 Н. Прессующий стержень направляется с помощью осевого шарикоподшипника для обеспечения вертикального перемещения. Сжимающее усилие измеряют с помощью датчика температуры-компенсированного усилия, который соединен с неподвижной частью компрессионной платформы. Электронные измеряющие устройства включают калибровку датчика и регулировку.
Прочность шейки бедренной кости
Максимальную нагрузку на шейку бедренной кости определяют с помощью теста на консольное сгибание. Штативом для кости служит толстая пластина из полиметилметакрилата, в которой просверлено несколько отверстий различного размера. На одной стороне каждого отверстия прорезана бороздка для трети вертела бедренной кости. Бедренную кость пропиливают точно между серединой и нижней третью тела бедренной кости. Кость вставляют перпендикулярно и плотно в подходящее отверстие на штативе. Малый вертел каждой кости соприкасается с поверхностью пластины. Указанный способ дает возможность быстрой и стабильной фиксации кости без использования каких-либо дополнительных материалов. Вогнутую компрессионную головку 2,5 мм в диаметре изготавливают из алюминия. Комплекс головка-шейка бедренной кости подвергают испытанию на разрушение, создавая параллельную телу нагрузку на головку.
Оценка противоопухолевой активности in vivo
Противоопухолевую активность оценивают, применяя модель DMBA - ДМБА (диметилбенз[а]антрацена). Одной разовой пероральной дозой ДМБА (12 мг) инициируют онкогенез молочной железы. Новые соединения вводят в течение 5 недель, до появления пальпируемых опухолей. Размер опухолей и число новых опухолей внимательно оценивают раз в неделю до завершения срока. Модель описана подробно Kangas’ом et аl., 1986. Рост опухолей измеряют один раз в неделю. Все опухоли классифицируют, согласно их способностям к росту, на прогрессирующие, стабильные и регрессирующие. Исчезнувшие опухоли подсчитывают отдельно. Опухоли считаются прогрессирующими, если объем опухоли вырос более чем в 8 раз за 5-недельный период дозированного введения лекарственного средства, и регрессирующими, если объем опухоли сократился до одной четвертой или менее величины от начального объема. Если объем опухоли изменился меньше или остался неизменным, то опухоли считаются стабильными.
Результаты
В общей сложности вышеуказанными способами оценено 46 соединений, которые включены в список примеров характерных соединений, пронумерованных и перечисленных в таблице 1.
| Таблица 1Перечень номеров (№) и названий характерных соединений | |
| № | Соединение |
| 1 | (Е)-(2-{4-[4-Хлор-1-(4-фторфенил)-2-фенилбут-1-енил]фенокси}-этил)диметиламин |
| 2 | (Z)-(2-{4-[4-Хлор-1-(4-фторфенил)-2-фенилбут-1-енил]фенокси}-этил)диметиламин |
| 3 | (Е)-(2-{4-[4-Хлор-1-(4-хлорфенил)-2-фенилбут-1-енил]фенокси}-этил)диметиламин |
| 4 | (Е)-(2-{4-[4-Хлор-1,2-бис(4-хлорфенил)бут-1-енил]фенокси}этил)-диметиламин |
| 5 | (Z)-(2-{4-[4-Хлор-1,2-бис(4-хлорфенил)бут-1-енил]фенокси}этил)-диметиламин |
| 6 | (Е)-4-Хлор-1-[4-(2-хлорэтокси)фенил]-1,2-бис(4-хлорфенил)-бут-1-ен |
| 7 | (Z)-4-Хлор-1-[4-(2-хлорэтокси)фенил]-1,2-бис(4-хлорфенил)-бут-1-ен |
| 8 | (Е)-2-{4-[4-Хлор-2-фенил-1-(4-фторфенил)бут-1-енил]фенокси}-этанол |
| 9 | (Е)-2-{4-[4-Хлор-1,2-бис(4-хлорфенил)бут-1-енил]фенокси}этанол |
| 10 | (Е)-3-{4-[4-Хлор-1-(4-хлорфенил)-2-фенил-бут-1-енил]фенокси}-пропан-1,2-диол |
| 11 | (Z)-4-Хлор-1-[4-(2-метилсульфанилэтокси)фенил]-1,2-ди-фенил-бут-1-ен |
| 12 | (Е)-{4-[4-Хлор-1-(4-хлорфенил)-2-фенилбут-1-енил]фенокси}-уксусная кислота |
| 13 | (Z)-{4-[4-Хлор-1-(4-хлорфенил)-2-фенилбут-1-енил]фенокси}-уксусная кислота |
| 14 | (Е)-1-(4-{2-[(2-Хлорэтокси]этокси}фенил)-4-хлор-1-(4-хлорфенил)-2-фенил-бут-1-ен |
| 15 | (Е)-1-(4-{2-[(2-Хлорэтокси]этокси}фенил)-4-хлор-1-(4-фторфенил)-2-фенил-бут-1-ен |
| 16 | 2-(4-{4-Хлор-1-[4-(2-гидроксиэтокси)фенил]-2-фенил-бут-1-енил}-фенокси)-1-этанол |
| 17 | (Е)-2-{4-[4-Хлор-2-фенил-1-(4-хлорфенил)бут-1-енил]фенокси}этанол |
| 18 | (Z)-2-[3-(4-Хлор-1,2-дифенил-бут-1-енил)фенокси]этанол |
| 19 | (Z)-2-{2-[4-(4-Хлор-1,2-дифенилбут-1-енил)фенокси]этокси}этанол |
| 20 | (Z)-3-[4-(4-Хлор-1,2-дифенил-бут-1-енил)фенокси]пропан-1,2-диол |
| 21 | (Z)-1-{2-[4-(4-Хлор-1,2-дифенил-бут-1-енил)фенокси]этил}-1Н-имидазол |
| 22 | (Z)-2-({2-[4-(4-Хлор-1,2-дифенил-бут-1-енил)фенокси]этил}метиламино)этанол |
| 23 | (Z)-(2-{4-[4-Хлор-2-(4-хлорфенил)-1-фенилбут-1-енил]фенокси}-этил)диметиламин |
| 24 | (Е)-(2-{4-[4-Хлор-2-(4-хлорфенил)-1-фенилбут-1-енил]фенокси}-этил)диметиламин |
| 25 | (Z)-(2-{4-[4-Хлор-2-(4-фторфенил)-1-фенилбут-1-енил]фенокси}-этил)диметиламин |
| 26 | (Z)-(2-{4-[4-Хлор-2-(4-хлорфенил)-1-(4-метоксифенил)бут-1-енил]-фенокси}этил)диметиламин |
| 27 | (Е)-(2-{4-[4-Хлор-2-(4-хлорфенил)-1-(4-метоксифенил)бут-1-енил]-фенокси}этил)диметиламин |
| 28 | (z)-1-(2-{4-[4-Хлор-2-(3-метоксифенил)-1-фенилбут-1-енил] фенокси}-этил)пиперидин |
| (Таблица 1 продолжение) | |
| № | Соединение |
| 29 | (Е)-1-(2-{4-[4-Хлор-2-(3-метоксифенил)-1-фенилбут-1-енил]фенокси}-этил)пиперидин |
| 30 | (Z)-1-(2-{4-[4-Хлор-2-{2-метоксифенил)-1-фенилбут-1-енил]фенокси}-этил)пиперидин |
| 31 | (Е)-1-(2-{4-[4-Хлор-2-(2-метоксифенил)-1-фенилбут-1-енил]фенокси}-этил)пиперидин |
| 32 | (Z)-1-[4-(2-Диметиламиноэтилсульфанил)фенил]-1,2-дифенил-4-хлор-бут-1-ен |
| 33 | (Z)-{2-[3-(4-Хлор-1,2-дифенилбут-1-енил)фенокси]этил}диметиламин |
| 34 | (Е)-3-{4-Хлор-1-[4-(2-гидроксиэтокси)фенил]-2-фенилбут-1-енил}-фенол |
| 35 | (Z)-3-[4-(4-Хлор-1,2-дифенилбут-1-енил)фенокси]пропан-1-ол |
| 36 | (Z)-2-[4-(4-Хлор-1,2-дифенилбут-1-енил)фенилсульфанил]этанол |
| 37 | (Z)-2-{4-[4-Хлор-2-(4-хлорфенил)-1-(4-метоксифенил)бут-1-енил]-фенокси}этанол |
| 38 | (Z)-1-(2-{4-[4-Хлор-2-(2-хлорфенил)-1-фенилбут-1-енил]фенокси}-этил)пиперидин |
| 39 | (Е)-3-{4-Хлор-1-[4-(2-имидазол-1-ил-этокси)фенил]-2-фенил-бут-1-енил}фенол |
| 40 | (Z)-3-{4-Хлор-1-[4-(2-имидазол-1-ил-этокси)фенил]-2-фенил-бут-1-енил}фенол |
| 41 | (Z)-2-[4-(4-Хлор-1,2-дифенил-бут-1-енил)фениламино]этанол |
| 42 | (Z)-4-{1-(2-Хлорэтил)-2-[4-(2-гидроксиэтокси)фенил]-2-фенил-винил}фенол |
| 43 | (Е)-4-{1-(2-Хлорэтил)-2-[4-(2-гидроксиэтокси)фенил]-2-фенил-винил}фенол |
| 44 | (Z)-{2-[4-(4-Хлор-1,2-дифенилбут-1-енил)фенокси]этил}метилпроп-2-иниламин |
| 45 | (Z)-3-[4-(4-Хлор-1,2-дифенилбут-1-енил)феноксиметил] пентан-3-ол |
| 46 | (Z)-2-[4-(4-Хлор-1,2-дифенилбут-1-енил)фенокси]бутан-1-ол |
| 47 | N-[4-(4-хлор-1,2-дифенилбут-1-енил)фенил]-N’,N’-диметилэтан-1,2-диамин |
Структуры характерных соединений представлены далее:
Соединения диметиламиноэтокси фрагментов
| R1 | R3 | № |
| 4-F | H | 1 и 2 |
| 4-Cl | H | 3 |
| 4-Cl | 4-Cl | 4 и 5 |
| H | 4-Cl | 23 и 24 |
| H | 4-F | 25 |
| 4-ОСНз | 4-Cl | 26 и 27 |
Соединения с диметиламиноэтокси фрагментом
| R1 | R3 | R | № |
| Н | Н | СН2СН2имидазолил | 21 |
| Н | Н | CH2CH2N(СН3)CH2CH2OH | 22 |
| Н | 3-ОСН3 | СН2СН2пиперидинил | 28 и 29 |
| Н | 4-ОСН3 | СН2СН2пиперидинил | 30 и 31 |
| Н | 2-Сl | СН2СН2пиперидинил | 38 |
| 3-Он | Н | СН2СН2имидазолил | 39 и 40 |
| Н | Н | CH2CH2N(СН3)CH2CCH | 44 |
Спирты
| R1 | R3 | № |
| 4-F | Н | 8 |
| 4-Сl | 4-Сl | 9 |
| 4-ОСН2СН2ОН | Н | 16 |
| 4-Сl | Н | 17 |
| З-ОН | Н | 34 |
| 4-ОСН3 | 4-Сl | 37 |
| Н | 4-ОН | 42 и 43 |
| R1 | R3 | R | № |
| 4-Сl | 4-Сl | CH2CH2Cl | 6 и 7 |
| 4-Сl | Н | СН2СН(ОН)СН2ОН | 10 |
| Н | Н | СН2СН2SСН3 | 11 |
| 4-Сl | Н | СН2СНООН | 12 и 13 |
| 4-Сl | Н | СН2СН2OСН2СН2Сl | 14 |
| 4-F | Н | СН2СН2OСН2СН2Сl | 15 |
| Н | Н | СН2СН2ОСН2СН2OН | 19 |
| Н | Н | СН2СН(ОН)СН2OН | 20 |
| Н | Н | СН2СН2СН2OН | 35 |
| Н | Н | СНС(ОН)(СН2СН3)2 | 45 |
| Н | Н | СН(СН2СН3)СН2OН | 46 |
Эстрогенные и антиэстрогенные, а также цитотоксические действия некоторых соединений in vitro представлены в таблице 2, из которой можно видеть, что спектр гормональной активности соединений варьирует, и это создает возможность применения соединений при различных клинических заболеваниях.
Соединения со слабой гормональной активностью, которые эффективно уничтожают клетки MCF-7 (человеческие раковые клетки молочной железы) при наибольших исследуемых концентрациях (10 мкМ) предпочтительно могут быть использованы при лечении рака молочной железы. Указанным соединениям среди прочих соединений принадлежат номера №1, 3, 16, 19, 26, 27, 39 и 40 (таблица 2). Указанные соединения и некоторые другие являются менее эффективными эстрогенами и антиэстрогенами, чем хорошо известные лекарственные средства против рака молочной железы, тамоксифен и торемифен (таблица 3). Особый интерес представляет соединение №19, поскольку оно является более эффективным противораковым средством in vivo в модели ДМБА-индуцированной опухоли молочной железы на крысах, даже при очень низких дозах, чем клинически используемые тамоксифен и торемифен (таблица 6).
Соединения со слабым эстрогенным и антиэстрогенным действием могут быть в особенности полезны для профилактики и лечения остеопороза и климактерических симптомов. К указанным соединениям (из числа прочих) относятся соединения №3, 10, 11, 18, 19, 20, 25, 32, 36 и 44 (таблицы 2, 3 и 4).
Соединения, снижающие уровень холестерина, могут быть полезны в качестве сердечно-сосудистых лекарственных средств. Для женщин допустима некоторая эстрогенность указанных соединений, а соединения, которые не являются эстрогенами, либо очень слабые эстрогены, и снижают уровень холестерина, могут быть использованы также мужчинами для профилактики и лечения сердечно-сосудистых заболеваний. К указанным соединениям относятся (из числа прочих) соединения №3, 19, 20 (также для мужчин) и 33 (для женщин) (таблица 4). Предполагается также, что те же самые соединения будут полезны для лечения или предупреждения болезни Альцгеймера. В последнем случае цитотоксическое действие соединений должно быть слабым, как, например, в случае соединения №33 (таблица 2). Следует отметить, что соединение №19 не оказывает никакого эстрогенного влияния на массу предстательной железы в дозах, которые активны в модели ДМБА-индуцированной опухоли молочной железы (таблицы 6 и 7). Поэтому оно может иметь особый успех у мужчин и может иметь преимущество, кроме лечения вышеуказанных состояний, в лечении рака предстательной железы.
Гормональный профиль соединений может быть в некоторых случаях различным in vitro и in vivo, например, соединение №1 обладает эстрогенным действием in vitro (таблица 2), но оказывает слабое эстрогенное действие in vivo (таблица 3). Таким образом, вышеуказанные примеры следует рассматривать как примеры полезного применения при различных заболеваниях. Указанные примеры не следует рассматривать как ограничивающее возможное применение указанных соединений при различных клинических показаниях.
Таблица 2. Эстрогенное, антиэстрогенное и цитотоксическое действия исследуемых соединений в клетках MCF-7.
Подробности оценок приведены в тексте. Максимальный эстрогенный агонизм в отсутствие эстрадиола рассчитывают в процентах от эстрадиол-стимула (100%). Антиэстрогенное свойство оценивают при концентрации 1 мкмоль/л, принимая теоретически полный антагонизм за 100 процентов. Токсичность при концентрации 10 мкмоль/л оценивают как фракцию погибших клеток по сравнению с контролем (т.е. 100 означает, что все клетки погибли). В качестве стандартов использованы известные антиэстрогены.
| Соединение№ | Без эстрадиола (Е2) | С эстрадиолом (Е2) | ||
| Максимальный агонизм (% от Е2) | Максимальная гибель клеток (% фракции погибших клеток) | Антагонизм при 1 мкМ (% от полного антагонизма) | Максимальная гибель клеток (% фракции погибших клеток) | |
| 1 | 1 | 100 | 8 | 100 |
| 2 | 100 | 32 | 39 | 100 |
| 3 | 1 | 100 | 1 | 94 |
| 4 | 10 | 90 | 10 | 100 |
| 5 | 11 | 100 | 31 | 100 |
| 6 | 0 | 47 | 16 | 40 |
| 8 | 31 | 2 | 92 | 52 |
| (Таблица 2 продолжение) | ||||
| Соединение№ | Без эстрадиола (Е2) | С эстрадиолом (Е2) | ||
| Максимальный агонизм (% от Е2) | Максимальная гибель клеток (% фракции погибших клеток) | Антагонизм при 1 мкМ (% от полного антагонизма) | Максимальная гибель клеток (% фракции погибших клеток) | |
| 9 | 14 | 45 | 9 | 62 |
| 10 | 34 | 7 | 0 | 35 |
| 11 | 14 | 26 | 0 | 55 |
| 14 | 12 | 10 | 27 | 57 |
| 15 | 74 | 82 | 5 | 9 |
| 16 | 22 | 90 | 23 | 96 |
| 17 | 0 | 44 | 17 | 38 |
| 18 | 30 | 10 | 1 | 40 |
| 19 | 14 | 14 | 21 | 50 |
| 20 | 8 | 5 | 25 | 60 |
| 21 | 5 | 80 | 0 | 91 |
| 22 | 1 | 15 | 12 | 41 |
| 23 | 14 | 89 | 5 | 93 |
| 24 | 46 | 89 | 4 | 98 |
| 25 | 17 | 42 | 6 | 27 |
| 26 | 0 | 97 | 11 | 98 |
| 27 | 0 | 99 | 5 | 100 |
| 28 | 3 | 86 | 18 | 92 |
| 30 | 5 | 91 | 4 | 92 |
| 32 | 11 | 86 | 0 | 90 |
| 33 | 20 | 0 | 58 | 80 |
| 34 | 0 | 0 | 0 | 0 |
| 35 | 45 | 50 | 14 | 50 |
| 36 | 8 | 17 | 13 | 37 |
| 37 | 4 | 39 | 0 | 41 |
| 38 | 0 | 99 | 68 | 100 |
| 39 | 0 | 68 | 17 | 78 |
| 40 | 0 | 63 | 3 | 46 |
| 41 | 54 | 0 | 10 | 47 |
| 42 | 9 | 23 | 13 | 54 |
| 43 | 78 | 80 | 6 | 22 |
| (Таблица 2 продолжение) | ||||
| Соединение№ | Без эстрадиола (Е2) | С эстрадиолом (Е2) | ||
| Максимальный агонизм (% от Е2) | Максимальная гибель клеток (% фракции погибших клеток) | Антагонизм при 1 мкМ (% от полного антагонизма) | Максимальная гибель клеток (% фракции погибших клеток) | |
| 44 | 24 | 78 | 8 | 95 |
| 45 | 15 | 6 | 3 | 19 |
| 46 | 18 | 15 | 23 | 51 |
| Тамоксифен | 31 | 100 | 43 | 100 |
| Торемифен | 37 | 100 | 44 | 100 |
| FC-1271а | 23 | 50 | 21 | 80 |
| ICI 164384 | 9 | 100 | 100 | 100 |
Таблица 3. Гистеротропное (например, эстрогенное) и эстроген-антагонистическое действие исследуемых соединений в 3-дневном гистеротропном испытании на недоразвитых матках крыс.
Эстрогенное действие оценивают как процент от максимального, эстроген-индуцированного действия. Антиэстрогенное действие выражают как процент от теоретически полного ингибирования действия эстрогена (100%).
| Соединение № | Гистеротропное действие (% от эстрадиола). Введение без эстрадиола | Эстроген-антагонизм (% ингибирования от эстрадиола). Введение с эстрадиолом | ||
| доза: | 3-5 мг/кг | 10-50 мг/кг | 3-5 мг/кг | 10-50 мг/кг |
| 1 | 42 | 74 | 26 | 31 |
| 3 | 44 | 54 | 65 | 38 |
| 19 | 13 | 37 | 10 | 44 |
| 20 | 33 | 62 | 5 | 20 |
| 20 | 48 | 72 | 26 | 39 |
| 21 | 26 | 39 | 10 | 20 |
| 35 | 43 | 66 | 35 | 32 |
| (Таблица 3 продолжение) | ||||
| Соединение№ | Гистеротропное действие (% от эстрадиола). Введение без эстрадиола | Эстроген-антагонизм (% ингибирования от эстрадиола). Введение с эстрадиолом | ||
| доза: | 3-5 мг/кг | 10-50 мг/кг | 3-5 мг/кг | 10-50 мг/кг |
| 36 | 14 | 29 | 0 | 5 |
| 38 | 73 | 72 | 0 | 12 |
| 39 | 9 | 19 | 50 | 70 |
| 40 | 13 | 9 | 45 | 54 |
| 44 | 55 | 75 | н.д. | 42 |
| 45 | 43 | 62 | 30 | 30 |
| 46 | 77 | 100 | 0 | 0 |
| Тамоксифен | 44 | 51 | 51 | 58 |
| Торемифен | 26 | 44 | 45 | 58 |
| Ралоксифен | 11 | 13 | 90 | 92 |
Таблица 3 (продолжение). Размер матки после 4-недельного введения новых соединений подвергнутым овариэктомии крысам (пероральная суточная доза приведена в мг/кг).
Ложно оперированные (симулированные), получавшие эстрадиол и получавшие ралоксифен, подвергнутые овариэктомии крысы служили контролем.
| Группа | Размер матки (г) |
| Симулированная контрольная | 0,497±0,103 |
| Подвергнутая овариэктомии | 0,099±0,016 |
| №3 3,0 мг/кг | 0,140±0,006 |
| №19 1,0 мг/кг | 0,192±0,029 |
| №19 5,0 мг/кг | 0,221±0,023 |
| №20 5,0 мг/кг | 0,133±0,032 |
| Ралоксифен 3,0 мг/кг | 0,141±0,021 |
| FC-1271a 5,0 мг/кг | 0,411±0,042 |
Таблица 4. Действие соединений №3, 19 и 20 на уровень холестерина в сыворотке крыс у подвергнутых овариэктомии (OVX) крыс после 4-недельного дозированного введения лекарственного средства.
Эстрадиол дают одной группе для сравнения. Результат показывает, что овариэктомия вызывает повышение уровня холестерина. Эстрадиол, соединения №3, 19 и 20 могут предупреждать указанный рост даже при очень низкой дозе и опускать указанный уровень ниже ложно оперированного уровня. Число животных в каждой группе составляло 8.
| Группа | Уровень холестерина в сыворотке (ммоль/л) |
| Ложно оперированная крыса | 3,8±0,4 |
| OVX-крыса | 4,6±0,7 |
| OVX-крыса + эстрадиол 3 мкг/кг | 4,0±0,4 |
| OVX + №3 3 мг/кг | 3,1±0,4 |
| OVX + №19 0,3 мг/кг | 3,6±0,4 |
| OVX + №19 10 мг/кг | 3,9±0,6 |
| OVX + №20 1 мг/кг | 3,3±0,6 |
| OVX + №20 5 мг/кг | 2,3±0,4 |
Таблица 5. Действие соединений №3, 19 и 20 на кости подвергнутых овариэктомии крыс после 4-недельного дозированного введения лекарственного средства.
Крыс подвергают овариэктомии (контроли ложно оперируют). Соединения дают в течение 4 недель в указанных дозах (мг/кг) п.о., начиная через неделю после овариэктомии. Большеберцовый эпифиз и шейку бедренной кости препарируют для оценки качества кости.