Олигомерная частица, индуцирующая иммунитет против вируса гепатита с, способ получения олигомерной частицы, композиция, специфическое антитело, набор (варианты), иммунологический анализ и вакцина против вируса гепатита с
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Предложена олигомерная частица, способная индуцировать иммунитет против вируса гепатита С. Частица состоит из очищенных белков или их частей, оболочки вируса гепатита С (HCV) E1, E1s и Е2. Предложенная частица имеет диаметр от 5 до 100 нанометров. Предложен также способ получения такой частицы. Способ предусматривает очистку белков HCV в растворе, образование олигомерных частиц путем замены очищенных белков раствором детергента или раствором соли и очистку олигомерных частиц. Предложены также композиция для индукции иммунитета против HCV, содержащая предложенную частицу, специфическое к частице антитело, наборы для обнаружения HCV антигенов, иммунологический анализ для обнаружения антител к HCV и вакцина против вируса гепатита С (HCV), которая содержит олигомерную частицу. Предложенные изобретения позволяют индуцировать специфический гуморальный и клеточный иммунитет к белкам оболочки HCV, а также проводить диагностику HCV. Изобретение может быть использовано в медицине. 9 н. и 62 з.п. ф-лы, 23 ил., 6 табл.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на открытии того, что белки оболочки HCV индуцируют благотворный иммунный ответ у шимпанзе, которые хронически инфицированы гетерологичным штаммом HCV подтипа 1а или подтипа 1b. Более конкретно настоящее изобретение относится к открытию того, что белки оболочки являются высоко иммуногенными и приводят к стимуляции как клеточного, так и гуморального иммунного ответа. Кроме того, настоящее изобретение относится к открытию того, что блокирование цистеинов алкилированием имеет результатом даже более иммуногенные белки. Кроме того, белки оболочки по настоящему изобретению можно включать в частицы, которые проявляют высокую иммуногенность и иммунную реактивность. Кроме того, было продемонстрировано, что такие частицы могут включать в себя другие белки.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Инфекция вирусом гепатита С (HCV) является наиболее важной проблемой здравоохранения как в развитых, так и в развивающихся странах. Подсчитано, что примерно от 1 до 5% населения мира поражено этим вирусом. Оказалось, что HCV инфекция является наиболее важной причиной гепатита, связанного с переливанием крови, и часто прогрессирует до хронического поражения печени. Кроме того, имеется свидетельство вовлечения HCV в индукцию печеночно-клеточного рака. Следовательно, высока потребность в надежных диагностических способах и эффективных терапевтических агентах. Необходимы также чувствительные и специфические способы скрининга зараженных HCV продуктов крови и усовершенствованные способы культивирования HCV.
HCV представляет собой вирус с однонитевой позитивной РНК из примерно 9600 оснований, которая кодирует по меньшей мере три структурных белка и шесть неструктурных белков. На основании гомологии последовательности эти структурные белки функционально определили как один отдельный ядерный белок и два белка оболочки: Е1 и Е2. Белок Е1 состоит из 192 аминокислот и содержит от 5 до 6 сайтов N-гликозилирования в зависимости от генотипа HCV. Белок Е2 состоит из 363-370 аминокислот и содержит 9-11 сайтов N-гликозилирования в зависимости от генотипа HCV (в качестве обзоров смотри: Major and Feinstone, 1997; Maertens and Stuyver, 1997). Белок Е1 содержит различные вариабельные домены (Maertens and Stuyver, 1997), тогда как белок Е2 содержит три гипервариабельных домена, из которых главный домен локализован на N-конце этого белка (Maertens and Stuyver, 1997). Последние белки оболочки получены с помощью рекомбинантных методик в Escherichia соli, клетках насекомых, дрожжевых клетках и клетках млекопитающих. Использование системы экспрессии в культуре клеток высших эукариот и особенно в культуре клеток млекопитающих имеет результатом белки оболочки, которые эффективно распознаются антителами в образцах от пациентов (Maertens et al., 1994).
Было выдвинуто предположение, что белок оболочки Е1 нуждается в белке оболочки Е2, чтобы достичь состояния правильной укладки субъединиц (Deleersnyder et al., 1997). Кроме того, предположили, что Е1 и Е2 образуют гетеродимеры, которые могут образовать основную единицу вирусной оболочки (Yi et al., 1997). В WO 98/21338 Liang et al. использовали эти предположения, чтобы сконструировать частицы HCV, которые состоят из Е1 и Е2, а также из Core и Р7. Иными словами, в уровне техники не было предложено использовать Е1 или Е2 по отдельности для иммунизации и других целей. Однако Houghton (1997) сообщал, что повторные иммунизации рекомбинантным gрЕ1Е2 (4×25 мкг) 3 хронически инфицированных HCV шимпанзе не индуцировали значимого иммунного ответа. Авторы настоящей заявки убедились, что индукция иммунного ответа против оболочки у пациентов с хроническим гепатитом С действительно будет желательной и благотворной для пациента, поскольку высокие уровни таких антител, по-видимому, коррелируют с хорошим ответом на терапию интерфероном и могут, следовательно, способствовать выведению вируса у пациента (РСТ/ЕР 95/03031, Maertens et al.). Авторы настоящего изобретения, кроме того, убедились, что, поскольку уровни антител против Е1 у хронических носителей HCV находятся в числе низших среди всех HCV антител, то поднятие этих уровней антител и, возможно, клеточного ответа может быть благотворным для индукции борьбы с этой инфекцией или даже клиренса этой инфекции у хозяина. По-видимому, высокие уровни клеточного иммунитета против Е1 также коррелируют с хорошим ответом на терапию интерфероном (Leroux-Roels et al., 1996).
Помимо важности иммунитета против Е1 в отношении терапии интерфероном, другие показатели указывают на то, что некоторые другие участки генома HCV могут быть значимыми для индукции специфического иммунного ответа, который может дать возможность бороться с этой инфекцией. У пациентов, отвечающих на терапию интерфероном, также чаще наблюдали реактивность Т-клеток против С-концевого района ядерного белка (Leroux-Roels et al., 1996). Потенциально нейтрализующие антитела против белка NS4B были продемонстрированы у пациентов, выводящих HCV после трансплантации печени (Villa et al., 1998). В пределах NS3 картировали также несколько Т-клеточных эпитопов, которые, по-видимому, коррелируют с выведением HCV в период острой фазы (смотри: РСТ/ЕР 94/03555, Leroux-Roels et al.; Leroux-Roels et al., 1996; Rehermann et al., 1996 и 1997; Diepolder et al., 1995 и 1997). Кроме того, антитела к NS5A, подобно антителам к Е1, демонстрируют высокие уровни на базовом уровне перед терапией интерфероном-альфа в долговременных отвечающих организмах (long term responders, LTR) по сравнению с неотвечающими организмами.
В настоящее время терапевтическая вакцинация против HCV не является успешной. Показано также, что профилактическая вакцинация эффективна только против гомологичного штамма HCV (Сhоо et al., 1994). Настоящее изобретение относится к удивительному открытию того, что введение антигена оболочки HCV может кардинально улучшить состояние при хроническом активном гепатите у индивидуума, инфицированного гетерологичным штаммом или изолятом, как при инфекции гетерологичным субтипом 1а, так и при инфекции гетерологичным субтипом 1b. Действительно, хронически инфицированные шимпанзе, которым вводили шесть доз по 50 мкг E1s (то есть аминокислоты 192-326 из Е1), неожиданно продемонстрировали сильный гуморальный и клеточный иммунные ответы, которые не повышались в течение всего периода хронической инфекции до последней вакцинации. Более того, вирусный антиген становился не обнаружимым в печени в течение периода от двух до пяти месяцев и оставался не обнаружимым в течение по меньшей мере 5 месяцев после вакцинации. Хотя титры HCV РНК в печени не снижались, уровни ферментов печени в сыворотке показывали явную тенденцию к нормализации. Наиболее важно, что при обеих вакцинах кардинально улучшалась гистология печени. Настоящее изобретение далее относится к удивительному открытию того, что белок Е1, используемый для вакцинации, который экспрессировали в виде отдельного HCV белка без его гидрофобного якоря, образует стабильные частицы. Следует также отметить, что для того, чтобы избежать индукции иммунного ответа против ненужных эпитопов, белок Е1, используемый для вакцинации, конструировали в виде согласованной последовательности индивидуальных клонов, имеющих происхождение от одного образца сыворотки от одного хронического носителя. Кроме того, настоящая заявка относится к открытию того, что индукцию таких ответов против Е1 можно усилить с помощью использования антигенов иного генотипа, чем генотипы инфекции, присутствующей у хозяина. Кроме того, настоящая заявка относится к открытию того, что, когда цистеины белков оболочки HCV алкилированы, например, N-(иодэтил)-трифторацетамидом, этиленимином или активными галогенами, такими как иодацетамид, олигомерные частицы, как описано выше, демонстрируют даже более высокую иммуногенность. Наконец, настоящее изобретение относится также к открытию того, что мутация цистеинов белков оболочки HCV в любую другую природную аминокислоту, предпочтительно метионин, глутаминовую кислоту, глутамин или лизин, в олигомерных частицах, как описано выше, также приводит к более высокой иммуногенности по сравнению с исходными белками оболочки.
ЗАДАЧА ИЗОБРЕТЕНИЯ
Из литературы ясно, что существует настоятельная необходимость в разработке надежных вакцин и эффективных терапевтических агентов для HCV. Следовательно, задачей настоящего изобретения является разработка антигенного препарата, который способен индуцировать специфический гуморальный и клеточный иммунитет к белкам оболочки HCV даже (но не исключительно) у хронических HCV носителей. Те же самые антигены можно применять для диагностики иммунного ответа.
Более конкретно задачей настоящего изобретения является разработка антигенного препарата, как определено выше, который состоит из стабильных частиц отдельных белков оболочки HCV. Должно быть ясно, что в настоящее время такие частицы или способ получения таких частиц в данной области техники неизвестны. Кроме того, в уровне техники отсутствуют указания на то, что какой-либо антигенный препарат, включающий в себя такие стабильные частицы или такие очищенные отдельные белки оболочки HCV, можно успешно применять в качестве (гетерологичной) профилактической или терапевтической вакцины против HCV. Таким образом, задачей настоящего изобретения также является разработка способа получения стабильных частиц, которые можно успешно применять в качестве профилактического или терапевтического агента против HCV, и, кроме того, разработка ДНК вакцин, кодирующих HCV антигены. Более конкретно задачей настоящего изобретения является разработка способа получения последних частиц на основе образования частиц в присутствии детергента (смотри далее). Кроме того, задачей настоящего изобретения является разработка способов получения частиц, состоящих из антигенов, полученных от различных HCV генотипов.
Кроме того, задачей настоящего изобретения является разработка антигена, который представляет собой согласованную последовательность из индивидуальных клонов, которая может обеспечить возможность более правильной укладки этих белков. Это делается, чтобы избежать стимуляции иммунитета против ненужных эпитопов.
Кроме того, задачей настоящего изобретения является разработка антигенного препарата, в частности, для терапевтической вакцинации, на основе генотипа HCV, которым инфицирован хронический носитель. В этом отношении задачей настоящего изобретения является разработка белка оболочки либо гомологичного, либо отличного генотипа или подтипа по сравнению с генотипом или субтипом этого хронического носителя.
Следующей задачей настоящего изобретения является разработка способа лечения или терапевтической вакцинации хронически инфицированных пациентов при использовании указанных выше антигенов или ДНК вакцин, возможно в сочетании с другими соединениями. Задачей настоящего изобретения также является разработка способа профилактической вакцинации людей против HCV.
Другой задачей настоящего изобретения является разработка олигомерных частиц, которые обладают лучшей иммуногенностью вследствие мутации по меньшей мере одного цистеинового остатка белка оболочки HCV в природную аминокислоту, предпочтительно метионин, глутаминовую кислоту, глутамин или лизин. Альтернативно можно осуществлять алкилирование по меньшей мере одного цистеинового остатка белка оболочки HCV. В частности, последний белок можно алкилировать с помощью этиленимина, N-(иодэтил)трифторацетамида или активных галогенов. В этом отношении задачей настоящего изобретения является разработка дополнительного применения олигомерных частиц в качестве носителей для эффективного представления не-HCV эпитопов.
В задачу настоящего изобретения также входила разработка способа лечения остро или хронически инфицированных пациентов антителом против оболочки, таким как антитело против Е1, например антителом против V2 района Е1, либо отдельно, либо в сочетании с другими терапиями.
В задачу настоящего изобретения также входила разработка антигена, стимулирующего Т-клетки, такого как Core, Е1, Е2, Р7, NS2, NS3, NS4A, NS4B, NS5A или NS5B, вместе с белками оболочки по изобретению.
Считается, что все аспекты задачи настоящего изобретения встречаются в воплощениях, как указано ниже.
КРАТКОЕ ОПИСАНИЕ ТАБЛИЦ И ГРАФИЧЕСКИХ МАТЕРИАЛОВ
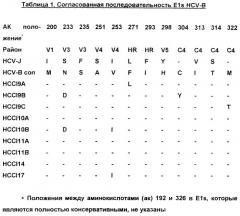
В таблице 1 представлены последовательности клонов Е1, полученных от одного хронического носителя, конструкция Е1, использованная для продуцирования вакцины, представляет собой согласованную последовательность всех этих индивидуальных клонов. V1-V5, вариабельные районы 1-5; С4, константный домен 4; HR, гидрофобный район; HCV-B con, согласованная последовательность в положениях, которые являются вариабельными между клонами и HCV-J.
В таблице 2 представлены последовательности белка Е1 вакцины и белка Е1, как он обнаружен у инфицированных шимпанзе Phil и Ton. Изолят субтипа 1b от Phil отличается на 5,92% от вакцинного штамма. Различие между вакциной и изолятом субтипа 1а от Ton составило 20,74%.
В таблице 3 представлен схематический обзор изменений, индуцированных терапевтической вакцинацией у двух хронически инфицированных шимпанзе (Ton и Phil). Анализ проводили, как описано для Фиг.8 и 11. Кроме того, оценивали гистологию и воспаление на основании биопсий печени.
В таблице 4 представлены последовательности пептидов, использованных для картирования эпитопов В-клеток. Отметим, что HR перекрывается с V4V5.
В таблице 5 показана перестройка NS3 для получения более короткого белка, несущего все главные эпитопы, коррелирующие с клиренсом вируса.
В таблице 6 показана реактивность в LIA (иммунолюминесцентный анализ) E1s-ацетамида против E1s-малеимида с сыворотками хронических носителей HCV. Белки иммобилизовали на LIA мембранах. E1s-ацетамид сам по себе распыляли на полосках LIA, тогда как E1s-малеимид (также содержащий биотин-малеимид) перед распылением подвергали комплексованию со стрептавидином. Антигены связывали с LIA-мембранами и полоски обрабатывали по существу, как описано в Zrein et al. (1998). Человеческие антитела, направленные против этих антигенов, визуализировали, используя человеческий анти-IgG, конъюгированный с щелочной фосфатазой. NBT (нитросиний тетразолий) и BCIP (5-бром-4-хлор-3-индолилфосфат) использовали для цветового проявления полоски. Окрашивание оценивали от 0,5 до 4, как указано в Zrein et al. (1998). Число (#поз.) и процент (%поз.) позитивных образцов указаны в нижней части таблицы с использованием отсечки для данного анализа, равной 0,5.
Фиг.1. Наложенные друг на друга профили гель-хроматографии в 3ФР (забуференный фосфатом физиологический раствор)/3% Empigen-BB белков E1s и E2s, экспрессированных и очищенных согласно Maertens et al. (РСТ/ЕР95/03031).
Фиг.2. Наложенные друг на друга профили гель-хроматографии (size exclusion chromatography, SEC) белков E1s и E2s, экспрессированных и очищенных согласно Maertens et al. (PCT/EP95/03031) и подвергнутых второму пробегу на той же SEC колонке в ЗФР/0,2% CHAPS (3-[(3-холамидопропил)диметил-аммонио]-1-пропансульфонат) для получения конкретных олигомерных структур с установленной примерной молекулярной массой порядка 250-300 кДа. Подобные степени связывания можно получить с помощью использования 3%-ного бетаина.
Фиг.3. Наложенные друг на друга профили гель-хроматографии белков E1s и E2s, экспрессированных и очищенных согласно Maertens et al. (PCT/EP95/03031), подвергнутых второму пробегу в 0,2%-ном CHAPS или в 3%-ном бетаине, чтобы получить конкретные олигомерные структуры, как показано на Фиг.2, и подвергнутых третьему пробегу на той же SEC колонке в 0,05% CHAPS для получения специфичных гомо-олигомерных структур с установленной примерной молекулярной массой порядка 250-300 кДа (E2s) и свыше 600 кДа (E1s). Подобные степени связывания можно получить путем использования 0,1 или 0,5%-ного бетаина.
Фиг.4. Анализ динамического светорассеяния, выраженного в виде процента числа частиц по отношению к наблюдаемому диаметру в нм, для Е1s в ЗФР/0,05% CHAPS.
Фиг.5. Анализ динамического светорассеяния, выраженного в виде процента числа частиц по отношению к наблюдаемому диаметру в нм, для Е1s в ЗФР/0,1% бетаина (сверху) или 0,5% бетаина (снизу).
Фиг.6. Электронно-микроскопическое окрашивание (А) Е1s в ЗФР/0,05% CHAPS и (Б) E1s в ЗФР/3% бетаина.
Фиг.7. Распределение по размеру частиц E1s в ЗФР/0,05% CHAPS.
Фиг.8. Эволюция антител анти-Е1, индуцированных шестью последовательными и 3 повторными иммунизациями (указаны маленькими стрелками) у инфицированного 1b шимпанзе (Phil), и эволюция АЛТ (ALT, аланинаминотрансферазы), HCV РНК и анти-Е1 антител. Анти-Е1 антитела, связывающиеся с твердой фазой Е1, обнаруживали, используя специфическую вторичную антисыворотку против IgG человека, конъюгированную с пероксидазой. В качестве субстрата для цветового проявления использовали ТМВ (тетраметилбензидин). Результаты выражены в виде конечного титра. АЛТ уровни определяли клиническим анализатором и выражали в виде ед./л. HCV РНК в сыворотке определяли, используя HCV Monitor (Roche, Basel, Switzerland). Вирусную нагрузку в печени определяли с помощью полуколичественного определения количества Е2 антигена, окрашенного в печеночной биопсии, используя специфичное моноклональное антитело (ЕСАСС, номер по каталогу 98031215, как описано в заявке ЕР №98870060.5).
Фиг.9. Эпитопное картирование гуморальных ответов, индуцированных иммунизацией Е1 у шимпанзе Phil. Реактивность антител по отношению к различным пептидам измеряли с помощью непрямого ELISA (твердофазного иммуноферментного анализа), при котором биотинилированные пептиды (смотри также Таблицу 4) адсорбировали на титрационных микропланшетах с помощью стрептавидина. Специфические антитела обнаруживали, используя специфическую вторичную антисыворотку против IgG человека, конъюгированную с пероксидазой. В качестве субстрата для цветового проявления использовали ТМВ.
Фиг.10. Результаты анализа пролиферации лимфоцитов до и после вакцинации у шимпанзе Phil. Замороженные РВМС (мононуклеарные клетки периферической крови) оттаивали и стимулировали в трех повторах различными антигенами. Негативный контроль составляла чистая среда, тогда как в качестве позитивного контроля использовали конканавалин А в концентрации 5 мкг/мл. РВМС в концентрации 2-4×105 клеток/лунку в конечном объеме 150 мкл культивировали в среде RPMI 1640, в которую добавляли 10% инактивированной нагреванием ФТС (фетальной телячьей сыворотки), в U-образных 96-луночных титрационных микропланшетах вместе с контролями или 1 мкг/мл Е1 в течение 90 ч при 37°С в увлажненной атмосфере, содержащей 5% CO2. В течение последних 18 ч клетки подвергали импульсному мечению 0,5 мкКи (3H) тимидина на лунку. Затем эти культуры собирали на фильтрах из стекловолокна и определяли включение метки.
Результаты выражены в виде индексов стимуляции (ИС): среднее число импульсов в минуту (срm) антигена/среднее число импульсов в минуту (срm) чистой среды в трех определениях.
Фиг.11. Эволюция антител анти-Е1, индуцированных шестью последовательными и 3 повторными иммунизациями (указаны маленькими стрелками) у шимпанзе Ton, инфицированного HCV подтипа 1а. Показаны эволюция АЛТ, HCV РНК в сыворотке и определение HCV антигена в печени. Анти-Е1 антитела определяли с помощью непрямого ELISA: специфические антитела, связывающиеся с твердой фазой, покрытой Е1, обнаруживали, используя специфическую вторичную антисыворотку против IgG человека, конъюгированную с пероксидазой. В качестве субстрата для цветового проявления использовали ТМВ. Результаты выражены в виде конечных титров. АЛТ уровни определяли клиническим анализатором и выражали в виде ед./л. HCV РНК в сыворотке определяли, используя HCV Monitor (Roche, Basel, Switzerland). E2 антиген окрашивали в печеночной биопсии, используя специфическое моноклональное антитело (ЕСАСС, номер по каталогу 98031215, как описано в заявке ЕР №98870060.5). Полуколичественная оценка указана черными квадратами для явного позитивного окрашивания в большинстве клеток, серыми квадратами - для явного окрашивания в большинстве клеток и белыми квадратами - для биопсий, не выявляющих обнаружимого окрашивания. HCV РНК указана маленькими черными прямоугольниками. Окрашивание E2 можно подтвердить окрашиванием Core и Е1 (данные не представлены).
Фиг.12. Эпитопное картирование гуморального ответа, индуцированного иммунизацией Е1 у Ton. Реактивность антител по отношению к различным пептидам измеряли с помощью непрямого ELISA, при котором биотинилированные пептиды (смотри также Таблицу 4) адсорбировали на титрационных микропланшетах с помощью стрептавидина. Специфические антитела обнаруживали, используя специфическую вторичную антисыворотку против IgG человека, конъюгированную с пероксидазой. В качестве субстрата для цветового проявления использовали ТМВ.
Фиг.13. Анализ Е1 гуморальных ответов на Е1 белки субтипа 1а и субтипа 1b у шимпанзе Ton. Для этой цели Е1 генотип 1а получали из HCV-H последовательности; получали рекомбинантный вирус коровьей оспы, экспрессирующий тот же участок Е1, что и для генотипа 1b (смотри ниже). Е1 получали из сырых лизатов инфицированных вирусом коровьей оспы клеток RK13 (полученных, как описано в Maertens et al. (PCT/EP95/03031)). Реактивность антител измеряли с помощью непрямого ELISA, при котором Е1 адсорбировали на титрационных микропланшетах посредством высоко связывающего маннозу агглютинина Galathus nivalis (GNA). Специфические антитела обнаруживали, используя специфическую вторичную антисыворотку против IgG человека, конъюгированную с пероксидазой. В качестве субстрата для цветового проявления использовали ТМВ. Результаты выражены в виде дифференциальной ОП (оптической плотности) (ОП лунки с адсорбированным Е1 минус ОП лунки без адсорбированного Е1).
Фиг.14. Результаты анализа пролиферации лимфоцитов до и после вакцинации у шимпанзе Ton. Замороженные РВМС оттаивали и стимулировали в трех повторах различными антигенами. Негативный контроль составляла чистая среда, тогда как в качестве позитивного контроля использовали конканавалин А в концентрации 5 мкг/мл. РВМС в концентрации 2-4×105 клеток/лунку в конечном объеме 150 мкл культивировали в среде RPMI 1640, в которую добавляли 10% инактивированной нагреванием ФТС, в U-образных 96-луночных титрационных микропланшетах вместе с контролями или 1 мкг/мл Е1 в течение 90 ч при 37°С в увлажненной атмосфере, содержащей 5% СO2. В течение последних 18 ч клетки подвергали импульсному мечению 0,5 мкКи (3H) тимидина на лунку. Затем эти культуры собирали на фильтрах из стекловолокна и определяли включение метки. Результаты выражены в виде индексов стимуляции (ИС): среднее число импульсов в минуту антигена/среднее число импульсов в минуту чистой среды в трехкратных определениях.
Фиг.15 (а, б, в, г). Карты конструкций, использованных для получения экспрессии белка Е2 с делегированным N-концевым гипервариабельным районом. Конструкции pvHCV-92 и pvHCV-99 являются промежуточными конструкциями, использованными для конструирования делеционных мутантов pvHCV-100 и pvHCV-101.
фиг.16 (а, б). Последовательность (нуклеотиды: А; трансляция: Б), соответствующая конструкциями, изображенным на Фиг.15 (смотри выше).
Фиг.17. Титры антител, полученные у мышей при иммунизации различными препаратами Е1, как описано в примере 9. Титры определяли с помощью ELISA: мышиные сыворотки разбавляли 1/20 и далее (0,5 log10) и инкубировали на E1s (модифицированном либо ацетамидом, либо малеимидом), нанесенном на титрационные микропланшеты. После отмывки связанные антитела обнаруживали, используя специфическую вторичную антисыворотку против IgG мыши, конъюгированную с пероксидазой. В качестве субстрата для цветового проявления использовали ТМВ. Результаты выражены в виде конечного титра, показаны стандартные отклонения (n=6).
Фиг.18. Эпитопное картирование гуморального иммунного ответа, индуцированного иммунизацией различными препаратами E1s у мышей. Реактивность антител по отношению к различным пептидам измеряли с помощью непрямого ELISA, при котором биотинилированные пептиды (перечисленные в таблице 4) адсорбировали на титрационных микропланшетах посредством стрептавидина. Мышиные сыворотки разбавляли 1/20, и специфические антитела обнаруживали, используя специфическую вторичную антисыворотку против IgG человека, конъюгированную с пероксидазой. В качестве субстрата для цветового проявления использовали ТМВ.
Фиг.19. Профиль изотипирования иммуноглобулина мышей, иммунизированных различными препаратами E1s. Специфические антитела класса и подкласса Ig адсорбировали на титрационном микропланшете. После захвата мышиного Ig из иммунных сывороток, разбавленных 1/500, E1s инкубировали при 1 мкг/мл. Образовавшиеся иммунокомплексы далее инкубировали с поликлональной антисывороткой кролика, направленной против Е1. Наконец, антитела кролика обнаруживали, используя вторичную антисыворотку Ig коза против кролика, конъюгированную с пероксидазой. В качестве субстрата для цветового проявления использовали ТМВ. Результаты нормировали по IgG (то есть IgG сигнал для каждого животного отдельно считали равным 1 и все результаты для других изотипов выражали относительно этого результата IgG1).
Фиг.20. Титры антител, индуцированных двумя иммунизациями приблизительно на 1000-е сутки E1s-ацетамидом у шимпанзе Phil. Антитела анти-Е1 определяли с помощью непрямого ELISA: специфические антитела, связывающиеся с твердой фазой Е1, обнаруживали, используя специфическую вторичную антисыворотку против IgG человека, конъюгированную с пероксидазой. Титр выражен в единицах/мл, эти единицы относятся к местному стандарту, который основан на человеческих сыворотках.
Фиг.21. Титры антител, индуцированных двумя иммунизациями приблизительно на 900-е сутки E1s-ацетамидом у шимпанзе Ton. Антитела анти-Е1 определяли с помощью непрямого ELISA: специфические антитела, связанные с твердой фазой Е1, обнаруживали, используя специфическую вторичную антисыворотку против IgG человека, конъюгированную с пероксидазой. Титр выражен в единицах/мл, эти единицы относятся к местному стандарту, который основан на человеческих сыворотках.
Фиг.22 (А, Б, В). SEC профиль конечной стадии снижения детергента (от 0,2 до 0,5% CHAPS): частица одного Е1 (А), частица одного Е2 (Б) или эквимолярная смесь Е1 и Е2; смешанная частица (В). На этой фигуре также показано перекрывание значений ОП ELISA, специфически обнаруживающего только Е1 (сверху), только Е2 (в середине) и ELISA, обнаруживающего только смешанные частицы (снизу).
Фиг.23. SEC профиль конечной стадии снижения детергента (от 0,2 до 0,5% CHAPS): частица одного Е1 генотипа 1b (сверху), частица одного Е1 генотипа 4 (в середине) или эквимолярная смесь Е1 генотипа 1b и 4; смешанная частица (снизу). На этой фигуре также показано перекрывание значений ОП ELISA, специфически обнаруживающего только смешанные частицы (смотри также Фиг.22).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение, описанное здесь, основано на ранее опубликованной работе и заявках на патент, находящихся на рассмотрении. К примеру, такая работа состоит из научных работ, патентов или заявок на патент, находящихся на рассмотрении. Все эти публикации и заявки, цитированные ранее или ниже, включены здесь путем ссылки.
Настоящее изобретение относится к HCV вакцинации. Впервые успешная иммунотерапия шимпанзе с тяжелым хроническим активным гепатитом С смогла быть достигнута с помощью вакцинации HCV антигеном. Эта вакцина не только индуцировала высокие иммунные ответы, но также индуцировала клиренс вирусного антигена из печени и значительное улучшение гистологической активности и степени заболевания печени. Кроме того, настоящее изобретение относится к очищенным отдельным белкам оболочки HCV и, в частности, к олигомерным частицам. Эти олигомерные частицы состоят по существу из белков оболочки HCV и имеют диаметр от 1 до 100 нм при измерении с помощью динамического светорассеяния или, возможно, электронной микроскопии. В этом отношении следует подчеркнуть, что эти частицы могут быть образованы только Е1 и/или Е2 белками, либо их частями (смотри ниже). Следовательно, олигомерные частицы по настоящему изобретению фундаментально отличаются от HCV-подобных частиц, описанных в WO 98/21338, которые обязательно состоят из Е1 и Е2, а также Core и Р7. Термин “олигомерные частицы, состоящие по существу из белков оболочки HCV”, здесь определен как структуры специфической природы и формы, содержащие несколько основных единиц HCV Е1 и/или Е2 белков оболочки, которые сами по себе считают состоящими из одного или двух Е1 и/или Е2 мономеров соответственно. Должно быть ясно, что частицы по настоящему изобретению определяют как свободные от инфекционных HCV РНК геномов. Частицы по настоящему изобретению могут представлять собой частицы высшего порядка сферической природы, которые могут быть пустыми, состоящими из оболочки из оболочечных белков, в которую могут быть включены липиды, детергенты, ядерный белок HCV или молекулы адъювантов. Последние частицы также можно инкапсулировать липосомами или аполипопротеинами, такими как, например, аполипопротеин В или липопротеины низкой плотности, либо с помощью любых других средств, обеспечивающих направленную доставку указанных частиц к конкретному органу или ткани. В этом случае на такие пустые сферические частицы часто ссылаются как на “вирусоподобные частицы” или ВПЧ. Альтернативно эти частицы высшего порядка могут представлять собой твердые сферические структуры, в которых заполненная сфера состоит из олигомеров белков оболочки Е1 или Е2 HCV, в которые могут быть дополнительно включены липиды, детергенты, ядерный белок HCV или молекулы адъювантов, или которые в свою очередь сами могут быть инкапсулированы липосомами или аполипопротеинами, такими как, например, аполипопротеин В, липопротеины низкой плотности, либо с помощью других средств, обеспечивающих направленную доставку указанных частиц к конкретному органу или ткани, например асиалогликопротеинов. Эти частицы могут также состоять из более мелких структур (по сравнению с пустыми или твердыми сферическими структурами, указанными выше), которые обычно имеют округлую (смотри далее) форму и которые обычно содержат не более одного слоя белков оболочки HCV. Типичным примером таких более мелких частиц являются розетко-подобные структуры, которые состоят из меньшего числа белков оболочки HCV, обычно между 4 и 16. Конкретный пример последних включает в себя более мелкие частицы, полученные с E1s в 0,2%-ном CHAPS, пример которых приведен здесь, которые содержат примерно 8-10 мономеров E1s. Такие розетко-подобные структуры имеют плоскостную организацию и характеризуются круглой формой, например формой колеса. Опять же, дополнительно могут быть включены липиды, детергенты, капсидный белок HCV или молекулы адъюванта, либо эти более мелкие частицы могут быть инкапсулированы липосомами или аполипопротеинами, такими как, например, аполипопротеин В или липопротеины низкой плотности, либо с помощью любых других средств, обеспечивающих направленную доставку указанных частиц к конкретному органу или ткани. Более мелкие частицы могут также образовывать небольшие сферические или глобулярные структуры, состоящие из подобного меньшего числа белков оболочки Е1 или Е2 HCV, в которые могут быть дополнительно включены липиды, детергенты, ядерный белок HCV или молекулы адъюванта, или которые в свою очередь могут быть инкапсулированы липосомами или аполипопротеинами, такими как, например, аполипопротеин В или липопротеины низкой плотности, либо с помощью любых других средств, обеспечивающих направленную доставку указанных частиц к конкретному органу или ткани. Размер (то есть диаметр) этих определенных выше частиц, измеренный с помощью известных в данной области методик динамического светорассеяния (смотри далее в разделе примеров), составляет обычно между 1 и 100 нм, более предпочтительно между 2 и 70 нм, еще более предпочтительно между 2 и 40 нм, между 3 и 20 нм, между 5 и 16 нм, между 7 и 14 нм или между 8 и 12 нм.
Далее изобретение относится к олигомерной частице, как определено выше, где указанные белки оболочки выбраны из группы, состоящей из HCV Е1, HCV E1s, HCV E2 белков, SEQ ID No 13 или SEQ ID No 14, либо их частей. Белки HCV E1 и HCV E2, а также детальное описание того, как очистить последние белки, подробно представлены и охарактеризованы в РСТ/ЕР 95/03031, Maertens et al. HCV E1s, SEQ ID No 13 или SEQ ID No 14, либо их части можно очистить подобно тому, как описано для HCV E1 или HCV E1s в РСТ/ЕР 95/03031, Maertens et al. Следует подчеркнуть, что все содержание, включая все определения, последнего документа включено в настоящую заявку посредством ссылки. Белок HCV E1s относится к аминокислотам 192-326 E1 и представляет собой E1 белок без его С-концевого гидрофобного якоря. Термин “или его части” относится к любой части указанных здесь белков, которая является иммуногенной, если она представляет собой часть частицы по настоящему изобретению.
Изобретение далее относится к олигомерным частицам, как описано здесь, где по меньшей мере один цистеиновый остаток белка оболочки HCV, как описано выше, алкилирован, предпочтительно алкилирован с помощью алкилирующих агентов, таких как, например, активные галогены, этиленимин или N-(иодэтил)трифторацетамид. В этом отношении следует понимать, что алкилирование цистеинов относится к цистеинам, в которых атом водорода при атоме серы заменен на (СН2)nR, в котором n составляет 0, 1, 2, 3 или 4, a R=Н, СООН, NH2, CONH2, фенил или любое их производное. Алкилирование можно осуществлять любым способом, известным в данной области, таким как, например, использование активных галогенов Х(СН2)nR, в которых Х представляет собой галоген, такой как I, Br, Cl или F. Примерами активных галогенов являются метилиодид, иодуксусная кислота, иодацетамид и 2-бромэтиламин. Другие способы алкилирования включают в себя использование этиленимина или N-(иодэтил)трифторацетамида, причем оба приводят к замещению Н на -CH2-CH2-NH2 (Hermanson, 1996). Термин “алкилирующие агенты”, как его используют здесь, относится к соединениям, которые способны осуществлять алкилирование, как описано здесь. Такие алкилирования в конечном итоге приводят к получению модифицированного цистеина, который может имитировать другие аминокислоты. Алкилирование этиленимином приводит к структуре, имеющей сходство с лизином, таким образом, что вводятся новые сайты расщепления для трипсина (HerNanson, 1996). Подобным же образом использование метилиодида приводит к получению аминокислоты, имеющей сходство с метионином, тогда как использование иодацетата и иодацетамида приводит к получению аминокислот, имеющих сходство с глутаминовой кислотой и глутамином соответственно. По аналогии эти аминокислоты предпочтительно используют при прямой мутации цистеина. Следовательно, настоящее изобретение относится к олигомерным частицам, как описано здесь, где по меньшей мере один цистеиновый остаток белка оболочки HCV, как описано здесь, мутирован в природную аминокислоту, предпочтительно метионин, глутаминовую кислоту, глутамин или лизин. Термин “мутирован” относится к сайт-направленному мутагенезу нуклеиновых кислот, кодирующих эти аминокислоты, то есть к хорошо известным в данной области способам, таким как, например, сайт-направленный мутагенез посредством ПЦР или опосредованный олигонуклеотидами мутагенез, как описано в Sambrook et al. (1989).
Термин “очищенный”, как его применяют здесь, относится к композиции, где желаемые компоненты, такие как, например, белки оболочки HCV или олигомерные частицы, составляют по меньшей мере 35% совокупных компонентов в этой композиции. Желаемые компоненты предпочтительно составляют по меньшей мере примерно 40%, более предпочтительно по меньшей мере примерно 50%, еще более предпочтительно по меньшей мере примерно 60%, еще более предпочтительно по меньшей мере примерно 70%, даже более предпочтительно по меньшей мере примерно 80%, даже более предпочтительно по меньшей мере примерно 90%, даже более предпочтительно по меньшей мере примерно 95% и наиболее предпочтительно по меньшей мере примерно 98% фракции совокупных компонентов в этой композиции. Эта композиция может содержать другие соединения, такие как, например, углеводы, соли, липиды, растворители и тому подобное, без воздействия на определение процента чистоты, как используют здесь. “Выделенная” олигомерная частица HCV подразумевает композицию олигомерных частиц HCV, которая является по меньшей мере на 35% чистой. В этом отношении должно быть ясно, что термин “очищенный отдельный белок оболочки HCV”, как его используют здесь, относится к выделенным белкам оболочки HCV в по существу чистой форме. Термины “по существу очищенные