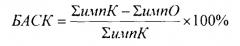Способ определения бактерицидной активности сыворотки крови
Иллюстрации
Показать всеИзобретение относится к области биомедицинских измерительных технологий, а именно к способам определения бактерицидной активности сыворотки крови. Сущностью изобретения является проведение оценки бактерицидности сыворотки крови по выраженности ее ингибирующего влияния на интенсивность свечения серочувствительных люминесцирующих бактерий (∑импО) по сравнению с контролем - интенсивностью свечения тех же серочувствительных люминесцирующих бактерий, не имевших контакта с сывороткой крови (∑импК), после чего рассчитывают значение бактерицидной активности сыворотки крови по формуле:. В качестве серочувствительных люминесцирующих бактерий используют природные или рекомбинантные микроорганизмы, характеризующиеся прямой пропорциональностью между интенсивностью снижения уровня спонтанной биолюминесценции и выраженностью бактерицидного эффекта. Например, возможно использование штамма Escherichia coli с генами люминесцентной системы Photobacterium leiognathi. Способ позволяет сократить длительность определения бактерицидной активности сыворотки крови и уменьшить его трудоемкость. 1 з.п. ф-лы, 1 табл.
Реферат
Область техники, к которой относится изобретение.
Изобретение относится к области биомедицинских измерительных технологий, а именно к способам определения бактерицидной активности сыворотки крови (БАСК) с использованием жизнеспособных серочувствительных микроорганизмов.
В частности, изобретение предназначено для определения бактерицидной активности сыворотки крови с использованием спонтанно люминесцирующих серочувствительных микроорганизмов.
Задача тестирования бактерицидной активности сыворотки крови определяется необходимостью интегральной оценки уровня неспецифической противоинфекционной резистентности организма человека и животных при ряде физиологических и патологических состояний. В этой связи определение бактерицидных свойств крови внесено в “Номенклатуру клинических лабораторных исследований” (п.6.3.2), утвержденную Приказом Министерства здравоохранения РФ № 64 от 21.02.2000 г.
Таким образом, заявляемый способ предназначен для использования в лабораториях биологического и медицинского профиля, решающих вопросы оценки гомеостаза внутренней среды организма и уровня антиинфекционной резистентности с целью выявления их возможных нарушений и контроля эффективности соответствующих коррекционных мероприятий.
Уровень техники.
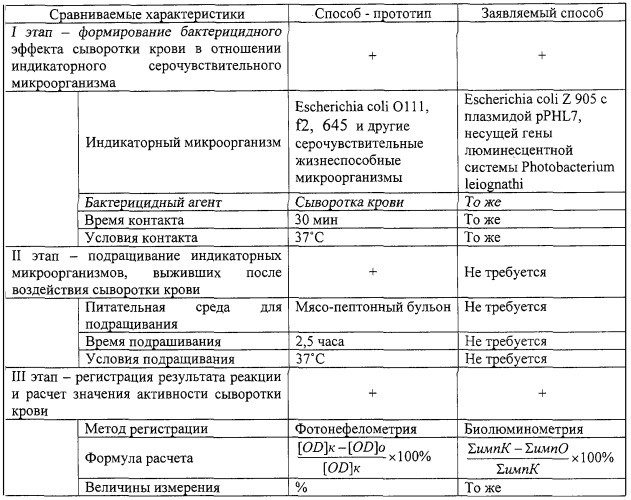
Существующие подходы к определению БАСК основаны на одном и том же принципе - воздействии сыворотки крови на популяцию жизнеспособных серо чувствительных микроорганизмов с последующей оценкой доли клонов, выживших после подобного контакта, по сравнению с контролем - теми же микроорганизмами, инкубированными вне контакта с сывороткой крови. При этом в качестве серо чувствительных микроорганизмов обычно используются различные штаммы Escherichia coli: 0111 [1], 675 [3], f2 [5] и др., что определяется особенностями строения их клеточной стенки, эффективно разрушаемой под действием комплекса сывороточных факторов. Вычисление значений БАСК производится на основании сходных и имеющих одинаковый биологический смысл формул, основанных на расчете соотношения микроорганизмов, выросших в опыте и контроле, и выражается в процентах.
Вместе с тем по технологии своего исполнения существующие методы определения БАСК могут быть подразделены на две большие группы.
Первую составляют так называемые “бактериологические” методы, основанные на определении количества микроорганизмов, выживших после контакта с сывороткой крови и при посеве на плотные питательные среды формирующих на них изолированные колонии. Несмотря на многочисленные попытки уменьшения трудоемкости подобных методов, снижения расхода питательных сред [2, 3, 4] говорить об их использовании в настоящее время можно только в историческом аспекте (способы-аналоги).
Вторая группа представлена так называемыми “фотонефелометрическими” методами, основанными на оптической регистрации феномена задержки роста бактериальной культуры в жидкой питательной среде [1, 5, 6], и в настоящее время получили наибольшее распространение. Первый из них (метод О.В.Бухарина и В.Л.Созыкина, 1979) по совокупности признаков является наиболее близким к заявляемому и может быть охарактеризован как способ-прототип.
Определение БАСК по способу-прототипу предусматривает выполнение трехстадийной процедуры.
Первый этап является абсолютно необходимым и определяет сущность проводимой реакции, при этом осуществляется контакт жизнеспособного серо чувствительного микроорганизма - Esherichia coli 0111 - с сывороткой крови (30 мин, 37°С), во время которого часть бактериальной популяции гибнет. На втором этапе к данной смеси добавляется мясопептонный бульон и осуществляется подращивание оставшейся части бактериальной популяции в жидкой питательной среде (2 часа 30 мин, 37°С). На третьем нефелометрическое определение и сравнение значений оптической плотности подращенной культуры с контролем (значениями оптической плотности бактериальной популяции, инкубируемой в тех же условиях, но не имевшей контакта с сывороткой крови). Поскольку оптическая плотность растущей культуры пропорциональна количеству жизнеспособных бактерий, по степени ее подавления судят о выраженности бактерицидного действия сыворотки крови, выражая ее в процентах. Итоговое значение БАСК рассчитывают по формуле:
где [OD]к - оптическая плотность бактериальной суспензии в контроле, [OD]о - оптическая плотность бактериальной суспензии в опыте.
Основной причиной, препятствующей получению требуемого результата при использовании способа-прототипа, является существенная длительность второго этапа определения бактерицидной активности, лимитируемая скоростью роста индикаторного серо чувствительного микроорганизма после контакта с сывороткой крови до значений оптической плотности, доступных для фото нефелометрической регистрации.
Альтернативные подходы, ведущие к устранению данного недостатка, в доступной нам литературе не описаны.
Таким образом, заявляемый способ не известен из уровня техники, т.е. является новым.
Сущность изобретения.
Основной задачей, на решение которой направлен заявляемый способ, является снижение длительности процедуры определения бактерицидной активности сыворотки крови (повышение его экспрессности). Дополнительной задачей, решаемой при осуществлении заявляемого способа, является снижение трудоемкости его выполнения.
Сущностью заявляемого способа, сформулированной на уровне функционального обобщения и лежащей в его основе, является следующее:
- уровень угнетения свечения популяции спонтанно люминесцирующих серочувствительных микроорганизмов под действием сыворотки крови пропорционален доли бактериальных клеток, в отношении которых в этих условиях развивается бактерицидный эффект.
Соответственно, при реализации заявляемого способа определения БАСК характеристика действий, порядок их выполнения и условия осуществления в сравнении со способом-прототипом представляются следующим образом (таблица 1).
На первом этапе определения бактерицидной активности сыворотки крови в “опытную” и “контрольную” кюветы вносят по 20 мкл суспензии серо чувствительных спонтанно люминесцирующих бактерий с концентрацией 10 КОЕ/мл. В качестве подобной бактериальной культуры может использоваться генно-инженерный штамм Escherichia coli Z 905, несущий плазмиду pPHL7 с генами люминесцентной системы Photobacterium leiognathi. Данный штамм депонирован в “Коллекции культур светящихся бактерий” Института биофизики Сибирского отделения Российской академии наук (Каталог светящихся бактерий / под ред. Э.К.Родичевой. - Новосибирск: Наука, 1997. - 125 с.) и в настоящее время выпускается в виде лиофилизированного препарата под коммерческим названием “Микробиосенсор E.coli Z 905”, содержащего 109 КОЕ/мл жизнеспособных люминесцирующих микроорганизмов.
После этого в контрольную кювету вносят 20 мкл 0,9% раствора хлористого натрия, а в опытную 20 мкл тестируемой сыворотки крови, предварительно в соотношении 1:1 разбавленной 0,9% раствора хлорида натрия. Образцы выдерживают в течении 30 минут при 37°С.
Содержание этапа - формирование бактерицидного действия сыворотки крови в отношении используемого индикаторного микроорганизма - принципиально не отличается от такового в способе прототипе.
В то же время использование заявляемого способа позволяет отказаться от 2,5-часового этапа подращивания индикаторных микроорганизмов, выживших после воздействия сыворотки крови, и непосредственно перейти к этапу регистрации результата бактерицидного эффекта. В результате общая продолжительность определения БАСК сокращается в 6 раз (со 180 минут до 30 минут). Дополнительной задачей, решаемой при использовании заявляемого способа, является снижение его трудоемкости за счет исключения этапа подращивания бактериальных культур (внесение в пробы питательной среды, перемешивание, помещение в термостат и выемка из него, внесение проб в измерительные кюветы).
На завершающем этапе осуществления заявляемого способа к “опытной” и “контрольной” пробам добавляют по 1 мл 0,9% раствора хлорида натрия, что позволяет остановить развитие бактерицидного эффекта путем одномоментного 25-кратного разбавления действующих компонентов реакции. После этого кюветы помещают в измерительную ячейку люминометра и замеряют уровень свечения бактериальной суспензии в видимой сине-зеленой области спектра 420-600 нм в течении 30 секунд. В качестве измерительного прибора при реализации заявляемого способа могут использоваться биохемилюминометр БХЛ-6 (НПО “Биофармавтоматика”, Нижний Новгород), БЛМ 8802 М (СКТБ “Наука”, Красноярск), а также прочие отечественные и зарубежные люминометры, работающие в обозначенной области спектра и обеспечивающие соответствующую дискретность измерений.
Содержание этапа - регистрация результата реакции - также имеет некоторые отличия от такового в способе-прототипе, т.к.:
- во-первых, используется иной физический принцип - определение люминесценции вместо фото нефелометрии оптической плотности;
- во-вторых, оценка эффекта проводится непосредственно на бактериальных клетках, подвергнутых действию сыворотки крови, а не на их “потомках” после десятков генераций (как в способе-прототипе).
В то же время итоговый расчет БАСК проводят по формуле, которая по своей сути аналогична таковой в способе-прототипе и выражают в тех же величинах, т.е. в процентах, а именно:
где ∑импК - сумма импульсов испускаемых бактериальной суспензией в контроле, ∑импО - сумма импульсов испускаемых бактериальной суспензией в опыте.
Возможность получения технического результата при выполнении перечисленных действий в указанных интервалах значений определяется следующим комплексом причинно-следственных связей:
1) выраженность бактерицидного эффекта сыворотки крови в отношении серо чувствительных спонтанно люминесцирующих микроорганизмов (как природного изолята Photobacterium phosphoreum В 17677 F, так и генно-инженерного штамма Escherichia coli Z 905, несущего плазмиду pPHL 7 с генами люминесцентной системы Photobacterium leiognathi), регистрируемого с использованием способа-прототипа по интенсивности подавления роста в жидкой питательной среде с фото нефелометрической регистрацией результата, прямо пропорциональна уровню снижения их спонтанной люминесценции (коэффициент корреляции r=0,96; t=7,11; P<0,001), что является главным обоснованием возможности использования серо чувствительных люминесцирующих бактерий для тестирования бактерицидной активности сыворотки крови с использованием биолюминометрии;
2) наибольшая чувствительность к бактерицидному действию сыворотки крови с использованием как заявляемого способа, так и способа-прототипа, по сравнению с Р. phosphoreum В 17677 F продемонстрирована у E.coli Z 905, что определяет предпочтительность его использования при определении бактерицидной активности сыворотки крови;
3) зависимость интенсивности бактерицидного эффекта и подавления бактериальной люминесценции от концентрации сыворотки крови имеет S-образный характер со значением БАСК в отношении E.coli Z 905 на уровне 40-60% при использовании сыворотки крови в концентрации 25% от общего объема реакционной смеси, что диктует целесообразность использования именно этой концентрации, как позволяющей оценить наибольшую вариабельность БАСК вокруг ее “средних” значений.
4) при проведении сравнительного изучения БАСК в серии из 100 сывороток с использованием заявляемого способа и способа-прототипа установлено соответствие результатов, полученных обоими методами (достоверная положительная корреляционная связь с коэффициентом r=0,556; t=3,48; P=0,002), что позволяет использовать заявляемый способ для изучения всех ранее выявленных закономерностей изменения БАСК при различных физиологических и патологических состояниях.
В целом, резюмируя приведенные выше материалы о сущности заявляемого способа, характеристике действий, порядке их выполнения и условия осуществления, можно констатировать, что заявляемый способ не следует из уровня техники и по этому показателю должен быть оценен как соответствующий критерию “изобретательский уровень”.
Сведения, подтверждающие возможность осуществления изобретения.
Для определения бактерицидной активности крови одним из общепринятых методов в стерильных (асептичных) условиях осуществляют забор 1-2 мл венозной крови без консерванта и после ретракции сгустка отбирают верхнюю прозрачную часть (сыворотку) крови.
В дальнейшем последовательность выполнения действий при осуществлении заявляемого способа, их условия и режимы являются следующими:
1) Готовят суспензию живых серочувствительных люминесцирующих бактерий с концентрацией 109 КОЕ/мл. При выполнении способа по п.2 формулы изобретения в качестве серо чувствительной люминесцирующей бактерии используют генно-инженерный штамм E.coli Z 905, несущий плазмиду pPHL 7 с генами люминесцентной системы Р.leiognathi.
Помимо использования данной бактериальной культуры, предварительно перед проведением исследования выращенной на среде Эндо в течение 18-24 часов при 37°С, технология выполнения выполнении заявляемого способа предполагает использование лиофилизированного препарата этой бактерии под коммерческим названием “Микробиосенсор E.coli Z 905”. В этом случае до начала исследования флакон с охлажденной лиофилизированной культурой светящихся бактерий Е.coli Z 905 выдерживают в течении 30-40 минут при температуре 37°С, после чего в него вносят 2 мл 0,9% раствора хлористого натрия и содержимое флакона перемешивают. Суспензию выдерживают при температуре 37°С в течении 45 минут с целью реактивации и стабилизации биолюминесценции, после чего она пригодна к использованию.
2) В “опытную” и “контрольную” кюветы вносят по 20 мкл суспензии серочувствительных люминесцирующих бактерий с концентрацией 109 КОЕ/мл, после чего в “контрольную кювету” вносят 20 мкл 0,9% раствора хлористого натрия, а в “опытную” 20 мкл тестируемой сыворотки крови, предварительно в соотношении 1:1 разбавленной 0,9% раствора хлорида натрия.
3) Кюветы инкубируют в термостате 30 минут при 37°С.
4) В “опытную” и “контрольную” кюветы добавляют по 1 мл 0,9% раствора хлорида натрия.
5) Кюветы помещают в измерительные ячейки биолюминометра и замеряют уровень свечения в видимой сине-зеленой области спектра при 420-600 нм в течение 30 сек.
6) Производят расчет бактерицидной активности исследуемой сыворотки крови по формуле
где ∑импК - сумма импульсов испускаемых бактериальной суспензией в контроле, ∑импО - сумма импульсов испускаемых бактериальной суспензией в опыте.
Пример 1.
В ожоговое отделение Муниципальной городской клинической больницы № 5 г. Оренбурга 21.12.02 г. около 16.00 поступил пациент А. с обширным ожогом правого бедра II Б степени. Для определения иммунного статуса с целью прогнозирования и течения болезни и ее возможной коррекции у пациента А. был осуществлен забор венозной крови в количестве 10 мл. В частности, в качестве интегрального показателя неспецифической противоинфеционной резистентности предполагалось определение бактерицидной активности сыворотки крови. Однако, ввиду значительной длительности (3 часа) определения БАСК фото нефелометрическим методом, данное исследование было отложено до утра следующего дня, для чего небольшое количество сыворотки (2 мл) было заморожено. Экспрессное определение уровня БАСК было осуществлено с помощью альтернативного метода, основанного на использовании биолюминометрии.
При выполнении данного исследования 20 мкл. сыворотки пациента А., предварительно разведенной физиологическим раствором в соотношении 1:1 было помещено в измерительную кювету, туда же добавили 20 мкл суспензии люминесцирующих бактерий (E.coli Z 905) в концентрации 109 КОЕ/мл. В контрольную измерительную кювету было помещено 20 мкл физиологического раствора и 20 мкл суспензии тех же люминесцирующих бактерий. После 30-минутной инкубации в термостате при 37°С в каждую из измерительных кювет было добавлено по 1 мл. физиологического раствора. Кюветы с образцами поместили в прибор регистрирующий биологическое свечение - биолюминометр БЛМ 8802 (СКТБ “Наука”, Красноярск) и замерили уровень люминесценции в контроле и опыте.
После расчета полученных результатов по формуле:
где ∑импК - сумма импульсов испускаемых бактериальной суспензией в контроле, ∑импО - сумма импульсов испускаемых бактериальной суспензией в опыте, уровень БАСК оказался равным 17%, что позволило оценить его как “низкий”.
В связи с тем что у пациента А. была выявлена низкая противоинфекционная защита организма, уже через час после поступления в ожоговое отделение ему было сделано переливание 400 мл плазмы крови с целью повышения уровня БАСК.
На следующий день замороженную накануне сыворотку пациента А. исследовали на бактерицидную активность фотонефелометрическим методом, который подтвердил правильность результатов полученных при использовании биолюминометрии (уровень БАСК=15%).
Таким образом, положительный эффект от использования способа проявился в экспрессности получения результатов определения БАСК, что позволило провести оперативную коррекцию комплекса лечебных мероприятий.
Пример 2.
Фирма, выпускающая биологически активные добавки для домашних животных, разработала новый препарат “Z”, добавление которого в рацион должно вызывать не только прирост живого веса, но и увеличение уровня неспецифической противоинфекционной резистентности организма животного.
Для исследования препарата “Z” на базе хозяйств “Самородово” и “Пригородный”, было отобрано 90 кроликов породы “Великан” (45 опытных и 45 контрольных), 90 поросят крупной белой породы (45 опытных и 45 контрольных) и 90 телят черно-пестрой породы (45 опытных и 45 контрольных). Каждый день животные взвешивались, каждые пять дней осуществлялся забор крови для определения комплекса факторов естественной противоинфекционной резистентности, в том числе уровня бактерицидной активности сыворотки крови.
Определение БАСК проводили с помощью люминесцирующих бактерий (“Микробиосенсор E.coli Z 905”). Сыворотки крови 90 исследуемых животных (45 получавших + 45 не получавших препарат “Z”), предварительно разведенные физиологическим раствором в соотношении 1:1, в объеме 20 мкл помещались в микропланшету на 96 лунок; в оставшиеся 6 лунок вносили физиологический раствор в объеме 20 мкл (контроль). После этого во все лунки добавляли по 20 мкл люминесцирующих бактерий. Планшету с пробами выдерживали в течение 30 минут при 37°С и после внесения в лунки разбавляющего физиологического раствора помещали в люминоскан “Ascent” (Thermo Labsystems), регистрирующий биологическое свечение в планшетах.
С использованием предварительно записанной в программу люминоскана формулы
где ∑импК - сумма импульсов испускаемых бактериальной суспензией в контроле, ∑импО - сумма импульсов испускаемых бактериальной суспензией в опыте, рассчитывали БАСК в сравниваемых группах животных. Полученные данные позволили констатировать стабильное и достоверное повышение уровня БАСК в двух из трех групп лабораторных животных, что явилось дополнительным аргументом в пользу использования препарата “Z” в ветеринарной практике.
В целом определение БАСК 90 животных заявляемым способом заняло менее 1 часа.
Таким образом, положительный результат, полученный при использовании заявляемого способа, выступает в виде сокращения длительности выполнения процедуры определения бактерицидной активности крови и уменьшения его трудоемкости.
Источники информации, в которых содержатся сведения об аналогах изобретения
1. Бухарин О.В., Созыкин В.Л. Фотонефелометрический метод определения бактерицидной активности сыворотки крови // Факторы естественного иммунитета. - Оренбург, 1979. - С.43-45.
2. Евтушенко А.Д., Тимохина Т.Х., Аргунова Г.А. Модифицированный способ бактериологического определения бактерицидной активности сыворотки крови // Лаб. дело. - 1982. - № 12. - С.41-42.
3. Красильников А.П., Титов Л.П. Определение бактерицидной активности сыворотки крови методом реплик // Лаб. дело. - 1981. - № 4. - С.245-247.
4. Слоним А.А., Толчеев Ю.Д. Определение бактерицидной активности сыворотки крови и лимфы // Лаб. дело. - 1989. - № 7. - С.65-66.
5. Смирнова О.В., Кузьмина Т.А. Определение бактерицидной активности сыворотки крови методом фото нефелометрии // Ж. микробиол. - 1966. - № 4. - С.8-11.
6. Смирнова О.В. Кузьмина Т.Д., Исиченко И.Б. По поводу критических замечаний относительно метода определения бактерицидной активности сыворотки крови при использовании фотонефелометра // Лаб. дело. - 1981. - № 10. - С.626-628.
1. Способ определения бактерицидной активности сыворотки крови путем исследования ее влияния на жизнеспособные серочувствительные микроорганизмы, отличающийся тем, что оценивают ингибирующее влияние сыворотки крови на интенсивность свечения серочувствительных люминесцирующих бактерий (ΣимпО), в качестве которых используют природные или рекомбинантные микроорганизмы, характеризующиеся прямой пропорциональностью между интенсивностью снижения уровня спонтанной биолюминесценции и выраженностью бактерицидного эффекта, по сравнению с контролем - интенсивностью свечения тех же серочувствительных люминесцирующих бактерий, не имевших контакта с сывороткой крови (ΣимпК), после чего рассчитывают значение бактерицидной активности сыворотки крови по формуле
2. Способ по п.1, отличающийся тем, что в качестве серочувствительной люминесцирующей бактерии, демонстрирующей параллелелизм между развитием бактерицидного эффекта и уровнем тушения люминесценции, используют рекомбинантные штаммы Escherichia coli с генами люминесцентной системы Photobacterium leiognathi.