Способ экспериментального моделирования мочекаменной болезни
Иллюстрации
Показать всеИзобретение относится к экспериментальной медицине и касается моделирования мочекаменной болезни у крыс. Способ включает внутрибрюшинное введение 60% раствора глюкозы из расчета 1 мл на 100 г веса животных 2 раза в день на протяжении двух месяцев. Способ прост в исполнении, не дорог и позволяет добиться камнеобразования у 25% экспериментальных животных. 3 ил., 4 табл.
Реферат
Изобретение относится к экспериментальной медицине и касается моделирования мочекаменной болезни у крыс.
Известны методы моделирования заболеваний на лабораторных животных с помощью химических веществ, вводимых различными способами [3, 4].
Цель изобретения: экспериментальное моделирование мочекаменной болезни.
Описание способа. Крысам-самцам, содержавшимся на обычном пищевом и питьевом рационе, два раза в день (с интервалом 5-6 часов) внутрибрюшинно вводили 60% раствор глюкозы из расчета 1 мл на 100 г веса животного.
В качестве критерия развития мочекаменной болезни был выбран показатель наличия камней в мочевом пузыре. Животные выводились из эксперимента через два месяца декапитацией.
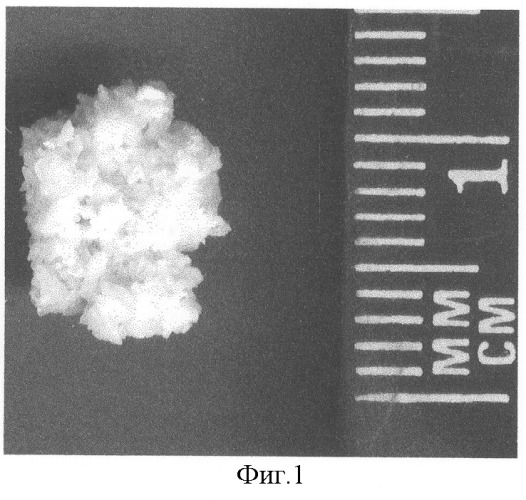
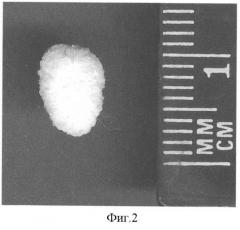
Данный способ моделирования прост в исполнении, не требует дорогостоящих реагентов и позволяет добиться камнеобразования у 25% экспериментальных животных (фиг.1, 2).
Отправной точкой для моделирования камнеобразования (уролитиаза) у крыс послужили данные о развитии мочекаменной болезни у лиц с тяжелым декомпенсированным течением сахарного диабета. Известно, что выраженная гипергликемия сопровождается дегидратацией организма и значительными электролитными расстройствами. Эти нарушения приводят к дисбалансу в тонкой регуляции минерального обмена - перенасыщению мочи нерастворимыми веществами, их кристаллизации с последующей агрегацией и образованием камня [1].
Для успешного моделирования камнеобразования в мочевыводящих путях крыс требовалось создание определенных условий, в частности тяжелого и продолжительного (до нескольких месяцев) диабетогенного, гиперосмолярного синдрома, посредством значительной и продленной гипергликемии.
В задачи данного исследования входило:
1) нарушить углеводный обмен у экспериментальных крыс;
2) вызвать тяжелое обезвоживание (гиперосмолярную дегидратацию) организма животных значительной и продленной гипергликемией.
Используя литературные данные, мы провели экспериментальный поиск эффективного способа нарушения углеводного обмена у крыс, отвечающего необходимым требованиям, описанным выше. Для этого применялись следующие методики:
1) моделирование аллоксанового диабета;
2) содержание животных на диете, обогащенной фруктозой;
3) введение раствора глюкозы при помощи зонда в желудок (пероральный способ создания искусственной гипергликемии);
4) введение раствора глюкозы внутрибрюшинно (парентеральный способ).
В экспериментах были использованы нелинейные животные - белые крысы-самцы массой 250-300 г, в возрасте 7-8 месяцев. Количество подопытных животных в интактных и экспериментальных группах составляло от 13 до 25.
Краткий отчет по результатам использованных методик.
Способ 1. При высоких значениях гипергликемии отмечалась недостаточная продолжительность экспериментального сахарного диабета. Крысы с тяжелым течением диабета (уровень гликемии - 22±4,8 ммоль/л) и выраженным гиперосмолярным синдромом погибали, как правило, в ранние сроки от начала заболевания - в первые две-три недели [2], что не позволяло в полной мере добиться реализации процесса камнеобразования.
Способ 2. Содержание животных на фруктозной диете (60% фруктозы от всего пищевого рациона) на протяжении 2 месяцев сопровождалось резким снижением массы тела без сколько-нибудь значимых изменений в углеводном обмене. Экспериментальную модель диабета при помощи данной методики получить не удалось.
Способ 3. При данном способе имела место кратковременная (не более 2 часов) и незначительная гипергликемия (8,6±2,2 ммоль/л) (табл.1), приводившая к развитию легкого по степени тяжести гиперосмолярного синдрома. Максимально возможная доза углеводной нагрузки составляла 600 мг/100 г веса животного (или 1 мл 60% раствора на 100 г веса животного). Все попытки добиться повышения уровня и продолжительности гликемии путем увеличения концентрации и/или объема вводимого раствора глюкозы оказались неудачными. Это объяснялось высокой вязкостью концентрированных растворов глюкозы и невозможностью их введения через зонд; осмотической активностью глюкозы (развитие диареи и удаление избытка глюкозы из пищеварительного тракта); ограниченными размерами желудка (введение значительного объема жидкости вызывает острое расширение желудка и гибель животных).
| Таблица 1Гликемический профиль при пероральной углеводной нагрузке (60% раствор глюкозы 1 мл/100 г) | |||||||
| Способ углеводной нагрузки | Уровень гликемии (ммоль/л) (M±SD) | ||||||
| n | натощак | После углеводной нагрузки | |||||
| ч/з 30 мин | ч/з 1 час | ч/з 2 часа | ч/з 3 часа | ч/з 4 часа | |||
| Пероральный | 20 | 3,2±0,4 | 5,0±0,7 | 8,6±2,2 | 5,3±1,0 | 3,7±0,6 | - |
Способ 4 оказался наиболее оптимальным для создания тяжелой и продолжительной гипергликемии. Данный способ выгодно отличался от предыдущих тем, что предоставлял большие возможности при подборе необходимой концентрации и объема вводимого раствора для получения требуемой величины гипергликемии и соответственно степени тяжести гиперосмолярного синдрома. К тому же введение глюкозы, минуя желудочно-кишечный тракт, обеспечивало более длительную гипергликемию, связанную с отсутствием пищеварительной фазы стимуляции высвобождения инсулина.
Опытным путем была установлена максимально возможная, не летальная доза углеводной нагрузки, которая составила 600 мг/100 г. Введение глюкозы в установленной дозе приводило к развитию тяжелого гиперосмолярного синдрома с выраженным обезвоживанием животных (табл.2). При этом продолжительность гипергликемического эпизода составляла в среднем 4 часа.
| Таблица 2Гликемический профиль при парентеральном способе углеводной нагрузки (600 мг/100 г) | |||||||
| Способ углеводной нагрузки | n | Уровень гликемии (ммоль/л) (M±SD) | |||||
| натощак | После углеводной нагрузки | ||||||
| ч/з 30 мин | ч/з 1 час | ч/з 2 часа | ч/з 3 часа | ч/з 4 часа | |||
| Парентеральный | 20 | 3,4±0,2 | 23,7±2,9 | 22,0±3,4 | 16,8±3,7 | 12,1±3,1 | 6,8±2,3 |
Пример 1. Известно, что у крыс, содержащихся в стандартных условиях вивария, в мочевыводящих путях не наблюдается процесса камнеобразования.
Для получения модели уролитиаза у животных вызывали обезвоживание (гиперосмолярную дегидратацию) гипергликемией средней и тяжелой степени тяжести при внутрибрюшинном введении глюкозы в дозе 400 мг и 600 мг на 100 г веса животного соответственно, используя при этом различную кратность введения - 1 и 2 раза в день.
В эксперимент по моделированию мочекаменной болезни были взяты 80 беспородных белых крыс-самцов массой 250-320 грамм, возраст которых к началу эксперимента составлял 7-8 месяцев. Животные находились в виварии на обычном пищевом и питьевом рационе с соблюдением всех условий питания, температурных факторов, освещенности и влажности помещения.
Подопытные животные были разделены на две равные по численности группы (по 40 в каждой): первую и вторую. Каждая группа, в свою очередь, поделена на две подгруппы: А и В (по 10 животных). В первой группе использовалась углеводная нагрузка в дозе 400 мг/100 г (40% раствор глюкозы 1 мл/100 г), во второй группе - 600 мг/100 г (60% раствор 1 мл/100 г). В подгруппах А раствор глюкозы вводился один раз в день. В подгруппах В - 2 раза, с интервалом между введениями 6 часов. При этом учитывалось, что введение в таком режиме концентрированного раствора глюкозы может привести к быстрой гибели животных от полного обезвоживания. Поэтому перед повторным введением оценивалась тяжесть состояния - вялые и апатичные животные получали воду дополнительно - ad libitum.
Из эксперимента животные выводились декапитированием по окончании - 4-й и 8-й недели. Выбор животных для этого осуществлялся случайным образом. После забоя изучалась макроскопическая картина внутренних органов, вскрывался просвет мочевого пузыря, производился забор материала для гистологического исследования (почки, мочевой пузырь).
Результаты
Внутрибрюшинное введение раствора глюкозы в дозе 400 мг/100 г приводило к развитию умеренной, среднетяжелой гипергликемии общей продолжительностью до 4 часов. Увеличение углеводной нагрузки до 600 мг/100 г вызывало значительную и тяжелую гипергликемию с нормализацией показателей глюкозы крови к 5 часу после введения раствора (табл.3).
| Таблица 3Гликемический профиль подопытных крыс при внутрибрюшинном введении растворов глюкозы различной концентрации | ||||||||
| Группы экспериментальных животных | n | Доза глюкозы (мг/100 г) | Уровень гликемии (ммоль/л) (M±SD) | |||||
| натощак | После углеводной нагрузки | |||||||
| ч/з 30 мин | ч/з 1 ч | ч/з 2 ч | ч/з 3 ч | ч/з 4 ч | ||||
| 1-я группа | 20 | 400 | 3,2±0,2 | 18,1±2,6 | 16,5±3,8 | 10,1±3,1 | 7,2±2,7 | 3,6±0,4 |
| 2-я группа | 20 | 600 | 3,4±0,2 | 23,7±2,9 | 22,0±3,4 | 16,8±3,7 | 12,1±3,1 | 6,8±2,3 |
| Р | =0,127 | =0,013 | =0,039 | =0,014 | =0,026 | =0,014 |
Введение концентрированных растворов глюкозы сопровождалось жаждой (животные лизали металлические конструкции клеток), полиурией, снижением активности вплоть до полного обездвиживания и апатии; в наиболее тяжелых случаях наблюдалось развитие генерализованных тонико-клонических судорожных припадков. Тяжесть проявления гиперосмолярного синдрома зависела от уровня и продолжительности гипергликемии.
Через 4 недели эксперимента, как в 1-й, так и во 2-й экспериментальных группах, в подгруппах А (с однократным введением глюкозы в течение дня), ни у одного из 20 декапитированных животных в мочевыводящих путях не было обнаружено признаков длительного выделения чрезмерно концентрированной мочи, т.е. образования кристаллов и/или камней.
В 1-й группе В, с двукратным введением глюкозы, гипергликемия также не приводила к значимой дегидратации и кристаллурии. Ни у одного из 10 исследованных животных не наблюдалось камнеобразования. И только в группе 2 В нам удалось получить первые последствия тяжелого обезвоживания, - у 3-х из 10 крыс в просвете мочевого пузыря произошло отложение бесформенных и рыхлых масс белого цвета, в которых содержались единичные очень мелкие светло-желтые кристаллы.
По завершении 8 недели эксперимента у оставшихся 8 крыс (2 крысы выбыли из эксперимента по разным причинам) 1А группы в мочевом пузыре так и не было обнаружено каких-либо патологических образований, которые могли бы свидетельствовать о серьезных нарушениях минерального баланса мочи. Во 2А группе у 3 крыс из 9 (1 крыса погибла от тяжелого гиперосмолярного синдрома) были найдены камни серовато-белого цвета, преимущественно неправильной округлой формы, с шероховатой поверхностью, крошащиеся при небольшом надавливании, состоящие из очень мелких непрозрачных белых кристаллов, а также прозрачных кристаллов, преломляющих свет, некоторые из которых имели вид прямоугольных пластинок. Количество камней и их размеры были различны: от множественных мелких (до 12 по 1-2 мм) до единичных крупных (до 10 мм).
Двукратное введение глюкозы животным 1В группы оставалось таким же неэффективным, как и прежде - уровень и продолжительность гипергликемии были недостаточными для осуществления процесса камнеобразования.
Наибольшее число животных с мочевыми камнями оказалось во 2В группе - группе, в которой гликемия достигала высоких цифр (23,7±2,9 ммоль/л) с общей продолжительностью в течение дня около 8 часов. Так из 7 подопытных животных (3 крысы погибли при явлениях гиперосмолярного синдрома) у 4 в мочевом пузыре были найдены плотные конкременты округлой формы преимущественно крупных размеров (5-12 мм), по внешним (цветовым и структурным) характеристикам идентичные описанным выше.
При этом у 2 крыс, имевших самые крупные камни (5-12 мм), отмечались признаки нарушенного оттока мочи. Мочевой пузырь таких животных был увеличен в размерах и содержал избыточное количество (от 5 до 10 мл) мутной мочи, соломенного, а в одном случае - бурого цвета. Стенки перерастянутого мочевого пузыря оказались истончены, у одной крысы - с участками изъязвления, покрытыми тонкими наложениями - кровяными сгустками. Мочеточники имели вид белесоватых жгутов с увеличенным просветом. Лоханки обеих почек были значительно расширены. У двух животных с признаками обструкции мочевыводящих путей в почках обнаружены мелкие множественные субкапсулярные гнойники. При микроскопическом исследовании почек описана картина апостематозного пиелонефрита - очаги гнойного расплавления ткани с нейтрофильно-лимфоидной инфильтрацией, дистрофией и атрофией канальцевого эпителия. В участке препарата мочевого пузыря - дефект слизистой оболочки с геморрагическим пропитыванием до мышечного слоя стенки мочевого пузыря. В области дна изъязвлений, в подслизистом слое, отмечались полосчатые очаговые отложения темно-синего цвета, похожие на кальциевые.
Пример 2.
Вторая серия опытов была проведена для определения возможности камнеобразования у крыс с тяжелой, продленной (с помощью двукратного введения глюкозы) гипергликемией и большей продолжительностью эксперимента (до 16 недель).
Условия для получения тяжелой гипергликемии и обезвоживания были оставлены прежними (доза глюкозы - 600 мг/100 г, путь введения - внутрибрюшной). В эксперименте использовались 30 белых нелинейных крыс-самцов 7-8 месяцев (более молодые животные плохо переносили длительную гипергликемию и быстро погибали), массой 250-350 г. Животные были разделены на две группы - по 15 в каждой. Для контроля камнеобразования забой подопытных животных проводили через 8 и 16 недель от начала эксперимента.
Результаты
После завершения 8-недельного эксперимента были забиты первые 15 крыс. Из них у 4 в просвете мочевого пузыря были обнаружены различные (по размерам и количеству) плотные камни светло-серого цвета.
Дальнейшее введение глюкозы в установленной дозе на протяжении последующих недель оставшимся 12 животным изменило переносимость ими гиперосмолярного синдрома. Крысы после углеводной нагрузки начинали раньше проявлять двигательную активность, стали более охотно поедать пищу; прибавили в весе. Наряду с этим на протяжении последующих 10-й - 12-й недель эксперимента у отдельных животных при мочеиспускании отмечалось периодическое обильное выделение творожестоподобных рыхлых беловато-желтых масс, в которых после высушивания на воздухе содержались в большом количестве мелкие серые кристаллы. Явление кристаллурии полностью прекратилось к 13 неделе.
Изучение гликемического профиля подопытных животных к моменту окончания эксперимента (16 неделя) выявило следующую картину. После введения 60% раствора глюкозы (1 мл/100 г) в крови, как и прежде, сохранялись высокие показатели гликемии 30-минутной и часовой проб (22,1±2,6 и 20,2±3,1 ммоль/л соответственно). Однако уже через 2 часа после углеводной нагрузки было отмечено резкое снижение гликемии до 8,8 ммоль/л, что в сравнении с прежними показателями первых недель эксперимента (16,8±3,7 ммоль/л) - меньше в 1,9 раз (р=0,006). Продолжительность гипергликемии после однократного введения глюкозы в среднем сократилась на час, а суммарная дневная (после двукратного введения), таким образом, - на два, составив 6 часов от прежних 8 (см. график, фиг.3).
После завершения 16-й экспериментальной недели и забоя оставшихся 12 животных каких-либо явлений уролитиаза - скопления кристаллов или наличия камней в мочевыводящих путях, обнаружено не было (табл.4).
| Таблица 4Влияние дозы и продолжительности углеводной нагрузки на развитие кристаллурии и камнеобразования у крыс | |||||||||
| Экспериментальные группы | n | Суммарная доза глюкозы (мг/100 г) | Максимальная гликемия (ммоль/л) | Начальная продолжительность гипергликемии (ч) | Продолжительность эксперимента | ||||
| 4 нед. | 8 нед. | 12 нед. | 16 нед. | ||||||
| Признаки уролитиаза (кристаллурия, камнеобразование) | |||||||||
| 1-я группа | А | 18 | 400 | 18,1±2,6 | 3 | - | - | ||
| В | 19 | 800 | 6 | - | - | ||||
| 2-я группа | А | 19 | 600 | 23,7±2,9 | 4 | - | +- | ||
| В | 44 | 1200 | 8 | +- | + | +- | - |
Пояснения к таблице: (-) отсутствие признаков; (+ -) кристаллурия; (+) камнеобразование. А - группа животных с однократным введением раствора глюкозы; В - группа животных с двукратным введением раствора глюкозы.
Таким образом, на основании полученных экспериментальных данных представляется вполне аргументированным заключение о том, что нарушение баланса между концентрацией и растворимостью веществ, содержащихся в моче крыс, возможно при условии развития тяжелого и продолжительного обезвоживания животных, что достигается ежедневным двукратным введением раствора глюкозы (600 мг/100 г) на протяжении 8 недель.
Литература
1. Шулутко Б.И. Нефрология 2002. Современное состояние проблемы. - СПб.: Ренкор, 2002, - с.471.
2. Галенок В. А., Гостинская Е.В., Диккер В.Е. Гемореология при нарушениях углеводного обмена. - Новосибирск.: Наука, 1987, - с.63.
3. Моделирование, методы изучения и экспериментальная терапия патологических процессов. - Материалы Всесоюзной конференции центральных научно-исследовательских лабораторий медицинских вузов и институтов усовершенствования врачей СССР. /Под общей редакцией А.С. Чечулина/ - М., 1973.
4. Моделирование заболеваний. /Под редакцией С.В.Андреева. - М.: Медицина, 1973.
Способ моделирования мочекаменной болезни у крыс, включающий внутрибрюшинное введение химического вещества, отличающийся тем, что 2 раза в день на протяжении двух месяцев вводили 60% раствор глюкозы из расчета 1 мл на 100 г веса животных.