Слитые белки с fc-фрагментом иммуноглобулина для повышения иммуногенности белковых и пептидных антигенов
Иллюстрации
Показать всеИзобретение относится к области фармакологии. Сущность изобретения состоит в том, что иммуногенность повышается путем слияния предварительно выбранного антигена с константной областью тяжелой цепи иммуноглобулина для получения слитого белка Fc-антиген. Слитые белки Fc-антиген связываются рецепторами для Fc на поверхности предъявляющих антиген клеток, тем самым адресно направляя антиген к предъявляющим антиген клеткам. Кроме того, в изобретении раскрыто семейство адъювантов. Например, описан слитый белок Fc-адъювант для использования в комбинации со слитыми белками Fc-антиген, чтобы усилить или модулировать специфическую иммунную реакцию на предварительно выбранный антиген. Технический результат - расширение арсенала средств стимуляции иммунитета. 2 с. и 25 з.п.ф-лы, 14 ил., 1 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится в целом к способам и составам для повышения иммуногенности предварительно выбранного белкового или пептидного антигена у млекопитающего. Конкретнее, настоящее изобретение относится к способам и составам, включающим нуклеиновые кислоты, кодирующие аминокислотные последовательности, определяющие слитые белки, содержащие константную область тяжелой цепи иммуноглобулина и предварительно выбранный антиген, причем предварительно выбранный антиген в слитом белке способен вызвать у млекопитающего более сильную иммунную реакцию по сравнению с одним предварительно выбранным антигеном.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Разработка вакцин традиционно была ориентирована на выработку защитных антител, способных нейтрализовать инфекционные агенты. К настоящему времени агенты, используемые в качестве вакцин, обычно включают инактивированные или аттенуированные (ослабленные) микроорганизмы (например, бактерии или вирусы), их продукты (например, токсины) или очищенные антигены. С развитием методологии современной молекулярной биологии и клонирования генов стало возможным получать более чистые и, по-видимому, более специфичные вакцины. Кроме того, знание иммунной системы на молекулярном уровне позволило выделить и исследовать иммунные реакции, стимулированные инфекционными агентами. Два компонента иммунной системы, которые, как считается, являются главными для успешной выработки иммунных реакций, включают: центральную роль регуляторных и цитотоксических Т-клеток и способ, которым антиген предъявляется этим клеткам антиген-предъявляющей клеткой (АПК). Для примера см. Fundamentals of Immunology. Под ред. W.E.Paul. Raven Press, Ltd. New York, 1993.
Обычно белковый или пептидный антиген, полученный АПК извне (экзогенный антиген) расщепляется внутри эндоцитной везикулы, или эндосомы АПК, после чего полученный пептидный фрагмент образует комплекс с белками главного класса II тканевой совместимости (major histocompatibility (MHC) class II). Полученный комплекс перемещается к клеточной поверхности, где он передаутся иммунной клетке, соседствующей с АПК. Пептидный фрагмент попадает в полость, определяемую молекулой MHC, и комплекс может распознаваться Т-клеткой, экспрессирующей Т-клеточный рецептор, способный специфически связываться с комплексом. Взаимодействие между нагруженной пептидом молекулой II класса MHC и хелперной Т-клеткой, которую называют CD4 Т-клеткой, стабилизируется далее взаимодействием между самой молекулой II класса MHC и рецептором CD4+ на поверхности Т-клетки. Таким образом, экзогенный антиген, который преобразован внутри клеток АПК, помещен теперь на поверхность клетки через посредство молекулы II класса MHC. Если комплекс MHC II класса предъявлен CD4+ Т-клеткам, это приводит к появлению секретированных CD4+ хелперной клеткой цитокинов, которые стимулируют В-клетки к продуцированию антител к пептиду (см. выше Paul W.E., ред.).
Вакцинация экзогенным антигеном обычно имеет результатом Т-клеточную реакцию при посредстве CD4 клеток, что, как правило, приводит к продуцированию антител. Цитотоксичные Т-лимфоциты (ЦТЛ) обычно не стимулируются по такому пути. По-видимому, ЦТЛ стимулируются тогда, когда антиген появляется изнутри самих АПК (эндогенный антиген), например при продуцировании вирусных белков в зараженной вирусом клетке или опухолеспецифичных белков в раковой клетке. Действительно, считается, что при многих вирусных заболеваниях образование ЦТЛ является решающим в удалении зараженных вирусом клеток и избавлении от инфекции.
Исследования показывают, что процессы преобразования эндогенного и экзогенного антигенов различны. При синтезе новообразуемых полипептидов часть полипептида расщепляется внутриклеточной структурой, названной протеосомой. Получаемые в этом процессе фрагменты образуют комплекс с молекулами МНС не II класса, а I класса, после чего образовавшиеся комплексы МНС I класса с антигеном переносятся на поверхность клетки. Вновь происходит связывание с рецепторами Т-клеток для специфических пептидных фрагментов, но в этом случае необходимое вспомогательное рецепторное связывание происходит между молекулой МНС I класса и молекулой CD8. Соответственно эндогенный антиген на поверхности АПК предъявляется CD8+ Т-клеткам. Хотя и существуют некоторые нецитотоксичные типы CD8+ Т-клеток, большинство ЦТЛ составляют CD8+ Т-клетки.
Поэтому для создания вакцины, способной индуцировать сильные реакции с участием клеток ЦТЛ, необходимо, чтобы молекула антигена (главным образом белка) либо продуцировалась внутри клетки, либо доставлялась в нужный отсек клетки, чтобы она могла включиться в путь процессинга МНС I класса. Одна из стратегий состоит во включении целевого белка или пептида в вирус с последующим использованием сконструированного вируса в качестве вакцины (Lorenz и др. // Hum. Gene Ther. 1999. Т. 10. С. 623-631). Другая стратегия заключается во введении в клетку кодирующего белок ДНК-вектора с последующим введением клетки животному или пациенту, где белок экспрессируется внутри клетки и затем переносится на поверхность клетки с помощью молекул МНС I класса (Donnelly и др. // Аппи. Rev. Immunol. 1997. Т.15. С.617). Было установлено, что более простая техника инъецирования ДНК-векторов прямо в мышцу или кожу индуцирует реакцию с участием ЦТЛ и/или образование антител к некоторым антигенам (Lai и др. // Crit. Rev. Immunol. 1988. Т. 18. С. 449-484 и патент США №5589466). Исследования показали, что антиген захватывается и процессируется АПК, после чего он предъявляется иммунной системе (Lai и др., см. выше).
Включение экзогенных пептидов или белков в путь МНС I класса было довольно успешным при использовании химических адъювантов, таких как адъювант Фрейнда, и смесей сквалена и детергентов (Hilgers и др. // Vaccine. 1999. Т. 17. С. 219-228), а позднее - при использовании малых гранул, покрытых антигеном, которые подвергаются фагоцитозу макрофагами и индуцируют реакции с участием ЦТЛ по альтернативному пути МНС I класса (De Bruijn и др. // Eur. J. Immunol. 1995. Т. 25. С. 1274-1285). Кроме того, другие способы усиления иммунных реакций на антиген могут включать использование химических адъювантов в комбинации с рекомбинантными иммуностимулирующими цитокинами, например IL-2, IL-12, GM-CSF и другими. Например, в одном из методов применены антитела к гаптену, слитые с IL-2, это позволяет связать этот цитокин с белковым антигеном, который химически прореагировал с гаптеном (Harvill и др. // J.Immunol. 1996. Т. 157. С. 3165).
В другой методике использована “антигенизация” антител, при которой часть вариабельной части иммуноглобулина замещена пептидным антигеном. Пептидный антиген гибридной молекулы предъявляется АПК, как только рекомбинантное антитело связывается с АПК путем взаимодействия с рецепторами для Fc на поверхности АПК (Lanza и др. // Рrос. Nаtl. Acad. USA. 1993. Т. 90. С. 11683-11687). При расширении такого подхода используют инъекцию в селезенку плазмидной ДНК, кодирующей “антигенизированную” тяжелую цепь иммуноглобулина, после чего рождающиеся в селезенке В-клетки секретируют рекомбинантные антитела, как только появляется партнер - легкая цепь иммуноглобулина.
Однако иммуногенность системы доставки антигена является одним из главных препятствий в разработке современных вакцин. Цель вакцинации - вызвать мощную иммунную реакцию. Однако поскольку иммунная система хозяина возникла для борьбы с бактериями и вирусами, при использовании бактерий и вирусов в качестве векторов посланец обычно погибает вместе с посланием. Кроме того, сильная иммунная реакция на некоторые вирусные векторы, например вирус оспы или аденовирус, ограничивает их применимость, и полагают, что подобные же проблемы могут возникать при использовании бактериальных токсинов как белковых векторов. Подобным же образом “белковые векторы” на основе антител, использующие вариабельные части, которые в силу их природы не рассматриваются иммунной системой как “свои”, также потенциально иммуногенны. Предполагается, что частое использование этих молекул-носителей может индуцировать антиидиотипическую реакцию, что препятствует их эффективному использованию. Поэтому задача настоящего изобретения - предложить вакцину, которая дает сильный и продолжительный иммунитет к выбранному предварительно белковому или пептидному антигену.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано частично на открытии того, что можно усилить иммуногенность у млекопитающего предварительно выбранного пептидного или белкового антигена путем слияния предварительно выбранного антигена с константной (неизменяемой) областью тяжелой цепи иммуноглобулина. Получаемый слитый белок (который здесь также называется “слитый белок Fc-антиген” или “слитый антигенный белок”) или последовательность нуклеиновой кислоты, кодирующая слитый белок, могут затем быть введены млекопитающему в виде вакцины, чтобы вызвать иммунную реакцию на предварительно выбранный антиген. Кроме того, было обнаружено, что интенсивность и тип иммунной реакции на предварительно выбранный антиген можно модулировать, вводя вместе со слитым белком Fc-антиген или последовательностью нуклеиновой кислоты, кодирующей слитый белок Fc-антиген, специфические адъюванты.
Поэтому настоящее изобретение предлагает способ повышения иммуногенности у млекопитающего предварительно выбранного антигена. В одном из аспектов способ состоит во введении млекопитающему слитого белка Fc-антиген, содержащего константную область тяжелой цепи иммуноглобулина, соединенную полипептидной связью с предварительно выбранным антигеном, количество которого достаточно для вызывания иммунной реакции. В другом аспекте, способ состоит во введении млекопитающему последовательности нуклеиновой кислоты, например дезоксирибонуклеиновой кислоты (ДНК) или рибонуклеиновой кислоты (РНК), кодирующей слитый белок Fc-антиген, содержащий константную область тяжелой цепи иммуноглобулина, слитую с предварительно выбранным антигеном. Для предварительно выбранного антигена, если он составляет часть слитого белка Fc-антиген (введенного либо как слитый белок, либо как нуклеиновая кислота, которая затем экспрессируется в хозяине с продуцированием слитого белка), характерно то, что он способен стимулировать в млекопитающем иммунную реакцию, превосходящую реакцию после введения сопоставимого количества (например, по весу или по числу молекул) только предварительно выбранного антигена, то есть предварительно выбранного антигена, не слитого с константной областью тяжелой цепи иммуноглобулина.
Кроме того, иммунные реакции на предварительно выбранный антиген в составе слитого белка Fc-антиген можно усилить или модулировать введением слитого белка Fc-антиген вместе с адъювантом. Хотя в практике применения настоящего изобретения можно использовать многие адъюванты, например химические адъюванты, такие как полный адъювант Фрейнда или олигонуклеотид, содержащий неметилированную последовательность CpG, традиционно предпочтительными адъювантами для использования вместе со слитым белком Fc-антиген являются другой слитый с Fc-фрагментом иммуноглобулина белок (называемый здесь “слитый белок Fc-адъювант” или “слитый адъювантный белок”) или нуклеиновая кислота, кодирующая такой слитый с Fc белок. Предпочтительные слитые белки Fc-адъювант содержат константную область тяжелой цепи иммуноглобулина, соединенную полипептидной связью с адъювантным белком, например цитокином. Предпочтительные цитокины, пригодные для использования в конструировании слитых белков Fc-адъювант, включают, например, интерферон-γ (ИФН-γ), интерлейкин-2 (IL-2), интерлейкин-4 (IL-4), интерлейкин-12 (IL-12), IL-18, фактор некроза опухолей (tumor necrosis factor - TNF), гранулоцитный фактор стимуляции образования колоний макрофагами (granulocyte macrophage colony stimulating factor - GMCSF). Другой класс слитых белков Fc-адъювант представляет собой область тяжелой цепи иммуноглобулина, слитую с адъювантной частью, соответствующей внеклеточному домену белка, который обычно является частично или полностью мембраносвязанным. Например, для использования в качестве усиливающего иммунную реакцию адъювантного белка лиганд CD40 сливают с Fc-фрагментом молекулы.
Для модулирования типа стимулированной иммунной реакции на предварительно выбранный антиген можно использовать совместное введение слитых белков Fc-антиген и Fc-адъювант (например, Fc-антиген после Fc-адъюванта или Fc-адъювант после Fc-антигена). В ответ на различные стимулы инициируются два класса иммунных реакций, названные Th1 и Th2, в которых участвуют различные цитокины. Th1 является посредником в иммунных реакциях, по своей природе клеточных, тогда как Th2 является посредником в иммунных реакциях, по своей природе гуморальных. Поэтому реакция Th1 может быть полезной в борьбе с измененными клетками, такими как раковые клетки или зараженные вирусом клетки, тогда как реакция Th2 может быть полезна в воздействии на внеклеточные агенты, такие как паразиты. Часто для стимуляции генерализованной иммунной реакции или для инициирования или модулирования специфических Th1 или Th2 реакций полезно вводить цитокины, слитые с константными областями тяжелой цепи иммуноглобулина.
Например, слитый белок Fc-адъювант, содержащий константную область тяжелой цепи иммуноглобулина, соединенную пептидной связью с GMCSF, является мощным общим стимулятором иммунных реакций, включая как Th1, так и Th2 реакции. Для стимуляции первично клеточной иммунной реакции, или иммунной реакции с участием Th1, может быть одновременно введен слитый белок Fc-адъювант, содержащий IL-12 или ИФН-γ. В качестве альтернативы для стимуляции первично гуморальной иммунной реакции, или иммунной реакции с участием Th2, может быть введен слитый белок Fc-адъювант, содержащий IL-4.
Далее, выбор конкретного цитокина, представленного в слитом белке Fc-адъювант, может определять класс продуцируемых антител к предварительно выбранному антигену в составе слитого белка Fc-антиген. Например, слитый белок Fc-адъювант, содержащий IL-12, может стимулировать хелперные Т-клетки и продуцирование класса антител lgG2a. Наоборот, слитый белок, содержащий IL-4, может стимулировать продуцирование класса антител IgE.
Как обсуждалось выше, в предпочтительном осуществлении способ включает введение слитого белка Fc-антиген или нуклеиновой кислоты, кодирующей слитый белок Fc-антиген, в комбинации со слитым белком Fc-адъювант. Используя два слитых белка, каждый из которых содержит константную область тяжелой цепи иммуноглобулина, можно локализовать совместно (солокализовать) и содержащий предварительно выбранный антиген белок, и содержащий адъювант (например, цитокин) белок в одном и том же или в подобных типах клеток млекопитающего. Например, макрофаги, В-клетки, гранулоциты и дендритные клетки экспрессируют на своей клеточной поверхности рецепторы для Fc. Поэтому совместное введение слитых белков Fc-антиген и Fc-адъювант, способных связываться с рецепторами для Fc, позволяет солокализовать антиген из слитого с антигеном белка и адъювант из слитого с адъювантом белка на одних и тех же типах клеток. Затем адъювант может стимулировать, усиливать или иным образом модулировать иммунную реакцию в окрестностях предварительно выбранного антигена.
В данном предпочтительном осуществлении изобретение использует две различных формы локализации и концентрирования. Во-первых, изобретение использует общую часть молекулы, слитую как с антигеном, так и с адъювантом, которая концентрируется в определенных областях тела. Таким способом повышается эффективная локальная концентрация антигена в соседстве с адъювантом. Во-вторых, изобретение направляет антиген в аппарат иммунной системы, предназначенный для процессинга и предъявления антигена. Первый этап концентрирования может быть осуществлен путем слияния белка-антигена и белка-адъюванта белков с такой частью молекулы, которая приводит к концентрированию в какой-нибудь части тела, доступной для иммунной системы. Второй этап адресования может быть осуществлен слиянием белка-антигена с любой частью молекулы, которая улучшает доставку в систему предъявления антигена или осуществляемый этой системой процессинг.
В соответствии с этим в настоящем изобретении обеспечение этих эффектов концентрирования достигается двумя альтернативными способами. Один способ заключается в конструировании и введении двух различных слитых белков - слитого белка, локализующего антиген, и слитого белка, локализующего адъювант. Второй способ состоит в конструировании и введении слитого белка, содержащего антиген, адъювант и локализующий белок. Фрагмент Fc молекулы является примером локализующего белка.
Важная особенность константной области тяжелой цепи иммуноглобулина состоит в том, что в отличие от предварительно выбранного антигена в слитом белке Fc-антиген она для намеченного реципиента предпочтительно неиммуногенна или только слабо иммуногена. Другими словами, в слитом белке Fc-антиген предварительно выбранному антигену предназначено быть в реципиенте более иммуногенным, чем константная область тяжелой цепи иммуноглобулина. Подобным же образом ожидается, что слитый белок Fc-адъювант будет также неиммуногенным или слабо иммуногенным для намеченного реципиента. Иммуногенность константной области тяжелой цепи иммуноглобулина можно снизить или в некоторых случаях исключить путем использования последовательностей константной области иммуноглобулина, полученных из организмов того же вида, как и намеченный реципиент, или подобных имеющимся в организмах того же вида. Например, для создания слитых белков, которые нужно вводить людям, используют константные области тяжелой цепи иммуноглобулина преимущественно человеческого происхождения. Подобным же образом, если намеченный реципиент - человек, адъювантный белок в слитом белке Fc-адъювант также предпочтительно должен иметь человеческое происхождение. Выбором подходящих аминокислотных последовательностей, определяющих константные области тяжелой цепи иммуноглобулина и адъювантные белки, можно оптимизировать выработку иммунитета непосредственно к предварительно выбранному антигену.
В предпочтительном осуществлении константная область тяжелой цепи иммуноглобулина в слитом белке Fc-антиген содержит шарнирную область иммуноглобулина и факультативно - домен константной области иммуноглобулина, выбранный их группы, состоящей из домена СН2, домена СН3 и домена СН4 или же их комбинации. Однако константная область тяжелой цепи иммуноглобулина предпочтительно лишена по крайней мере домена СН1. Кроме того, слитые белки с Fc-фрагментом иммуноглобулина по настоящему изобретению предпочтительно лишены домена вариабельной области тяжелой цепи иммуноглобулина (VН). Если слитый белок должен быть введен человеку, константная область тяжелой цепи иммуноглобулина предпочтительно содержит шарнирную область и домен СН2 или домен СН3, наиболее же предпочтительно содержит шарнирную область и оба домена – СН2 и СН3. Предполагается, что константные области тяжелой цепи иммуноглобулина, пригодные в практике применения настоящего изобретения, могут быть получены из иммуноглобулинов, принадлежащих к любому из пяти классов иммуноглобулинов, которые в данной области знания обозначаются как IgA (Igα), IgD (lgδ), IgE (Igε), IgG (Igγ) и IgM (lgμ). Однако предпочтительными являются области тяжелой цепи иммуноглобулина из класса IgG.
Предполагается, что в слитый белок Fc-антиген по настоящему изобретению может быть включен любой предварительно выбранный целевой антиген. В предпочтительном осуществлении предварительно выбранный антиген выбран из группы, состоящей из простатит-специфического мембранного антигена, эктодомена рецептора цитокина, вирусного белка и специфичного для рака или опухоли антигена.
В практике применения настоящего изобретения могут быть полезны слитые белки Fc-антиген, имеющие различные конфигурации. Например, N-конец предварительно выбранного антигена может быть соединен полипептидной связью с С-концом константной области тяжелой цепи иммуноглобулина. В качестве альтернативы, С-конец предварительно выбранного антигена может быть соединен пептидной связью с N-концом константной области тяжелой цепи иммуноглобулина. Кроме того, подразумевается, что слитые белки Fc-антиген могут содержать множество из одного или более предварительно выбранных антигенов, один или несколько из которых могут быть присоединены непосредственно или через полипептидный мостик к каждому из других антигенов или к константной области тяжелой цепи иммуноглобулина. Далее, два или несколько слитых белков Fc-антиген могут быть соединены вместе либо нековалентной либо ковалентной связью, например с помощью одной или нескольких дисульфидных связей, образуя димерные или мультимерные композиции. Предполагается, что слитые белки Fc-антиген в димерной конструкции могут быть одними и теми же или отличаться друг от друга. Например, хотя оба слитых белка Fc-антиген могут содержать одинаковую константную область тяжелой цепи иммуноглобулина, предварительно выбранные антигены могут различаться. Предполагается, что подобные же конфигурации могут быть применены также и для слитых белков Fc-адъювант.
Кроме того, в практике применения настоящего изобретения могут быть полезны разнообразные последовательности нуклеиновой кислоты, кодирующие слитые белки с участием Fc. Например, последовательности нуклеиновой кислоты могут кодировать в направлении от 5' к 3' либо константную область тяжелой цепи иммуноглобулина и предварительно выбранный антиген, либо предварительно выбранный антиген и константную область тяжелой цепи иммуноглобулина. Кроме того, последовательности нуклеиновой кислоты могут также факультативно включать “лидерную” или “сигнальную” последовательность, основанную, например, на последовательности легкой цепи иммуноглобулина, непосредственно слитой с последовательностью для шарнирной области константной области тяжелой цепи иммуноглобулина. В предпочтительном варианте осуществления, когда фрагмент Fc основан на последовательностях IgG, соответствующая фрагменту Fc нуклеотидная последовательность кодирует в направлении от 5' к 3' по меньшей мере шарнирную область иммуноглобулина (то есть шарнирную область, содержащую по меньшей мере один цистеиновый аминокислотный остаток, способный образовывать дисульфидную связь со второй последовательностью шарнирной области иммуноглобулина), домен СН2 иммуноглобулина и домен СН3. Кроме того, последовательность нуклеиновой кислоты, кодирующая слитые белки Fc-антиген, может быть также включена в способный к репликации экспрессирующий вектор, который может экспрессировать слитый белок, например, либо в бактерии-хозяине, либо в намеченном реципиенте, либо в обоих.
Ожидается, что инъекция последовательностей нуклеиновой кислоты, кодирующих слитый белок Fc-антиген (или их одних, или в комбинации с последовательностями нуклеиновой кислоты, кодирующими слитый белок Fc-адъювант), может приводить к формированию клеточной иммунной реакции, гуморальной иммунной реакции или их обеих. Сочетание иммунизации нуклеиновой кислотой и иммунизации, основанной на белках (например, введения слитого белка Fc-антиген до, в ходе или после введения нуклеиновой кислоты, кодирующей слитый белок Fc-антиген), может давать синергический эффект, вызывая более сильную иммунологическую реакцию на предварительно выбранный антиген по сравнению с иммунизацией только нуклеиновой кислотой или только белком.
Все вышеизложенное и другие задачи, отличительные особенности и преимущества настоящего изобретения будут очевидны из нижеследующих подробного описания, чертежей и формулы.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Все вышеизложенное и другие цели, отличительные особенности и преимущества настоящего изобретения, так же как и само изобретение, будут полнее понятны из последующего описания предпочтительных осуществлении, если их изучать вместе с сопроводительными чертежами, на которых:
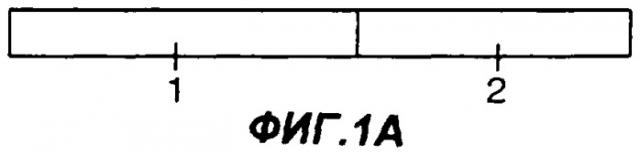
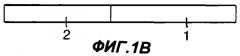
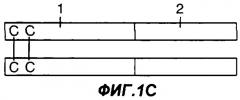
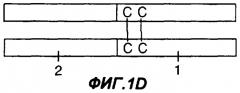
Фигуры 1A-1G являются схематическими иллюстрациями типовых слитых белков с участием Fc, пригодных в практике применения настоящего изобретения. На фиг.1А представлен слитый белок Fc-антиген или Fc-адъювант, у которого константная область тяжелой цепи иммуноглобулина (1) присоединена к N-концу антигена или адъюванта (2). На фиг.1В представлен слитый белок Fc-антиген или Fc-адъювант, у которого константная область тяжелой цепи иммуноглобулина (1) присоединена к С-концу антигена или адъюванта (2). На фиг.1С и 1D представлен димерный белок, у которого одна или каждая из обеих полипептидных цепей представляет собой слитый белок Fc-антиген или Fc-адъювант. На фиг.1С по меньшей мере в одной из полипептидных цепей константная область тяжелой цепи иммуноглобулина (1) присоединена к N-концу антигена или адъюванта (2), а на фиг.1D константная область тяжелой цепи иммуноглобулина (1) присоединена к С-концу антигена или адъюванта (2). На фиг.1Е представлен димерный белок, у которого одна или каждая из обеих полипептидных цепей представляет собой слитый белок Fc-антиген-антиген, Fc-адъювант-адъювант, Fc-адъювант-антиген или Fc-антиген-адъювант. На фиг.1F представлен димерный слитый белок, у которого одна или каждая из обеих полипептидных цепей представляет собой слитый белок антиген -Fс-адъювант или адъювант-Fс-антиген. На фиг.1G представлен димерный слитый белок, у которого одна или каждая из обеих полипептидных цепей представляет собой слитый белок антиген-адъювант-Fc или адъювант-антиген-Fc.
На фигурах 2А-2В схематически представлены последовательности ДНК, полезные в практике применения настоящего изобретения. На фиг.2А представлен экспрессирующий вектор для слитого белка с Fc человека. На фиг.2В представлено генное слияние для экспрессии слитого белка с Fc иммуноглобулина IgG2a мыши.
Фигуры 3A-3F представляют собой графики, демонстрирующие влияние химического адъюванта и адъюванта Fc-цитокин на продуцирование антител у мышей, иммунизированных слитым белком Fc-антиген, а именно слитым белком из мышиного Fc с эктодоменом рецептора IL-4 человека (FC-IL-4R). На фиг.3А мыши были иммунизированы FC-IL-4R и Fc-IL-2 в полном адъюванте Фрейнда (CFA). На фиг.3В мыши были иммунизированы FC-IL-4R в фосфатно-буферном солевом растворе (PBS). На фиг.3С мыши были иммунизированы FC-IL-4R в CFA. На фиг.3D мыши были иммунизированы FC-IL-4R и Fc-IL-2 в PBS. На фиг.3Е мыши были иммунизированы FC-IL-4R и Fc-GMCSF в CFA. На фиг.3F мыши были иммунизированы FC-IL-4R и Fc-GMCSF в PBS. На фигурах 3A-3F квадраты, ромбы и треугольники представляют данные, полученные у трех разных мышей. Уровни содержания антител к антигену измеряли методом твердофазного иммуноферментного анализа ELISA; по оси Y указана оптическая плотность (ОП) в пробах ELISA.
Фигуры 4A-4D представляют собой графики, показывающие эффект иммунизации мышей раковым антигеном человека PSMA в форме слитого белка Fc-антиген при использовании в качестве адъюванта различных количеств слитого белка Fc-GMCSF. На фиг.4А мышей иммунизировали только 50 мкг слитого белка Fc-PSMA. На фиг.4В мышей иммунизировали 50 мкг Fc-PSMA и 0,05 мкг Fc-GMCSF в качестве адъюванта. На фиг.4С мышей иммунизировали 50 мкг Fc-PSMA и 0,5 мкг Fc-GMCSF в качестве адъюванта. На фиг.4D мышей иммунизировали 50 мкг Fc-PSMA и 5 мкг Fc-GMCSF. На фиг.4A-4D квадраты, ромбы и треугольники представляют данные, полученные у трех разных мышей.
Фигуры 5A-5F представляют собой графики, позволяющие сопоставить продуцирование специфических антител к антигену PSMA, введенному в виде либо нативного белка (5А-5С), либо слитого белка Fc-PSMA с Fc мыши (5D-5F). На фиг.5А мышей иммунизировали 50 мкг PSMA в качестве антигена. На фиг.5В мышей иммунизировали 50 мкг PSMA в качестве антигена и 0,2 мкг GMCSF в качестве адъюванта. На фиг.5С мышей иммунизировали 50 мкг PSMA в качестве антигена и 0,5 мкг Fc-GMCSF в качестве адъюванта. На фиг.5D мышей иммунизировали 50 мкг Fc-PSMA в качестве антигена. На фиг.5Е мышей иммунизировали 50 мкг Fc-PSMA в качестве антигена и 0,2 мкг GMCSF в качестве адъюванта. На фиг.5F мышей иммунизировали 50 мкг Fc-PSMA в качестве антигена и 0,5 мкг Fc-GMCSF в качестве адъюванта. На фигурах 5A-5F квадраты, ромбы и треугольники представляют данные, полученные у трех разных мышей. Уровни содержания антител к антигену измеряли методом твердофазного иммуноферментного анализа ELISA; по оси Y указана оптическая плотность в пробах ELISA.
Фиг.6 - это диаграмма сравнения адъювантного действия Fc-GMCSF или Fc-F3L, введенных совместно с Fc-PSMA, на продуцирование антител к PSMA человека. Все животные получали либо только 50 мкг Fc-PSMA, либо 50 мкг Fc-PSMA в комбинации с указанным Fc-цитокином в качестве адъюванта. В каждом опыте использовали трех мышей.
Фигуры 7А-7В представляют собой графики, показывающие иммуногенность слитого белка Fc-EpCAM у индивидуальных мышей при введении его в отдельности или в комбинации с адъювантом Fc-GMCSF. Фиг.7А и 7В показывают титры антител, измеренные соответственно через 7 и 14 дней после активной (“бустерной”) иммунизации. Бустерную иммунизацию проводили через 3 недели после предварительной иммунизации. На обеих фигурах незаполненные ромбы соответствуют подкожной инъекции мышам только 10 мкг Fc-EpCAM, а зачерненные треугольники соответствуют подкожной инъекции мышам 10 мкг Fc-EpCAM и 1 мкг Fc-GMCSF в качестве адъюванта. Уровни содержания антител к антигену измеряли методом твердофазного иммуноферментного анализа ELISA; по оси Y указана оптическая плотность в пробах ELISA.
Фигуры 8А-8В представляют собой графики, показывающие иммуногенность у мышей слитого белка EpCAM-Fc (обратное расположение области Fc и антигена) при введении его в отдельности или в комбинации с адъювантным слитым белком Fc-GMCSF. Фиг.8А и 8В показывают титры антител, измеренные соответственно через 14 дней и 21 день после иммунизации (то есть через 7 дней после бустерной иммунизации). На обеих фигурах незаполненные ромбы представляют средние значения титров антител у трех мышей, иммунизированных 25 мкг слитого белка EpCAM-Fc, а зачерненные треугольники соответствуют иммунизации мышей 25 мкг EpCAM-Fc и 2,5 мкг Fc-GMCSF в качестве адъюванта. Уровни содержания антител к антигену измеряли методом твердофазного иммуноферментного анализа ELISA; по оси Y указана оптическая плотность в пробах ELISA.
На фиг.9 показана схема конструирования плазмидного вектора, кодирующего слитый белок EpCAM-Fc-GMCSF. В этом случае антиген ЕрСАМ слит с амино-концом константной области тяжелой цепи иммуноглобулина (Fc-фрагмента), а адъювантный GMCSF слит с карбоксильным концом Fc-фрагмента.
Фигуры 10A-10D представляют собой графики, показывающие титры антител у мышей после инъекции им плазмидных векторов, кодирующих слитый белок Fc-EpCAM при использовании в качестве носителя либо PBS, либо 25% раствора (вес к объему) сахарозы. На фигурах 10A-10D представлены титры антител, регистрируемые соответственно через 13, 27, 55 и 69 дней после первоначальной инъекции. Во всех фигурах незаполненные ромбы соответствуют титрам у отдельных мышей, которым кодирующая Fc-EpCAM плазмида была введена в PBS, а зачерненные треугольники соответствуют титрам у отдельных мышей, которым кодирующая Fc-EpCAM плазмида была введена в сахарозе. Уровни содержания антител к антигену измеряли методом твердофазного иммуноферментного анализа ELISA; по оси Y указана оптическая плотность в пробах ELISA.
Фигуры 11А-11В представляют собой графики, показывающие стимуляцию включения 3Н - тимидина в ответ на стимуляцию антигеном in vitro селезеночных макрофагов (спленоцитов), выделенных из мышей, иммунизированных ДНК-вакцинацией или инъекцией белка. На фиг.11В представлена в увеличенном виде нижняя часть фиг.11А. Во всех фигурах незаполненные ромбы соответствуют спленоцитам, взятым у мышей, иммунизированных 100 мкг плазмидной ДНК, кодирующей слитый белок CMV-Fc-EpCAM (CMV -цитомегаловирус, ЦМВ), незаполненные кружки соответствуют макрофагам, взятым у мышей, иммунизированных 100 мкг плазмидной ДНК кодирующей слитый белок CMV-EpCAM-Fc, а крестики соответствуют макрофагам, взятым у мышей, иммунизированных 10 мкг белка Fc-EpCAM. Селезенки удаляли у мышей на 70-й день после первичной инъекции плазмидной ДНК или белка и двух бустерных иммунизаций с интервалами в 3 недели.
Фигуры 12А-12В представляют собой графики, показывающие результаты испытаний киллерной активности цитотоксических Т-лимфоцитов (ЦТЛ) с использованием спленоцитов из мышей, иммунизированных плазмидной ДНК или белком Fc-EpCAM. На фиг.12А показана активность спленоцитов по отношению к опухолевым клеткам СТ 26 мыши, экспрессирующим белок ЕрСАМ человека. На фиг.12В показана активность спленоцитов по отношению к исходным опухолевым клеткам СТ 26 мыши. На обеих фигурах незаполненные ромбы относятся к спленоцитам из мышей, иммунизированных ДНК, несущей конструкцию (промотор CMV)-EpCAM, незаполненные квадраты относятся к спленоцитам из мышей, иммунизированных ДНК, несущей конструкцию слияния (промотор CMV)-Fc-EpCAM, незаполненные треугольники относятся к спленоцитам из мышей, иммунизированных ДНК, несущей конструкцию слияния (промотор CMV)-EpCAM-Fc, а крестики относятся к спленоцитам из мышей, иммунизированных слитым белком Fc-EpCAM. Для анализа активности ЦТЛ были использованы спленоциты из иммунизированных мышей, культивированные в течение 5 дней с 10 ед/мл IL-2. Меченые клетки-мишени смешивали с указанными эффекторами и инкубировали в течение 4 ч. Процент специфического лизиса рассчитывали по выходу радиоактивности.
Фиг.13 представляет собой график, показывающий титры антител у мышей, иммунизированных подкожно либо только 50 мкг слитого белка Fc-MCSP в PBS, либо 50 мкг этого слитого белка в комбинации с 5 мкг Fc-GMCSF в качестве адъюванта. Зачерненные ромбы соответствуют титрам антител в нормальной сыворотке, незаполненные квадраты представляют титры антител в сыворотке мышей, иммунизированных только слитым белком Fc-MCSP, a зачерненные треугольники представляют титры антител в сыворотке мышей, иммунизированных слитым белком Fc-MCSP в комбинации с адъювантом Fc-GMCSF. Уровни содержания антител к антигену измеряли методом ELISA; по оси Y указана оптическая плотность в пробах ELISA.
Фигуры 14А-14В представляют собой графики, показывающие титры антител у мышей, иммунизированных слитым белком Fc-gp41 pep 626 - либо только им, либо в комбинации с адъювантом Fc-цитокин. На фигурах 14А и 14В представлены титры антител, полученные соответственно через 7 дней и 33 дня после второй бустерной иммунизации. На этих фигурах незаполненные ромбы соответствуют титрам антител у мышей, иммунизированных внутрикожной инъекцией только 25 мкг антигена Fc-gp41 pep 626, незаполненные квадраты соответствуют титрам антител у мышей, иммунизированных внутрикожной инъекцией 25 мкг антигена Fc-gp41 рер 626 в комбинации с 2,5 мкг адъюванта Fc-GMCSF, а зачерненные треугольники соответствуют титрам антител у мышей, иммунизированных внутрикожной инъекцией 25 мкг антигена Fc-gp41 рер 626 в комбинации с 2,5 мкг адъюванта Fc-IL2. Уровни содержания антител к антигену измеряли методом ELISA; по оси Y указана оптическая плотность в пробах ELISA.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение нацелено на эффективную доставку белковых или пептидных антигенов in vivo для индукции у млекопитающего гуморальной (т.е. основанной на антителах) или опосредованной клетками Th2 иммунной реакции, клеточной или опосредованной клетками Тh1 иммунной реакции, а в некоторых случаях - обоих типов иммунных реакций. Теперь установлено, что можно усилить иммуногенность у млекопитающего предварительно выбранного белкового или пептидного антигена слиянием предварительно выбранного антигена с константной областью тяжелой цепи иммуноглобулина, чтобы получить слитый белок Fc-антиген. Полученный слитый белок Fc-антиген или последовательности нуклеиновой кислоты, кодирующие слитые белки Fc-антиген, могут затем быть введены млекопитающему, например человеку, в виде вакцины, чтобы вызвать иммунную реакцию на предварительно выбранный антиген.
Слитый белок Fc-антиген избирательно направляет антиген к антиген-предъявляющим клеткам (АПК). Не вдаваясь в теорию, можно считать, что связывание слитых белков Fc-антиген с АПК происходит при посредстве рецепторов для Fc, экспрессируемых на многих типах иммунных клеток, в том числе, например: на дендритных клетках, макрофагах, В-клетках и гранулоцитах. Слитый белок Fc-антиген, введенный млекопитающему, связывается с рецепторами для Fc, после чег