Способ исследования поглотительной и метаболической активности нейтрофилов периферической крови методами фагоцитоза и нст-теста
Иллюстрации
Показать всеИзобретение относится к области клинической иммунологии, в частности к исследованию факторов неспецифической антимикробной защиты, точнее к исследованию фагоцитарной и метаболической активности нейтрофилов периферической крови у детей. Гепаринизированную венозную кровь разливают в пять конических пробирок по 0,1 мл, первые три из которых содержат по 0,1 мл суспензии неокрашенного латекса с размером частиц 1,5 мкм, 4-я - 0,1 мл среды 199 и 0,1 мл 0,1% водного раствора нитросинего тетразолия (НСТ), 5-я - 0,1 мл суспензии латекса и 0,1 мл 0,1% водного раствора НСТ. Инкубируют в термостате при t 37°С: 1-ю пробирку - 5 мин, 2-ю - 30 мин, 3-ю - 1 час, 4-ю и 5-ю - 40 мин. Готовят из 0,2 мл инкубационной смеси мазки на стеклах, высушивают при t 37°С, фиксируют в пламени горелки, окрашивают 1% водным раствором метиленового синего, повторно высушивают и микроскопируют под иммерсией при увеличении 90х10. Результаты исследования оценивают по поглотительной активности в реакциях фагоцитоза, определяя процент фагоцитирующих клеток, фагоцитарное число, фагоцитарный интегральный индекс и показатели скорости фагоцитоза. Реакцию НСТ-теста определяют путем подсчета процента формазан-позитивных клеток, вычисления цитохимического показателя активности и индекса стимуляции НСТ-теста. Способ позволяет сократить время исследования, удешевить и повысить точность исследования. 1 ил., 3 табл.
Реферат
Известен способ определения поглотительной активности нейтрофилов периферической крови с использованием в качестве тест-системы окрашенных частиц латекса диаметром 3 мкм (Медведев А.Н., Чаленко В.В. Способ исследования поглотительной фазы фагоцитоза // Лабораторное дело, 1991, №2, с.19-20).
Известен способ исследования реакций бактериального фагоцитоза нейтрофилами капиллярной крови (Нестерова И.В., Слынько Л.И., Светличная М.А., Майченко Л.Г. Диагностика изменений в микробицидной системе нейтрофильных гранулоцитов при аллергических заболеваниях / Методические рекомендации. Краснодар, 1989, с.11-12).
Известен способ исследования кислородзависимого метаболизма нейтрофилов периферической крови с использованием в качестве тест-системы лабораторного штамма Staphylococcus aureus P-209 (Park B.H., Fikrig S.M., Smithwich E.M. Infection and nitrobluetetrazolium reduction by neutrophils; a diagnostic aid // Lancet, 1968, vol.11, №2, p.532-534).
Существует также способ исследования метаболической активности нейтрофилов (Виксман М.Е., Маянский А.Н. Характеристика опсонических факторов по реакции восстановления нитросинего тетразолия нейтрофилами человека // Бюллетень экспериментальной биологии и медицины, 1980, т.89, №2, с.214-215).
Каких либо работ, описывающих определение поглотительной фазы фагоцитоза и метаболической активности нейтрофилов периферической крови в порядке одного исследования, в литературе не обнаружено.
Целью изобретения является оптимизация исследования, сокращение времени, удешевление и повышение его чувствительности.
Эта цель достигается тем, что гепаринизированную венозную кровь ребенка разливают в пять конических пробирок по 0,1 мл, первые три из которых содержат по 0,1 мл суспензии неокрашенного латекса с размером частиц 1,5 мкм, 4-я - 0,1 мл среды 199 и 0,1 мл 0,1% водного раствора нитросинего тетразолия (НСТ), 5-я - 0,1 мл суспензии латекса и 0,1 мл 0,1% водного раствора НСТ, инкубируют в термостате при t 37°С: 1-ю пробирку - 5 мин, 2-ю - 30 мин, 3-ю - 1 час, 4-ю и 5-ю - 40 мин; готовят из 0,2 мл инкубационной смеси мазки на стеклах, высушивают при t 37°С, фиксируют в пламени горелки, окрашивают 1% водным раствором метиленового синего, повторно высушивают и микроскопируют под иммерсией при увеличении 90×10, причем результаты исследования оценивают по поглотительной активности в реакциях фагоцитоза, определяя процент фагоцитирующих клеток, фагоцитарное число, фагоцитарный интегральный индекс и показатели скорости фагоцитоза, а реакцию НСТ-теста определяют путем подсчета процента формазан-позитивных клеток, вычисления цитохимического показателя активности и индекса стимуляции НСТ-теста.
Пример 1. Исследование поглотительной фазы фагоцитоза и метаболической активности нейтрофилов периферической крови было проведено у 36 практически здоровых детей в возрасте от 1 месяца до 5 лет. Первую группу составили 16 детей в возрасте до 1 года (средний возраст - 4,2±1,1 мес), вторую группу - 20 детей в возрасте от 1 года до 5 лет (2,9±1,8 лет). Зависимость показателей функциональной активности нейтрофилов периферической крови от возраста детей представлена в табл.1.
| Таблица 1Показатели фагоцитоза и НСТ-теста у здоровых детей | |||
| Показатель | 1 группа(n=16) | 2 группа (n=20) | Достоверность различия |
| ФАГОЦИТОЗ | |||
| %Ф 5 мин | 31,8±6,2 | 55,3±7,2 | Р<0,05 |
| ФЧ 5 мин | 2,66±0,78 | 2,57±0,61 | |
| %Ф 30 мин | 53,2±7,3 | 76,8±5,9 | Р<0,05 |
| ФЧ 30 мин | 2,86±0,32 | 3,84±0,48 | Р<0,05 |
| %Ф 1 час | 77,4±3,9 | 88,5±5,5 | Р<0,05 |
| ФЧ 1 час | 4,47±0,98 | 6,69±0,81 | Р<0,05 |
| КФЧ1 | 0,72±0,08 | 0,68±0,06 | |
| КФЧ2 | 0,59±0,07 | 0,41±0,05 | Р<0,05 |
| ФИИ | 2,01±0,51 | 2,94±0,55 | |
| Спонтанный НСТ-тест | |||
| %ПК | 36,5±4,4 | 26,1±3,3 | Р<0,05 |
| ЦПА | 0,97±0,09 | 0,62±0,03 | Р<0,05 |
| Стимулированный НСТ-тест | |||
| %ПК | 50,0±5,8 | 44,3±5,6 | |
| ЦПА | 1,46±0,11 | 1,28±0,17 | |
| ИСНСТ | 1,51±0,12 | 1,84±0,10 | Р<0,05 |
Исследование реакций фагоцитоза и НСТ-теста проводят параллельно, из одной порции биосубстрата, с применением идентичных реактивов, красителей, лабораторной посуды и оборудования.
В качестве тест-системы используют частицы неокрашенного латекса (10% полистирольная суспензия) диаметром 1,5 мкм производства фирмы ДИАэМ, Россия. При постановке НСТ-теста, кроме этого, используют нитросиний тетрозолий (НСТ) - С40Н30Сl2N10О6 с молекулярным весом 817,65 производства Германии.
Методика фагоцитоза. Три конических пробирки, содержащих 0,1 мл суспензии латекса и 0,1 мл гепаринизированной венозной крови, инкубируют в термостате при 37°С (1-ю пробирку - 5 минут, 2-ю - 30 минут, 3-ю - 1 час). Готовят мазки инкубационной смеси на стекле, которые после высыхания, фиксации в пламени горелки, окраски 1% метиленовым синим микроскопируют при увеличении 90×10 под иммерсией. Учитывают данные на 100 нейтрофилов, из которых рассчитывают фагоцитарную активность (%Ф) - процент фагоцитирующих нейтрофилов; фагоцитарное число (ФЧ) - среднее количество частиц, захваченных одной клеткой, и фагоцитарный интегральный индекс (ФИИ) - среднее число поглощенных частиц латекса на 100 нейтрофилов. Высчитывают коэффициенты фагоцитарного числа (КФЧ), характеризующие скорость фагоцитоза: отношение ФЧ 5 мин к ФЧ 30 мин - КФЧ 1 и отношение ФЧ 5 мин к ФЧ 1 час - КФЧ 2.
Из той же порции крови одновременно с исследованием реакций фагоцитоза ставится НСТ-тест: 0,1 мл гепаринизированной крови и 0,1 мл 0,1% водного раствора НСТ инкубируют в конических пробирках при 37°С в течение 40 минут с 0,1 мл среды 199 - спонтанный НСТ-тест или с 0,1 мл суспензии латекса - стимулированный НСТ-тест. Аналогично приготовлению мазка для фагоцитоза готовят мазки: 0,2 мл инкубационной смеси наносят на стекло, просушивают, фиксируют, окрашивают 1% раствором метиленового синего, высушивают и микроскопируют под иммерсией при увеличении 90×10. Оценка НСТ-теста проводится по следующим показателям: % ПК - процент формазан-позитивных нейтрофилов; вычисляется индекса стимуляции НСТ-теста (ИС НСТ) - отношение % ПК в стимулированном НСТ-тесте к % ПК в спонтанном НСТ-тесте. С целью вычисления цитохимического показателя активности (ЦПА) проводят визуальную оценку количества гранул диформазана в нейтрофилах с использованием принципа Kaplow L.S. по формуле
где а, b, с, d, е - количество клеток соответственно 0, 1, 2, 3, 4-й степени.
Пример 2. Ребенок Р. Яна, 7 мес, поступила в отделение реанимации и интенсивной терапии Морозовской детской клинической больницы (МДКБ) по наряду скорой помощи из дома с диагнозом: Острая пневмония?, дыхательная недостаточность II степени. При обследовании в стационаре была выявлена острая полисегментарная деструктивная пневмония.
На 3-й, 10-й и 30-й день болезни ребенку было проведено исследование функциональной активности нейтрофилов (табл.2). Исследование проводилось аналогично примеру 1.
| Таблица 2Показатели функциональной активности нейтрофилов периферической крови ребенка Р. Яны, 7 мес. | ||||
| Показатели | 3-й день болезни | 10-й день болезни | 30-й день болезни | Нормальные значения |
| ФАГОЦИТОЗ | ||||
| %Ф 5 мин | 27 | 70* | 32 | 31,8±6,2 |
| ФЧ 5 мин | 3,22 | 3,91* | 2,81 | 2,66±0,78 |
| %Ф 30 мин | 46 | 84* | 48 | 53,2±7,3 |
| ФЧ 30 мин | 3,26 | 6,83* | 3,74 | 2,86±0,32 |
| %Ф 1 час | 60* | 89* | 74 | 77,4±3,9 |
| ФЧ 1 час | 4,01 | 5,92* | 5,50 | 4,47±0,98 |
| КФЧ1 | 0,79* | 0,83* | 0,73 | 0,72±0,08 |
| КФЧ2 | 0,47* | 0,75* | 0,51 | 0,59±0,07 |
| ФИИ | 7,09* | 4,84* | 1,42 | 2,01±0,51 |
| Спонтанный НСТ-тест | ||||
| %ПК | 28 | 60* | 34 | 36,5±4,4 |
| ЦПА | 0,52* | 0,97 | 0,88 | 0,97±0,09 |
| Стимулированный латексом НСТ-тест | ||||
| %ПК | 34* | 87* | 55 | 50,0±5,8 |
| ЦПА | 1,84* | 2,20* | 1,55 | 1,46±0,11 |
| ИСНСТ | 1,21* | 1,45 | 1,62 | 1,51±0,12 |
| * - достоверность различия с нормальными значениями Р<0,05. |
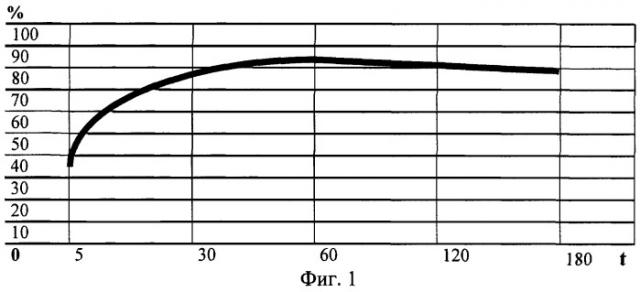
При исследовании зависимости показателей фагоцитоза от времени инкубации было установлено, что % Ф и ФЧ достоверно увеличиваются во времени, достигая максимальных значений к 1 часу. При дальнейшей инкубации показатели фагоцитарной активности не меняются. На чертеже представлена зависимость показателя %Ф нейтрофилов от времени инкубации в минутах. Очевидно, что длительная инкубация, предлагаемая в некоторых методиках, при исследовании поглотительной фазы фагоцитоза с применением в качестве тест-системы частиц латекса не рациональна. Инкубация в течение 1 часа является достаточной для достоверной оценки фагоцитарной активности нейтрофилов, одновременно сокращая временные затраты на проведение исследования.
Установлено, что для одновременного исследования поглотительной фазы в реакциях фагоцитоза и кислородзависимого метаболизма нейтрофилов периферической крови методом НСТ-теста рационально использовать неокрашенный латекс с диаметром частиц 1,5 мкм. Использование более крупных и/или окрашенных частиц латекса затрудняет визуальную оценку стимулированного НСТ-теста по принципу Kaplow. Более мелкие частицы латекса захватываются нейтрофилами в значительном количестве (20-30 частиц на одну клетку), что затрудняет подсчет с применением обычного светового микроскопа.
Установлено влияние формы дна пробирки - круглой и конической. В конических пробирках наблюдаются более высокие значения как показателей фагоцитоза, так и НСТ-теста. По-видимому, повышение показателей функциональной активности нейтрофилов обусловлено влиянием короткодистанционного взаимодействия. Это послужило критерием выбора лабораторной посуды, как было отмечено в примере 1, при проведении исследования используются пробирки конической формы.
В ходе проведенного исследования зависимости поглотительной способности и метаболической активности нейтрофилов от различных стабилизаторов крови установлено, что трилон Б (динатриевая соль ЭДТА), в отличие от гепарина подавляет фагоцитоз, снижает кислородзависимый метаболизм нейтрофилов.
Пример 3. Ребенок С. Филипп, 5 лет, поступил в 8 отделение МДКБ с диагнозом: правосторонняя полисегментарная пневмония. Исследование фагоцитарной и метаболической активности нейтрофилов периферической крови было проведено на 4-й день и на 22-й день заболевания по методике, описанной в примере 1 (табл.3).
| Таблица 3Показатели функциональной активности нейтрофилов периферической крови ребенка С. Филиппа, 5 лет | |||
| Показатель | 4-й день болезни | 22-й день болезни | Нормальные значения |
| ФАГОЦИТОЗ | |||
| %Ф 5 мин | 80* | 63 | 55,3±7,2 |
| ФЧ 5 мин | 2,7 | 2,31 | 2,57±0,61 |
| %Ф 30 мин | 97* | 79 | 76,8±5,9 |
| ФЧ 30 мин | 5,43* | 3,59 | 3,84±0,48 |
| %Ф 1 час | 98* | 89 | 88,5±5,5 |
| ФЧ 1 час | 4,84* | 5,99 | 6,69±0,81 |
| КФЧ1 | 0,51* | 0,64 | 0,68±0,06 |
| КФЧ2 | 0,56* | 0,51 | 0,41±0,05 |
| ФИИ | 5,27* | 3,31 | 2,94±0,55 |
| Спонтанны и НСТ-тест | |||
| %ПК | 73* | 30 | 26,1±3,3 |
| ЦПА | 1,73* | 0,62 | 0,62±0,03 |
| Стимулированный латексом НСТ-тест | |||
| %пк | 69* | 52 | 44,3±5,6 |
| ЦПА | 1,70* | 1,33 | 1,28±0,17 |
| ИСНСТ | 0,94* | 1,74 | 1,84±0,10 |
| * - достоверность различия с нормальными значениями Р<0,05. |
Настоящее изобретение не очевидно для специалиста, работающего в области клинической иммунологии и педиатрии. Определение поглотительной фазы фагоцитоза и метаболической активности нейтрофилов периферической крови в порядке одного исследования ранее не проводилось, сама постановка такого вопроса казалась абсурдной. Новизна изобретения заключается в возможности проведения в порядке одного исследования двух методов с использованием одной порции биосубстрата (кровь), идентичных реактивов и оборудования. Это позволяет оптимизировать метод, делает его доступным у детей раннего возраста и новорожденных, повышает его информативность. Объединение двух разных методик потребовало длительных исследований и кропотливого труда по подбору оптимальных условий, позволяющих одновременно с экономией времени, реактивов и меньшей инвазивностью, обеспечить высокую информативность исследования.
Заявленный способ имеет важное социальное и экономическое значение. Он позволяет экономить время и реактивы, не требует дорогостоящего оборудования, создает ранее неизвестную возможность обследования детских коллективов с выявлением неожиданных результатов, которые могут быть положены в основу диагностики различных патологических состояний. Применение оборудования стандартной клинической лаборатории приводит не только к снижению материальных затрат, но и открывает перспективу внедрения предложенного исследования для изучения параметров неспецифического иммунитета в амбулаторных условиях. Снижение трудовых затрат, экономия времени создает потенциальную возможность проведения исследования как скрининг-теста при обследовании различных детских коллективов, что неизвестно специалистам, работающим в области клинической иммунологии и педиатрии.
Способ исследования поглотительной и метаболической активности нейтрофилов периферической крови у детей методами фагоцитоза и НСТ-теста, отличающийся тем, что гепаринизированную венозную кровь разливают в пять конических пробирок по 0,1 мл, первые три из которых содержат по 0,1 мл суспензии неокрашенного латекса с размером частиц 1,5 мкм, 4-я - 0,1 мл среды 199 и 0,1 мл 0,1% водного раствора нитросинего тетразолия (НСТ), 5-я - 0,1 мл суспензии латекса и 0,1 мл 0,1% водного раствора НСТ, инкубируют в термостате при t 37°С: 1-ю пробирку - 5 мин, 2-ю - 30 мин, 3-ю - 1 ч, 4-ю и 5-ю - 40 мин; готовят из 0,2 мл инкубационной смеси мазки на стеклах, высушивают при t 37°С, фиксируют в пламени горелки, окрашивают 1% водным раствором метиленового синего, повторно высушивают и микроскопируют под иммерсией при увеличении 90х10, причем результаты исследования оценивают по поглотительной активности в реакциях фагоцитоза, определяя процент фагоцитирующих клеток, фагоцитарное число, фагоцитарный интегральный индекс и показатели скорости фагоцитоза, а реакцию НСТ-теста определяют путем подсчета процента формазан-позитивных клеток, вычисления цитохимического показателя активности и индекса стимуляции НСТ-теста.