Микробиологический способ удаления нитроароматического соединения, присутствующего в растворе или в почве
Иллюстрации
Показать всеИзобретение относится к биотехнологии, в частности к микробиологическому способу удаления нитроароматических соединений, присутствующих в растворе или в почве, и к штамму микроорганизма. Штамм Penicillium sp. (номер депонирования I-2081, CNCM Институт Пастера, Франция) для удаления, по меньшей мере, одного нитроароматического соединения, присутствующего в растворе или почве. Данный штамм используют в способе, который заключается в контактировании раствора или почвы с биомассой штамма Penicillium sp. (номер депонирования I-2081, CNCM Институт Пастера, Франция) в условиях, подходящих для минерализации нейроароматического соединения указанным штаммом Penicillium sp. I-2081 в присутствии источника углерода для указанного штамма. Изобретение позволяет минерализовать более 75% нитроароматического соединения. 2 н. и 11 з.п. ф-лы, 4 ил., 2 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к области микробиологии, в частности к микробиологическому способу удаления нитроароматических соединений, присутствующих в растворе или в почве, и к штамму микроорганизма, способного минерализовать указанные нитроароматические соединения.
Способ, в соответствии с настоящим изобретением, может быть применен для обработки любого раствора, такого как, например промышленные сточные воды, или почвы, загрязненной нитроароматическими соединениями, такими как например, динитротолуолом (DNT) или тринитротолуолом (TNT).
УРОВЕНЬ ТЕХНИКИ
В известном уровне техники были изучены способы деградации различных нитроароматических соединений. Эти способы, по существу, являются либо биологическими, либо химическими.
Например, в 1998 г. KALAFUT и др. исследовали трансформацию TNT с помощью трех аэробных бактерий: Pseudomonas aeruginosa, Bacillus sp. и Staphylococcus sp. Он показал, что эти три штамма трансформируют TNT, но не могут использовать его только в качестве источника углерода или азота. Результаты этого исследования приведены в документе KAFAULT Т. с соавт., “Biotransformation patterns of 2,4,6-trinitrotoluene by aerobic bacteria” [Примеры биотрансформации 2,4,6-тринитротолуола аэробными бактериями] Cur. Microbiol., 1998, 36, 45-54.
В 1998 г. BOOPATHY с соавт. разработали аэробно/бескислородный биореактор лабораторного типа для очистки почвы, загрязненной TNT. Способ можно осуществить в дозированной или в полунепрерывной системе. Дозированная обработка делает возможной трансформацию TNT, но накапливаются некоторые метаболиты. Однако в полунепрерывном режиме (регулярная смена почвы 10%), TNT (8 г/кг почвы) разлагается полностью. Получаемое после 14-дневного инкубационного периода равновесие свидетельствует, что было минерализовано лишь 23% TNT, ассимилировано 27% и 8% было адсорбировано в этой почве. Оставшееся количество относится к образованию метаболитов, таких как аминодинитротолуолы (4%), 2,4-диамино-6-нитротолуол (3%) и 2,3-бутандиол, полученные в результате раскрытия цикла (30%). Последующие однократная, двукратная и трехкратная добавки почвы в неделю не влияет на скорость деградации TNT. Кроме того, реактор делает возможным поддержание используемой популяции бактерий с 0,3% мелассы, представляющей собой лишь необходимый косубстрат. С использованием этого же способа возможно удалить другие загрязнители почвы, такие как гексагидро-1,3,5-тринитро-1,3,4,-триазин (RDX), октагидро-1,3,5,7-тетранитро-1,3,5,7-тетразоцин (НМХ), тринитротолуол и 2,4 динитротолуол. Эти результаты опубликованы BOOPATHY с соавт. “A laboratory study of the bioremediation of 2,4,6-trinitrotoluene-contaminated soil using aerobic/anoxic soil slurry reactor” [Лабораторное изучение биовосстановления почвы, загрязненной 2,4,6-тринитротолуолом с использованием аэробно/бескислородного реактора, обеззараживающего почву], Water Environment Research, 1998.
В 1998 г. VORBECK с соавт. изучал микробиологическое восстановление нитрогрупп TNT и микробиологическое гидрирование ароматического цикла.
Из-за дефицита электронов, вызванного присутствием нитрогрупп, притягиваемых электронами, начальная бактериальная трансформация TNT представляет собой нитровосстановление. Гидрирование ароматического цикла описано для меньшей части остатков пикриновой кислоты. Из аэробной среды были выделены две бактерии, обогащенные TNT лишь в качестве источника азота: штамм TNT-8 (грам-) и штамм TNT-32 (грам+). Они катализируют нитровосстановление TNT. Однако штаммы Rhodoccus erythropolis HL РМ-1 (растущий на пикриновой кислоте) и Mycobacterium sp. HL 4-NT-1 (растущий на 4-нитротолуоле) с ферментными системами, которые катализируют гидрирование TNT и, следовательно, добавляют гидридный ион в ароматический цикл. Образованный гидридный
комплекс Meisenheimer TNT (H-TNT), превращаемый затем в неподверженный химическому или биологическому разложению желтый метаболит, идентифицирован с помощью ЯМР. В этом случае восстановительная денитрация TNT не наблюдается. Минерализация TNT не изучалась. Эти результаты приведены у VORBECK С. с соавт. "Initial Reductive reactions in aerobic microbial metabolism of 2,4,6-trinitrotoluene" [Начальные восстановительные реакции 2,4,6-тринитротолуола в метаболизме аэробных бактерий], Appl. Environ. Microbiol., 1998, 64(1), 246-252.
Однако микроорганизмы, описанные в этих документах, не делают возможной полную или почти полную минерализацию TNT.
Привлечение способов химической деградации приводит к различным недостаткам, связанным с использованием химических реагентов. Эти недостатки, в частности, включают расходы на химические реагенты и загрязнение, вызываемое этими реагентами при обработке растворов и почв.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Цель настоящего изобретения состоит в создании способа, обеспечивающего возможность полного или почти полного удаления любого нитроароматического соединения из раствора или из почвы посредством минерализации нитроароматического соединения.
Таким образом, способ, в соответствии с настоящим изобретением, может быть использован для обработки раствора или почвы, содержащих один или несколько нежелательных (обусловленных загрязнением) нитроароматических соединений.
Способ в соответствии с настоящим изобретением представляет собой микробиологический метод удаления, по меньшей мере, одного нитроароматического соединения, присутствующего в растворе или в почве, причем разработанный способ отличается тем, что он включает контактирование обрабатываемого раствора или почвы с биомассой штамма Penicillium в подходящих условиях для минерализации нитроароматического соединения штаммом Penicillium.
Термины “нитроароматическое соединение” или “раствор нитроароматического соединения” относятся далее соответственно к “нитроароматическому соединению(ям)” и к “раствору(ам) нитроароматического соединения(ям)”.
В соответствии с настоящим изобретением раствор нитроароматического соединения может представлять собой лабораторный раствор, промышленные сточные воды или поверхностные воды, содержащие одно или несколько нитроароматических соединений, и в котором предпочтительно штамм Penicillium может метаболизировать нитроароматическое(ие) соединение(я). В соответствии с настоящим изобретением обрабатываемый раствор представляет собой предпочтительно водный раствор.
В соответствии с настоящим изобретением, по меньшей мере, одно нитроароматическое соединение может представлять собой соединение, включающее, по меньшей мере, один ароматический цикл, включающий, по меньшей мере, одну нитрогруппу и, соответствующей, по меньшей мере, одной функции, выбранной из группы, включающей -ОН, -СООН, галоген, -NH2, циклический или линейный моносахарид, линейный или разветвленный алкил, включающий 1-12 углеродных атомов, или арил, незамещенный или замещенный, с помощью, по меньшей мере, одной функции, выбранной в группе, включающей -ОН, -СООН, галоген, -NH2, -ОН.
Например, по меньшей мере, одно нитроароматическое соединение может представлять собой соединение, выбранное из нитротолуола, динитротолуола, тринитротолуола и их производных, или смесь этих соединений.
В соответствии с настоящим изобретением способ также включает, перед стадией контактирования, стадию нейтрализации рН раствора нитроароматического соединения или почвы, так чтобы контактирование с биомассой, например с штаммом Penicillium, осуществлялось предпочтительно при рН от 4,5 до 6,5.
В соответствии с настоящим изобретением контактирование можно осуществлять в присутствии глюкозы с концентрацией от 0,5 до 50 г глюкозы/л в растворе.
В соответствии с настоящим изобретением штамм Penicillium может представлять собой обычный штамм Penicillium. Например, штамм LCM Penicillium sp, зарегистрированный под номером 1-2081 в Национальной Коллекции Культур Микроорганизмов (CNCM), поддерживаемой Институтом Пастера во Франции, можно использовать для способа по настоящему изобретению. Настоящее изобретение относится также к штамму LCM Penicillium sp., зарегистрированному под номером 1-2081 в CNCM, поддерживаемому Институтом Пастера во Франции.
В соответствии с настоящим изобретением биомассу штамма Penicillium можно получить с помощью традиционных микробиологических методов получения биомассы, например, путем выращивания культуры Penicillium в культуральной среде, предпочтительно богатой, твердой или жидкой, предпочтительно жидкой, при подходящей температуре и рН, обеспечивающей возможность оптимального метаболизма штамма Penicillium.
Культуральная среда, которую можно использовать для получения биомассы, приведена далее в примерах.
Для получения достаточного количества биомассы с использованием жидкой культуральной среды биомассу можно, например, собирать фильтрованием или центрифугированием, предпочтительно фильтрованием.
Предпочтительно в способе, в соответствии с настоящим изобретением, используют свежую биомассу, что не исключает и какого-либо иного использования.
Для обеспечения возможности для минерализации нитроароматических соединений биомасса, контактирующая с раствором или почвой, должна присутствовать в достаточном количестве. Достаточное количество биомассы можно определить, например, в качестве функции определенного количества минерализуемых нитроароматических соединений или требуемой скорости минерализации. Количество биомассы может быть, например, определено с использованием образцов раствора нитроароматического соединения, смешиваемых с различными количествами биомассы, при пермиссивных температуре и рН, которые предпочтительно обеспечивают штамму Penicillium оптимальные условия метаболизма.
В соответствии с настоящим изобретением контактирование можно осуществлять путем смешивания биомассы и раствора нитроароматического соединения или путем пропускания раствора через биомассу, причем биомасса находится в, или на, субстрате так, обеспечивая прохождение раствора через нее, что делает возможной минерализацию нитроароматического соединения, содержащегося в растворе.
Если контактирование осуществляют путем смешивания биомассы с раствором нитроароматического соединения, контактирование можно осуществлять, например, в обычном реакторе, таком как ферментер, в частности, включающем, например, систему перемешивания или смешивания раствора и биомассы и систему нагревания. Такой вид контактирования пригоден, например, для полунепрерывной системы или периодической системы, для обработки раствора нитроароматического соединения с использованием способа по настоящему изобретению.
Если контактирование осуществляют путем пропускания раствора нитроароматического соединения через биомассу, биомасса находится в, или на поверхности субстрата. Действительно, культуральные формы Penicillium агрегируют или осаждаются, что облегчает их легкое отделение от раствора, например, фильтрованием.
В соответствии с настоящим изобретением субстрат может представлять собой, например, колонку или обычный реактор, обеспечивающие непрерывное пропускание раствора нитроароматического соединения через биомассу, без поддерживания биомассы. Биомассу можно удерживать, например, с помощью сетки, ткани или сетки из органических или неорганических волокон, которые позволяют пропускать раствор нитроароматического соединения, но не биомассу. Колонка или реактор включают систему для перемешивания раствора и биомассы и систему нагревания. Этот тип контактирования пригоден, например, для системы непрерывной обработки раствора нитроароматического соединения с использованием способа настоящего изобретения.
Если обрабатываемый раствор представляет собой поверхностные воды, контактирование можно осуществлять путем простого диспергирования биомассы и штамма Penicillium в поверхностных водах.
В соответствии с настоящим изобретением при помещении биомассы для контактирования с раствором нитроароматического соединения биомасса может быть смешана с раствором нитроароматического соединения с помощью обычной мешалки, например роторной мешалки, с подходящей скоростью перемешивания, например, от 50 до 250 об/мин. Такое перемешивание может поддерживаться в течение всего времени контактирования биомассы Penicillium и раствора нитроароматического соединения для оптимизации контактирования.
В соответствии с настоящим изобретением стадию контактирования осуществляют с помощью штамма Penicillium в подходящих условиях для минерализации нитроароматического соединения(ий). Обычно предварительно оптимизируют условия роста Penicillium с образцами раствора нитроароматического соединения при различных температурах и других параметрах, например, рН, поддерживаемых постоянными, что делает возможным определения пермиссивной (подходящей) температуры. Следует отметить, что Penicillium может развиваться даже при температуре около 4°С. Таким образом, одним из преимуществ способа по настоящему изобретению является возможность его использования в широком диапазоне температур.
Пермиссивная температура может быть, например, около 10-35°С, предпочтительно 15-35°С. Авторы изобретения отмечают хороший уровень минерализации при температуре от 20°С до 30°С, особенно при температуре от 25°С до 28°С. Преимущественно температуру поддерживают практически постоянной в течение всего времени контактирования для оптимизации минерализации.
В соответствии с настоящим изобретением стадию контактирования осуществляют при пермиссивном рН для метаболизма штамма Penicillium. Для определения пермиссивного рН проводят тесты, аналогичные вышеупомянутым, но при постоянной температуре и при различных значениях рН. Как правило, значение рН составляет от 5,0 до 7,5, предпочтительно от 5,0 до 6,0 и более предпочтительно около 5,5.
Следует отметить, что рН раствора может изменяться во время осуществления способа настоящего изобретения, поскольку нитрогруппы нитроароматического соединения могут восстанавливаться во время минерализации нитроароматического соединения. Такие изменения в значении рН не влияют на способ настоящего изобретения.
Однако в соответствии с одним из вариантов настоящего изобретения значение рН раствора можно поддерживать практически постоянным в течение стадии контактирования с помощью обычных буферов, таких как фосфатный или цитратный буфер. Буфер можно добавить к почве или к раствору нитроароматического соединения или в течение стадии контактирования, в соответствии со способом настоящего изобретения.
В соответствии с настоящим изобретением контактирование можно осуществлять в присутствии источника углерода для штамма Penicillium. Источник углерода является индуктором метаболизма у Penicillium и способствует минерализации нитроароматического соединения микроорганизмом. Источник углерода можно добавлять в достаточном количестве для оптимизации метаболизма у Penicillium, и в частности, минерализации нитроароматического соединения. Источник углерода можно выбирать, например, из группы, включающей глюкозу, полимеры глюкозы, мелассу, кукурузные гидролизаты и т.п. Полимеры глюкозы включают, например, крахмал. Источник углерода можно добавлять к обрабатываемому в реакторе раствору, в случае поверхностных вод, или почвы, непосредственно в воду или почву.
В непрерывной системе реактор также может включать систему снабжения реактора источником углерода.
В соответствии с настоящим изобретением при использовании глюкозы в качестве источника углерода и раствора нитроароматического соединения, представляющего собой насыщенный раствор указанного соединения, например насыщенный раствор TNT, DNT, производное указанного соединения или смесь указанных соединений или их производных, концентрация глюкозы в течение контактирования может составлять, например, от 2 до 25 г/л, предпочтительно 15 г/л.
Оптимальную концентрацию источника углерода можно определить, например, с помощью тестов способа, в соответствии с настоящим изобретением, на образцах раствора нитроароматического соединения, таких как упомянутые выше.
В соответствии с настоящим изобретением подходящие условия могут также включать различные добавки, регулирующие или индуцирующие рост Penicillium, такие как магний сернокислый, натрий азотнокислый, калий хлористый, соединения сернокислого железа, и т.п., микроэлементы, и, в качестве общего правила, любую добавку, которая благоприятствует росту Penicillium.
В соответствии со способом настоящего изобретения контактирование предпочтительно осуществляют так, чтобы обеспечить оптимальный контакт между Penicillium и обрабатываемым раствором, и включает перемешивание, осуществляемое в реакторе.
Избыток биомассы Penicillium может вызвать образование агрегатов, которые могут оказать неблагоприятное воздействие на оптимальное контактирование между микроорганизмом и обрабатываемым раствором.
В соответствии с настоящим изобретением для контактирования с раствором нитроароматического соединения предпочтительно используют от 50 до 800 г свежей биомассы Penicillium на литр раствора, более предпочтительно, например, приблизительно 150 г/л.
Если способ настоящего изобретения относится к способу удаления нитроароматического соединения, присутствующего в почве, подходящие условия для его минерализации штаммом Penicillium, по меньшей мере, нитроароматического соединения, присутствующего в почве, представляют собой, разумеется, условия, благоприятствующие для метаболизма штамма Penicillium, который минерализует нитроароматическое соединение, которое удаляется. Эти условия представляют собой условия, в частности, описанные выше.
Важно также отметить, что штамм Penicillium лучше растет во влажной среде.
При обработке почвы способ по настоящему изобретению предпочтительно может включать перед стадией контактирования, во время нее или после нее стадии, включающие добавление (заливки) к почве водного раствора для образования раствора нитроароматического соединения.
После добавления воды может быть применен способ минерализации нитроароматического соединения в растворе, в соответствии с настоящим изобретением, описанный выше.
Специалистам в области очевидно, что увлажнение почвы может быть естественным, в частности дождевой водой. В этом случае, стадия, включающая добавление к почве водного раствора, будет осуществляться естественным образом дождевой водой.
В соответствии с настоящим изобретением контактирование почвы, или раствор, полученный в результате добавления водного раствора к почве, можно осуществлять путем диспергирования штамма Penicillium в обрабатываемой почве, предпочтительно биомассой штамма Penicillium, до или после добавления воды к почве. Естественно, к почве можно добавить водный раствор, содержащий биомассу Penicillium.
Источник углерода, буфер для поддержания рН и добавку, описанную выше, можно диспергировать на почве до или во время контактирования со штаммом Penicillium.
Способ по настоящему изобретению обладает определенными преимуществами по сравнению со способами, известными в области техники. Действительно, авторы настоящего изобретения показали, в частности, что штамм Penicillium делает возможным легко минерализовать более 75% нитроароматического соединения, такого как соединения, описанные выше, например, TNT, DNT и их производные, в то время как минерализация с помощью микробиологических методов, ранее известных в области техники, редко превышала 10%. Минерализация по способу настоящего изобретения обеспечивает полную или почти полную деградацию, или биодеградацию нитроароматического соединения.
Кроме того, неожиданно оказалось, что способ настоящего изобретения позволяет обрабатывать любой раствор с вышеуказанными результатами, даже если он насыщен нитроароматическим соединением, т.е. содержит приблизительно 100-120 мг/л нитроароматического соединения, например TNT, DNT и их производных. Эта концентрация очень высокая и поначалу ингибирует рост любого микроорганизма, используемого для удаления этих соединений.
Кроме того, способ настоящего изобретения не является загрязняющим способом, поскольку при его использовании образуется мало или почти не образуется промежуточных метаболитов, он не требует использования загрязняющих химических реагентов, и в нем используются безвредные микроорганизмы.
Кроме этого, способ настоящего изобретения оказывается весьма экономичным, поскольку в нем используется недорогостоящий, коммерчески доступный и легко растущий, даже при температурах около 4°С бактериальный штамм.
Кроме того, Penicillium склонен образовывать осадок, который можно очень легко отделить от любого раствора, например, путем простого фильтрования, что облегчает обработку растворов, таких как промышленные сточные воды, например, в непрерывном режиме.
Ряд других преимуществ и характеристик настоящего изобретения очевиден рядовым специалистам в области техники при ознакомлении с нижеследующими иллюстративными, неограничивающими, примерами, со ссылками на прилагаемые чертежи.
ПЕРЕЧЕНЬ ЧЕРТЕЖЕЙ
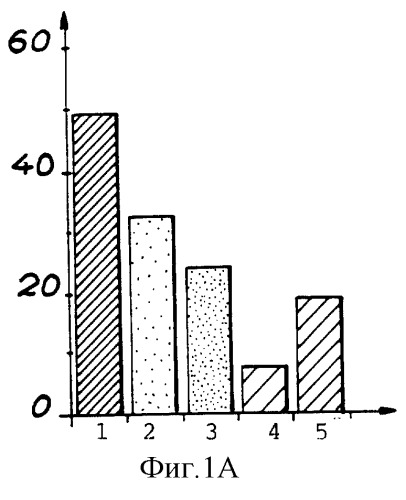
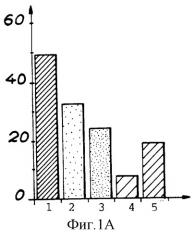
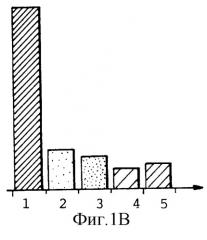
Фиг.1А и 1В показывают влияние глюкозы на минерализацию TNT согласно способу настоящего изобретения в отсутствие глюкозы (1А) и в присутствии глюкозы (1В);
где
1 - начальная радиоактивность в растворе
2 - общая радиоактивность
3 - общая радиоактивность в присутствии НСl
4 - радиоактивность супернатанта
5 - радиоактивность биомассы
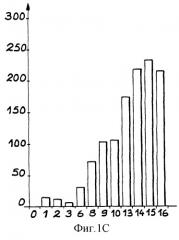
- фиг.1С и ID графически показывают кинетику образования нитритов в присутствии (ID) или в отсутствие (1С) глюкозы;
- фиг.2 графически показывает влияние концентрации TNT в растворе при минерализации по способу настоящего изобретения как функцию от числа дней;
- фиг.3 графически показывает деградацию TNT в растворе в соответствии со способом настоящего изобретения;
- фиг.4 показывает диаграмму, иллюстрирующую идентификацию экстрагируемых метаболитов, образовавшихся во время минерализации TNT с использованием способа по настоящему изобретению, с помощью тонкослойной хроматографии на силикагеле путем сканирования радиоактивности пластин.
Сведения, подтверждающие возможность осуществления изобретения
ПРИМЕРЫ
Пример 1: получение биомассы Penicillium
Культуральная среда для получения биомассы включает 0,5 г/л KH2PO4, 0,1 г/л К2НРO4, 30 г/л глюкозы, 10 г/л кукурузного гидролизата (сорт: Кукуруза Steep, производимая by Societe des Produits du Mais), 0,5 г/л MgSO4, 2 г/л NaNO3, 0,5 г/л КСl и 0,02 г/л FeSO4.
Используемый штамм Penicillium, названный авторами изобретения штамм LCM Penicillium sp., был зарегистрирован под номером 1-2081 в CNCM (Институт Пастера, Франция).
Культивирование проводили в Эрленмейеровских колбах в течение трех дней при температуре 27°С при перемешивании со скоростью 250 об/мин.
Биомассу отделяли фильтрованием.
Пример 2: удаление нитроароматических соединений, присутствующих в растворе в соответствии со способом настоящего изобретения
Биодеградация нитроароматического соединения и условия анализа.
В этом примере использовали следующие нитроароматические соединения: тринитротолуол (TNT), 2,4-динитротолуол и 2,6-динитротолуол.
Раствор TNT, 62 г/л, получен от Poudres et Explosifs (Vert-Le-Petit, Франция).
TNT, меченный С14, получен от Chemsyn Science Laboratories, США, и обладал нижеследующими характеристиками: 21,5 мКи/ммоль-100 мкКи/мл в воде.
2,4-динитротолуол получен от Rhone-Poulenc (Франция), а 2,6-динитротолуол поставлен Aldrich (каталог Aldrich).
Нитроароматические соединения подвергали биодеградации с помощью свежей биомассы, полученной согласно примеру 1, с использованием настольной роторной мешалки при 250 об/мин в термостатированной комнате при 27°С.
Нитроароматическое соединение добавляли при соотношении 0,05 или 0,1 г/л на 7,5 г свежей биомассы, ресуспендированной в 50 мл 1,5%-ной глюкозы на дистиллированной воде (раствор 15 г глюкозы/л раствора), то есть при концентрации 150 г свежей биомассы на 1 литр раствора.
Для изучения процесса минерализации нитроароматического соединения эксперименты осуществляли в присутствии следов радиоактивной метки (50 мкл).
Деградацию радиоактивного или нерадиоактивного TNT или 2,4- или 2,6-динитротолуола анализировали с помощью высокоэффективной жидкостной хроматографии высокого давления (HPLC) при λ=254 нм на колонке из пористого графита марки Hypercab, поставляемой фирмой Shandon, Франция, с элюцией раствором, содержащим 80% ацетонитрила, 0,05% трифторуксусной кислоты и водой.
Используемая хроматографическая система состоит из инжектора марки Waters 717, насоса для воды марки Waters 600Е (скорость потока 1 мл/мин), UV-детектора марки Waters 486, работающего при 220 нм, поставляемого фирмой WATER, Франция, и дозиметра радиоактивного детектора радиоактивности Монитор LB 506 С-1, поставляемого фирмой Berthhold, Франция.
Суммарную радиоактивность определяли с использованием сцинтилляционного счетчика марки LKB 1214 Rackbeta фирмы Wallac.
Концентрацию нитритов определяли по методу Griess. В 96-луночных планшетах Elisa смешивали 50 мкл образца для анализа и 50 мкл реактива Griess (5% сульфаниламид в 2 М НСl+0,5% N-1-нафтилэтилендиамина в 2 М НСl, проценты объемные).
Через 20 минут при комнатной температуре измеряли поглощение при 540 нм с помощью считывающего устройства для планшет фирмы Dynatech.
Нитриты и нитраты анализировали также с помощью HPLC на Hepersyl-колонке марки ODS, поставляемой фирмой Shandon: 5 мм, 4,6×250 мм для парных ионов: 10% 5 мМ MeOH/Pic A (Waters), при 210 нм. Время задержки составляет 4,9 минут для нитритов и 6,0 минут для нитратов. Концентрации определяли с помощью калибровочной кривой от 0 до 200 мкМ.
TNT анализировали с помощью тонкослойной хроматографии (TLC) на силикагеле этилацетате (Rf=0,87). Радиоактивность хроматограмм определяли с использованием автоматического линейного тонкослойного анализатора марки Tracemaster 20 фирмы Berthold.
Определение продуктов биодеградации
Инкубационную среду центрифугировали 15 минут при 10000 об/мин, при 4°С и затем трижды экстрагировали этилацетатом. Органическую фазу высушивали над MgSO4. После фильтрования растворитель удаляли на роторном испарителе. Полупрепаративную очистку осуществляли на силикагелевой пластинке с силикагелевой подложкой. Силикагелевые фракции, содержащие продукты бидеградации, переносили в этилацетат. Силикагель удаляли фильтрованием, фильтрат выпаривали и обезвоживали. Полученные фракции анализировали.
1- Влияние глюкозы на минерализацию TNT по способу настоящего изобретения
Тестирование проводили в растворе, содержащем 100 мг/л TNT, 150 г/л свежей биомассы и различные концентрации глюкозы. Для каждого теста через 5 дней измеряли радиоактивность, результаты приведены на фиг.1А и 1В. На оси Y показана радиоактивность в растворе после 16 дней счета в виде числа импульсов в минуту (cpm×103)/мл.
Как следует из фиг.1А и 1В, глюкоза благоприятствует минерализации TNT: 46,7% минерализации в отсутствие глюкозы по сравнению с 66,7% в присутствии глюкозы через 16 дней инкубации в приведенных выше условиях. Начальная радиоактивность TNT ассимилируется (усваивается) намного больше в среде не обогащенной источником углерода. Следовательно, глюкоза благоприятствует минерализации TNT.
В этих экспериментах также определяли концентрацию нитритов. Присутствие глюкозы в инкубационной среде полностью ингибирует образование NO
| - |
| 2 |
Поэтому очевидно, что денитрификация, происходящая в окисляющих условиях, т.е. в отсутствие восстанавливающих эквивалентов, т.е. глюкозы, не обязательно благоприятствует минерализации, происходящей в восстанавливающих условиях, т.е. присутствие глюкозы.
Кинетику образования нитритов в присутствии или в отсутствие глюкозы проводили в растворах, приведенных выше.
Результаты этих измерений приведены на фиг.1С и 1D: на фиг.1С показана кинетика образования азота (в мкм) в растворе в отсутствие глюкозы как функция времени в днях, а на фиг.1D показана кинетика образования нитритов (в мкм) в растворе в присутствии глюкозы как функция времени в днях.
Эти результаты показывают, что денитрификация, происходящая в окисляющих условиях, т.е. в отсутствие глюкозы, не обязательно благоприятствует минерализации, происходящей в восстанавливающих условиях, т.е. в присутствии глюкозы.
На пятый день инкубации минерализация TNT штаммом LCM Penicillium. sp. стабилизируется. Стабилизация происходит внезапно с одновременным ухудшением биомассы. Дефицит питательных веществ, токсичность TNT или его метаболитов для микроорганизма или снижение жизнеспособности штамма, может, вероятно, вызывать снижение каталитической активности, чем и объясняется наблюдаемое ингибирование.
2- Влияние начальной концентрации TNT на минерализацию TNT по способу настоящего изобретения
Максимальная растворимость TNT в воде при комнатной температуре составляет 100 мг/л. Для определения не является ли эта концентрация слишком высокой для полной минерализации TNT или его производных, - 2,4- и 2,6-DNT, проводили сравнение процента минерализации при концентрации TNT 50 мг/л и 100 мг/л. Инкубацию проводили при 27°С с перемешиванием при 150 об/мин в присутствии 150 г/л свежей биомассы Penicillium и 15 г/л глюкозы.
Результаты анализа приведены в таблице I.
| ТАБЛИЦА I | |||||||
| Время, дни | 0 | 1 | 2 | 3 | 4 | 7 | |
| TNT, 50 мг/л | cpm* 103/мл | 48 | 41 | 44 | 19 | 14 | 15 |
| TNT, 100 мг/л | cpm* 103/мл | 46 | 47 | 44 | 29 | 16 | 15 |
| cpm*=число импульсов в минуту - определяется в результате измерения радиоактивности |
Графическая интерпретация этих результатов приведена на фиг.2, где на оси Х отложено время в днях, а на оси Y - радиоактивность в виде числа импульсов в минуту (cpm)/×103/мл. Эти результаты показывают, что через 7 дней инкубации процент минерализации TNT с помощью Penicillium при концентрации TNT 50 мг/л (кривая 2А) и при концентрации TNT 100 мг/л (кривая 2В) является одинаковым и стабилизируется приблизительно на уровне 70%.
3- Минерализация TNT
Тестирование проводили, как указано выше, с раствором, включающим 100 мг/мл TNT в присутствии радиоактивно меченного TNT по всем углеродным атомам цикла. Этот раствор также включал 150 г/л свежей биомассы Penicillium, как указано выше в примере 1, и 15 г/л глюкозы. Контактирование проводили при температуре 27°С с перемешиванием при 150 об/мин.
Результаты анализа приведены в таблице II.
| ТАБЛИЦА II | ||||||||
| Время, дни | 0 | 1 | 2 | 4 | 6 | 7 | 8 | 10 |
| 100 мг/л TNT (cpm×103) | 52 | 21 | 19 | 7 | 8 | 9 | 10 | 10 |
Графическая интерпретация этих результатов приведена на фиг.3, где на оси Х отложено время в днях, а на оси Y - радиоактивность в числе импульсов в минуту (cpm).
Результаты свидетельствуют о 79% минерализации TNT за 10 дней.
4 - Идентификация экстрагируемых метаболитов, образующихся во время минерализации TNT по способу настоящего изобретения
С помощью HPLC было обнаружено полное исчезновение TNT за 24 часа без исчезновения известных метаболитов, таких как динитротолуол, аминодинитротолуол, диаминонитротолуол, образующихся из TNT при использовании раствора TNT 100 мг/л. Это наблюдение было подтверждено с помощью тонкослойной хроматографии на силикагеле в сочетании со сканированием радиоактивности пластин при анализе экстрактов (этилацетат), полученных из инкубационной среды. Результаты анализа приведены на фиг.4. Действительно, в используемом растворителе остаточная радиоактивность через 24 часа полностью ассоциирована с осадком. Она составляет лишь 25-30% от первоначальной радиоактивности и не связана с 2,4- или 2,6-DNT, Rf которых в данной системе составляет приблизительно 0,8.
Высокий процент минерализации TNT, превышающий 70%, приводит, соответственно, к низкой остаточной радиоактивности супернатантов, что не позволяет определить конкретные образовавшиеся метаболиты. Для выявления и характеризации остаточных метаболитов заявители провели препаративные эксперименты с 1 л TNT при концентрации 100 мг/л. По окончании реакции и даже несмотря на проведение нескольких экстрагирований, общий выход составил лишь около 20%. Заявители выделили основной продукт (70%) с мол. массой MW 182. Этот продукт, который не удалось обнаружить на радиоактивной пластинке (Rf=0,4), присутствует в концентрации, которая оказалась слишком низкой для обнаружения с помощью сканера. Хотя мол. масса у выделенного продукта такая же, как и у DNT, выделенный продукт не является DNT, поскольку значения их Rf различаются.
5- Заключение
Таким образом, нитчатый гриб Penicillium sp. штамм LCM обеспечивает полную деградацию TNT и его производных, таких как 2,4- и 2,6-DNT, при их концентрации 100 мг/л в растворе менее чем за 24 часа, что соответствует 70%-ной минерализации в течение 5 дней. Столь высокий процент минерализации TNT и его производных, таких как 2,4- и 2,6-DNT, при 100 мг/л концентрации ранее не был описан в научной литературе. Изучение влияния различных факторов на биодеградацию показало, что отсутствие глюкозы несколько снижает процент минерализации TNT, но способствует денитрификации TNT, a также, что температура и рН влияют на минерализацию TNT и его производных, таких как 2,4- и 2,6-DNT.
Пример 3: удаление нитроароматических соединений, присутствующих в почве, в соответствии со способом настоящего изобретения.
К почве, содержащей TNT, добавляли водный раствор, содержащий 50 мМ фосфатного буфера и крахмал в качестве источника углерода.
Биомассу Penicillium получали, как в примере 1, а затем вносили в почву.
Альтернативно, раствор для добавления к образцу почвы может содержать 50 мМ фосфатного буфера, крахмал и биомассу.
1. Микробиологический способ удаления, по меньшей мере, одного нитроароматического соединения, присутствующего в растворе или в почве, включающий контактирование раствора или почвы с биомассой штамма Penicillium sp. (номер депонирования 1-2081, CNCM, Институт Пастера, Франция) в условиях, подходящих для минерализации нитроароматического соединения указанным штаммом Penicillium sp. в присутствии источника углерода для указанного штамма.
2. Способ по п.1, дополнительно включающий добавление к почве водного раствора для образования раствора нитроароматического соединения.
3. Способ по п.1, в котором контактирование осуществляется либо путем смешивания биомассы и раствора нитроароматического соединения, либо путем пропускания раствора через биомассу, причем биомасса задерживается в или на субстрате, так, чтобы раствор был способен проходить через биомассу, обеспечивая возможность минерализации содержащегося нитроароматического соединения.
4. Способ по п.1 или 3, в котором раствор нитроароматического соединения представляет собой водный раствор.
5. Способ по п.4, в котором раствор нитроароматического соединения представляет собой лабораторный раствор, промышленные сточные воды или поверхностные воды.
6. Способ по п.5, в котором контактирование осуществляется при пермиссивной температуре для метаболизма указанного штамма Penicillium sp.
7. Способ по п.1, в котором источник углерода выбирают из группы, состоящей из глюкозы, полимеров глюкозы, мелассы и гидролизатов кукурузы.
8. Способ по п.7, в котором контактирование осуществляется в присутствии глюкозы при концентрации от 0,5 до 50 г/л раствора.
9. Способ по п.8, в котором контактирование указанного штамма Penicillium sp. с раствором нитроароматического соединения осуществляется при концентрации от 50 до 800 г свежей биомассы на 1 л раствора нитроароматического соединения.
10. Способ по п.9, в котором нитроароматическое соединение представляет собой соединение, включающее, по меньшей мере, один ароматический цикл, включающий, по меньшей мере, одну нитрогруппу и, по меньшей мере, одну функциональную группу, выбираемую из группы, состоящей из -ОН, -СООН, галогена, -NH2, циклического или линейного моносахарида, линейного или разветвленного алкила, включающего 1-12 углеродных атомов, или арила, незамещенного или замещенного, по меньшей мере, одной функциональной группой, выбираемой из группы, состоящей из -ОН, -СООН, галогена, -NH2, или -ОН.
11. Способ по п.9, в котором нитроароматическое соединение представляет собой соединение, выбираемое из нитротолуола, динитротолуола, тринитротолуола и их производных или из смеси этих соединений.
12. Способ по п.11, в котором перед контактированием с биомассой указанного штамма Penicillium sp. pH раствора и