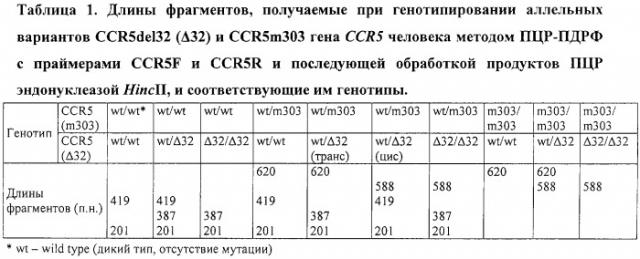
Способ одновременного определения мутаций ccr5de132 и ccr5m303 в гене ccr5 человека, обуславливающих генетическую устойчивость обследуемых к инфицированию вирусом иммунодефицита человека первого типа (вич1)
Иллюстрации
Показать всеИзобретение относится к области генетической инженерии и медицинской генетики. Предложен способ определения генетической устойчивости обследуемых к инфицированию вирусом иммунодефицита человека первого типа (ВИЧ1). Способ предусматривает выделение ДНК, амплификацию гена CCR5 путем проведения полимеразной цепной реакции с использованием двух праймеров, комплементарных двум участкам гена CCR5. Далее проводят рестрикцию продуктов амплификации с помощью эндонуклеазы HincII (HindII) и определение размера полученных амплифицированных фрагментов и выявление делеционной и однонуклеотидной мутаций по полученным результатам. Способ позволяет одновременно проводить определение наличия двух мутаций в гене CCR5 человека, в случае присутствия обеих мутаций у индивидуума в гетерозиготном состоянии, позволяет отличить трансположение от цис-положения. Способ может быть использован в медицине для диагностики наследственной генетической устойчивости индивидуума к инфицированию ВИЧ1. 2 ил., 1 табл.
Реферат
Изобретение относится к области биотехнологии, генетической инженерии и медицинской генетики и может найти применение в медицине при диагностике наследственной генетической устойчивости индивидуума к инфицированию вирусом иммунодефицита человека первого типа (ВИЧ1) и быстрому прогрессированию к синдрому приобретенного иммунодефицита (СПИД).
Известно, что некоторые люди, несмотря на многочисленные незащищенные сексуальные контакты с ВИЧ-инфицированными, остаются незараженными (Rowland-Jones et al., 1995). ВИЧ1 заражает клетки, имеющие на поверхности СD4-рецептор. Наличия CD4 для инфицирования недостаточно и для проникновения через клеточную мембрану в цитоплазму и заражения необходимо взаимодействие вируса с дополнительными корецепторами. В опытах in vitro было показано, что ВИЧ может использовать лишь некоторые из хемокиновых рецепторов для заражения. Показано, что природная устойчивость к ВИЧ-инфекции в значительной мере связана с
функциональным состоянием хемокинового рецептора CCR5 (корецептора ВИЧ1). CCR5 представлен преимущественно на поверхности активированных моноцитов/макрофагов, а также Т-лимфоцитов памяти (CD26High, CD45RA-, CD45R0+, CD69-, CD95+), которые инфицируются М-тропным (macrophage-tropic HIV-1 strains) вариантом ВИЧ, передающимся при половых контактах и доминирующих преимущественно на ранних стадиях инфекции (Berger et al., 1999).
Одним из факторов естественной резистентности к инфицированию М-тропным вариантом ВИЧ1 являются мутации CCR5del32 и CCR5m303 в гене CCR5 человека. Мутация CCR5del32 представляет собой делецию в 32 пары нуклеотидов (мутация CCR5del32) в позиции 794-825 открытой рамки считывания гена CCR5 (chemokine (C-C motif) receptor 5) (Dean et al., 1996; Liu et al., 1996; Samson et al., 1996). Мутация CCR5m303 является однонуклеотидной заменой (трансверсия) тимина на аденин в позиции 303 открытой рамки считывания гена CCR5, которая приводит к появлению стоп-кодона и прекращению синтеза белка (Quillent et al., 1998; Ometto et al., 1999; Voevodin et al., 1999; Beretta et al., 2000; Wang et al., 2003).
При наличии любой из этих мутаций ВИЧ1 не может использовать рецептор CCR5 в качестве корецептора для проникновения в клетку, поскольку транслируется функционально неактивный рецептор. Случаи гомозиготного состояния мутаций CCR5del32 и CCR5m303, а также присутствие обеих мутаций у одного индивидуума в гетерозиготном состоянии в транс-положении обеспечивают защиту от инфицирования ВИЧ1 при половом пути передачи. Гетерозиготные по CCR5del32 индивидуумы не защищены от инфицирования ВИЧ, однако, по некоторым данным в случае заражения у таких пациентов ВИЧ-инфекция прогрессирует медленнее по сравнению с индивидуумами, не несущими мутаций CCR5del32 (Гришаев и др., 1999).
Информация о присутствие мутаций CCR5del32 и CCR5m303 в гене CCR5 человека позволяет прогнозировать течение заболевания и возможность заражения вирусом иммунодефицита человека в группах риска.
Известен способ определения генетической устойчивости обследуемых к инфицированию вирусом иммунодефицита человека первого типа путем выявления делеционной мутации в гене CCR5, включающего выделение ДНК обследуемого, амплификацию фрагмента гена CCR5 путем проведения полимеразной цепной реакции с использованием двух праймеров, комплементарным двум участкам гена CCR5, расположенным соответственно с 5' и 3' стороны выявляемых делеционной мутаций, определения длины полученных амплифицированных фрагментов и выявления делеционной мутации по полученным результатам определения (Сломинский и др., 1999).
Однако в данном известном способе проводится анализ только одной мутации CCR5del32, тогда как в новом способе одновременно определяются две мутации (CCR5del32 и CCR5m303), которые независимо друг от друга влияют на генетическую устойчивость обследуемых к инфицированию вирусом иммунодефицита человека первого типа.
Наиболее близким к новому способу является способ определения присутствия мутаций CCR5del32 и CCR5m303 в гене CCR5 человека (Beretta et al., 2000).
Изобретение позволяет выявлять присутствие мутаций CCR5del32 и CCR5m303 в гене CCR5 человека на уровне ДНК методом ПЦР и ПЦР-ПДРФ (полиморфизм длин рестрикционных фрагментов) соответственно, а также мутации CCR5m303 на белковом уровне.
Однако для выявления мутаций CCR5del32 и CCR5m303 в гене CCR5 человека использовали две различные пары праймеров, что усложняет процесс генотипирования. Применение двух пар праймеров не позволяет отличить транс-положение от цис-положения в случае присутствия обеих мутаций у одного индивидуума в гетерозиготном состоянии, что является одним из протективных вариантов генотипа.
Техническим результатом, получаемым при реализации настоящего изобретения, является расширение возможностей диагностирования генетической устойчивости обследуемых к инфицированию вирусом иммунодефицита человека первого типа за счет возможности одновременно определять мутации CCR5del32 и CCR5m303 в гене CCR5 человека, а в случае присутствия обеих мутаций у одного индивидуума в гетерозиготном состоянии оценивать взаимное расположение анализируемых аллелей на материнской и отцовской хромосомах.
Достигается это тем, что используется способ определения генетической устойчивости обследуемых к инфицированию вирусом иммунодефицита человека первого типа (ВИЧ1) путем одновременного выявления делеционной и однонуклеотидной мутаций в гене корецептора ВИЧ1 CCR5 человека, включающий выделение ДНК обследуемого, амплификацию фрагмента гена CCR5 путем проведения полимеразной цепной реакции с использованием двух праймеров, комплементарным двум участкам гена CCR5, расположенным, соответственно, с 5' и 3' стороны выявляемых делеционной и однонуклеотидной мутаций, последующую рестрикцию продуктов амплификации с помощью рестрицирующей эндонуклеазой HincII (HindII), определение размера полученных амплифицированных фрагментов и выявление делеционной и однонуклеотидной мутаций по полученным результатам определения.
Отличительной особенностью является то, что используются праймеры:
CCR5F: 5'-CGCTCTACTCACTGGTGTTCA-3'
CCR5R: 5'-CATGATGGTGAAGATAAGCCTCAC-3'
В конкретном исполнении проводят предварительную термическую обработку ДНК, амплификацию проводят путем проведения 25-40 циклов ПЦР, причем каждый следующий цикл состоит из последовательной термической обработки в течение 25-45 сек при температуре 92-96°С, 56-60°С и 72-76°С, после чего цикл повторяется. Продукты амплификации подвергаются рестрикции с помощью рестрицирующей эндонуклеазой HincII (HindII). Длину рестрикционных фрагментов определяют в 4-8% полиакриламидном геле с последующим окрашиванием ДНК в геле бромистым этидием.
В отличие от прототипа (Beretta et al., 2000) новый способ позволяет одновременно определять наличие двух мутаций (CCR5del32 и CCR5m303) в гене CCR5 человека и в случае присутствия обеих мутаций у одного индивидуума в гетерозиготном состоянии тест-система позволяет отличить транс-положение (когда мутации находятся на разных копиях гена) от цис-положения (когда обе мутации расположены на одной копии, а вторая копия нормальная).
На фиг.1 представлен фрагмент гена CCR5, включающий мутации CCR5del32 и CCR5m303 и локализации новых предложенных в данном способе праймеров.
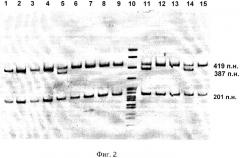
На фиг.2 представлены результаты выявления у обследуемых лиц мутаций CCR5del32 и CCR5m303 в гене CCR5.
Ниже приведены примеры реализации нового способа.
Пример 1
Способ определения по п.1 основан на применении метода ПЦР с последующим рестрикционным анализом продуктов амплификации (ПЦР-ПДРФ). Праймеры подбирали с помощью компьютерных программ “Oligo” и “Primer v5.0”. Амплификацию проводят в объеме 10 мкл. Состав реакционной смеси: 1 мкл 10-кратного буфера для полимеразы (10-кратный буфер: 670 мМ Трис-HCl, 160 мМ (NH4)2SO4, 0.1% Tween 20), прямой и обратный праймеры (по 50 нг каждого), 0.2 мМ каждого дезоксинуклеозидтрифосфата (dNTP), 2.0 мМ MgCl2, 1 ед. активности Taq-полимеразы, 20-100 нг анализируемой геномной ДНК. Амплификацию проводят в программируемом термоциклере. Условия амплификации: денатурация 95°С/40сек, отжиг 58°С/30 сек, синтез 74°С/40 сек, количество циклов - 35. ПЦР начинали с денатурации (95°С/4 мин) и заканчивали на стадии синтеза (74°С/7 мин). Размер амплифицируемого фрагмента составляет 620 п.н., а при наличие делеции - 588 п.н.
Рестрикционный анализ проводят в объеме 12 мкл. Состав реакционной смеси: 1 мкл 10-кратного буфера для рестрицирующей эндонуклеазы Y+/Tango™ (33 мМ Трис-ацетат (рН 7.9 при 37°С), 10 мМ ацетат магния, 66 мМ ацетат калия, 0.1 мг/мл БСА), 2 ед. активности рестрицирующей эндонуклеазы HincII (HindII), весь объем (10 мкл) ПЦР продукта. Условия рестрикции: 37°С/2 ч.
Разделение продуктов рестрикции проводят методом электрофоретического разделения фрагментов ДНК в 6%-ном полиакриламидном геле (ПААГ) при напряжении 10-12 В/см. Детекцию продуктов рестрикции проводят в ультрафиолетовом свете после окрашивания этидий бромидом. Длины продуктов рестрикции представлены в табл.1.
Пример 2
По методике примеров проведен анализ 156 образцов периферической крови в группах ВИЧ-инфицированных (28 человек) и неинфицированных ВИЧ (128 человек) лиц. Выявлено 2 человека с полной устойчивостью и 11 с частичной устойчивостью к ВИЧ-инфекции.
Пример определения генетической устойчивости обследуемых к инфицированию вирусом иммунодефицита человека первого типа (ВИЧ1) представлен на фиг.2. У чувствительных к ВИЧ-инфекции выявляется два фрагмента размером 419 и 201 п.н. У лиц с частичной резистентностью к ВИЧ-инфекции выявляется три фрагмента размером 419, 387 и 201 п.н.
Все определение новым способом занимает 5 ч рабочего времени, в то время как определение обеих мутаций по известному способу (Beretta et al., 2000) занимает более 6 ч, а другой известный способ определения генетической устойчивости к ВИЧ-инфекции (Сломинский и др., 1999) занимает 6 ч, тогда как выявляется только одна мутация.
Список литературы:
1. Гришаев М.П., Гришаева О.Н. Генетически обусловленная устойчивость к ВИЧ-инфицированию // Новости "Вектор-Бест". 1999. Т.12. №2. С.3-5.
2. Сломинский П.А., Шадрина М.И., Лимборская С.А., Свердлов Е.Д. Способ определения генетической устойчивости обследуемых к инфицированию вирусом иммунодефицита человека первого типа (ВИЧ-1). Патент Российской Федерации RU 2126048 C1, 10.02.1999 г.
3. Beretta A., Quillent С., Arenzana S., Braun J. Human immunodeficiency virus co-receptor variants associated with resistance to virus infection // United States Patent 6,153,431. November 28, 2000.
4. Berber E.A., Murphy P.M., Farber J.M. Chemokine receptors as HIV-1 coreceptors: roles in viral entry, tropism, and disease // Annu Rev. Immunol. 1999. V.17. P.657-700.
5. Dean M., Carrington M., Winkler C., Huttley G.A., Smith M.W., Allikmets R., Goedert J.J., Buchbinder S.P., Vittinghoff E., Gomperts E., Donfield S., Vlahov D., Kaslow R., Saah A., Rinaldo C, Detels R., O'Brien S.J. Genetic restriction of HIV-1 infection and progression to AIDS by a deletion allele of the CKR5 structural gene. Hemophilia Growth and Development Study, Multicenter AIDS Cohort Study, Multicenter Hemophilia Cohort Study, San Francisco City Cohort, ALIVE Study // Science. 1996. V.273. P.1856-1862.
6. Liu R., Paxton W.A., Choe S., Ceradini D., Martin S.R., Horuk R., MacDonald M.E., Stuhlmann H., Koup R.A., Landau N.R. Homozygous defect in HIV-1 coreceptor accounts for resistance of some multiply-exposed individuals to HIV-1 infection // Cell. 1996. V.86. P.367-377.
7. Ometto L., Bertorelle R., Mainardi M., Giurisato M., Chieco-Bianchi L., De Rossi A. Analysis of the CC chemokine receptor 5 m303 mutation in infants born to HIV-1-seropositive mothers // AIDS. 1999. V.13. P.871-872.
8. Quillent C., Oberlin E., Braun J., Rousset D., Gonzalez-Canali G., Metais P., Montagnier L., Virelizier J.L., Arenzana-Seisdedos F., Beretta A. HIV-1-resistance phenotype conferred by combination of two separate inherited mutations of CCR5 gene // Lancet. 1998. V.351 P.14-18.
9. Rowland-Jones S., Sutton J., Ariyoshi K., Dong Т., Gotch F., McAdam S., Whitby D., Sabally S., Gallimore A., Corrah Т., et al. HIV-specific cytotoxic T-cells in HIV-exposed but uninfected Gambian women // Nat Med. 1995. V.1. P.59-64.
10. Samson M., Libert F., Doranz B.J., Pucker J., Liesnard C., Farber C.M., Saragosli S., Lapoumeroulie C., CognauxJ., Forceille C., Muyldermans G., Verhofstede C., Burtonboy G., Georges M., Imai Т., Rana S., Yi Y., Smyth R.J., Collman R.G., Doms R.W., Vassart G., Parmentier M. Resistance to HIV-1 infection in Caucasian individuals bearing mutant alleles of the CCR-5 chemokine receptor gene //Nature. 1996. V.382. P.722-725.
11. Voevodin A., Samilchuk E.. Dashti S. Frequencies of SDF-1 chemokine, CCR-5, and CCR-2 chemokine receptor gene alleles conferring resistance to human immunodeficiency virus type 1 and AIDS in Kuwaitis // J Med Virol. 1999 V.58. P.54-58.
12. Wang F.S., Hong W.G., Cao Y., Liu M.X., Jin L., Ни L.P., Wang Z, Feng T.J., Hou J., Zhang B., Shi M, Xu D.P., Lei Z.Y., Wang В., Liu Z.D., Ye J.J., Peng L., Qiu Y., Winkler
С. Population survey of CCR5 delta32, CCR5 m303, CCR2b 641, and SDF1 3'A allele frequencies in indigenous Chinese healthy individuals, and in HIV-1-infected and HIV-1-uninfected individuals in HIV-1 risk groups // J Acquir Immune Defic Syndr. 2003. V.32. P.124-130.
1. Способ определения генетической устойчивости обследуемых к инфицированию вирусом иммунодефицита человека первого типа (ВИЧ1) путем одновременного выявления делеционной и однонуклеотидной мутаций в гене корецептора ВИЧ1 CCR5 человека, включающий выделение ДНК обследуемого, амплификацию фрагмента гена CCR5 путем проведения полимеразной цепной реакции с использованием двух праймеров, комплементарных двум участкам гена CCR5, расположенным соответственно с 5' и 3' стороны выявляемых делеционной и однонуклеотидной мутаций, последующую рестрикцию продуктов амплификации с помощью рестрицирующей эндонуклеазой HincII (HindII), определение размера полученных амплифицированных фрагментов и выявление делеционной и однонуклеотидной мутаций по полученным результатам определения, отличающийся тем, что используют праймеры следующей структуры:
CCR5F: 5'-CGCTCTACTCACTGGTGTTCA-3';
CCR5R: 5'-CATGATGGTGAAGATAAGCCTCAC-3',
а о генетической устойчивости обследуемых судят по размеру полученных рестрикционных фрагментов согласно таблице 1, при этом обследуемый является генетически устойчивым при детекции следующих вариантов сочетаний длин рестрикционных фрагментов:
387 и 201 п.н.;
620, 387 и 201 п.н.;
588, 387 и 201 п.н.;
620 п.н.;
620 и 588 п.н.;
588 п.н.
2. Способ по п.1, отличающийся тем, что термическую обработку ДНК проводят путем проведения 25-40 циклов ПЦР, причем каждый следующий цикл состоит из последовательной термической обработки в течение 25-45 с при температуре 92-96°С, 56-60°С и 72-76°С, после чего цикл повторяется.