Пестицидные и противопаразитные композиции
Иллюстрации
Показать всеИзобретение относится к средствам борьбы с вредителями, в частности к композициям для борьбы с вредителями, болезнями и паразитами, поражающими растения и животных. Эти композиции включают один хитинолитический агент или агент, индуцирующий хитинолитическую активность, и сульфид, или агент, продуцирующий сульфид из микроорганизмов или химических соединений. Для осуществления эффективной борьбы данный препарат можно использовать в значительно меньшем количестве, чем препараты из любых вышеуказанных соединений, используемых индивидуально. 21 з.п. ф-лы, 9 табл.
Реферат
Настоящее изобретение включает несколько синергических композиций пестицидного и противопаразитного типа, которые можно использовать для борьбы с паразитическими фитонематодами и зоонематодами, некоторыми болезнями (грибковыми и бактериальными) и для борьбы с паразитическими трематодами (Fasciola hepatica).
Уровень техники
Нематоды наносят самый большой ущерб сельскому хозяйству в тропических, субтропических и умеренных регионах по всему миру (Nickle W.R. (Editor). 1991. Manual of Agricultural Nematology, Marcel Dekker, Inc., New York, N.Y. Pub. 1035 pp). Мировая продукция бананов имеет около 20% потерь, связанных только с нематодами, что составляет ежегодно 178 миллионов $ (Sasser J.N. and Freckman D.W. 1987. A world perspective on nematology: the role of the society. Vistas on nematology: a commemoration of the twenty-fifth anniversary of the Society of Nematologists/ edited by Joseph A. Veech and Donald W. Dickson. p.7-14). Бананы и банановые плантации в значительной степени повреждаются Radopholus similis.
Meloidogyne spp является наиболее важной паразитической нематодой растений, так как потери из-за ее активности составляют от 11% до 25% урожая почти во всех тропических регионах (Sasser J.N. 1979. Root-knot nematodes. Ed. F. Lamberti & C.E.Taylor, Academic Press, London, p. 359). Поэтому существует значительная необходимость в борьбе с этими паразитами, с которыми раньше боролись с помощью химических нематоцидов. Такие соединения могут быть очень эффективными, однако многие из них представляют большую опасность для окружающей среды. В некоторых случаях регламентирующие органы вводили ограничения на вносимые количества или частоту внесения (или и то и другое) таких соединений, тем самым, снижая их нематоцидную эффективность.
Борьба с нематодами все еще не приносит успехов. Использование химических нематоцидов с каждым днем все более и более ограничивается, так как они представляют собой высокотоксичные и широкого спектра действия соединения. В результате предпринимались попытки найти эффективные средства, позволяющие исключить повреждения, вызываемые нематодами, чтобы уменьшить применение химических пестицидов. Один из подходов состоит в использовании вместо химических нематоцидов биологических объектов со специфическим типом действия и относительно безопасным токсикологическим профилем. Некоторые из альтернативных нематоцидов включают ABG-9008, метаболит грибков Myrothecium verrucaria и комбинацию авермектинов (или родственных соединений, подобных милбецинам) с жирными кислотами (Abercrombie K.D. 1994. Synergistic pesticidal compositions. Patent US 5346698. Mycogen Corporation. Sept.13). Аналогично способ, который включает одновременную обработку для исключения повреждений растений, вызываемых нематодами, участка, почвы или семян, которые требуется обработать a) метаболитом грибков Myrothecium verrucaria и b) химическим пестицидом, а также эффективной в таком случае синергической нематоцидной композицией, заявлен в патенте (Warrior P., Heiman D.F. and Rehberger Linda A. 1996. Synergistic nematocidal compositions. Abbott laboratories. WO 9634529, 1996-11-07).
Другой подход состоит в комбинации спор Pasteuria penetrans, бактериального паразита нематод, с фосфорорганическими нематоцидами (Nordmeyer D. 1987. Synergistic nematocidal compositions of Pasteuria penetrans spores and an organophosphorus nematocide. 1987. CIBA-GEIGY AG Patent AU 06057386A1. 01/29/1987).
Однако при получении спор P. penetrans в промышленном масштабе приходится сталкиваться с проблемой, состоящей в том, что этот организм является облигатным паразитом; следовательно, его необходимо выращивать in situ, в нематодах, выделенных из переваров корней, инфицированных нематодами.
Хитинолитические грибки и бактерии, обитающие в той же среде, что и нематоды, могут иметь некоторое биологическое равновесие и каким-то образом ограничивать распространение нематод. Два штамма хитинолитических бактерий (Toda T. and Matsuda H. 1993. Antibacteriall, anti-nematode and/or plant-cell activating composition, and chitinolytic microorganisms for producing the same. Toda Biosystem Laboratory, Japan. Patent US 5208159, 05/04/1993) были заявлены как антибактериальная, антинематодная и/или активирующая клетки растений композиция. Существует несколько примеров хитинолитического воздействия на нематоды. Некоторыми из наиболее важных являются раскрытые штаммы новых бактерий (Suslow T. and Jones D.G. 1994. Novel chitinase-producing bacteria and plants. DNA Plant Technology Corporation, US 04940840, 07/10/1990), которые созданы в результате введения ДНК, которая кодирует продуцирование хитиназы, фермента, который может разлагать хитин в грибках и нематодах. Эти штаммы можно использовать для получения хитиназы для ингибирования растительных патогенов. Описаны также новые устойчивые к патогенам растения, устойчивость которых определяется введением в них ДНК, кодирующей продуцирование хитиназы.
Описаны также другие примеры микроорганизмов, снижающих популяции нематод, которые повреждают растения в природных условиях. Rodriguez-Kabana et al. (Rodriguez-Kabana R., Jordan J.W., Hollis J.P. 1965. Nematodes: Biological control in rice fields-role of hydrogen sulfide. Science. 148: 524-26); Hollis and Rodriguez-Kabana (Hollis, J.P., y R. Rodriguez-Kabana. 1966. Rapid kill of nematodes in flooded soil. Phytopathology 56, pp. 1015-19) наблюдали соответствие между бактерией Desulfovibrio desulfuricans, продуцированием сероводорода и паразитическими нематодами растений, популяция которых снижена на рисовых плантациях Луизианы. Сульфиды являются ингибиторами переноса электронов в процессе дыхания аэробных организмов, точно так же, как и других метаболитов, продуцируемых некоторыми почвенными бактериями (Rodriguez-Kabana, R. 1991. Control biolуgico de nematodos de plantas. NEMATROPICA, 21(1), pp. 111-22).
PAECILTM, известный также как BIOACT или Nemachek, является биологическим нематоцидом, который содержит запатентованный штамм из Paecilomyces lilacinus в сухом виде и со стабильной концентрацией спор, для обработки почвы и семян. Эти виды грибков обычно находятся во всех почвах по всему миру. Запатентованный штамм, используемый в качестве активного ингредиента PAECILTM обладает особенной эффективностью против паразитических нематод растений. Исходно он был выделен в университете Филиппин и был разработан в Австралии, в университете Macquarie. Кроме того, он был тестирован по широкой программе для борьбы с некоторыми типами нематод, которые повреждают основные сельскохозяйственные культуры в Австралии, Филиппинах, в Южной Африке и т.д. Композиция PAECILTM имеется в продаже как пестицид, зарегистрированный в Филиппинах, под торговой маркой BIOACTR; в Южной Африке под названием PL PLUS; в Индонезии под названием PAECILTM. В настоящее время Австралийское Национальное Регистрационное Агентство рассматривает этот продукт как пестицид (Holland, R. PAECILTM. 1998. http://www.ticorp.com.au/article1.htm).
Однако вышеуказанные случаи не могут решить всех проблем, связанных с паразитическими гельминтами. Поэтому все еще актуальна необходимость в создании усовершенствованных средств, которые обеспечивали бы борьбу с паразитами и заменили бы химические пестициды и противопаразитические продукты. Трематоды вызывают значительные экономические потери в области продуктивного животноводства и наносят вред здоровью людей. Разнообразие видов, относительная злокачественная патогеничность и эндемизм в отдельных регионах, по-видимому, являются существенными факторами, которые влияют на недостаточность знаний о трематодах. Вообще говоря, кишечные трематоды являются зоонозными и имеют большое количество резервных хозяев в каждом из видов.
С точки зрения экономики одной из наиболее важных трематод является Fasciola hepatica, первая известная паразитическая трематода; она поражает человека, обитая в желчных протоках. Ее яйцо является одним из самых крупных яйцевидных покрытых оболочкой гельминтов и вызывает нарушения пищеварительной системы, состоящие в желудочной диспепсии, нарушении подвижности в толстой кишке, боли в печени и желчном пузыре, лихорадке и печеночных коликах. Другие признаки могут включать цистические формы в легких, глазах, в мозге, печеночной вене и в других тканях (Saleha A. 1991. Liver fluke disease (fasciolosis) epidemiology, economic impact and public health significance. Southeast Asian J. Trop. Med. Public health 22 supp 1dic. P 361-4).
Зоогельминты стали значительными вредителями для овец и крупного рогатого скота. Противогельминтная устойчивость широко распространена, особенно в популяциях паразитических нематод мелких жвачных животных.
Были разработаны новые дополнительные методики, а другие находятся в стадии исследований. Грибок Duddingtonia flagrans является хищником, который образует сетки, создает широкую стенку, неподвижные споры: clamidospores, способные пережить прохождение по желудочно-кишечному тракту крупного рогатого скота, лошадей, овец и свиней (Larsen M. 1999. Biological control of helminths. Int. J. Parasitol. Jan.; 29(1): 139-46, and Larsen, M. 2000. Prospects for controlling animal parasitic nematodes by predacious micro fungi. Parasitology, 120, S120-S121).
Исследования D. flagrans в Дании, во Франции, в Австралии, США и Мексике подтвердили высокий потенциал биологической борьбы с этим грибком.
Подобно многим другим важным странам-производителям овец Южная Африка претерпевает большой кризис с точки зрения противогельминтной устойчивости, особенно в отношении желудочно-кишечных нематод у овец и коз. Важные паразитические гельминты участвуют в этом феномене; однако это вызывает конкретную проблему с сычужным гематофаговым паразитом Haemonchus contortus. Исследования выявили, что более 90% штаммов этого паразита из большинства важных овцеводческих регионов Южной Африки демонстрируют некоторую степень устойчивости к лекарствам в трех из четырех противогельминтных групп доступных на рынке в Южной Африке. Даже на площадях обычных пастбищ в Северной Провинции он был обнаружен в пяти стадах, исследованных в 1993 (van Wyk J.A., Bath G.F. and Malan F.S. 2000. The need for alternative methods to control nematode parasites of ruminant livestock in South Africa. World Animal Review. http://www.fao.org/ag/AGA/AGAP/FRG/FEEDback/War/contents.htm).
Проблема повышения устойчивости стала серьезной, так как она была обнаружена также в других ареалах. В последнее время был проведен ряд противогельминтных исследований в четырех странах Латинской Америки: в Аргентине (Eddi, C., Caracostantogolo, J., Peya, M., Schapiro, J., Marangunich, L., Waller, P.J. & Hansen, J.W. 1996. The prevalence of anthelmintic resistance in nematode parasites of sheep in southern Latin America: Argentina. Vet. Parasitol., 62: 189-197); в Бразилии (Echevarria F., Borba M.F.S., Pinheiro A.C., Waller P.J. & Hansen J.W. 1996. The prevalence of anthelmintic resistance in nematode parasites of sheep in southern Latin America: Brazil. Vet. Parasitol., 62: 199-206); в Парагвае (Maciel S., Giminez A.M., Gaona, C., Waller P.J. & Hansen J.W. 1996. The prevalence of anthelmintic resistance in nematode parasites of sheep in southern Latin America: Paraguay. Vet. Parasitol., 62: 207-212); и в Уругвае (Nari A., Salles J., Gil A., Waller P.J. & Hansen J.W. 1996. The prevalence of anthelmintic resistance in nematode parasites of sheep in southern Latin America: Uruguay. Vet. Parasitol., 62: 213-222).
Одной из нематод, которая наиболее сильно поражает крупный рогатый скот, является Dictyocaulus viviparous, паразит, который достигает половой зрелости, и, будучи взрослым, попадает в легкие скота, особенно в легкие молодых животных. Вызываемая при этом болезнь известна как гельминтозный бронхит, или коровий Dictyocaulosis, и заражение происходит при поедании корма, зараженного личинками. Лечение требует противогельминтных препаратов (Borgsteede F.H.M, de Leeuw W.A. & Burg W.P.J. 1988. A comparison of the efficacy of four different long-acting boluses to prevent infections with Dictyocaulus viviparus in calves. The Veterinary Quarterly, Vol. 10, № 3), но успех определяется дороговизной из-за новых штаммов, устойчивых к лекарствам, что делает дальнейшее лечение инфицированного животного более трудным. Высокая стоимость этих продуктов является ограничивающим фактором для стран с большим количеством ресурсов, и при использовании этих препаратов наносится вред экологии. Международная проблема противогельминтной устойчивости дополняется тем фактом, что, хотя химиотерапия продолжает оставаться краеугольным камнем в борьбе с паразитами, по-видимому, мало надежды на то, что какой-либо новый химически не родственный противогельминтный препарат появится в течение, по крайней мере, следующего десятилетия (Soll, M.D. 1997. The future of anthelmintic therapy from an industry perspective. In J.A. van Wyk & P.C. van Schalkwyk, eds. Managing anthelmintic resistance in endoparasites, p.1-5. Proceedings of the 16th International Conference of the World Association for the Advancement of Veterinary Parasitology, Sun City, South Africa, 10-15 August 1997).
Что касается бактерий и патогенных грибков, то существуют исчерпывающие сообщения о биологических препаратах, действие которых основано главным образом на антагонизме, и о том, что большое количество таких препаратов коммерчески доступно. Вот некоторые из них: Conquer (Pseudomonas fluorescens, который является антагонистом Pseudomonas tolassii), Galltrol-A (Agrobacterium radiobacter, который контролирует Agrobacterium tumefaciens), Bio-Fungus (Trichoderma spp, который контролирует следующие грибки: Phytophthora, Rhizoctonia solani, Pythium spp, Fusarium, Verticillium), Aspire (Candida oleophila I-182, который контролирует Botrytis spp. и Penicillium spp), и т.д.
Одним из биофунгицидов, обладающих наиболее широким спектром активности, является Trichoderma spp (Chet I., Inbar J. 1994 Biological control of fungal pathogens. Appl Biochem Biotechnol; 48(1):37-43), грибок, механизм действия которого широко обсуждается, причем в этом механизме принимают участие хитиназы, которые разлагают клеточные стенки хозяина грибка. Более того, существуют экспериментальные доказательства хитинолитического действия грибков и бактерий, которые используют в качестве биорегуляторов грибковых заболеваний (Herrera-Estrella A, Chet I.1999. Chitinases in biological control. EXS; 87:171-84). Однако это не единственный способ воздействия бактерий в отношении фитопатогенных грибков; существуют другие способы борьбы, основанные на продуцировании вторичных метаболитов, подобных цианистоводородной кислоте, которая может ингибировать корневые патогенные грибки (Blumer C. and Haas D. 2000. Mechanism, regulation, and ecological role of bacterial cyanide biosynthesis. Arch Microbiol Mar; 173(3):170-7), в конкретном случае грибки штамма P. fluorescens CHAO.
Анализ взаимодействий типа бактерия-бактерия показал, что существуют три основные типа взаимодействия: антибиоз, субстратная конкуренция и паразитизм. В случае антибиоза некоторые штаммы бактерий, как известно, выделяют антибиотики с целью подавления активности окружающих бактерий, что можно использовать для биологического способа борьбы с патогенными видами. Аналогично субстратная конкуренция представляет собой механизм, который также можно использовать для достижения соответствующего биологического контроля, так как биорегулирующий организм способен синтезировать агенты, хелатирующие сидерофорные микроэлементы, что вызывает дефицит микроэлементов, главным образом железа, в среде, тем самым происходит ингибирование роста соответствующих патогенов (Ongena M. 1998. Conference on biological controls. Training program in the area of biotechnology applied to agriculture and bioindustry. Gembloux, Belgium).
Сущность изобретения
Настоящее изобретение относится к композиции, которая содержит, по крайней мере, один хитинолитический агент или агент, индуцирующий хитинолитическую активность, и сульфид или агент, продуцирующий сульфид из микроорганизмов или химических соединений, где хитинолитический агент или агент, индуцирующий хитинолитическую активность, и сульфид или агент, продуцирующий сульфид из микроорганизмов или химических соединений, совместно наносят в существенно меньшем количестве, чем если бы каждый компонент использовали независимо, для достижения эффективной борьбы с гельминтами и каузативными агентами бактериальных и грибковых заболеваний.
Настоящее изобретение относится также к использованию таких композиций и/или к одновременному введению указанных соединений из различных источников, таких как биологические и химические, для эффективной борьбы с широким спектром паразитических нематод растений (Meloidogyne spp, Angina spp, Ditylenchus spp, Pratylenchus spp, Heterodera spp, Aphelenchus spp, Radopholus spp, Xiphinema spp, Rotylenchulus spp), паразитических нематод животных и трематод (Haemonchus spp, Trichostrongylus spp, Dictyocaulus spp. y Fasciola hepatica), бактериальных агентов, вызывающих заболевания (Erwinia chrysanthemi, Burkholderia glumae) и грибковых агентов, вызывающих заболевания (Pestalotia palmarum, Alternaria tabacina, Sarocladium orizae).
Действие хитинолитического агента или агента, индуцирующего хитинолитическую активность, и сульфида или продуцирующего сульфид агента на гельминты, бактерии и грибки было ранее продемонстрировано или об этом сообщалось. Однако в настоящем исследовании впервые продемонстрирован синергический эффект при одновременном использовании обоих компонентов.
Если хитинолитический агент или агент, индуцирующий хитинолитическую активность, и сульфид или агент, продуцирующий сульфид, используют отдельно, эффект всегда оказывается меньше, чем если одновременно используют оба агента.
При использовании в виде композиции настоящего изобретения, хитинолитический агент или агент, индуцирующий хитинолитическую активность, и сульфид или агент, продуцирующий сульфид, можно соответствующим образом смешать в виде раствора, суспензии, эмульсии, порошка или гранулированной смеси и нанести на растение или почву в виде удобрения, предварительно упакованной почвы, оболочки для семян, порошка, гранулята, аэрозоля, суспензии, жидкости, или любой из указанных выше форм в капсулах для борьбы с паразитическими гельминтами и бактериальными и грибковыми заболеваниями.
Оптимальные дозы нанесения хитинолитического агента или агента, индуцирующего хитинолитическую активность, и сульфида или агента, продуцирующего сульфид, для конкретного случая с нематодами, трематодами, бактериями или грибками, и для случая специфических условий, интервалы доз определяют экспериментально, in vitro, в теплице или в полевых условиях.
В соответствии с результатами, раскрытыми в настоящем изобретении, значительный успех в борьбе с гельминтами, бактериями и грибками достигается при использовании смеси 1) продуцирующего хитиназу микроорганизма от 107 колонииобразующих единиц (CFU) до 1012 CFU конкретного микроорганизма на грамм композиции или хитина от 1% до 50% композиции; и 2) продуцирующего сульфид микроорганизма от 107 CFU до 1012 CFU конкретного микроорганизма на грамм композиции и любого продуцирующего сульфид химического агента, где с выходом сульфида в диапазоне от 0,1 мг/мин до 1,0 мг/мин на грамм композиции.
Любая композиция с содержанием микроорганизма от 107 CFU до 1012 CFU на грамм композиции, которая одновременно продуцирует хитинолитические агенты и сульфид, годится для борьбы с гельминтами, бактериями и грибками. Указанные выше композиции включали комбинации следующих агентов в вышеуказанных пропорциях:
1. Хитиназа и Na2S.
2. Хитиназа и FeS.
3. Хитиназа и микроорганизм Desulfovibrio desulfuricans.
4. Хитин и Na2S.
5. Хитин и FeS.
6. Хитин и микроорганизм Desulfovibrio desulfuricans.
7. Микроорганизм, который одновременно продуцирует хитинолитическую активность и H2S.
Известные ранее композиции эффективны против широкого круга паразитических нематод растений, включая (но этим не ограничиваясь) виды Meloidogyne, такие как M. incognita; Anginaspecies, такие как A. tritici; Ditylencus виды, такие как dipsaci; Pratylenchus виды, такие как P. coffee; Heterodera виды, такие как H. glycines; Aphelenchus виды, такие как A. avenae; Radopholus виды, такие как R. similis; Xiphinema виды, такие как X. index; Rotylenchulus виды, такие как R. reniformis; zoonematodes, такие как: Haemonchus spp, Trichostrongylus spp, Ostertagia spp, Nematodirus spp, Cooperia spp, Ascaris spp, Bunostomum spp, Oesophagostomum spp, Chabertia spp, Trichuris spp, Strongylus spp, Trichonema spp., Dictyocaulus spp., Capillaria spp., Heterakis spp., Toxocara spp, Ascaridia spp, Oxyuris spp, Ancylostoma spp, Uncinaria spp, Toxascaris spp и Parascaris spp; trematodes, такие как Fasciola hepatica; патогенные бактерии растений, такие как Erwinia chrysanthemi, Burkholderia glumae, и патогенные грибки растений, такие как Pestalotia palmarum, Alternaria tabacina и Sarocladium orizae.
ПРИМЕРЫ
Пример 1: In vitro оценка нематоцидного эффекта сероводорода из химических источников и хитинолитического фермента.
Используют яйца зоонематод Haemonchus spp и Trichostrongylus colubriformis и Dictyocaulus viviparous, а также личинки паразитических фитонематод (ювенильные 2) Melodoigyne incognita.
Собирают Haemonchus spp и Trichostrongylus colubriformis нематоды из овечьего (овцы) и коровьего (скот) сычуга соответственно. Взрослых самок нематод промывают в физиологическом растворе и обрабатывают “Hibitane” (Хлоргексидинацетат) в концентрации 0,5%, в течение 1 минуты, причем процесс проводят при 37°C. Примерно 100 предварительно дезинфицированных самок помещают в склянку Эрленмейера, содержащую 50 мл раствора LB среды, разбавленной десятикратно дистиллированной стерильной водой, и оставляют для откладывания яиц на ночь (8-10 часов).
Сбор нематод D. viviparous осуществляют из инфицированных легких предварительно умерщвленной коровы (скот). Ту же процедуру используют для Haemonchus spp. и T. colubriformis; однако самок оставляют для откладывания яиц на 2-3 часа.
Начиная с этого момента, манипуляции осуществляют в асептических условиях в вертикальном ламинарном потоке, используя 24-луночные планшеты для культуры тканей. Полный объем среды, содержащей самок и яйца, фильтруют, используя сетку-сито 60 мкм. Яйца нематод остаются на сетке второго сита 30 мкм. Их помещают в раствор Hibitane концентрации 0,5% на 3 минуты, затем трижды промывают LB средой, разбавленной в 10 раз стерильной дистиллированной водой.
После процедуры дезинфекции яйца извлекают с сита и осторожно снова суспендируют в растворе LB среды, разбавленной 10 раз стерильной дистиллированной водой. Конечный результат распределения проверяют, подсчитывая и регистрируя яйца в каждой лунке с помощью микроскопа с инверсией Olympus, на этой фазе осуществляют также наблюдения за однородностью эволюционного состояния.
Haemonchus spp и T. colubriformis вылупились из яиц во временном интервале от 24 до 48 часов при инкубировании при 28°C, тогда как D. vivparus вылупились из яиц до 24 часов. Хорошее приготовление образцов происходит, если во всех необработанных контролях более 60% вылупливания происходит в указанные выше временные интервалы для каждого из видов.
Сбор кучек яиц Meloidogyne incognita осуществляют из корней тыквы (Cucurbita pepo), предварительно инфицированной и выращенной в теплицах. Для этой операции используют стереоскопический микроскоп и иголки с соответствующим образом измененными кончиками. Кучки помещают в стерильную дистиллированную воду в чашки Петри при 28°C в количестве 50 кучек в чашку. Проводят ежедневные наблюдения, чтобы проконтролировать вылупливание из яиц. Примерно через 72 часа набирается достаточно личинок, чтобы начать их сбор и дезинфицирование.
Весь объем воды, содержащей кучки яиц и личинки, фильтруют через сетку сита 60 мкм. Начиная с этого момента, все манипуляции осуществляют в асептических условиях в вертикальном ламинарном потоке, используя 24-луночные планшеты для культуры тканей. Яйца, выделенные из кучек, не способны к вылупливанию и остаются на сетке сита 30 мкм; личинок собирают на следующей сетке 5 мкм. Их помещают в раствор Hibitane с концентрацией 0,5% на 3 минуты, а затем трижды промывают LB средой, разбавленной в 10 раз стерильной дистиллированной водой.
После дезинфицирования личинки Meloidogyne incognita снимают с сетки сита, и осторожно снова суспендируют в растворе LB среды, разбавленной в 10 раз стерильной дистиллированной водой. Конечную концентрацию и результаты дезинфекции проверяют, подсчитывая и регистрируя живых личинок с помощью микроскопа с инверсией Olympus.
Яйца нематод и личинки помещают в количестве 100 штук примерно в 2 мл LB среды, разбавленной в 10 раз. Этот объем помещают в барботажные кюветы, которые обеспечивают прохождение воздуха через жидкость, и поэтому обеспечивается контакт газов с яйцами и личинками. Каждую кювету дублируется для каждой обработки.
Сероводород получают в реакции двух сульфидных солей (Na2S и FeS) с хлористоводородной кислотой и в результате анаэробной ферментации бактерий Desulfovibrio desulfuricans subs. desulfuricans ATCC 27774 (выделены из овечьего рубца). В качестве хитинолитического фермента используют хитиназу SIGMA C 1650 из бактерии Serratia marcescens.
Исследуемые яйца и личинки нематод подвергают следующим обработкам в течение 24 часов:
1. Контрольная обработка: хитиназу не добавляют, и воздух циркулирует через кювету.
2. Обработка хитиназой: хитиназа в количестве 0,2 единицы на дубликат.
3. Обработка сульфидом: сероводород из Na2S при потоке 0,2 при 0,3 мг/мин.
4. Обработка сульфидом: сероводород из FeS при потоке 0,2 при 0,3 мг/мин.
5. Обработка сульфидом: сероводород из Desulfovibrio desulfuricans при потоке 0,2 при 0,3 мг/мин.
6. Комбинированная обработка: одновременное осуществление обработок 2 и 3.
7. Комбинированная обработка: одновременное осуществление обработок 2 и 4.
8. Комбинированная обработка: одновременное осуществление обработок 2 и 5.
Все вышеуказанные обработки повторяют по 4 раза.
Через двадцать четыре часа после начала эксперимента подсчитывают появившиеся личинки (Haemonchus sp., T. colubriformis и D. viviparous) и количество живых личинок при всех обработках. Результаты эффективности (E) представлены в таблице 1. Эта величина представляет среднее из 4 повторов в каждой обработке. Для полученных результатов для каждого из видов исследуемых нематод используют дисперсионный анализ (ANOVA) отдельно; используют тест Дункана (Lerch G. 1977. La en las ciencias y agrнcolas. 1ra p.p.203-308, Editorial Cientifico-Tecnica, La Habana), результаты которого также представлены в таблице 1. Одинаковые буквы указывают, что среди измерений нет значительных расхождений (p<0,05).
| Таблица 1Эффективность обработки (Е*) | ||||||||
| Эффективность обработки (Е*) | ||||||||
| 1.Ecконтроль | 2.Eq | 3.Esn | 4.Esf | 5.Esd | 6.Eqsn(2+3) | 7.Eqsf(2+4) | 8.Eqsd(2+5) | |
| Нaemonchus | 0,00(a) | 0,32(b) | 0,41(c) | 0,40(c) | 0,37(b,c) | 0,86(d) | 0,85(d) | 0,82(d) |
| Trichostrongilus | 0,00(a1) | 0,37(b1) | 0,40(b1,c1) | 0,39(b1,c1) | 0,38(b1,c1) | 0,88(d1) | 0,88(d1) | 0,83 (d1) |
| Dictyocaulus | 0,00(a2) | 0,35(b2) | 0,44(c2) | 0,42(c2) | 0,40(b2,c2) | 0,91(d2) | 0,90(d2) | 0,86(d2) |
| Meloidogyne | 0,00(a3) | 0,39(b3) | 0,51(c3) | 0,52(c3) | 0,47(c3) | 0,95(d3) | 0,93(d3) | 0,90(d3) |
| *Эффективность (E) представляет собой результат вычитания величины активной частоты (Fr) для вылупливания или живых личинок из 1, независимо от случая. Fr представляет отношение между количеством вылупливающихся или живых личинок в каждой обработке (Ntto) и количеством вылупливающихся или живых личинок при обработке 1 (Nc):E=1–Fr, где Fr=Ntto-Nc; поэтому E=1–Ntto/Nc |
Для определения эффекта синергизма при обработках 6, 7 и 8 принимали, что акты, происходящие в них, не исключаются.
Для этого типа анализа ожидаемые эффективности (EE) должны быть равны сумме индивидуальных эффектов (EI), определяемых эффективностями, связанными с действием хитиназы (Eq) и эффективностями, связанными с действием сероводорода (Esn, Esf и Esd), минус эффект пересечения (ei) (Sigarroa, A. 1985. Biometrнa y diseсo experimental. 1ra. Parte. Minist. Sup. Ed. Pueblo y Cap. 3. pag 69-107).
EE=Eq+Es–ei, где ei=Eq×Es
Если экспериментальные эффективности (E) в тех обработках, где объединены два нематоцидные агента (обработки 6, 7, 8), больше чем ожидаемые эффективности (EE) для этих обработок, можно быть уверенными в том, что существует синергизм в плане нематоцидной активности хитинолитического агента (хитиназы) и сероводорода, если оба эти агента одновременно используют в одной и той же обработке. Полученные величины представлены в таблице 2.
| Таблица 2.Экспериментальная (Е) и ожидаемая (ЕЕ) эффективности | ||||||
| Экспериментальная (Е) и ожидаемая (ЕЕ) эффективности | ||||||
| Обработка 6 | Обработка 7 | Обработка 8 | ||||
| Е | ЕЕ | Е | ЕЕ | Е | ЕЕ | |
| Нaemonchus | 0,86 | 0,60 | 0,85 | 0,59 | 0,82 | 0,57 |
| Trichostrongilus | 0,88 | 0,62 | 0,88 | 0,62 | 0,83 | 0,61 |
| Dictyocaulus | 0,91 | 0,64 | 0,90 | 0,62 | 0,86 | 0,61 |
| Meloidogyne | 0,95 | 0,70 | 0,93 | 0,71 | 0,90 | 0,68 |
Для этих трех обработок, при которых одновременно объединены хитаназа и сероводород, экспериментальная эффективность (E) оказалась выше, чем ожидаемая эффективность (EE) для четырех исследуемых нематод, что статистически демонстрирует существование синергизма между обоими соединениями (если они действуют одновременно) в отношении их нематоцидной активности.
Никаких значительных различий не наблюдалось как в отношении источников сульфидов, так и их нематоцидного эффекта (Таблица 1).
Пример 2: Оценка в теплице нематоцидного эффекта агента, индуцирующего хитинолитическую активность (хитина), и агента, продуцирующего сероводород (Desulfovibrio desulfuricans subps. desulfuricans ATCC 29577, выделенный из почвы).
Выбирают коричневую почву с нейтральным значением рН: ее сушат и просеивают на 0,5 см сетке для удаления нежелательных частиц. Ее стерилизуют в вертикальном автоклаве в течение 1 часа при 120°C и давлении 1 атмосфера (Sambrook J., Fritsch E.F. and Maniatis T. 1989. Molecular Cloning: A Laboratory Manual. 2nd.Ed. Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y., USA). Ее сушат при комнатной температуре в течение 3-4 дней для того, чтобы позднее приготовить смеси для обработок с речным песком, гумусом земляных червей и хитином (ICN каталог, номер 101334).
Двадцать горшков (15 см диаметр, 13 см глубина и емкость 1 литр) заполняют в указанных соотношениях для следующих обработок:
1. Контрольная обработка: почва 70%, речной песок 25% и гумус 5%.
2. Обработка хитином: почва 70%, речной песок 25%, гумус 4% и хитин 1%.
3. Микроорганическая обработка: почва 70%, речной песок 25%, гумус 5% и D. desulfuricans, добавленные до концентрации 1010 CFU/горшок.
4. Комбинированная обработка: почва 70%, речной песок 25%, гумус 4% и D. desulfuricans, добавленные до концентрации 1010 CFU/горшок.
Каждую обработку осуществляют 5 раз (5 горшков).
Для обработок 2 и 4 предварительную смесь гумуса и хитина приготавливают в соотношении 4:1, а затем приготавливают окончательную смесь с почвой и песком. Для обработок 3 и 4 D. desulfuricans вносят со 100 мл деионизированной воды в каждый горшок. Эти объемы равномерно вносят во время первого полива.
Для всех обработок в горшки инокулируют по 500 нематод видов Radopholus similes, предварительно собранных из инфицированных естественным образом корней бананов. Используют метод центрифугирования-флотации (Jenkins, W. R. 1964. A rapid centrifugal-flotation tecnique for separation nematodes from soil. Plant Disease Reporter, 48: 692); образцы разбавляют в 5 мл дистиллированной воды и равномерно вносят на глубину 5 см под поверхность почвы.
Горшки помещают в теплицу и оставляют там на 3 дня после осуществления обработок и инокулирования нематодами. На этой стадии осуществляют ежедневный полив, чтобы сохранить условия достаточной влажности. Перед четвертым днем после обработок в горшки сажают растения бананов var. Cavendish, полученные методом культуры тканей in vitro. Начиная с этого момента и далее осуществляют жесткий режим орошения, который обеспечивает постоянную влажность почвы в ее полевой емкости.
Конечную оценку проводят спустя три месяца после начала эксперимента; корни растений осторожно освобождают от почвы. Затем регистрируют количество экземпляров (личинок и взрослых нематод) и живых нематод, собранных с растений, используя метод центрифугирования-флотации (Jenkins, W. R. 1964. A rapid centrifugal-flotation tecnique for separation nematodes from soil. Plant Disease Reporter, 48: 692), и обращенный микроскоп для подсчета. Результаты достигнутой эффективности для различных обработок представлены в таблице 3. Они представляют среднее значение из 5 повторов для каждой из обработок. Для обработки результатов используют дисперсионный анализ (ANOVA), затем тест Дункана (Lerch G. 1977. La Experimentaciуn en las ciencias y agrнcolas. 1ra p.p.203-308, Editorial Cientifico-Tecnica, La Habana), полученные результаты представлены в таблице 3. Одинаковые буквы означают, что нет значительных расхождений (p<0,05) между обработками.
| Таблица 3.Эффективность обработки (E)* | ||||
| Эффективность обработки (E)* | ||||
| 1.Ec | 2. Eq | 3. Esd | 4. Eqsd | |
| Radopholus similis | 0,00(a) | 0,21(b) | 0,18 (b) | 0,48(c) |
| *Эффективность (E) представляет собой результат вычитания величины относительной частоты живых экземпляров (Fr) из 1. Fr представляет отношение числа живых экземпляров в каждой из обработок (Ntto) и числа живых экземпляров для обработки 1 (Nc):E=1–Fr, где Fr=Ntto/Nc, поэтому E=1-Ntto/Nc. |
Для определения возможного эффекта синергизма при обработке 4, предполагалось, что происходящие акты (нематоцидный эффект) не исключаются.
Аналогично примеру 1 ожидаемая эффективность (EE) должна быть равна сумме индивидуальных эффектов (EI), представленной эффективностью, обусловленной действием хитина (Eq) как индуктора хитинолитической активности микроорганизмов, присутствующих в смеси почвы и гумуса, и эффективностью, обусловленной действием сероводорода (Esd), выделяемого бактериями D. desulfuricans; минус перекрестный эффект (ei) между двумя обработками (Sigarroa, A. 1985. experimental. 1ra. Parte. Minist. Sup. Ed. Pueblo y Educaciуn. Cap.3. pag 69-107)
EE=Eq+Es–ei, где ei=Eq×Es
Если экспериментальная эффективность (E) для обработки 4, где объединены два нематоцидные агента, оказывается выше, чем ожидаемая эффективность (EE), можно быть уверенными в том, что существует синергизм между агентом, индуцирующим хитинолитическую активность (хитином) и сероводородом (from D. desulfuricans), когда их используют одновременно для одной и той же обработки. Полученные значения представлены в таблице 4.
| Таблица 4Экспериментальные (Е) и ожидаемые (ЕЕ) эффективности | ||
| Экспериментальные (Е) и ожидаемые (ЕЕ) эффективности | ||
| Е | ЕЕ | |
| Обработка 4 | ||
| Radopholus similis | 0,48 | 0,35 |
При обработке 4 инициатор хитинолитической активности (хитин), и биологический источник сероводорода (D. sulfuricans) объединены. В этом случае экспериментальная эффективность (E) оказалась выше, чем ожидаемая эффективность (EE), что доказывает существование синергизма (в отношении их нематоцидной активности) для этих двух соединений, если их вносят в почву одновременно.
Пример 3: Демонстрация хитинолитической активности и продуцирования сульфида бактериями Corynebacterium paurometabolum C-924 и Tsukamurella paurometabola DSM 20162.
Определение продуцирования сульфида:
В ампулы для сбора газа объемом по 100 мл отбирают образцы газа, выделяющегося при ферментации штаммов C-924 и DSM 20162 в 5 литровых биореакторах. Полное время культивирования составляет 24 часа. Образование сероводорода впервые детектируется после 16 часов.
Образцы обрабатывают аналогично способу обработки при получении H2S. Анализ осуществляют с помощью газового хроматографа Varian в следующих условиях:
- Пламенный фотометрический детектор с фильтром, чувствительным к серусодержащим соединениям.
- Образец сероводорода: 43,2 нг/мл, (в двух экземплярах).
- Образцы: по два образца для каждого из моментов времени отбора образцов.
- Ввод: 1 мл или мкл в головную часть.
- Колонка: DB-5 (15 м×0,53 мм).
- Температура: 35°C.
- Газ-носитель: азот 1,5 мл/мин.
- Детектор: FPD-S
- Продувочный газ: азот 30 мл/мин.
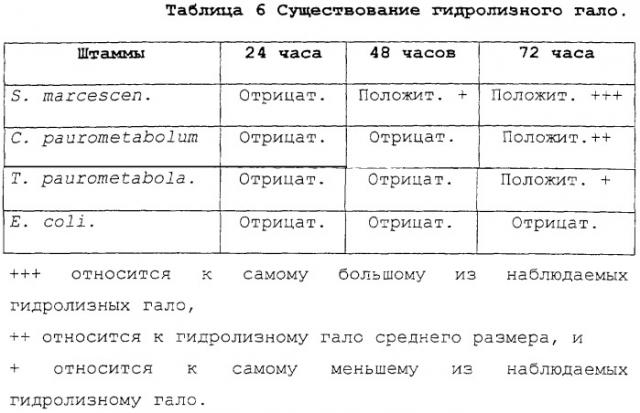
В таблице 5 представлены результаты анализов сульфидных газов, выделяемых двумя штаммами в различные моменты времени.
| Таблица 5.Анализ сульфидных газов | ||||||
| Поток H2S мг/мин (Детектируемый сульфидный поток) | ||||||
| Штамм | Образец | 16 час | 18 час | 20 час | 22 час | 24 час |
| C-924 | 1 | 0,0673 | 0,2208 | 0,4779 | 0,3578 | 0,0672 |
| 2 | 0,0659 | 0,2160 | 0,4755 | 0,3552 | 0,0680 | |
| DSM 20162 | 1 | 0,0231 | 0,0416 | 0,1014 | 0,1863 | 0,0009 |
| 2 | 0,0240 | 0,0422 | 0,1040 | 0,1887 | 0,0097 |
Оба штамма продуцируют сульфиды, но поток у штамма C-924 сильнее, чем у штамма DSM 20162.
Определение хитинолитической активности:
Используют штаммы Corynebacterium paurometabolum C-924, Tsukamurella paurometabola DSM 20162, Serratia marcescen ATCC 13880 и E. coli ATCC 25922
Культуры бактерий исследуемых штаммов выращивают в LB среде при 28°C и вращении со скоростью 100 об/мин в течение 24 часов, затем центрифугируют при скорости 3500 об/мин; надосадочные жидкости фильтруют через две сетки 0,2 мкм. Профильтрованный продукт анализируют в планшетах, подготовленных с коллоидной суспензией хитина (0,5%), добавляют также агарозу вплоть до 0,8%, для получения среднего желе и обеспечения пористости для облегчения диффузии белка. После образования желе лунки диаметром 5 мм открывают и добавляют 100 мкл профильтрованной надосадочной жидкости от каждого бактериального штамма. Каждый планшет повторяют в трех экземплярах и инкубируют при 28°C в темноте.
Начиная с 48 часов и далее наблюдается уменьшение мутности среды, напоминающее гало, что демонстрирует гидролиз хитина. В приведенной далее таблице (таблица 6) представлены количественные результаты из гидролизного гало в различные моменты вре