Способ местного лечения эрозивно-язвенных поражений кожи и слизистых
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к хирургии, и может быть использовано для местного лечения эрозивно-язвенных поражений кожных покровов и слизистых, в том числе длительно незаживающих ран, воспалительных заболеваний кишечника. Способ включает использование культивируемых вне организма диплоидных эмбриональных фибробластов. При этом фибробласты предварительно подвергают воздействию дексаметазоном в концентрации 10-4 моль/л в культуральных условиях в течение 1 часа с последующей отмывкой от препарата и сменой среды. В дальнейшем применяют образуемый ими суточный супернатант в виде локального нанесения на пораженный участок один раз в сутки. Способ позволяет уменьшить воспалительные проявления в ранах и эрозивно-язвенных поражениях кожи и слизистых оболочек, стимулирует регенераторные процессы с минимальными ограничениями в использовании данного способа со стороны участка поражения, снижает материальные затраты. 6 табл., 7 ил.
Реферат
Изобретение относится к медицине, а именно к хирургии, и может быть использовано для местного лечения эрозивно-язвенных поражений кожных покровов и слизистых, в том числе длительно незаживающих ран, воспалительных заболеваний кишечника.
Известен способ лечения ожоговых ран с использованием аллогенных диплоидных фибробластов (АДФ) (Федоров В.Д. и соавт., 1993 г. Патент РФ №2023424), заключающийся в трансплантации ЭФ на рану за 24-48 ч до выполнения свободной кожной аутодермопластики. При реализации данного метода конечный результат обусловлен способностью трансплантированных клеток синтезировать компоненты внеклеточного матрикса, а также взаимодействовать с клеточным микроокружением в ране реципиента, способствуя завершению воспалительного процесса.
Наиболее близким является способ лечения ран, предложенный И.И.Горяиновым и соавт., в котором усиливается противовоспалительное действие трансплантируемых АДФ путем предварительной обработки их низкоинтенсивным магнитно-лазерным облучением (Горяинов И.И. и соавт., 1998. Патент РФ №2157269).
Однако использование трансплантации АДФ требует для своего применения определенных условий со стороны участка повреждения, а именно санации раны от бактериальной флоры, купирования активного воспалительного процесса [Саркисов Д.С. и соавт., 1991]. Кроме того, получение достаточного для закрытия обширного участка повреждения количества фибробластов связано со значительными финансовыми затратами, требует дополнительного использования подложек для выращивания клеток, соответствующих определенным требованиям, предъявляемым к биологическим покрытиям, и при этом нетоксичных для клеток и выдерживающих ферментативное воздействие среды в процессе культивирования.
Задачей изобретения является уменьшение воспалительных проявлений в ранах и эрозивно-язвенных поражениях кожи и слизистых оболочек, стимуляция регенераторных процессов с минимальными ограничениями в использовании данного способа со стороны участка поражения, сочетающееся со снижением материальных затрат.
Поставленная задача достигается использованием для лечения указанных поражений кондиционированной эмбриональными фибробластами среды культивирования. ЭФ предварительно подвергаются обработке дексаметазоном в концентрации 10-4 моль/л в течение 1 ч с последующей отмывкой от препарата и сменой среды культивирования.
Как известно, развитие, течение и завершение воспалительного процесса в значительной степени модулируется продукцией провоспалительных (ФНО-α, ИЛ-1, ИЛ-8, хемокины) и противовоспалительных (раИЛ-1, ИЛ-4, ТФРβ) цитокинов клетками-участницами воспаления, главным образом мононуклеарными фагоцитами, Т-лимфоцитами, фибробластами и эндотелиальными клетками. Также большую роль играет продукция нейтрофилами агрессивных свободных радикалов и протеолитических ферментов. В связи с этим разработка способов ограничения продукции провоспалительных параллельно со стимуляцией выработки противовоспалительных факторов является актуальной для оптимизации местного лечения поражений кожи и слизистых воспалительного характера.
Предположили, что выявленное ингибирующее влияние ЭФ на продукцию ФНО в смешанной культуре с аллогенными мононуклеарами периферической крови может быть обусловлено продукцией ЭФ растворимых медиаторов. В качестве стимулятора противовоспалительной активности был выбран дексаметазон, известный своей способностью ингибировать продукцию провоспалительных медиаторов широким диапазоном клеток.
Изобретение поясняется следующими таблицами и чертежами:
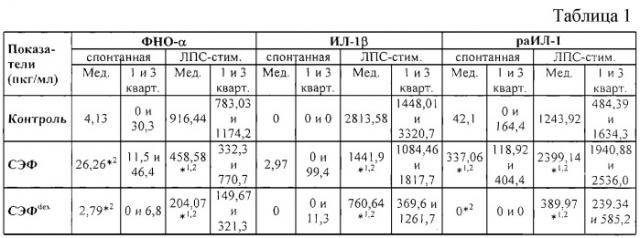
- в табл. 1 - показатели продукции цитокинов мононуклеарами периферической крови здоровых доноров - медиана, 1-й и 3-й квартили;
- в табл. 2 - показатели функциональной активности нейтрофилов in vitro;
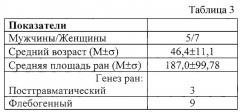
- в табл. 3 - характеристика первой исследуемой группы;
- в табл. 4 - характер цитологической картины ран до и на фоне применения супернатанта эмбриональных фибробластов;
- в табл. 5 - характеристика второй исследуемой группы;
- в табл. 6 - показатели эффективности лечения супернатнтом эмбриональных фибробластов во второй исследуемой группе - медиана (1 квартиль; 3 квартиль);
- на фиг.1 - влияние супернатанта эмбриональных фибробластов на продукцию ФНО-α мононуклеарами периферической крови здоровых доноров;
- на фиг.2 - влияние супернатанта эмбриональных фибробластов на ЛПС-стимулированную продукцию ИЛ-1β мононуклеарами периферической крови здоровых доноров;
- на фиг.3 - влияние супернатанта эмбриональных фибробластов на продукцию раИЛ-1 мононуклеарами периферической крови здоровых доноров;
- на фиг.4 - влияние супернатанта эмбриональных фибробластов на адгезию нейтрофилов к пластику;
- на фиг.5 - влияние супернатанта эмбриональных фибробластов на активность миелопероксидазы нейтрофилов in vitro;
- на фиг.6 - влияние супернатанта эмбриональных фибробластов на показатели НСТ-теста нейтрофилов in vitro;
- на фиг.7 - влияние супернатанта эмбриональных фибробластов на активность кислой фосфатазы нейтрофилов in vitro.
На всех чертежах и во всех таблицах: *1 - р<0,05 по сравнению с контролем; *2 - р<0,05 между группами с воздействием СЭФ и СЭФdex. Для статобработки использовали критерии Фридмана, Уилкоксона, Ньюмена-Кейлса и парный критерий Стъюдента.
Способ осуществляется следующим образом.
Перевиваемые линии ЭФ получали стандартными методами механической и ферментативной дезагрегации тканей эмбриона 7-12 недель трипсином с последующим культивированием в питательной среде 199, дополненной 10% сыворотки крови крупного рогатого скота, в стандартных условиях. С целью проведения опыта ЭФ высевали в лунки 24-луночного планшета при плотности посева 1×106/мл в той же питательной среде. По достижении монослоя к ЭФ в часть лунок вносили дексаметазон в концентрации 10-4 моль/л и инкубировали в стандартных условиях в течение 3 часов, после чего ЭФ трижды отмывались бессывороточной средой 199. К отмытым ЭФ вносили полную питательную среду 199 с 10% сыворотки крови крупного рогатого скота. Через сутки из периферической крови здоровых доноров выделяли фракцию нейтрофилов (НФ) и мононуклеарных клеток (МНК) с использованием ступенчатого градиента фиколл-урографин с относительной плотностью 1,114 и 1,077. После отмывки МНК ресуспендировали в полной питательной среде RPMI-1640 с добавлением 5% эмбриональной телячьей сыворотки и вносили в лунки 24-луночного планшета в конечной концентрации 1×106/лунку. К МНК добавляли суточный супернатант ЭФ в различном соотношении. В часть лунок вносили ЛПС в концентрации 10 мкг/лунку. Клетки инкубировали в течение суток в СО2-инкубаторе и по окончании культивирования оценивали концентрацию ФНО-α и ИЛ-1β в твердофазном ИФА с использованием тест-систем фирмы “Протеиновый контур” (Санкт-Петербург, Россия). Полученные результаты представлены в табл. 1 и на фиг.1-3. Как видно из фиг.1 и табл. 1, супернатант ЭФ статистически значимо стимулирует спонтанную продукцию ФНО-α, однако данный эффект не имеет клинического значения, поскольку концентрации ФНО-α сопоставимы с нормальным содержанием данного цитокина в сыворотке крови здорового человека.
Показатели активности нейтрофилов представлены в табл. 2 и на фиг.4-7.
Как видно из представленных результатов, ЭФ in vitro оказывали противовоспалительное влияние, выражавшееся в подавлении продукции провоспалительных цитокинов аллогенными мононуклеарными клетками в условиях стимуляции липополисахаридом, подавлении адгезионной способности аллогенных нейтрофилов. При этом отмечается стимуляция продукции рецепторного антагониста ИЛ-1 мононуклеарами, особенно в условиях индукции липополисахаридом, и повышение активности факторов бактерицидности нейтрофилов. Ингибирующее влияние супернатанта на продукцию провоспалительных цитокинов потенцировалось предварительной обработкой фибробластов дексаметазоном в концентрации 10-4 моль/л.
На основании полученных in vitro результатов было проведено исследование клинической эффективности супернатанта модифицированных дексаметазоном в указанной концентрации фибробластов в лечении воспалительной патологии кожи и слизистых при его местном применении. В качестве воспалительной патологии служили длительно незаживающие гранулирующие раны (первая исследуемая группа) и неспецифический язвенный колит, дистальная форма (вторая исследуемая группа).
В первую исследуемую группу были включены 12 больных с гранулирующими ранами различного генеза (табл. 3), у которых на фоне проводимой стандартной терапии (мази левосин, левомеколь, мази и гель солкосерил, гиалуронат цинка - “Куриозин”® [Gedeon Richter, Венгрия]) не отмечалось заживления ран. У двоих больных ранее было выполнено по 3 свободных кожных пластики расщепленным кожным лоскутом с лизисом аутотрансплантатов. На момент начала исследования раны характеризовались вялым ростом грануляционной ткани, наличием скудной серозной экссудации. Клеточный состав ран в основном характеризовался преобладанием воспалительного процесса над регенераторным (табл. 4).
Супернатант применялся в виде влажно-высыхающих повязок 1 раз в день на предварительно обработанную 0,09% раствором гипохлорита натрия и просушенную рану. Лечение проводили в течение 5-12 суток до начала активного роста здоровой грануляционной ткани, после чего выполнялась свободная кожная пластика расщепленным или перфорированным 1:2 кожным лоскутом. В послеоперационном периоде СЭФdex продолжали применять 1 раз в день до полного приживления аутотрансплантата. Выраженность воспалительной реакции в ране оценивали по клеточному составу мазков-отпечатков, окрашенных гематоксилином-эозином. Цитологическая картина в ранах накануне аутодермопластики характеризовалась наличием активного регенераторного процесса (табл. 4). Аутодермопластика была проведена 10 из 12 больных. У двух больных с посттравматической раной и флебогенной трофической язвой соответственно через 12 и 139 дней наступила самостоятельная полная эпителизация.
Во время операции во всех случаях отмечалось прилипание трансплантата к ране, а на третьи сутки механического смещения лоскута с раны не наблюдалось. Приживление аутотрансплантата с закрытием перфорационных отверстий за счет краевой эпителизации наблюдалось на 4-6 сутки. Ни в одном случае лизиса трансплантатов не было. Каких-либо побочных эффектов или осложнений в процессе исследования не отмечено, больные выписаны с выздоровлением.
Во вторую исследуемую группу (табл. 5) были включены 20 больных с левосторонней и дистальной формами неспецифического язвенного колита, у которых на фоне приема сульфасалазина в дозе 1,5-2 г/сут и местного введения гидрокортизона в капельных ректальных клизмах не удавалось добиться наступления клинической ремиссии.
Местное введение СЭФdex в данном случае могло бы послужить альтернативой системному назначению глюкокортикоидов. СЭФdex применяли в виде микроклизм по 30 мл 1 раз в сутки в течение 14 дней. Критерии оценки эффективности лечения и средние показатели до и после лечения представлены в табл. 6.
Как видно из представленных данных, супернатант модифицированных дексаметазоном эмбриональных фибробластов оказывал статистически значимое противовоспалительное действие на течение процесса в ранах различного генеза и эрозивно-язвенного поражения кишечника. Указанное влияние выражалось в купировании клинических проявления воспаления, изменении цитологической картины в мазках-отпечатках из ран и видимого улучшения эндоскопической картины поражения кишечника.
В процессе лечения у двоих больных во второй исследуемой группе (6,67%, доверительный интервал 0-20% согласно биномиальному распределению) в первые 2 дня лечения было отмечено появление чувства жжения в области прямой кишки в течение 15-30 минут после введения супернатанта, которое купировалось самостоятельно и не служило поводом для прекращения лечения. Каких-либо других побочных эффектов или осложнений в процессе исследования отмечено не было.
Таким образом, супернатант модифицированных дексаметазоном в концентрации 10-4 моль/л эмбриональных фибробластов позволяет уменьшить явления воспаления и способствует активации регенераторных процессов как в кожных ранах, так и при эрозивно-язвенных поражениях слизистых. При этом он обладает слабо выраженным местно-раздражающим побочным действием, проявляющимся не более чем у 20% в первые дни от начала лечения, купирующимся самостоятельно и не требующим отмены препарата или применения других лекарственных средств.
Клинический пример №1. Больной П., 45 лет. Жалобы на ноющие боли внизу живота, жидкий стул до 6-8 раз в сутки с примесью крови и слизи. Страдает дистальной формой неспецифического язвенного колита в течение 3 лет. Последнее обострение около 1 месяца. Лечение сульфасалазином в дозе 1,5 г/сут, метилурацилом, мезимом, тавегилом, платифиллином, солкосерилом и микроклизмами с гидрокортизоном без эффекта. При RRS: тубус введен на 24 см. Слизистая до 15-16 см отечная, ярко-розовой окраски, зернистой структуры. В нижнем ампулярном отделе единичные эрозии. В просвете большое количество гноеродной слизи. Крипты отечные, раздражены. Выше 15 см отек и гиперемия уменьшаются. Сосудистый рисунок прослеживается. количество слизи незначительное. Микроклизмы с гидрокортизоном были заменены на микроклизмы с СЭФdex по 30 мл 1 раз в сутки. Через неделю самочувствие значительно улучшилось, болевой синдром купирован, примесь крови и слизи в кале заметно уменьшилась. Еще через неделю достигнута полная клиническая ремиссия.
Клинический пример №2. Больная К., 67 лет. Диагноз: посттромбофлебитическая болезнь правой голени с трофическими нарушениями - язва правой голени. Длительность существования указанной язвы около 1 года. За это время проводилось местное лечение мазями “Левомеколь” и “Биопин 5%”, гелем “Солкосерил”, препаратом гиалуроната цинка “Куриозин”, растворами антисептиков (фурацилин, гипохлорит натрия), системное курсовое лечение “Эскузаном”, “Анавенолом”. Несмотря на проводимую терапию, размеры язвы постепенно увеличивались. На момент осмотра на медиальной стороне правой голени трофическая язва размерами 10×15 см в диаметре, около 1,5 мм глубиной, чистая, края язвы фестончатого типа, на дне - вялые грануляции светло-розового цвета, экссудация минимальная, серозная. Кожа вокруг язвы гиперпигментирована, плотная. В мазке-отпечатке с раны - воспалительно-регенераторный тип цитограммы. При бакисследовании соскоба с дна язвы получен отрицательный результат. У больной имела место сопутствующая патология в виде ИБС: стенокардии напряжения, III ФК; постоянной мерцательной аритмии, нормосистолической формы. НК IIА, что являлось противопоказанием к выполнению планового оперативного вмешательства - аутодермопластики.
Начаты перевязки с СЭФdex 1 раз в день. Через неделю отчетливо определялась тенденция к краевой эпителизации трофической язвы, которая сохранялась на протяжении всего периода лечения (4,5 месяца). В результате достигнута полная эпителизация трофической язвы.
Способ местного лечения эрозивно-язвенных поражений кожи и слизистых с использованием культивируемых вне организма диплоидных эмбриональных фибробластов, отличающийся тем, что фибробласты предварительно подвергают воздействию дексаметазоном в концентрации 10-4 моль/л в культуральных условиях в течение 1 ч с последующей отмывкой от препарата и сменой среды, и в дальнейшем применяют образуемый ими суточный супернатант в виде локального нанесения на пораженный участок один раз в сутки.