Производные спиро(2h-1-бензопиран-2,4`-пиперидина) как ингибиторы транспорта глицина
Иллюстрации
Показать всеНастоящее изобретение относится к новым производным спиро[2Н-1-бензопиран-2,4’-пиперидина], имеющим общую формулу (I)
где пунктирная линия обозначает необязательную связь;
Y обозначает 1-4 заместителя, независимо выбираемые из водорода, галогена, (С1-6)алкила (необязательно замещенного одним или более галогенами), (C1-6)алкилокси (необязательно замещенного одним или более галогенами или (С3-6)циклоалкилом), (С2-6)алкенилокси, (С2-6)алкинилокси, (С3-6)циклоалкилокси, (С6-12)арилокси, арилалкилокси, пиридилметокси, SR3, NR3R4, OSO2R5 и NR3SO2R4;
2 заместителя Y могут вместе образовывать O-(СН2)n-O или O-(CF2)n-O, где n принимает значение 1 или 2; или Y обозначает конденсированную (С5-6)арильную группу;
X обозначает 1-3 заместителя, независимо выбираемые из водорода, галогена, гидрокси, (C1-6)алкилокси, и (С1-4)алкила;
r1 обозначает водород, (С1-4)алкил или (C6-12)арил;
r2, r3 и R4 обозначают независимо водород или (C1-4)алкил;
R5 обозначает (С6-12)арил; или его фармацевтически приемлемой соли. Изобретение также относится к фармацевтическим композициям, включающим указанные производные, обладающим активностью в отношении ЦНС. Технический результат - получение новых соединений с ценным фармакологическим действием. 2 н. и 7 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к производным спиро[2Н-1-бензопиран-2,4’-пиперидина], к фармацевтическим композициям, включающим их, а также к применению указанных производных спиро[2Н-1-бензопиран-2,4’-пиперидина] в терапии.
Простейшая α-аминокислота глицин имеет множество важных функций в центральной нервной системе (ЦНС) млекопитающих. Вместе с γ-аминомасляной кислотой (ГАМК) она является основным пост-синаптическим ингибитором проведения нервного импульса в спинном мозге и в стволе головного мозга, действуя через лиганд, находящийся у входа в ионные каналы. Антагонистом взаимодействия глицина с указанными рецепторами, может быть алкалоид стрихнин. В этой связи указанные рецепторы рассматриваются как рецепторы глицина, “чувствительные к стрихнину”. Глицинергическая нейротрансмиссия важна для осуществления и регуляции зрительной, слуховой и двигательной сигнальных систем. Глицин также является обязательным соагонистом, действующим вместе с глютаматом на рецептор N-метил-D-аспартата (NMDA). Таким образом, глицин функционирует в цепи проведения нервного возбуждения модулируя действие глютамата - основного нейромедиатора в цепи проведения нервного возбуждения в ЦНС. Кроме того, указанная аминокислота играет роль в метаболизме пептидов и белков, включая обмен моноуглеродных соединений.
Регуляция доступности глицина для участия в указанных выше процессах может оказывать влияние на их функционирование и представлять собой средство для лечения множества заболеваний и состояний. Одним из основных процессов, контролирующих концентрацию свободного глицина вблизи “стрихнин-чувствительных” и “стрихнин-нечувствительных” рецепторов глицина, является, кроме метаболизма, функционирование селективных переносчиков с высокой аффинностью к глицину. Указанные белки могут активно ограничивать распространение глицина за пределы непосредственного окружения рецепторов, поддерживая таким образом пространственную и временную точность активации рецептора. Быстрое выделение медиатора в нейрональные или глиальные клетки с помощью переносчика способствует также сохранению глицина для последующего высвобождения.
В результате клонирования переносчиков глицина были выявлены два основных класса: GlyT-1 и GlyT-2. GlyT-1 экспрессируется всем мозгом, при этом наибольший уровень мРНК обнаруживается в каудальных зонах и клетки локализуются преимущественно в глиальной области. Кимом с соавт (Kirn et al., Molecular Pharm. 1994, 45, 608-617) были идентифицированы три изоформы GlyT-1: 1a, 1b и 1с, возникающие в результате дифференциального сплайсинга и использования экзона. Недавно в заявке на европейский патент ЕР 951543 (Allelix Neuroscience, Inc.) были раскрыты клонирование и экспрессия другой человеческой изоформы GlyT-1d.
По данным иммунохимических исследований распределение GlyT-2 четко соответствует локализации ингибитора “стрихнин-чувствительных” рецепторов глицина, в особенности в спинном мозге.
Можно ожидать, что посредством регуляции уровня глицина в синапсах, переносчики GlyT-1 и GlyT-2 будут селективно воздействовать, соответственно, на активность рецепторов NMDA и “стрихнин-чувствительных” рецепторов глицина.
Соединения, которые изменяют функциональную активность переносчиков глицина могут приводить к изменению уровня глицина в тканях, и в этой связи могут использоваться при лечении многих болезненных состояний. Такие болезненные состояния включают те состояния, которые связаны с пониженным или ухудшенным функционированием рецепторов NMDA, а именно:
психоз, депрессия, деменция и другие формы нарушения познавательной способности, такие как расстройство внимания. Рецепторы NMDA участвуют также в патогенезе состояний, возникающих в результате гибели нейрональных клеток и нейродегенерации, таких как, например, кровоизлияние (травма головы), болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона. Повышенное ингибирование глицинергического проведения нервного импульса, возникающее при ингибировании активности GlyT-2 или GlyT-1, может использоваться при лечении мышечной гиперактивности, связанной с мышечной спастичностыо, миоклонией и эпилепсией. Соединения, повышающие уровень глицина в спинном мозге, могут также обладать анальготическими свойствами.
Соединения, ингибирующие транспорт глицина через переносчиков Gly-T1 или Gly-T2, раскрыты в WO 97/45115 (Trophix Pharm. Inc.), в WO 97/45423 (Trophix Pharm. Inc.), в WO 99/34790 (Allelix Neuroscience Inc.) и в WO 00/07978 (Akzo Nodel N.V.) в качестве соединений, полезных при лечении указанных выше неврологических и нейропсихиатрических заболеваний. Исходя из сказанного, имеется потребность в дополнительных соединениях, пригодных для лечения психических и неврологических заболеваний, особенно в таких соединениях, которые обладают селективным фармакологическим профилем.
Было обнаружено, что производные спиро[2Н-1-бензопиран-2,4'-пиперидина], имеющие общую формулу I
где
пунктирная линия обозначает необязательную связь;
Y обозначает 1-4 заместителя, независимо выбираемые из водорода, галогена, (C1-6)алкила (необязательно замещенного одним или более галогенами), (C1-6)алкилокси (необязательно замещенного одним или более галогенами или (С3-6)циклоалкилом), (С2-6)алкенилокси, (С2-6)алкинилокси, (С3-6)циклоалкилокси, (С6-12)арилокси, (C7-15)арилалкилокси, гетероарилокси, гетероарилалкилокси, SR3, NR3R4, OSO2R5 и NR3SO2R4;
два заместителя Y могут вместе образовывать O-(СН2)n-O или O-(CF2)n-O, где n принимает значение 1 или 2; или Y обозначает конденсированную (C5-6)арильную группу;
Х обозначает 1-3 заместителя, независимо выбираемые из водорода, галогена, гидрокси, (C1-4)алкилокси, SR3, NR3SO2R4 и (C1-4)алкила, необязательно замещенного галогеном;
r1 обозначает водород, (С1-4)алкил или (С6-12)арил;
R2, R3 и R4 обозначают независимо водород или (С1-4)алкил;
r5 обозначает (С1-4)алкил (необязательно замещенный одним или более галогенами) или (С6-12)арил (необязательно замещенный (C1-4)алкилом);
или их фармацевтически приемлемая соль
селективно ингибируют транспорт глицина с помощью переносчика GlyT-1 человека, по сравнению с участием переносчика GlyT-2 человека, и могут применяться при лечении или профилактике шизофрении, депрессии, деменции и других формах нарушения познавательной способности или нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона, или мышечной гиперактивности, связанной с мышечной спастичностыо, миоклонией и эпилепсией.
Термин "(C1-6)алкил" в контексте определения формулы I обозначает алкильную группу с разветвленной или прямой цепью, содержащую 1-6 атомов углерода, типа гексила, пентила, неопентила, (2,2-диметилпропила), бутила, изобутила, третичного бутила, пропила, изопропила, этила и метила. Аналогично, термин (C1-4)алкил относится к алкильной группе, содержащей 1-4 атома углерода.
В термине "(C1-6)алкилокси" (C1-6)алкил обозначает разветвленную или неразветвленную алкильную группу, определенную выше. (C1-6)алкилокси группа может быть замещена 1-3 галогенами или (С3-6)циклоалкилом, который означает циклическую алкильную группу, содержащую 3-6 атомов углерода, типа циклопропила, циклобутила, циклопентила или диклогексила. Примеры таких замещенных (C1-6)алкилокси групп включают трифторметилокси и циклопропилметилокси.
Термин “галоген” обозначает F, Cl, Вr или I. В том случае, когда галоген представляет собой заместитель на алкильной группе, предпочтителен F. Предпочтительной галогензамещенной группой является трифторметил.
Термин "(С2-6)алкенил", такой как используемый в термине (С2-6)алкенилокси, означает разветвленную или прямоцепочечную алкенильную группу, содержащую 2-6 атомов углерода, такую как этенил (винил), 2-пропенил (аллил), изопропенил и 2-бутенил.
Термин "(С2-6)алкинил", такой как используемый в термине (С2-6)алкинилокси, означает разветвленную или прямоцепочечную алкинильную группу, содержащую 2-6 атомов углерода, такую как пропаргил.
В термине "(С6-12)арилокси", используемом в определении формулы I, (С6-12)арил означает ароматическую углеводородную группу, содержащую 6-12 атомов углерода, такую как фенил, нафтил, тетрагидронафтил, инденил или бифенил. Указанные ароматические группы могут быть замещены галогеном или (C1-4)алкилом или (C1-4)алкилокси, где (С1-4)алкил имеет указанные ранее значения и может быть замещен галогеном или (C1-4)алкилокси.
Термин "(C7-15)арилалкил", используемый в определении формулы I, означает арилалкильную группу, содержащую от 7 до 15 атомов углерода, причем указанная алкильная группа представляет (C1-6)алкильную группу и указанная арильная группа представляет (С6-12)арил, определенные ранее. Фенил(C1-6)алкильные группы представляют собой предпочтительно арилалкильные группы, такие как бензил.
Термин “гетероарил”, используемый в термине гетероарилокси, означает замещенную или незамещенную ароматическую группу, содержащую 6-12 атомов углерода и включающую по меньшей мере один гетероатом, выбираемый из N, О и S, типа, например, имидазолила, тиенила, бензтиенила, хинолинила и индолила. Гетероарильная группа может нести заместители, приведенные для арильной группы.
Гетероарилалкильные группы представляют собой аналоги (7-15)арилалкильных групп, включающих по меньшей мере один гетероатом, выбранный из N, О и S.
В определении формулы I Y может обозначать конденсированную (C5-6)арильную группу, что означает, что Y представляет собой 5- или 6-членное ароматическое кольцо, конденсированное с бензольным кольцом, к которому Х присоединяется с образованием (C11-12) ароматической кольцевой системы, наподобие нафталинового или инденового кольца.
В дополнение к определению R1, O-R1 группа в формуле I может представлять собой любую другую группу, из которой может быть получена (in vivo) свободная кислота (R1 обозначает водород). В технике известны такие альтернативные предшественники кислоты или пролекарства, такие как сложноэфирные или амидные производные, которые входят в объем настоящего изобретения.
Производные спиро [2Н-1-бензопиран-2,4’-пиперидина] формулы I и их соли могут содержать один или более стереогенных центров и могут существовать в виде стереоизомеров. В объем настоящего изобретения включены указанные стереоизомеры, а также энантиомеры соединений формулы I и их солей, которые по существу свободны от другого энантиомера, то есть содержат его менее, чем на 5%, предпочтительно, менее, чем на 2%, и в особенности, менее, чем на 1%, а также смеси таких стереоизомеров в любых пропорциях, включая рацемические смеси, содержащие по существу равные количества двух энантиомеров.
Предпочтительными являются производные спиро[2Н-1-бензопиран-2,4’-пиперидина] формулы I, в которых пунктирная линия обозначает связь, и более предпочтительны те соединения, в которых, кроме того, R1 и R2, оба, обозначают водород.
Особенно предпочтительные производные спиро[2Н-1-бензопиран-2,4’-пиперидина] согласно настоящему изобретению и их соли соответствуют соединениям формулы I, в которых пунктирная линия обозначает связь, R1 и R2 обозначают водород и Y обозначает заместитель в пара-положении, выбираемый из хлора, брома, (C1-4)алкилокси, (C1-4)алкенилокси, (C1-4)алкинилокси и NR3R4, и 1 или 2 заместителя в мета-положении, выбираемые из галогенов, при этом предпочтительным является фтор. Конкретные примеры предпочтительного замещения для Y включают: 3-фтор-4-метил, 3-фтор-4-хлор, 3-фтор-4-диметиламино и 3,3-дифтор-4-диметиламино. Особенно предпочтительны соединения формулы I, в которых Y обозначает 3-фтор-4-алкилокси, в частности 3-фтор-4-н-пропокси и 3-фтор-4-н-бутокси, и 3,5-дифтор-4-алкилокси.
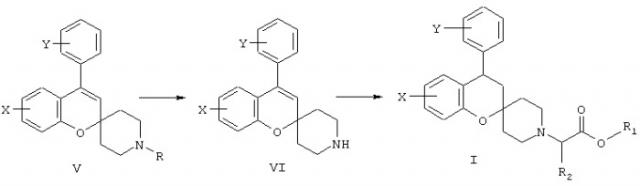
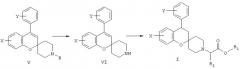
Производные спиро[2Н-1-бензопиран-2,4’-пиперидина] общей формулы I могут быть получены с помощью последовательности реакций, в которых 2’-гидроксиацетофеноновые производные формулы II, где Х имеет указанные выше значения, используются в качестве исходных материалов, и которые либо легко доступны коммерчески, либо могут быть получены синтезом с помощью методов, известных специалистам в области органического синтеза. Проводят конденсацию 2’-гидроксиацетофеноновых производных II с 1-метил-4-пиперидоном [R обозначает метил; в качестве альтернативы может использоваться 1-бензил-4-пиперидон (R обозначает бензил), бензильная группа зачастую легче удаляется, чем метильная группа (см. схему С)] в метанольном растворе в присутствии пирролидина для получения производных N-метил-спиро[2Н-1-бензопиран-2,4’-пиперидин]-4(3Н)-она, имеющего формулу III, показанную на схеме А:
Схема А.
Спиро-кето производные формулы III. затем подвергают обработке, как показано на схеме В, с использованием реагента Гриньяра формулы IV, где Y имеет указанное выше значение, в подходящем растворителе, таком как тетрагидрофуран, с получением после обработки кислотой производных 4-арил-N-метил- или N-бензил-спиро[2Н-1-бензопиран-2,4’-пиперидина] формулы V.
Схема В.
Альтернативно, соединения формулы V могут быть получены при превращении спиро-кето производных формулы III, где R обозначает Н, метил или бензил, в енолтрифлатное производное III’’ с последующим проведением реакции связывания Сузуки с производным фенилбороновой кислоты IV’’ (схема В’’).
Схема В”.
N-дезалкилирование соединений формулы V с использованием 1-хлорэтилхлорформиата в хлорсодержащем растворителе, таком как 1,3-дихлорпропан или дихлорметан, приводит к получению интермедиата в виде производных 4-арил-спиро[2Н-1-бензопиран-2,4’-пиперидина] формулы VI, которые далее подвергаются алкилированию в реакции с HalCH2R2-COOR1, где R1 может представлять (С1-4)алкил или (С6-12)арил, R2 имеет указанное ранее значение и Hal обозначает галоген, предпочтительно бром, с получением производных 4-арил-спиро[2Н-1-бензопиран-2,4’-пиперидина] формулы I, как показано на схеме С, сложноэфирная группа которого гидролизуется с образованием соединений формулы I, где R1 обозначает водород.
Схема С.
В том случае, когда требуемый реагент Гриньяра формулы IV недоступен коммерчески, его получают из соответствующего бромарена с помощью стандартной процедуры (The Handbook of Grignard Reagents, ed. G.S. Silverman and P.E. Rakita, 1996, Marcel Dekker, New York).
Соединения согласно настоящему изобретению могут использоваться при лечении шизофрении, депрессии, деменции и других форм нарушения познавательной способности, для лечения или профилактики нейродегенеративных расстройств, возникающих после кровоизлияний(инсульта) или травмы головы, для лечения нейродегенеративных заболеваний, таких как болезни Альцгеймера, Паркинсона и Хантингтона, для лечения мышечной гиперактивности, связанной с мышечной спастичностью, миоклонией и эпилепсией, для лечения или профилактики боли, расстройств настроения или расстройств, связанных с нарушением способности к обучению.
Соединения согласно настоящему изобретению могут обладать одним или более стереогенными центрами и могут быть получены в виде чистых стереоизомеров или в виде смеси стереоизомеров. В уровне технике известны методы ассиметричного синтеза, в результате которых получают чистые стереоизомеры и которые включают, например, синтез с хиральной индукцией, энантиоселективный ферментативный гидролиз сложного эфира, кристаллизацию солей, полученных из оптически активных кислот и рацемической смеси, разделение стереоизомеров или энантиомеров с помощью хроматографии на хиральных средах или хроматографии в прямой фазе или в обращенной фазе. Указанные методы описаны, например, в Chirality in Industry (edited by A.N. Collins, G.N. Sheldrake and J. Crosby, 1992; John Wiley).
Фармацевтически приемлемые соли соединений формулы I могут быть получены обработкой свободного основания соединений формулы I минеральной кислотой, такой как хлористоводородная кислота, фосфорная кислота, серная кислота, предпочтительно хлористоводородная кислота, или органической кислотой, такой как, например, аскорбиновая кислота, лимонная кислота, винная кислота, молочная кислота, малеиновая кислота, малоновая кислота, фумаровая кислота, гликолевая кислота, янтарная кислота, пропионовая кислота, уксусная кислота, метансульфоновая кислота и др.
Фармацевтически приемлемые соли соединения формулы I, в которых R1 обозначает водород, могут быть получены обработкой кислоты или цвиттерионной формы указанных соединения органическим основанием или неорганическим основанием, таким как гидроксид натрия, калия или лития.
Другим объектом изобретения являются фармацевтические композиции, включающие производное спиро[2Н-1-бензопиран-2,4’-пиперидина] формулы I или его фармацевтически приемлемые соли в смеси с фармацевтически приемлемыми добавками.
Фармацевтические композиции, применимые согласно настоящему изобретению, включают производное спиро[2Н-1-бензопиран-2,4’-пиперидина] формулы I или его фармацевтически приемлемую соль в смеси с фармацевтически приемлемыми добавками и необязательно с другими терапевтическими средствами. Термин “приемлемый” означает совместимость данного агента с другими ингредиентами композиции и безвредность для реципиента. Композиции могут быть получены с помощью стандартных методик, таких как, например, описаны в стандартном руководстве Gennaro et al., Remington’s Pharmaceutical Science, (18 th ed., Mack Publishing Company, 1990, см. в особенности Part 8: Pharmaceutical Preparations and Their Manufacture).
Композиции включают, например, такие композиции, которые пригодны для перорального, сублингвального, интраназального, подкожного, внутривенного внутримышечного, местного и ректального и др. введения, в виде стандартных дозированных форм.
Для случая перорального введения активный ингредиент может быть представлен в виде дискретных единиц, таких как таблетки, капсулы, порошки, гранулированные средства, растворы и суспензии.
Для случая парентерального введения фармацевтическая композиция согласно настоящему изобретению может быть представлена в виде разовой дозы или в виде контейнеров с многократной дозой, в частности, для инъекции жидкостей в заданных количествах, например, в запаянных флаконах и ампулах, а также может храниться в высушенном замораживанием (лиофилизированном) виде, которое требует лишь добавления стерильного жидкого носителя, например, воды, перед использованием.
Соединения согласно настоящему изобретению могут вводиться людям в дозе 0,001-50 мг на кг веса тела, предпочтительно, в дозе 0,01-20 мг на кг веса тела.
Настоящее изобретение также включает фармацевтическую композицию, указанную выше, в сочетании с упаковочным материалом, подходящим для данной композиции, причем указанная упаковка включает инструкцию по употреблению композиции с целью описанного выше применения.
Изобретение иллюстрируется с помощью приведенных ниже примеров.
Основные примечания.
Все масс-спектрометрические анализы проведены либо с использованием приборов РЕ SCIEX API 150EX, либо РЕ SCIEX API
365. Точки плавления не корректированы и определялись с использованием либо приборов системы Leica Galen III, либо Leica VMHB System Kofler.
Пример 1
Гидрохлорид 1’-карбоксиметил-7-метокси-4-фенилспиро[2Н-1-бензопиран-2,4’-пиперидина]
Стадия А: 7-метокси-Н-метилспиро[2Н-1-бензопиран-2,4’-пиперидин]-4(3Н)-он
К перемешиваемому раствору 2-гидрокси-4-метоксиацетофенона (4,08 г, 24,58 ммоль) в безводном метиловом спирте (60 см3) в атмосфере сухого азота добавляют 1-метил-4-пиперидинон (3 см3, 24,58 ммоль) и затем пирролидин (4 см3, 47,92 ммоль) и раствор нагревают до температуры кипения с обратным холодильником. Через 7 часов добавляют еще порцию 1-метил-4-пиперидинона (0,6 см3, 4,76 ммоль) и смесь нагревают до температуры кипения с обратным холодильником в течение еще 4,5 часов. Затем смеси позволяют охладиться до комнатной температуры, после чего летучие фракции удаляют при пониженном давлении. Образовавшееся масло обрабатывают дихлорметаном (100 см3), промывают водой (5×100 см3) и сушат над безводным сульфатом натрия с получением темного вязкого масла (6,33 г, 24,25 ммоль), которое частично кристаллизуется при стоянии в течение длительного периода времени.
Стадия В: 7-метокси-N-метил-4-фенилспиро[2Н-1-бензопиран-2,4'-пиперидин]
К перемешиваемому раствору 7-метокси-N-метилспиро[2Н-1-бензопиран-2,4’-пиперидин]-4(3Н)-она (6,19 г, 23,72 ммоль) в безводном тетрагидрофуране (80 см3) в атмосфере безводного азота добавляют по каплям раствор фенилбромида магния в тетрагидрофуране (40 см3, 1,0 М, 40 ммоль), поддерживая температуру реакции ниже 30°С. После завершения добавления реакционную смесь перемешивают при комнатной температуре в течение 2,5 часа, к этому времени реакция еще не завершается, но реагент Гриньяра отсутствует. Далее осторожно добавляют еще порцию фенилбромида магния (13,3 см3) и реакционную смесь перемешивают в течение ночи. Добавляют воду (30 см3) и затем насыщенный водный раствор хлорида аммония (30 см3). В вакууме удаляют летучие продукты и затем полученный материал обрабатывают диэтиловым эфиром (100 см3) и водой (100 см3). Отделяют органический слой и водную часть экстрагируют диэтиловым эфиром (2×100 см3). Объединенные экстракты промывают водой (3×100 см3), сушат над сульфатом натрия и эфир удаляют в вакууме. Остаток растирают с небольшим количеством диэтилового эфира и полученные кристаллы отделяют посредством фильтрования в вакууме (4,57 г, 12,15 ммоль), 51%). Твердый материал поглощают этиловым спиртом (75 см3) и обрабатывают хлористоводородной кислотой (75 см3, 2 н), после чего начинают нагревание до температуры кипения с обратным холодильником в течение 1,5 часа. Раствор концентрируют при пониженном давлении до начала кристаллизации. Затем смесь охлаждают и твердый материал отделяют фильтрованием в вакууме. Затем указанный материал обрабатывают смесью воды (300 см3), насыщенного водного раствора бикарбоната калия (50 см3) и диэтилового эфира (650 см3) и встряхивают. Водный слой отделяют и экстрагируют диэтиловым эфиром (2×100 см3) и затем объединенные экстракты промывают водой (3×250 см3), сушат над сульфатом натрия и летучие продукты удаляют в вакууме с получением указанного в заголовке соединения (3,91 г, 12,18 ммоль, 51% из кетона).
Стадия С: 7-метокси-4-фенилспиро[2Н-1-бензопиран-2,4’-пиперидин]
К перемешиваемому раствору 7-метокси-N-метил-4-фенилспиро[2Н-1-бензопиран-2,4’-пиперидина] (3,76 г, 11,71 ммоль) в безводном 1,2-дихлорпропане (150 см3) добавляют карбонат калия (4,04 г, 29,23 ммоль) и полученную суспензию охлаждают на ледяной бане, после чего добавляют по каплям 1-хлорэтилхлорформиат (1,58 см3, 14,64 ммоль). Реакционную смесь нагревают при температуре кипения с обратным холодильником в течение ночи и добавляют еще порцию 1-хлорэтилхлорформиата (0,8 см3, 7,4 ммоль) и смесь нагревают до температуры кипения с обратным холодильником в течение еще 24 часов. При охлаждении реакционную смесь фильтруют через хлопчатобумажный фильтр, который впоследствии промывают дихлорметаном (50 см3) и летучие фракции удаляют в вакууме. Полученный интермедиат обрабатывают метиловым спиртом (200 см3) и смесь нагревают при температуре кипения с обратным холодильником в течение ночи. При охлаждении летучие продукты удаляют в вакууме, после чего образовавшийся твердый материал растворяют в смеси дихлорметана (150 см3) и водного раствора карбоната натрия (5%, 30 см3). Органический слой отделяют, промывают водой (2×50 см3), сушат над сульфатом натрия и растворитель удаляют в вакууме с получением указанного в заголовке соединения в виде камеди (3,93 г).
Стадия D: этил 7-метокси-4-фенилспиро[2Н-1-бензопиран-2,4’-пиперидин]-1’-ацетат
К раствору 7-метокси-4-фенилспиро[2Н-1-бензопиран-2,4’-пиперидина] (3,85 г, 12,54 ммоль) в безводном N,N-диметилформамиде (75 см3) добавляют карбонат калия (4,32 г, 31,30 ммоль) и затем этилбромацетат (1,39 см3, 12,53 ммоль) и смесь нагревают до 100°С в атмосфере азота в течение 2 часов. Полученную смесь выливают в воду (600 см3) и экстрагируют этилацетатом (3×150 см3). Объединенные органические экстракты промывают водой (3×300 см3), сушат над сульфатом натрия и летучие продукты удаляют в вакууме. Указанный неочищенный продукт очищают хроматографией на колонке (силикагель, при элюировании смесью дихлорметан-этилацетат в соотношении от 9:1 до 4:1), что дает чистый этиловый сложный эфир (3,51 г, 71%).
Стадия Е:
Смесь этил 7-метокси-4-фенилспиро[2Н-1-бензопиран-2,4’-пиперидин]-1’-ацетата (3,38 г; 8,60 ммоль), этилового спирта (250 см3) и водного раствора гидроксида лития (2 н, 6,44 см3 12,88 ммоль) нагревают при температуре кипения с обратным холодильником в течение 3,5 часа. При охлаждении смесь обрабатывают соляной кислотой (5 н, 70 см3) и некоторое количество этилового спирта удаляют до начала выпадения осадка. Затем смесь охлаждают до 4°С до тех пор, пока не завершится кристаллизация. Твердый материал удаляют фильтрованием в вакууме с получением указанного в заголовке продукта в виде белого твердого вещества, Тпл. 195-230°С; положительный ион ESI (M+H)+ 366,4.
Приведенные ниже соединения получают аналогичным способом с использованием соответствующего производного 2’-гидроксиацетофенона формулы II (Схема А) и реагента Гриньяра формулы IV (Схема В):
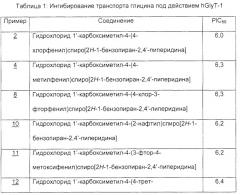
Пример 2: Гидрохлорид 1’-карбоксиметил-4-(4-хлорфенил)-спиро[2Н-1-бензопиран-2,4’-пиперидина]: Тпл. 259-265°С; положительный ион ESI (M+H)+ 370,0.
Пример 3: 4-(4-фторфенил)спиро[2Н-1-бензопиран-2,4’-пиперидин]-1'-ацетат лития:
Литиевую соль получают с помощью процедуры, аналогичной описанной в примере 1 (стадия Е) за исключением того, что гидролиз сложного этилового эфира проводят с использованием 1,02 молярных эквивалентов водного раствора гидроксида лития (2,0 н) и по завершению реакции летучие продукты удаляют в вакууме. Тпл. 285-291°С (разлож.); положительный ион ESI (M+H)+ 354/2.
Пример 4: Гидрохлорид 1’-карбоксиметил-4-(4-метилфенил)-спиро[2Н-1-бензопиран-2,4’-пиперидина]: Тпл. 247-249°С; положительный ион ESI (M+H)+ 352,2.
Пример 5: 6-Фтор-4-фенилспиро[2Н-1-бензопиран-2,4’-пиперидин]-1’-ацетат лития: Тпл. 293-298°С (разлож.); отрицательный ион ESI (M+H)+ 354,2.
Пример 6: Гидрохлорид 1’-карбоксиметил-6-метил-4-фенилспиро[2Н-1-бензопиран-2,4’-пиперидина]: Тпл. 240-244°С; положительный ион ESI (M+H)+ 350,2.
Пример 7: Гидрохлорид 1’-карбоксиметил-7-фтор-4-фенилспиро[2Н-1-бензопиран-2,4’-пиперидина]: Тпл. 237-242°С; положительный ион ESI (M+H)+ 354,2.
Пример 8: Гидрохлорид 1’-карбоксиметил-4-(4-хлор-3-фторфенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: Тпл. 263-274°С; положительный ион ESI (M+H)+ 388,2.
Пример 9: Гидрохлорид 1’-карбоксиметил-4-(1-нафтил)-спиро[2Н-1-бензопиран-2,4’-пиперидина]: Тпл. 237-252°С; положительный ион ESI (M+H)+ 385,9.
Пример 10: Гидрохлорид 1’-карбоксиметил-4-(2-нафтил)-спиро[2Н-1-бензопиран-2,4’-пиперидина]: Тпл. 253-264°С; положительный ион ESI (M+H)+ 386,2.
Пример 11: Гидрохлорид 1’-карбоксиметил-4-(3-фтор-4-метоксифенил)спиро[2Н-1-бензопиран-2,4’-пиперидина] Тпл. 252-261°С; положительный ион ESI (M+H)+ 384,2.
Пример 12: Гидрохлорид 1’-карбоксиметил-4-(4-трет-бутилфенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: положительный ион ESI (M+H)+ 392,2.
Пример 13: Гидрохлорид 1’-карбоксиметил-4-(3-фторфенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: положительный ион ESI (M+H)+ 354,4.
Пример 14: Гидрохлорид 4-(1,3-бензодиоксоло)-1’-карбоксиметилспиро[2Н-1-бензопиран-2,4’-пиперидина]: Тпл. 260-265°С; положительный ион ESI (M+H)+ 380,4.
Пример 15: Гидрохлорид 1’-карбоксиметил-4-(3,4-диметилфенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: Тпл. 224-234°С; положительный ион ESI (М+Н)+ 361,9.
Пример 16: Гидрохлорид 1’-карбоксиметил-4-(3,4-дихлорфенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: положительный ион ESI (M+H)+ 404,0.
Пример 17: Гидрохлорид 1’-карбоксиметил-4-(3,4-диметоксифенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: положительный ион ESI (M+H)+ 396,2.
Пример 18: Гидрохлорид 1’-карбоксиметил-4-(3,4,5-трифторфенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: Тпл. 242-250°С; положительный ион ESI (М+H)+ 390,1.
Пример 19: Гидрохлорид 1’-карбоксиметил-7-фтор-4-(4-метилфенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: Тпл. 153-163°С; положительный ион ESI (M+H)+ 368,0.
Пример 20: Гидрохлорид 1’-карбоксиметил-4-(4-метоксифенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: положительный ион ESI (M+H)+ 399,6.
Пример 21: Гидрохлорид 1’-карбоксиметил-4-(3-хлорфенил)-спиро[2Н-1-бензопиран-2,4’-пиперидина]: положительный ион ESI (M+H)+ 370,2.
Пример 22: Гидрохлорид 1’-карбоксиметил-4-(3-метокси-фенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: положительный ион ESI (М+Н)+ 366,4.
Пример 23: Гидрохлорид 1’-карбоксиметил-4-(3-метилфенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: положительный ион ESI (M+H)+ 350,0.
Пример 24: Гидрохлорид 1’-карбоксиметил-4-[4-(N,N-диметиламино)фенил]спиро[2Н-1-бензопиран-2,4’-пиперидина]
Указанное соединение получают с использованием методов, указанных в примере 1, за исключением того, что реакцию гидролиза на заключительной стадии Е проводят с 1,5 эквивалентами водного раствора гидроксида натрия (1 М). Как только реакция завершается, большую часть этилового спирта удаляют и полученные кристаллы собирают фильтрованием. Полученное твердое вещество обрабатывают избытком метанольного раствора хлористого водорода в течение 1 часа при комнатной температуре. Метиловый спирт удаляют в вакууме, а полученный продукт обрабатывают смесью 2-пропанол/метанол (1:1) и добавляют по каплям диэтиловый эфир до осаждения продукта. Указанный продукт отделяют фильтрованием и сушат; Тпл. 238-250°С; положительный ион ESI (M+H)+ 379,4.
Пример 25: Гидрохлорид 1’-карбоксиметил-4-(4-этилфенил)-спиро[2Н-1-бензопиран-2,4’-пиперидина]: положительный ион ESI (М+Н)+ 364,4.
Пример 26: Гидрохлорид 4-(4-бифенил)-1’-карбоксиметил-спиро[2Н-1-бензопиран-2,4’-пиперидина]: положительный ион ESI (М+Н)+ 412,2.
Пример 27: Гидрохлорид 1’-карбоксиметил-4-(4-феноксифенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: положительный ион ESI (М+H)+ 428,2.
Пример 28: Гидрохлорид 1’-карбоксиметил-4-(3-фтор-4-метилфенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: положительный ион ESI (М+Н)+ 368,2.
Пример 29: Гидрохлорид 1’-карбоксиметил-7-хлор-4-фенил-спиро[2Н-1-бензопиран-2,4’-пиперидина]: положительный ион ESI (M+H)+ 370,2.
Пример 30: Гидрохлорид 1’-карбоксиметил-6-хлор-4-фенил-спиро[2Н-1-бензопиран-2,4’-пиперидина]: положительный ион ESI (М+Н)+ 370,2.
Пример 31: Гидрохлорид 1’-карбоксиметил-7-хлор-4-(4-этилфенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: положительный ион ESI (М+Н)+ 398,2.
Пример 32: Гидрохлорид 1’-карбоксиметил-7-хлор-4-(4-пропилфенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: положительный ион ESI (М+Н)+ 412,2.
Пример 3 3: Гидрохлорид 1’-карбоксиметил-4-(2,2-дифтор-1,3-бензодиоксоло)спиро[2Н-1-бензопиран-2,4’-пиперидина]: Тпл. 248-250°С; положительный ион ESI (M+H)+ 416,2.
Пример 34: Гидрохлорид 1’-карбоксиметил-4-(2,3,5-трифторфенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: Тпл. 206-210°С; положительный ион ESI (M+H)+ 390,4.
Пример 35: Гидрохлорид 1’-карбоксиметил-7-хлор-4-(3-фтор-4-метилфенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: положительный ион ESI (M+H)+ 402,3.
Пример 36: Гидрохлорид 1’-карбоксиметил-4-(3,5-дифтор-4-метоксифенил)спиро[2Н-1-бензопиран-2,4'-пиперидина]: положительный ион ESI (M+H)+ 402,2 4-бром-2,6-дифторанизол, исходный материал для приготовления реагента Гриньяра формулы IV (схема В), получают из 4-бром-2,6-дифторфенола. К раствору фенола (49,0 г, 234 ммоль) в безводном ацетоне (980 см3) добавляют метилиодид (29,4 см3, 468 ммоль) и затем карбонат калия (80,85 г, 585 ммоль). Перемешиваемую смесь нагревают при температуре кипения с обратным холодильником в течение 2 часов, после чего позволяют смеси охладиться. Образовавшийся твердый материал отфильтровывают и фильтрат выпаривают в вакууме. Остаток переносят в диэтиловый эфир (1000 см3) и раствор промывают водой (3×300 см3), сушат (Na2SO4) и удаляют эфир в вакууме с получением неочищенного продукта, который используют для получения требуемого реагента Гриньяра без дополнительной очистки (49,4 г, 222 ммоль, 95%).
Пример 37: Гидрохлорид 1’-карбоксиметил-4-(4-диметиламино-3-фторфенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: Тпл. 231-239°С; положительный ион ESI (M+H)+ 397,4.
Пример 38: Гидрохлорид 1’-карбоксиметил-4-(3,5-дифтор-4-диметиламинофенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: Тпл. 231-242°С; положительный ион ESI (M+H)+ 415,0.
Пример 39: Гидрохлорид 4-(4-бром-3-фторфенил)-1’-карбоксиметил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: положительный ион ESI (М+Н)+ 432,5.
Пример 40: Гидрохлорид 1’-карбоксиметил-4-(3-бром-4-метоксифенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: положительный ион ESI (М+H)+ 444,1.
Пример 41: Гидрохлорид 1’-карбоксиметил-4-(3,5-дифторфенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: Тпл. 230-264°С; положительный ион ESI (M+H)4 372,2.
Пример 42: Гидрохлорид 1’-карбоксиметил-4-(3,5-дифтор-4-этоксифенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]:
Стадия А: Гидробромид 1’-карбоксиметил-4-(3,5-дифтор-4-гидроксифенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]
Смесь метилового эфира (2,35 г) в уксусной кислоте (15 см3) и 47% бромистоводородной кислоты перемешивают при 120°С в течение 40 часов. Полученную суспензию охлаждают в водяной бане со льдом и затем добавляют воду (30 см3). Твердый материал отделяют фильтрованием, промывают уксусной кислотой и затем водой, после чего сушат в вакууме.
Стадия В: Этил (3,5-дифтор-4-гидроксифенил)спиро[2Н-1-бензопиран-2,4’-пиперидин]-1’-ацетат
Гидробромид 1’-карбоксиметил-4-(3,5-дифтор-4-гидроксифенил)спиро[2Н-1-бензопиран-2,4’-пиперидина] (1,7 г, получен по методу, описанному на стадии А) суспендируют в растворе хлористого водорода в этиловом спирте (120 см3) и смесь нагревают при температуре кипения с обратным холодильником в течение 16 часов. При охлаждении летучие материалы удаляют в вакууме с получением твердого остатка, который распределяют между этилацетатом (100 см3) и смесью воды (100 см3) и насыщенного водного раствора бикарбоната калия (30 см3). Водный слой экстрагируют этилацетатом (2×50 см3), после чего объединенные экстракты промывают водой (2×50 см3) и сушат (Na2SO4). Неочищенный материал фильтруют через силикагель, используя в качестве элюента этилацетат, который затем выпаривают с получением твердого продукта (1,54 г).
Стадия С: Этил-(3,5-дифтор-4-этоксифенил)спиро[2Н-1-бензопиран-2,4’-пиперидин]-1’-ацетат
К этил (3,5-дифтор-4-гидроксифенил)спиро[2Н-1-бензопиран-2,4’-пиперидин]-1’-ацетату (350 мг), карбонату цезия (412 мг) и иодиду натрия (13 мг) добавляют N,N-диметилформамид (9 см3) и затем йодэтан (1,7 молярных эквивалента). Полученную смесь нагревают при перемешивании до 65°С в течение 3 часов. При охлаждении реакционную смесь разбавляют этилацетатом (90 см3) и затем промывают водой (5×35 см3) и сушат (Na2SO4). Указанный раствор неочищенного материала фильтруют затем через слой силикагеля, после чего растворитель удаляют в вакууме с получением гомогенного продукта.
Стадия D: Из этил (3,5-дифтор-4-этоксифенил)спиро[2Н-1-бензопиран-2,4’-пиперидин]-1’-ацетата в соответствии с процедурой, описанной в примере 1, получают гидрохлорид 1’-карбоксиметил-4-(3,5-дифтор-4-этоксифенил)спиро[2H-1-бензопиран-2,4’-пиперидина]: положительный ион ESI (M+H)+ 416,5.
Указанным методом получают также следующие соединения:
Пример 43: Гидрохлорид 1’-карбоксиметил-4-(3,5-дифтор-4-н-пропоксифенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: положительный ион ESI (M+H)+ 430,3.
Пример 44: Гидрохлорид 1’-карбоксиметил-4-(3,5-дифтор-4-н-бутоксифенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: положительный ион ESI (M+H)+ 444,4.
Пример 45: Гидрохлорид 1’-карбоксиметил-4-(4-бензилокси-3,5-дифторфенил)спиро[2Н-1-бензопиран-2,4’-пиперидина]: положительный ион ESI (M+H)+ 478/0.