Выделенный белок фактора роста кератиноцита (kgf), рекомбинантная молекула днк, вектор, способ конструирования клетки-хозяина, способ получения белка, фармацевтическая композиция
Иллюстрации
Показать всеИзобретение относится к биотехнологии, конкретно к факторам роста эпителиальных клеток, и может быть использовано для получения нового фактора роста кератиноцитов (KGF). Белок KGF получают путем культивирования рекомбинантной клетки-хозяина, трансформированной вектором, содержащим молекулу ДНК, которая кодирует аминокислотную последовательность белка KGF. Полученный белок KGF в составе фармацевтической композиции используют для стимуляции пролиферации эпителиальных клеток. Изобретение позволяет получить белок KGF, обладающий специфической митогенной активностью 3,4·104 единиц на мг белка в отношении кератиноцитных клеток. 7 н. и 45 з.п. ф-лы, 3 табл., 14 ил.
Реферат
Область изобретения.
Настоящее изобретение относится к факторам роста, особенно к выделению фактора роста, полипептида, аналогичного семейству факторов, включающему известные факторы роста фибробласта (FCF).
Настоящее изобретение относится также к конструированию сегментов комплементарной ДНК (cДНК) из информационной РНК (мРНК), кодирующей новый фактор роста. Кроме того, настоящее изобретение относится к синтезу продуктов таких ДНК сегментов рекомбинантными клетками, а также к производству и использованию некоторых других новых продуктов, получаемых в результате идентификации и клонирования ДНК, кодирующих такой фактор роста.
Сокращения, используемые в заявке
аFСF - фактор роста кислотного фибробласта
bFСF - фактор роста основного фибробласта
ЕСF - эпидермальный фактор роста
HCA - гепарин-Сефарозная сродственная хроматография
кb – килооснования
кДа – килодальтоны
КСF - фактор роста кератиноцита
NаДоdSО4/РАGЕ электрофорез в системе додецилсульфат натрия/SДS/полиакриламидный гель
RР-НРLС - обратимо-фазная хроматография высокого разрешения
ТGFа - трансформирующий фактор роста а.
Предпосылка создания изобретения
Факторы роста являются важными медиаторами межклеточной коммуникации. Такие мощные молекулы обычно выделяются клеткой одного типа и оказывают влияние на пролиферацию клеток другого типа (см. ссылку I-1 в Экспериментальном разделе I, ниже). Интерес к факторам роста усилился в результате получения свидетельств их потенциального участия в неоплазии (ссылка II-2 в Экспериментальном разделе II, ниже). У-sis трансформирующий ген вируса саркомы обезьян кодирует протеин гомологичный В цепи фактора роста - производного тромбоцита (I-1, I-2) Кроме этого, ряд онкогенов является гомологом генов, кодирующих рецепторы фактора роста (I-1). Таким образом, углубленное понимание путей сигнальной трансдукции, усиленной факторами роста или их рецепторами, по-видимому, может обеспечить проникновение в механизмы роста как нормальных, так и злокачественных клеток.
Известное семейство факторов роста, оказывающее влияние на клетки соединительной ткани, включает фактор роста кислотного фибробласта (аFcF), фактор роста основного фибробласта (bFСF) и родственные продукты hst и int-2 онкогенов.
Кроме того, известно, что некоторые факторы роста, включающие следующие разновидности, обладают гепарин-связующими свойствами aFcF (I-20, I-21), bFcF (I-19, I-20), фактор, стимулирующий гранулоцит/макрофаговую колонию (I-1), и интерлейкин 3 (I-1). Каждый из таких полипептидных факторов продуцируется стромальными клетками (I-1, I-2, I-25). По-видимому, такие факторы отлагаются во внеклеточной матрице или на протеогликанах, покрывающих поверхность стромальной клетки (I-1, I-25). Постулируется, что их хранение, выделение и контактирование с конкретными клетками-мишенями регулируется таким взаимодействием (I-25, I-28).
Однако хорошо известно, что большое число человеческих злокачественных образований является производными эпителиальных тканей (I-5). Были описаны эффекторы пролиферации эпителиальных клеток из мезенхимальных тканей (I-1, I-2, I-3), однако их молекулярная идентичность и структуры установлены не были. В свете дефицита сведений о мезинхимальных факторах роста, влияющих на эпителиальные клетки, совершенно понятно, что имеется необходимость в способах, композициях и биологических анализах, которые обеспечили бы углубленное знание и анализ механизмов регуляции пролиферации эпителиальных клеток и, особенно, необходимость в новых диагностических и терапевтических средствах, содержащих такие факторы.
Настоящее изобретение предусматривает применение методов выделения протеина и технологий на основе рекомбинантной ДНК для удовлетворения указанных потребностей и для создания средства продуцирования протеиновых факторов мезенхимального происхождения, которые, по-видимому, относятся к процессам пролиферации эпителиальных клеток и которые не могут быть получены иным путем. Настоящее изобретение также предусматривает применение механизмов действия таких факторов в отношении процессов роста эпителиальных клеток.
Сущность изобретения
Настоящее изобретение относится к разработке технологий выделения протеина и рекомбинантной ДНК, которые включают получение новых протеинов фактора роста, влияющих на эпителиальные клетки, которые не содержат других пептидных факторов. В сферу изобретения входят также новые сегменты ДНК и методы биологического анализа.
Главным образом настоящее изобретение относится к новому протеину, обладающему структурными и/или функциональными характеристиками известного семейства факторов роста, которое включает фактор роста кислотного фибробласта (аFCF), фактор роста основного фибробласта (bFBF) и родственные продукты hst и nit–2 - онкогенов. Такой новый член семейства FcF полипептидов сохраняет гепарин - связующие свойства FcF, но, кроме того, обладает уникальной специфичностью в отношении клетки-мишени. Такой фактор роста, по-видимому, специфичен по отношению к эпителиальным клеткам и проявляет особенную активность в отношении кератиноцитов. Поэтому такой новый фактор обозначен, как "фактор роста кератиноцита" (КСF). Несмотря на отсутствие активности в отношении фибробластов, поскольку такой фактор является шестым известным членом FCF полипептидного семейства, КСF может быть также обозначен, как FCF - 6.
В связи с этим, настоящее изобретение частично относится к очищенным КСF или КСF-подобным протеинам и способам получения таких протеинов. Такие очищенные факторы могут быть получены культивацией человеческих клеток, которые по своей природе секретируют такие протеины и применением методов выделения согласно практическому аспекту настоящего изобретения. Такие протеины могут использоваться для биохимических и биологических исследований, приводящих, например, к выделению сегментов ДНК, кодирующих KGF или КGF-подобные полипептиды.
Настоящее изобретение также относится к таким сегментам ДНК, которые кодируют KGF или КCF-подобные протеины. Согласно принципиальному воплощению настоящее изобретение относится к ДНК-сегментам, которые кодируют КGF-родственные продукты, состоящим из: человеческих сДНК клонов 32 или 49, полученных из полиаденилированной РНК экстрагированной из клеточной линии М426 человеческого эмбрионного легочного фибробласта; рекомбинантов и мутантов таких клонов; и родственных сегментов ДНК, которые могут детектироваться гибридизацией с любым из указанных выше сегментов человеческой ДНК; причем такие родственные сегменты кодируют КCF-подобные протеины или их части.
При практической реализации одного из воплощений настоящего изобретения ДНК-сегменты изобретения способны экспрессироваться в клетки подходящего хозяина в результате чего продуцируются КСF или КCF-подобные протеины. Настоящее изобретение также относится к мРНК, продуцированным в результате транскрипции чувствительных тяжей сегментов ДНК настоящего изобретения.
Согласно другому воплощению настоящее изобретение относится к молекуле рекомбинантной ДНК, включающей вектор и ДНК настоящего изобретения. Такие рекомбинантные молекулы могут быть представлены молекулами, включающими KCF сДНК и любую из следующих векторных ДНК: вектор, клонирующий бактериофаг λ (в качестве примера которого можно привести λ рСЕУ9); плазмидный вектор, устанавливающий последовательность ДНК (например, вариант рУС) вектор экспрессии бактериального гена (например, РКК233-2); или вектор экспрессии гена млекопитающего (такой как рММТ).
Согласно еще одному воплощению настоящее изобретение включает клетку, предпочтительно, клетку млекопитающего, трансформированную с помощью ДНК изобретения. Кроме этого, настоящее изобретение включает клетки, например, клетки насекомых, дрожжевые клетки и бактериальные клетки разновидностей Escherichia coli u B. subtilis, трансформированные ДНК настоящего изобретения. Согласно другому решению такого аспекта изобретения трансформирующая ДНК способна экспрессироваться в клетке, в результате чего в ней повышается количество KCF или КСF-подобного протеина закодированного такой ДНК.
Первичный продукт трансляции KCF, предсказанный на основании его сДНК последовательности, содержит N-терминальный гидрофобный участок, который вероятно служит сигнальной последовательностью для секреции и отсутствует в зрелой молекуле KCF. Согласно наиболее предпочтительному воплощению генно-экспрессионного аспекта изобретения клетка, трансформированная с помощью ДНК изобретения, секретирует протеин закодированный этой ДНК в такой форме (транкатированной), которая секретируется клетками человеческого эмбрионного легочного фибробласта.
Кроме этого, настоящее изобретение предусматривает KCF или КСF-подобные протеины, продуцированные экспрессией ДНК изобретения, или трансляцией РНК изобретения. Предпочтительно когда такие протеины находятся в секретированной форме (например, при отсутствии сигнальной последовательности). Такие протеиновые факторы могут использоваться для функциональных исследований и могут быть очищены для дополнительного структурного и функционального анализа, такого как качественный и количественный анализ на связывание рецептора.
Кроме этого, возможность продуцирования больших количеств такого нового фактора роста рекомбинантными методами позволяет осуществить испытание на его клиническую применимость в тех ситуациях, когда особенно важна специфическая стимуляция роста эпителиальных клеток. В соответствии с этим настоящее изобретение включает фармацевтические композиции, содержащие KCF или КСF-подобные полипептиды предназначенные для использования при лечении болезненных состояний включающем, например, заживление ран от ожогов или стимуляцию трансплатированной роговичной ткани.
В соответствии с таким воплощением настоящего изобретения новые КCF-подобные протеины представляют собой протеиновые продукты "немодифицированных" ДНК и мРНК настоящего изобретения, или модифицированные либо полученные методами генной инженерии протеиновые продукты. В результате инженерных мутаций в последовательностях ДНК модифицированные КCF-подобные протеины приобретают одно или более отличий в аминокислотной последовательности от соответствующих природных протеинов "дикого типа". В соответствии с одним из воплощений такого аспекта настоящего изобретения модифицированные КCF-подобные протеины будут включать "химерные" молекулы, содержащие сегменты аминокислотных последовательностей КCF, и, по крайней мере, один другой член FCF пептидного семейства.
Результаты аналогичных успешных подходов с использованием других пептидных факторов, обладающих аналогичными свойствами, позволяют заключить, что разработка таких химерных KCF-подобных полипептидов должна привести к улучшенным формам КCF-подобных пептидов "второго поколения", предназначенным для клинических целей. Так, например, такие модифицированные КСF-подобные продукты могут иметь меньший размер, могут быть более устойчивыми, более мощными и/или их получение может быть более легким или менее дорогостоящим.
Настоящее изобретение также охватывает новые методы биоанализа для определения экспрессии в человеческих клетках мРНК и протеинов, полученных из генов родственных сегментов ДНК изобретения. Согласно одному из таких воплощений ДНК настоящего изобретения могут использоваться в качестве зондов на определение уровней содержания стационарных состояний или кинетики индукции родственных мРНК. Доступность КСF-родственных cДНК клонов позволяет определять те случаи, когда аномальная экспрессия такого фактора роста имеет место в клинических состояниях, характеризующихся избыточным ростом эпителиальных клеток, включающих дисплазию и неоплазию (например, псориаз, злокачественные или доброкачественные опухоли).
Настоящее изобретение также предусматривает новые антитела для пептида закодированного ДНК сегментов настоящего изобретения. Согласно такому воплощению изобретения такие антитела могут быть моноклонального или поликлонального происхождения и их вырабатывают с помощью КСF-родственных полипептидов из природных, рекомбинантных или синтетических химических источников.
Антитела настоящего изобретения специфически связываются с KCF или КСF-подобным протеином, который включает последовательность такого пептида, предпочтительно в том случае, когда такой протеин находится в его природной (биологически активной) конформации. Такие антитела могут использоваться для детекции или очистки KCF либо они могут применяться для детекции или очистки KCF или KCF-подобных протеиновых факторов. Согласно наиболее предпочтительному воплощению этого аспекта изобретения антитела нейтрализуют промотирующую рост активность КСF, что позволяет осуществлять механистические исследования и, в конечном счете, проводить терапию клинических состояний, включающих избыточные уровни содержания КCF.
Краткое описание чертежей
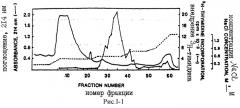
На рис.I-1 представлены результаты гепарин-Сефарозной сродственной хроматографии кондиционированной среды из м426 человеческих эмбрионных фибробластов, показывающие, что более 90% митогенной активности мышинных кератиноцитов (BAIB/MK) элюируется 0,6М NаСl.
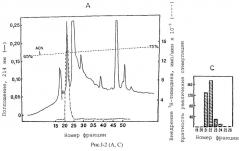
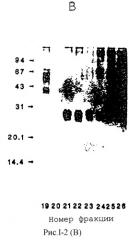
На рис.I-2 проиллюстрированы результаты дополнительной очистки митогена из человеческих фибробластов с использованием HPIC и адсорбционной матрицы. На фотографии (А) показан профиль обратимо-фазной (C4) HPIC BAIB/MK миогенной активности. На фотографии (В) представлены данные электрофорезного (NаДоdSО4/PAGE) анализа фракций, выбранных со стадии хроматографии С4, показанной на фотографии А, демонстрирующие тот факт, что пиковые HPIC фракции содержат единственную полосу на геле, окрашенном серебром. На фотографии (С) представлен график синтеза ДНК в клетках BAIB/MK, под действием фракций проанализированных на фотографии В, причем полученные результаты показывают, что относительная митогенная активность хорошо корредирует с интенсивностью протеиновой полосы в профиле активности.
На рис.I-3 показана альтернативная стадия с помощью очистки RP-HPIC, с использованием ситовой хроматографии с операциями на колонке (ТSК C3000SW GIaSPac) в водном растворе со значением рН, близким к значению физиологического раствора, в результате чего основной пик митогенной активности обнаруживается в BAIB/MK биологическом анализе.
На рис.I-4 приведено сравнение синтезов ДНК в BAIB/MK при воздействии ТSК-очищенного митогена и других факторов роста.
На рис.I-5 представлены данные сравнения роста клеток BAIB/MK в химически установленной среде при воздействии различных комбинаций факторов роста.
В таблице 1-1 суммированы результаты различных стадий очистки, демонстрирующие, что ситовая хроматография обеспечивает значительно лучшую регенерацию активности, чем использование адсорбционной RР-НPIС.
В таблице 1-2 суммированы данные по специфичности действия различных факторов роста в отношении клетки-мишени, демонстрирующие, что новый выделенный фактор обладает сильным митогенным действием на кератиноциты (BAIB/MK) и в резком отличие от этого не обнаруживает детектируемого действия на фибробласты или эндотелиальные клетки подкожной вены человека.
На рис.II-1 представлена нуклеотидная последовательность и установленная аминокислотная последовательность KCF сДНК, а также идентификация РНК транскрибированных из KCF гена. На фотографии (А) схематично представлены клоны сДНК человеческого KCF. На фотографии (В) изображен KCF СДНК нуклеотид и предсказанные аминокислотные последовательности. (C) - идентификация матриц РНК KCF генов анализом на окрашивание, по Нортерну.
На рис.II-2 представлены данные топологического сравнения семейства FCF родственных молекул, включая KCF, причем особое внимание уделено тем протеиновым областям, которые разделяют высокую гомологию, предполагаемым сигнальным пептидным последовательностям и двум консервированным цистеиновым остаткам.
На рис.II-3 представлены данные анализа (окрашивание по Нортерну) экспрессии KCF-родственной мРНК в отобранных нормальных человеческих клеточных линиях и тканях, которые позволяют установить, что одна матрица размером 2,4 кb присутствует в РНК из человеческих эмбрионных легочных фибробластов и из фибробластов кожи взрослых особей, тогда как матрица не была обнаружена в (В5/589) эпителиальной или (НА83) глиальных клеточных линиях, или в первичных культурах эндотелиальных клеток подкожной вены человека.
В таблице II-1 суммированы данные сравнения влияния гепарина на митогенную активность KCF с соответствующим влиянием на другие факторы роста, причем показано, что введение тимидина в ДНК с помощью клеток BAIB/MK при воздействии КCF ингиибируется гепарином в отличие от активностей как aFCF, так и bFCF, которые повышаются при такой обработке.
Описание конкретных воплощений.
Настоящее изобретение частично относится к очищенным KCF- или KCF-подобным протеинам и способам получения таких протеинов. Главное воплощение такого аспекта настоящего изобретения относится к гомогенному KCF, характеризующемуся кажущимся молекулярным весом порядка 28 кДа на основании миграции в NаДоdSО4/РАСЕ, движением одним пиком при анализе обратимо-фазной хроматографией высокого разрешения и удельной активностью по крайней мере 3,4×104 единиц на мг, предпочтительно, по крайней мере 3,2×105, единиц на мг, причем одна единица активности определяется как количество, вызывающее половину максимально возможной стимуляции синтеза ДНК в некоторых эпителиальных (кератиноцит) клетках в стандартных условиях анализа указанных ниже.
Для идентификации новых факторов роста специфичных к эпителиальным клеткам, клональную кератиноцитную клеточную линию мышей разновидности ВАIВ/с, обозначенную как ВАIВ/MK (I-6), использовали в качестве индикаторной клетки для детекции таких факторов. Такие клетки зависимы от их роста на экзогенном источнике митогена эпителиальной клетки даже в среде, содержащей сыворотку (I-6). Разработка химически определенной среды для таких клеток делает возможным демонстрацию того факта, что для пролиферации BAIB/MK требуется два главных митогенных пути. Один из них предполагает участие инсулиноподобного фактора роста I (или инсулина в высокой концентрации), а другой - эпидермального фактора роста (ЕСF), трансформирующего фактора роста а (ТСFа), фактора роста кислотного фибробласта (АFСF) или фактора роста основного фибробласта (bFВF) (I-7).
С использованием BAIB/MK в качестве прототипной эпителиальной клеточной линии и NIH/3ТЗ в качестве ее фибробластовой противочасти, кондиционированную среду из различных человеческих клеточных линий анализировали на наличие новых специфичных митогенов эпителиальных клеток. Такие методы биологического анализа настоящего изобретения позволяют осуществлять очистку до гомогенности одного из таких новых факторов роста, выделяемого человеческой эмбрионной легочной фибробластовой линией и обозначенного как фактор роста кератин опита (KCF).
Вкратце, биоанализ на KCF-подобную активность в стандартных условиях включает следующие стадии:
(I) Мышинные кератиноциты (BAIB/MK клетки) выращивают в культуре до слияния и затем выдерживают в течение 24-72 часов в среде не содержащей сыворотки;
(II) После добавления испытуемых образцов стимуляцию синтеза ДНК определяют путем введения 3Н-тимидина в кислотно-осаждаемую ДНК.
С целью определения специфичности действия митогенного фактора роста в отношении клетки-мишени, стимуляцию синтеза ДНК, выраженную отношением стимулированного синтеза к фоновому внедрению тимидина в отсутствие добавленного испытуемого образца, можно сравнить с аналогичной стимуляцией наблюдаемой в клетках отличных от кератиноцитов в аналогичных условиях анализа. В рамках такого сравнения было установлено, что митогенная активность KCF имеет ярко выраженную специфичность в отношении кератиноцитов в отличие от специфичности в отношении фибробластов (по крайней мере, 500-кратное увеличение стимуляции) и наблюдается меньшая, но значительно (по крайней мере, 50-кратная) более высокая активность по отношению к кератинопитам, чем по отношению к другим типам эпителиальных клеток (см. таблицу I-2 и раздел Материалы и методы исследования в Экспериментальном разделе I для более детального ознакомления со стандартными условиями биоанализа).
В результате использования метода продуцирования KCF, включающего культурирование клеток и выделение митогенной активности, причем такой метод включает ультрафильтрацию, гепарин-Сефарозную сродственную хроматографию (НSАС) и адсорбционную обратимофазную жидкостную хроматографию высокого разрешения (RР-НРIC), или согласно другому варианту HPIC на молекулярных ситах (TSK-HPIC), согласно настоящему изобретению было выделено количество препарата, достаточное для достаточного охарактеризования физических и биологических свойств такой молекулы.
Таким образом, способ получения KCF из таких продуцирующих клеток, как М426 человеческие эмбрионные фибробласты (I-8), включают, например, следующие стадии:
(I) Приготовление кондиционированной среды (например, 10 л) с использованием монослойных культур, полученных циклической обработкой в системе от среды, не содержащей сыворотки, до среды, содержащей ее, и хранение не содержащего сыворотки урожая при -70°С до последующего использования.
(II) Концентрирование ультрафильрацией с использованием мембран с молекулярным весом 10 кДа в несколько последовательных стадий при разбавлении в буффере (с целью облегчения удаления низкомолекулярных материалов), с последующим необязательным хранением при -70°С.
(III) Хроматографию по сродству на гепарине, связанном с полимерной подложкой (например, Сефарозой) при элюировании градиентом, повышающей концентрации NaCl.
(IV) Концентрирование до 10-20 кратного уменьшения объема с помощью мелкомасштабных ультрафильтрационных устройств с запором из материала с молекулярным весом 10 кДа (например, микроконцентратор Центрикон-10 от Амикон) и хранение при -70°С.
Следующая стадия процесса очистки включает приведенные ниже стадию (V) или (VI):
(V) Обратимо-фазная HPIC активных фракции (0,6М NаСl) с предыдущей стадии HSAC в системе органических растворителей, или
(VI) Молекулярно-ситовая HPIC (например, на ТSK-С3000 Глас-Пак колонке фирмы ЛКБ) в водном буфере при значении рН, близком к физиологическому (например, Трис-HCI, рН 6.8/0,5М NaCl) с последующим хранением при -70°С.
Препарат, полученный на стадии TSK (VI) имеет практически ту же чистоту, что и препарат, полученный с использованием RР-HPIC, согласно анализу серебрянного окрашивания NаДоdSO4/РAGЕ (данные не приведены). Однако использование ТSK обеспечивает значительно лучшую регенерацию активности (таблица I). Кроме этого, очищенный методом TSK материал обладал более высокой удельной активностью, чем материал, полученный методом RР-HPIC, KCF, полученный по описанной выше методике с участием ТSК, стимулирует синтез ДНК в эпителиальных клетках в субнаномольных концентрациях, но не индуцирует внедрение тимидина в ДНК фибробластов или эндотелиальных клеток при сравнимых или более высоких концентрациях (вплоть до 5 нМ). Такая активность чувствительна к кислотам, теплу и растворителям, используемым на стадии RP-HPIC (см. данные по чувствительности в разделе у Экспериментальной части, а также дополнительные подробности способа получения).
С использованием стандартной методологии, хорошо известной из литературы, была установлена аминокислотная последовательность для положений 2-13 из амино-окончания очищенного KCF: Asn-Asp-Met-Thr-Pro-Glu-Gln-Met-Ala-Thr-Asn-Val (см. Экспериментальный раздел I).
Настоящее изобретение также включает ДНК сегменты, кодирующие KCF и KCF-подобные полипептиды. Примерами ДНК настоящего изобретения могут служить следующие материалы: клоны 32-49 человеческой сДНК, полученные из полиаденилированных РНК, экстрагированных из клеточной линии М426 человеческого эмбрионного легочного фибробласта; рекомбинанты и метанты таких клонов; а также родственные ДНК сегменты, которые могут детектироваться гибридизацией в такие сегменты ДНК.
Как указывается в Экспериментальном разделе II, с целью поиска клонов сДНК, соответствующих известной части аминокислотной последовательности KCF, создавали две партии олегонуклеотидных зондов, базируясь на всех возможных нуклеотидных последовательностях, кодирующих девятую аминокислотную последовательность, Аsn-Аsn-Меt-Тhr-Рro-Glu-Gln-Met-Ala. Библиотеку сДНК конструировали в клонирующем векторе сДНК, λрСЕУ9, с использованием полиаденилированной РНК экстрагированной из клеточной линии М426 человеческого эмбирионного легочного фибробласта, которая представляла собой исходный источник фактора роста. В результате скрининга библиотеки (9×105 бляшек) с помощью 32Р-меченных олигонуклеотидов идентифицировали 88 бляшек, которые гибридизировали с обоими зондами.
Из 10 очищенных от бляшек клонов, которые подвергали анализу, один, обозначенный как клон 49, имел вставку сДНК в 3,5 кb, тогда как остальные имели вставки в интервале 1,8-2,1 кb. Анализ более мелких клонов позволил обнаружить несколько общих ограничительных сайтов, а установление аминокислотной последовательности одного из представителей мелких клонов, обозначенного, как клон 32, совместно с клоном 49, показано, что они представляют собой перекрывающиеся сДНК (рис.II-IA). Рассмотрение двух таких сДНК позволило установить наличие непрерывной последовательности в 3,8 кb, содержащей полную KCF кодирующую последовательность. Нуклеотидная последовательность чувствительного тяжа ДНК и закодированная предсказанная последовательность первичного протеина представлены для композитной KCF сДНК последовательности полной длины на рис.II-IB.
Такие ДНК, сДНК клоны 32 и 49, а также рекомбинантные формы таких сегментов, включающие полную KCF кодирующую последовательность, являются наиболее предпочтительными ДИК настоящего изобретения.
Из последовательности сДНК ясно следует, что продукты трансляции первичного KCF и hst содержат гидрофобные N-терминальные участки, которые, по-видимому, являются сигнальными последовательностями на основании схожести таких последовательностей в большом числе других протеинов. В соответствии с этим, такой Н-терминальный участок не присутствует в молекуле очищенного зрелого КСF, которая секретируется человеческими эмбрионными фибробластами.
Кроме того, KCF разделяет со всеми другими членами FСF семейства два основных участка гомологии, аминокислоты 65-156 и 162-189 в предсказанной последовательности KCF, которые разделены негомологическими сериями аминокислот различной длины у различных членов семейства. Последовательность очищенной формы KCF содержит пять цистеиновых остатков, два из которых сохраняются во всем семействе FСF-родственных протеинов. В последовательности KCF встречаются пять пар основных остатков. Та же картина наблюдается и у других членов семейства FCF.
Специалисту в данной области должно быть понятно, что в результате использования ДНК и РНК настоящего изобретения в методах гибридизации (таких как анализ геномных человеческих сДНК пятнением по Сaутерну), особенно наиболее предпочтительных ДНК перечисленных выше, без нежелательного экспериментирования можно осуществить скрининг геномной или сДНК библиотек с целью отыскивания других KCF подобных ДНК, охватываемых сферой настоящего изобретения. Кроме того, в результате такого использования ДНК настоящего изобретения, генетические маркеры, ассоциированные с КСF геном, такие как рестрикционные фрагменты длины полиморфизмов (PFIP), могут быть идентифицированы и связаны с унаследованными клиническими состояниями, включающими такие или близкие к ним гены.
Настоящее изобретение также включает модифицированные формы KCF ДНК. В соответствии с главным воплощением такого аспекта изобретения такие модифицированные ДНК кодируют KCF-подобные протеины, включающие сегменты аминокислотных последовательностей KCF, по крайней мере, один другой член семейства пептидов FCF, Так, например, поскольку не имеется существенной N-терминальной гомологии между секретированной формой KCF и аналогичными положениями в других FСF-росдственных протеинах, полипептиды с новыми структурными и функциональными свойствами могут быть созданы прививкой ДНК сегментов кодирующих N-терминальные сегменты другого полипептида в семействе FCF на сегмент ДНК КCF вместо его обычной NН2-терминальной последовательности.
Полипептидные химеры, продуцированные такими модифицированными ДНК, используются для определения достаточности NH2-терминального участка КСF в объяснении его уникальной специфичности в отношении клетки-мишени. Исследование таких химер должно также обеспечить информацию относительно природы участков, определяющей различное влияние гепарина на их биологическую активность.
Разумеется, что применимость такого подхода была уже подтверждена успешной генной инженерией и экспрессированием химерной молекулы, в которой около 40 аминокислот от NH2-окончания секретированной формы KCF (начиная от цисаминоокончания зрелого KCF, под номером 32 на рис.II-1 и кончая arg, остатком 78 КСF) связано со 140 аминокислотами СО2-окончания оболочки аFСF (начиная с остатка 39, arg и продолжаясь до С-окончания аFСF кодирующей последовательности. Такой химерный продукт превосходит кератиноциты, например KCF, по отношению к клетке-мишени, но уступает в восприимчивости к гепарину, что делает его более похожим на аFCF, а не на KCF. Такой новый КСF-подобный фактор роста может иметь преимущества в клинической практике, где желательно применение питедиально-специфичного фактора роста в присутствии гепарина, общепринятого антикоагулянта. Дополнительные детали конструкции такой химерной молекулы и свойства полипептида описаны в Экспериментальном разделе II.
Другие ДНК настоящего изобретения включают следующие молекулы рекомбинантной ДНК, содержащие KCF сДНК и любую из следующих векторных ДНК; клонирующий вектор бактериофага λ (λрСЕУ9), вектор устанавливающей аминокислотную последовательность плазмиды ДНК (вариант рУС), вектор бактериальной экспрессии (рКК233-2), вектор экспрессии млекопитающих (рММТ/neo). Такие рекомбинантные ДНК представлены примерами конструкций в Экспериментальных разделах.
Наиболее предпочтительные рекомбинантные молекулы включают: молекулы, содержащие последовательность, кодирующую секретированную форму KCF, и вектор бактериальной экспрессии (например, рКК233-2) или сДНК, кодирующую весь продукт первичной трансляций (включая NH2-терминальный сигнальный пептид), а также вектор экспрессии млекопитающего (например, рМMMT) способный экспрессировать вставленную ДНК в клетках млекопитающих (например, NIH/3Т3).
Конструкция рекомбинантных ДНК, содержащая КСF-ДНК и вектор бактериальной экспрессии, описана в экспериментальном разделе II. КСF сДНК была экспрессирована с продуцированием полипептида в E. coli путем помещения его кодирующей последовательности под контролем гибридного trk промотора в плазмидный экспрессионный вектор рКК233-2/(II-31).
Конструирование рекомбинантной ДНК, содержащей КСF-ДНК и вектор млекопитающего, способный к экспрессии вставленной ДНК в культивированных человеческих или животных клетках, можно осуществлять по стандартной технологии генной экспрессии с использованием хорошо известных методов, применимых для экспрессирования такого относительно простого полипептида. Одно конкретное воплощение рекомбинантной ДНК такого аспекта настоящего изобретения, включающее вектор млекопитающего рММТ, описано ниже в разделе, касающемся рекомбинантных клеток настоящего изобретения.
ДНК и РНК с чувствительными цепями настоящего изобретения могут использоваться совместно с методами продуцирования протеинов для получения большого количества практически чистых KCF или КСF-подобных протеинов. Полученный таким образом практически чистый протеин КСF может применяться, с использованием хорошо известных методик, в диагностических анализах на определение наличия рецепторов для такого протеина в различных образцах ткани и жидкостной среды тела.
В соответствии со сказанным, настоящее изобретение также охватывает клетку, предпочтительно клетку бактерии или млекопитающего, трансформированную с помощью ДНК изобретения, в которой трансформирующая ДНК способна к экспрессированию. Согласно предпочтительному воплощению такого аспекта изобретения клетка трансформированная ДНК изобретения производит протеин КCF в полностью митогенной форме. Наиболее предпочтительно, когда такие протеины находятся в секретированной форме (например, у них отсутствует сигнальная последовательность). Такие протеиновые факторы могут использоваться для функциональных исследований и могут быть очищены для дополнительного биохимического и функционального анализа, например качественный и количественный анализ на связывание рецептора.
Рекомбинантные E. coli клетки конструировали в бактериальном экспрессионном векторе, рКК233-2, для получения KCF, как это подробно описано в Экспериментальном разделе II. Некоторые рекомбинантные бактериальные клоны испытывали на продуцирование протеина обычными мелкомасштабными методами. Все испытанные рекомбинанты синтезировали протеины, о чем свидетельствовали антитела, возникающие у аминотерминального KCF пептида (см. ниже). Один рекомбинант выращивали в одном литре культуры, которая продуцировала рекомбинантный KCF, который эффективно стимулировали внедрение тимидина в ДНК клепки к ВАIВ/MK кератиноцита, но проявляя лишь незначительную активность в отношении NIH/3Т3 фибробластов. Половина максимальной стимуляции клеток BAIB/MK в стандартном биоанализе на керетиноцит достигалась при концентрации 2-5 нг/мл, по сравнению с концентрацией 10-15 кг/мл для КCF очищенного от клеток М426.
Один литр бактериальных клеток давал примерно 50 мкг моноочищенного рекомбинантного KCF. Специалисту в области генной экспрессии должно быть ясно, что такой первоначальный выход может быть значительно улучшен без нежелательного дополнительного экспериментирования путем применения различных известных приемов рекомбинантной ДНК технологии.
Рекомбинантные клетки млекопитающего (NIН/3Т3 также были сконструированы с использованием полной KCF сДНК последовательности (включая NН2-терминальный сигнальный пептид) и вектора рММТ/nео, который несет мышинный металлотиониновый (ММТ) промотор и селективный маркерный ген на устойчивость к неомицину. Такие клетки оценивали на продуцирование KCF. Особенно на секрецию зрелой формы (отсутствие сигнального пептида) продуцируемой человеческими фибробластами с использованием биоанализов настоящего изобретения. Такая комбинация вектора и клетки-хозяина были с успехом использованы для экспрессирования некоторых других аналогичных рекомбинантных полипептидов, включая цепи факторов роста А и В, являющихся производными тромбоцитов (РДСЕ, II-32). Таким образом, специалисту в данной области должно быть ясно, что высокие выходы рекомбинантного KCF могут быть достигнуты таким образом с использованием указанных выше рекомбинантных ДНК и трансформированных клеток настоящего изобретения.
Крупномасштабное производство может использоваться для клинических испытаний в условиях, требующих специфической стимуляции роста эпителиальных клеток. Материалы и методы получения фармацевтических композиций для локального применения полипептидов (на коже или роговице глаза) или их системного применения хорошо известны в данной области и они могут быть легко приспособлены для применения КСF и KCF-подобных пептидов без дополнительного экспериментирования.
Настоящее изобретение также охватывает новые антитела против пептида закодированного сегментом ДНК изобретения. Такое воплощение изобретения представлено примерами нескольких видов антител, которые распознают KCF. Они были получены с использованием стандартных методов хорошо известных в данной области экспериментальной иммунологии, как указывается в экспериментальном разделе II. Такие антитела включают: моноклональные антитела, вырабатываемые мышами против неповрежденного очищенного протеина из человеческ