Фармацевтические препараты эхинокандина, содержащие мицелообразующие поверхностно-активные вещества
Иллюстрации
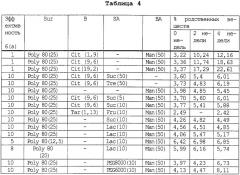
Показать всеИзобретение относится к химико-фармацевтической промышленности и касается новой парентеральной фармацевтической композиции, включающей эхинокандиновое соединение формулы I или его фармацевтически приемлемую соль, фармацевтически приемлемое мицеллообразующее поверхностно-активное вещество и нетоксичный водный растворитель, и стабилизирующий агент. Композиция обладает повышенной стабильностью и биодоступностью. 7 н. и 41 з.п. ф-лы, 4 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к фармацевтическим рецептурным смесям, содержащим соединение эхинокандин, включающие, в частности, мицеллообразующие поверхностно-активные вещества, для усиления их стабильности и водорастворимости.
УРОВЕНЬ ТЕХНИКИ
Парентеральные (ip) рецептурные смеси фармацевтических лекарственных средств могут быть введены пациентам внутримышечно (im), внутривенно (iv) или подкожно. Создание рецептурной смеси для конкретного лекарственного средства, зависит от определенной проблемы. В данной области техники, например, хорошо известно, что любая рецептурная смесь должна быть водорастворимой и стабильной. Лиофильно высушенная рецептурная смесь должна обладать способностью образовывать правильно отвердевший слой осадка и легко воссоздаваться (как правило, менее, чем за одну минуту). В конечном счете, рецептурная смесь должна обладать приемлемым внешним видом и содержать официально признанные безопасные наполнители.
Стабильность является существенной характеристикой создаваемой рецептурной смеси, особенно для парентерального применения. На практике рецептурная смесь должна сохраняться в течение, по меньшей мере, двух лет. Поэтому зачастую рецептурную смесь желательно лиофилизировать, чтобы обеспечить больший срок годности и лучшую сохраняемость при комнатной температуре.
Нестабильность и плохая водорастворимость (<0,1 мг/мл) соединений эхинокандина делает их особенно трудными для приготовления рецептурной смеси. Большинство рецептурных смесей, испытанных к настоящему времени, обладает сроком годности менее одного года. Вообще, срок годности должен составлять два и более лет. Поэтому для достижения требуемой стабильности рецептурную смесь, содержащую соединение эхинокандин, необходимо лиофилизировать.
Плохая водорастворимость соединений эхинокандина создает дополнительную проблему при создании рецептурной смеси, содержащей активный эхинокандин. Один из способов получения таких соединений состоит в добавлении поверхностно-активного вещества, которое усиливает растворимость данного лекарственного средства. Однако, в данной области техники общепризнано, что использование определенной концентрации поверхностно-активного вещества, как правило, ограничивает способность препарата лиофилизироваться. Типичная лиофилизированная рецептурная смесь обладает концентрацией поверхностно-активного вещества менее 5 мас.%. При изучении рынка лиофилизированных фармацевтических рецептурных смесей, содержащих поверхностно-активные вещества, установлено, что концентрация поверхностно-активного вещества составляет в лиофилизированном продукте, как правило, менее 5 мас.%. Смотрите, Carpenter et al., Pharm. Res., 14(8), 969-975, 1977-1997, Physicians' Desk Reference, 50th edition, Medical Economics, Co. NJ (1996). Принято считать, что рецептурная смесь с более высокими концентрациями поверхностно-активного вещества вряд ли образует лиофилизированный продукт с требуемыми характеристиками. То есть присутствие поверхностно-активного вещества вызывает "деформацию" лиофилизированного слоя осадка (брикета), полученного на дне ампулы (флакона), вместо правильно отвердевшего слоя. Этот остаток, как правило, менее стабилен, труден для воссоздания и не воспроизводим.
Из-за плохой водорастворимости соединений эхинокандина для получения приемлемой концентрации соединения эхинокандин в растворе обычно требуется 2-4% (масса на объем) поверхностно-активного вещества. Как отмечено выше, при таком содержании поверхностно-активного вещества лиофилизирование затруднено. Поэтому существует потребность в рецептурной смеси, которая улучшает растворимость соединений эхинокандина в воде, и, вместе с тем, допускает лиофилизацию для получения оптимальной стабильности.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Заявители нашли группу поверхностно-активных веществ, которые солюбилизируют соединения эхинокандина при высоких концентрациях и, как ни странно, сохраняют способность к лиофилизации соответствующей рецептурной смеси. В первом варианте осуществления настоящего изобретения создавали парентеральную фармацевтическую рецептурную смесь, которая включает в себя (i) соединение эхинокандин (или его фармацевтически приемлемую соль), (ii) фармацевтически приемлемое мицеллообразующее поверхностно-активное вещество (напр., полисорбаты, лецитин, соли желчных кислот, полиоксиэтиленовые касторовые масла и их смеси), и (iii) нетоксичный, водный растворитель. Раствор фармацевтической рецептурной смеси факультативно содержит один или несколько стабилизирующих агентов, тонизирующий агент и/или буфер. Массовое соотношение эхинокандина к поверхностно-активному веществу составляет, приблизительно, от 1:1,75 до 1:25 (наиболее предпочтительное соотношение от около 1:2 до около 1:3), а соединение эхинокандин представлено в количестве, превышающем или равным 1 мг/мл. Соответствующее поверхностно-активное вещество, как правило, присутствует в количестве, превышающем 1 масс.% на объем.
В одном варианте осуществления настоящего изобретения созданная лиофилизированная фармацевтическая рецептурная смесь включает в себя (i) соединение эхинокандин (или его фармацевтически приемлемую соль), (ii) фармацевтически приемлемое, мицеллообразующее поверхностно-активное вещество (напр., полисорбаты, лецитин, соли желчных кислот, полиоксиэтиленовые касторовые масла, и их смеси), и (iii) объемный наполнитель. Мицеллообразующее поверхностно-активное вещество присутствует в количестве, превышающем в лиофилизированном продукте 5 масс.%, а соотношение эхинокандина и поверхностно-активного вещества составляет, приблизительно, от 1:1,75 до 1:25 (предпочтительно соотношение от около 1:2 до около 1:3). Эта фармацевтическая лиофилизированная рецептурная смесь факультативно может содержать один или несколько стабилизирующих агентов и/или буфер. Создана также парентеральная фармацевтическая рецептурная смесь, полученная из лиофилизированного препарата.
Еще в одном варианте осуществления настоящего изобретения разработан способ получения парентеральной рецептурной смеси, который включает смешивание соединения эхинокандин (или комплекс эхинокандин/углевод) и фармацевтически приемлемого, мицеллообразующего поверхностно-активного вещества в водном растворителе.
В другом варианте осуществления настоящего изобретения разработан способ создания лиофилизированной рецептурной смеси, включающий нижеследующий порядок стадий: (i) растворение в водном растворителе соединения эхинокандин (или комплекса эхинокандин/углевод) в присутствии фармацевтически приемлемого мицеллообразующего поверхностно-активного вещества, в котором данное поверхностно-активное вещество представлено в количестве, превышающем 1 масс.% на объем; (ii) стерильное фильтрование данного раствора; (iii) лиофилизация данного раствора. В большинстве случаев объемный наполнитель добавляется в полученный раствор перед лиофилизацией. Факультативно перед стадией (iii) можно добавить один или несколько буферов, стабилизирующих агентов, тонизирующих агентов, или их сочетание.
Разработано также альтернативное получение лиофилизированной рецептурной смеси, которое включает (i) забуферивание нетоксичного водного раствора до рН между 4,0 и 5,0 с получением буферного раствора; (ii) добавление в забуференный раствор фармацевтически приемлемое мицеллообразующее поверхностно-активное вещество; (iii) охлаждение раствора со стадии (ii) до температуры между 5°С и 15°С (предпочтительно между 7°С и 10°С) с получением охлажденного раствора; (iv) добавление к полученному охлажденному раствору суспензии, включающей соединение эхинокандин или комплекс эхинокандин/углевод и второй нетоксичный водный растворитель; (v) стерильное фильтрование указанного раствора со стадии (iv); и (vi) лиофилизация указанного раствора со стадии (v). Перед осуществлением стадии (v) факультативно могут быть добавлены один или несколько объемных агентов, стабилизирующих агентов и/или тонизирующих агентов.
В другом варианте осуществления настоящего изобретения разработали парентеральный фармацевтический продукт, который получают растворением в водном растворителе соединения эхинокандин (или комплекс эхинокандин/углевод) в присутствии фармацевтически приемлемого, мицеллообразующего поверхностно-активного вещества с получением раствора, в котором данное поверхностно-активное вещество присутствует в количестве, превышающем 1 масс.% на объем; (ii) стерилизующим фильтрованием полученного раствора; и (iii) лиофилизацией данного раствора в ампуле, в котором массовое соотношение эхинокандина и поверхностно-активного вещества составляет, приблизительно, от 1:1,75 до 1:25. Перед использованием в эту ампулу приливают нетоксичный водный раствор.
Еще в одном варианте осуществления настоящего изобретения разработали способ лечения противогрибковой инфекции у млекопитающего, нуждающегося в нем, который включает введение этому млекопитающему вышеописанной парентеральной рецептурной смеси или парентеральной рецептурной смеси, полученной путем добавления фармацевтически приемлемого водного растворителя к одной из вышеописанной лиофилизированной рецептурной смеси.
Количества и проценты приведены здесь в виде массовых единиц, если не оговорено иначе.
Термин "эхинокандин" относится к соединению, обладающему следующей общей структурой:
где R представляет собой алкильную группу, алкенильную группу, алкинильную группу, арильную группу, гетероарильную группу или их сочетания; R1, R2, R3, R6, R7 и R10 независимо представляют собой гидрокси или водород; R4 представляет собой водород, метил или –СН2С(О)NH2; R5 и R11 независимо представляют собой метил или водород; R8 представляет собой -ОН, -ОРО3Н2, -ОРО3НСН3, -ОРО2НСН3 или ОSО3Н; a R9 представляет собой -Н, -ОН, или –ОSО3Н.
Термин "алкил" относится к углеводородному радикалу общей формулы CnH2n+1, содержащему от 1 до 30 углеродных атомов, если не указано иначе. Алкановый радикал может быть неразветвленным, разветвленным, циклическим, или мультициклическим. Этот алкановый радикал может быть замещенным или незамещенным. Аналогично алкильная часть алкоксигруппы или алканоат имеют то же значение, которое указано выше.
Термин "алкенил" относится к ациклическому углеводороду, содержащему по меньшей мере одну углерод-углеродную двойную связь. Алкеновый радикал может быть неразветвленным, разветвленным, циклическим или мультициклическим. Этот алкеновый радикал может быть замещенным или незамещенным.
Термин "алкинил" относится к ациклическому углеводороду, содержащему, по меньшей мере, одну тройную углерод-углеродную связь. Алкиновый радикал может быть неразветвленным или разветвленным. Этот алкиновый радикал может быть замещенным или незамещенным.
Термин "арил" относится к ароматическим составляющим, обладающим единственной (напр., фенильной) или конденсированной кольцевой системой (напр., нафталиновой, антраценовой, фенанатреновой и т.п.). Арильные группы могут быть замещенными или незамещенными. Замещенные арильные группы включают цепочку ароматических составляющих (напр., бифенильная, терфенильная, фенилнафталильная и т.п.).
Термин "гетероарил" относится к ароматическим составляющим, содержащим, по меньшей мере, один гетероатом в ароматической кольцевой системе (напр., пиррольной, пиридиновой, индольной, тиофеновой, фурановой, бензофурановой, имидазольной, пиримидиновой, пуриновой, бензимидазольной, хинолиновой и т.п.). Эта ароматическая составляющая может состоять из одной или конденсированной кольцевой системы. Гетероарильные группы могут быть замещенными или незамещенными.
В органической химии и особенно в органической биохимии обычно подразумевается, что существенное замещение соединений допускается или даже является полезным. В настоящем изобретении, например, термин алкильная группа допускает замещения, которые представляют собой классический алкил, такой как метил, этил, изопропил, изобутил, трет-бутил, гексил, изооктил, додецил, стеарил и т.п. Термин группа, в частности, подразумевает и допускает замещения по алкилам, которые обычны в данной области техники, такие как гидрокси, галоген, алкокси, карбонил, кето, сложный эфир, карбамато и т.п., а также включает незамещенную алкильную часть. Однако, специалистам в данной области понятно, что заместители должны быть выбраны так, чтобы не оказывать отрицательного влияния на фармакологические характеристики соединения или препятствовать использованию лекарственного средства. Подходящие заместители для любой вышеуказанной группы включают алкил, алкенил, алкинил, арил, галоген, гидрокси, алкокси, арилокси, меркапто, алкилтио, арилтио, моно- и диалкиламино, четвертичные аммонийные соли, аминоалкокси, гидроксиалкиламино, аминоалкилтио, карбамил, карбонил, карбокси, гликолил, глицил, гидразино, гуанил, и их сочетания.
"Комплекс эхинокандин/углевод" относится к кристаллическому комплексу, образованному эхинокандином и углеводом, при перекристаллизации эхинокандина из растворителя в присутствии углевода. Более подробное описание комплексов эхинокандин/углевод можно найти в публикации Larew, et аl., поданной 3 марта 1999, под названием "Echinocandin/Carbohydrate Complexes."
"Углевод" относится к альдегидному или кетонному производному многоатомных спиртов с формулой Сn(Н2O)n (напр., глюкоза, С6(Н2О)6; сахароза, C12(H2O)n). Углеводы включают соединения с относительно небольшими молекулами, такие как простые сахара (напр., моносахариды, дисахариды, и т.п.), а также макромолекулярные (полимерные) вещества, такие как крахмал, гликоген, и целлюлозные полисахариды. Сахара и их простые производные представляют собой углеводы (сахариды), обладающие общим составом (CH2O)n. Хотя простые мономерные сахара (глюкозы) описаны в виде полиоксиальдегидов или кетонов, напр., HOCH2-(СНОН)4-СНО для альдогексоз (напр., глюкоза) или НОСН2-(СНОН)3-СО-СН2OН для 2-кетоз (напр., фруктоза), их структуры, как правило, изображаются в виде пяти- (фураноза) или шести- (пираноза) членного кольца циклического эфира, напр.
Термин "мицеллообразующее поверхностно-активное вещество" относится к амфифильному веществу, которое спонтанно и обратимо образует водорастворимый агрегат. Более подробное описание образования мицелл и перечень мицеллообразующих поверхностно-активных веществ смотрите у Attwood. et al. Surfactant Systems. Their Chemistry, Pharmacy and Biology, Chapman and Hall (1983). Блок-сополимеры из пропиленоксида и этиленоксида не зарекомендовали себя хорошо при получении рецептурных смесей настоящего изобретения; поэтому данные блок-сополимеры не рассматриваются в качестве мицеллообразующих поверхностно-активных веществ.
Термин "фармацевтически приемлемый", используемый здесь в качестве прилагательного, по существу означает нетоксичный и в основном не наносящий вреда конкретному реципиенту.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Циклические пептиды, используемые в настоящем изобретении, могут быть получены путем культивирования различных микроорганизмов. Подходящий природный продукт исходных материалов, относящихся к семейству циклического пептида эхинокандин включает эхинокандин В, эхинокандин С, эхинокандин D, акулеацин Аγ, мулундокандин, спориофунгин А, пневмокандин A0, WF11899A и пневмокандин В0. В большинстве своем циклические пептиды могут характеризоваться в качестве циклического гексапептидного ядра с ацилированной аминогруппой по одной из аминокислот. Аминогруппа естественно встречаемого циклического пептида обычно ацилируется жирнокислотной группой, образующей боковую цепь ядра. Примеры естественно встречаемых ацильных групп включают линолеоил (эхинокандин В, С и D), пальмитоил (акулеацин Аγ и WF11899A), стеароил, 12-метилмиристоил (мулундокандин), 10,12-диметилмиристоил (спориофунгин А и пневмокандин А0) и им подобные.
Полусинтетические производные могут быть получены в результате удаления жирнокислотной боковой цепи из циклического пептидного ядра, которая образует свободную аминогруппу (т.е. дополнительная ацильная группа -С(О)R отсутствует). Затем этот свободный амин реацилируется подходящей ацильной группой. Например, ядро эхинокандина В реацилируется некоторыми не встречаемыми в природе частями боковой цепи, что создает ряд противогрибковых агентов. Смотрите Патент США №4293489. Специалистам в данной области техники очевидно, что N-ацильная боковая цепь включает целый ряд составляющих боковой цепи, известных в данной области техники. Соответствующие составляющие боковой цепи включают замещенные и незамещенные алкильные группы, алкенильные группы, алкинильные группы, арильные группы, гетероарильные группы и их сочетания. Предпочтительно, эта боковая цепь содержит жесткую кольцевую часть и гибкую алкильную часть, что повышает до предела противогрибковую эффективность. Репрезентативные примеры предпочтительных ацильных боковых цепей включают R-группы, обладающие следующими структурами:
где А, В, С и D независимо представляют собой водород, C1-C12 алкил, C2-C12 алкинил, C1-C12 алкокси, C1-C12 алкилтио, галоген, или -О-(СН2)m-[О-(СН2)n]p-O-(C1-C12 алкил), или -O-(CH2)q-X-E; m равно 2, 3 или 4; n равно 2, 3 или 4; р равно 0 или 1; q равно 2, 3 или 4; X представляет собой пирролидино, пиперидино или пиперазино; а Е представляет собой водород, C1-C12 алкил, С3-С12 циклоалкил, бензил или С3-С12 циклоалкилметил.
Как отмечено выше, описанные здесь циклические пептиды могут быть получены путем ферментации известных микроорганизмов, которые описаны в данной области техники. Последующее деацилирование обычно осуществляется энзиматически с использованием фермента деацилазы с помощью известных материалов, а способ описан в данной области техники.
Например, Патент США №3293482 описывает деацилирование и получение циклического пептида формулы I, где R4, R5, и R11 представляют собой метил. R9 представляет собой водород, a R1, R2, R6, R7, R8 и R10, каждый, представляет собой гидрокси. Патент США №4299763 описывает деацилирование и получение циклического пептида формулы I, где R4, R5, и R11 представляют собой метил, R2 представляет собой гидрокси, R7 и R9 представляют собой водород, a R1, R3, R6, R8 и R10, каждый, представляет собой гидрокси. Патент США №3978210 описывает получение акулеацина. Патент США №4304716 описывает деацилирование и получение циклического пептида формулы I, где R5 представляет собой -CH2C(O)NH2; R11 представляет собой метил; R4 и R9 представляют собой водород; R1, R2, R3, R6, R7, R8 и R10, каждый, представляет собой гидрокси, а ацильная группа с заместителем R представляет собой миристоил.
Циклические пептиды, где R2 и R7, каждый, представляет собой гидрокси, могут быть получены в результате воздействия на соответствующее соединение (где R2 и R7, каждый, представляет собой гидрокси; альфа-аминогруппа орнитина может являться свободной аминогруппой или быть ацилированной) сильной кислоты и восстанавливающего агента в соответствующем растворителе при температуре между -5°С и 70°С. Подходящие сильные кислоты включают трихлоруксусную кислоту, трифторуксусную кислоту или эфират трифторида бора. Предпочтительной сильной кислотой является трифторуксусная кислота. Подходящие восстанавливающие агенты включают цианборгидрид натрия или триэтилсилан. Предпочтительным восстанавливающим агентом является триэтилсилан. Подходящие растворители включают метиленхлорид, хлороформ или уксусную кислоту, предпочтительно метиленхлорид. Сильная кислота присутствует в количестве от 2 до 60 моль на моль субстрата, а восстанавливающий агент присутствует в количестве от около 2 до 60 моль на моль субстрата. Процесс кислотного восстановления избирательно удаляет аминную (R2) и бензильную (R7) гидроксигруппы.
Ацилирование α-аминогруппы орнитина можно осуществить разными способами, хорошо известные специалистам в данной области техники. Например, указанную аминогруппу можно ацилировать в реакции с замещенным соответствующим образом галоидным ацилом, предпочтительно в присутствии кислотного акцептора, такого как третичный амин (напр., триэтиламин). Обычно реакция осуществляется при температуре между, приблизительно, -20°С и 25°С. Соответствующие реакционные растворители включают полярные апротонные растворители, такие как диоксан или диметилформамид. Выбор растворителя не является существенным, поскольку используемый растворитель является инертным в происходящей реакции, а реагенты достаточно солюбилизированы для проведения требуемой реакции.
Аминогруппу можно также ацилировать в реакции с замещенной соответствующим образом карбоновой кислотой в присутствии связывающего агента. Соответствующие связывающие агенты включают дициклогексилкарбодиимид (DCC), N,N'-карбонилдиимидазол, бис(2-оксо-3-оксазолидинил)фосфинхлорид (ВОР-Сl), N-этоксикарбонил-2-этокси-1,2-дигидрохинолин (EEDQ), бензотриазол-1-илокси-трипирролидинофосфонийгексафторфосфат (РyВОР) и им подобные.
Альтернативно аминогруппа может быть ацилирована сложным активированным эфиром карбоновой кислоты, таким как пара-нитрофенил (НОВТ. H2O), 2,4,5-трихлорфенил, гидрат гидроксибензотриазола, пентафторфенол, и сложными карбоксилатными эфирами N-гидроксисукцинимида. Предпочтительными ацилирующими составляющими являются 2,4,5-трихлорфенил и сложные карбоксилатные эфиры НОВТ. Обычно реакция продолжается в течение 1-65 часов при температуре от около 0°С до 30°С в апротонном растворителе. Как правило, реакция заканчивается через, примерно, 24-48 часов, осуществляясь при температуре между, примерно, 15°С и 30°С. Соответствующие растворители включают тетрагидрофуран и диметилформамид или их смеси. В большинстве случаев аминогруппа присутствует в эквимолярных соотношениях по отношению к активированному эфиру или с небольшим избытком аминогруппы.
Кислотные предшественники R-COOH получают путем гидролиза нитрила формулы R-CN или сложного эфира формулы R-COO(C1-C4 алкил). Промежуточные продукты нитрила и сложного эфира могут быть получены с использованием способов, известных в данной области техники. Например, промежуточные продукты нитрила и сложного эфира, в которых R представляет собой алкоксиарильную составляющую, могут быть получены с использованием Метода А или Метода В.
Метод А. Один эквивалент алкилбромида, йодида, или пара-толуолсульфоната добавляют в смесь, содержащую один эквивалент основания, такого как трет-бутоксид калия или углекислый калий (К2СО3), и один эквивалент гидроксиарильного соединения в 200-300 мл ацетонитрила (CN3CN). Эту реакционную смесь кипятят с обратным холодильником в течение 6 ч, а затем концентрируют при отрицательном давлении с получением осадка, который растворяют в смеси Et2O/2N NaOH. Полученные слои разделяют и органический слой сушат над сульфатом магния (МgSО4), фильтруют и сушат до получения алкоксиарильного продукта.
Метод В. Диэтилазодикарбоксилат (1 экв.) по каплям добавляют к смеси, содержащей гидроксиарильное соединение (1 экв.), алкиловый спирт (1 экв.) и трифенилфосфин (1 экв.) в 200-300 мл THF. Через 17 ч при отрицательном давлении удаляют растворитель с получением остатка, который растворяют в Et2O. Полученную смесь промывают раствором 2N NaOH, сушат над МgSO4, фильтруют и концентрируют, получая продукт, который затем кристаллизуют из смеси Et2O/пентан или, если этот продукт содержит третичный амин, получают хлористоводородную соль и кристаллизуют из метанольной смеси (МеОН)/EtOAc. Промежуточные продукты нитрила и сложного эфира, в которых R представляет собой алкиниларильную составляющую можно получить с использованием Метода С.
Метод С. Смесь, содержащую Et2O (2 экв.), дихлорид палладия (0,05 экв.), трифенилфосфин (0,1 экв.), йодида меди (0,025 экв.) и алкин (1 экв.), добавляют под азотом (N2) к одному эквиваленту арилбромида, йодида, или трифторметансульфоната в CH3CN (600 мл/0,1 моль арильного реагента). Полученную смесь кипятят с обратным холодильником в течение 11 ч, а затем при отрицательном давлении удаляют растворитель, чтобы получить остаток, который представляет собой суспензию в 300 мл Et2O, и затем фильтруют. Полученный фильтрат промывают раствором 1N HCl, сушат над MgSO4, фильтруют и затем сушат с получением искомого продукта. Эфирные интермедиаты, в которых R представляет собой терфенильную составляющую, могут быть получены с использованием Метода Д.
Метод Р.
1. Получение реагента борной кислоты
К одному эквиваленту охлажденного (-78°С) галоидарила в THF добавляют бутиллитий (1,2 эквивалента). Через 15 минут добавляют триизопропилборат (2 эквив.). Через 10 минут эту реакционную смесь нагревают до комнатной температуры и резко охлаждают добавлением воды (Н2O) с последующим добавлением 1N HCl. Полученные слои разделяют и органический слой концентрируют при отрицательном давлении с получением твердого вещества, которое собирают путем фильтрования, и сушат при помощи гексана.
2. Получение терфенилового эфира
В смесь, содержащую арилборную кислоту (1 экв.), К2СО3 (1,5 экв.) и метил 4-йодобензоат (1 экв.) (или трихлорфениловый эфир йодобензоата) в толуоле, продуваемом N2, добавляют тетракис(трифенилфосфин)палладий (0,03 экв.). Полученную реакционную смесь кипятят с обратным холодильником в течение 7 ч, а затем декантируют для удаления К2СО3 и сушат при отрицательном давлении до получения остатка. Этот остаток растирают в CH3CN и фильтруют до получения искомого продукта. Вышеописанные арильные нитрилы и сложные эфиры могут быть преобразованы в результате гидролиза в соответствующие карбоновые кислоты с использованием Способа Е или Способа F.
Способ Е. Арилнитрил растворяют в этаноле (EtOH) и в избытке 50%-го раствора NaOH и кипятят с обратным холодильником в течение 2 ч. В эту реакционную смесь добавляют воду до получения осадка твердого вещества. Это твердое вещество собирают фильтрованием, добавляют смесь диoкcaн/6N НСl и полученную смесь кипятят с обратным холодильником в течение 17 ч. После практического завершения реакции полученный продукт карбоновой кислоты кристаллизуют путем добавления H2O, а затем собирают фильтрованием и сушат при отрицательном давлении.
Способ F. К сложному ариловому эфиру в МеОН приливают избыток 2N NaOH и полученный раствор кипятят с обратным холодильником в течение 5 ч, а затем подкисляют, добавляя избыток НСl. К полученной реакционной смеси добавляют воду до выпадения твердого осадка (карбоновая кислота). Собирают фильтрованием карбоновую кислоту и сушат при отрицательном давлении. Карбоновые кислоты могут быть преобразованы в соответствующие сложные 2,4,5-трихлорфениловые эфиры с использованием нижеприведенного Способа G. Активированные сложные эфиры используют затем для ацилирования аминного центра.
Способ G. Смесь, содержащую ариловую карбоновую кислоту (1 экв.), 2,4,5-трихлорфенол (1 экв.) и DCC (1 экв.) в CH2Cl2 перемешивают в течение 17 ч и затем фильтруют. Полученный фильтрат концентрируют с получением остатка, который растворяют в Et2O, фильтруют, и затем добавляют пентан вплоть до начала кристаллизации. Кристаллы собирают путем фильтрования и сушат при отрицательном давлении. Альтернативно, с использованием способа Н полученную карбоновую кислоту можно активировать путем ее преобразования в соответствующий сложный гидроксибензотриазольный эфир.
Способ Н. Ариловую карбоновую кислоту (1 экв.) и небольшой избыток N-метилсульфонильного замещенного гидроксибензотриазола (1,2 экв.) вводят в реакцию, под азотом, в присутствии небольшого избытка основания в DMF, такого как триэтиламин (Et3N) (1,3 экв.). По окончании реакции данную смесь разбавляют толуолом и промывают H2O. Полученую органическую часть разбавляют Н2O и затем фильтруют с использованием сложного трет-бутилметилового эфира (МТВЕ) для перемещения данного вещества. Полученный твердый осадок промывают с помощью МТВЕ и затем сушат при отрицательном давлении.
Соединение эхинокандина можно выделить очисткой и использовать как таковое в форме его фармацевтически приемлемой соли или гидрата, или в виде комплекса эхинокандин/углевод. Термин "фармацевтически приемлемая соль" относится к нетоксичным кислым аддитивным солям, полученным из неорганических и органических кислот. Соответствующие дериваты солей включают галоидные соединения, тиоцианаты, сульфаты, бисульфаты, сульфиты, бисульфиты, арилсульфонаты, алкилсульфаты, фосфонаты, двузамещенные фосфаты, однозамещенные фосфаты, метафосфаты, пирофосфонаты, алканоаты, циклоалкилалканоаты, арилалконаты, адипаты, аспартаты, бензоаты, фумараты, глюкогептаноаты, глицерофосфаты, лактаты, малеаты, никотинаты, оксалаты, пальмитаты, пектинаты, пикраты, пивалаты, сукцинаты, тартраты, цитраты, камфораты, камфорсульфонаты, диглюконаты, трифторацетаты и им подобные.
"Комплекс эхинокандин/углевод" относится к кристаллическому комплексу, образованному эхинокандиновым соединением и углеводом (или сахаром) при перекристаллизации эхинокандина из растворителя в присутствии углевода. Более подробное описание комплексов эхинокандин/углевод можно найти в публикации Larew, et al., поданную 3 марта 1999 г. под названием "Echinocandin/Carbohydrate Complexes" и включенную здесь путем ссылки. Эти комплексы образуются с использованием стандартных методов кристаллизации, которые обычно применяют для очистки соединений путем их перекристаллизации. Вещество эхинокандина и углевод растворяют при повышенной температуре (приблизительно 45-60°С, предпочтительно ниже 55°С) в растворителе. Затем полученный раствор медленно охлаждают вплоть до начала кристаллизации. Для инициации кристаллизации можно добавить затравочный кристалл (такой, например, как ранее закристаллизованный комплекс или нерастворенный сахар). Подходящие растворители включают любой растворитель, или смесь растворителей, инертные к происходящей реакции, которые достаточно солюбилизируют реагенты, создающих среду, в которой происходит требуемое комплексообразование между углеводом и соединением эхинокандина, такие, например, как протонный или кетонный растворители, включающие метанол, этанол, бензиловый спирт, а также смеси бензилового спирта с растворителями, такими как метанол, этанол, н-пропанол, изопропанол, н-бутанол, 2-бутанол, трет-бутанол, 2-пентанол, 2-метил-1-пропанол, МЕК, ацетон, этилацетат, толуол, ацетонитрил, фторбензол, метиленхлорид, нитрометан, или циклические кетоны, такие как циклопентанон и циклогексанон. Предпочтительные растворители включают метанол, этанол, бензиловый спирт, и смеси бензилового спирта с метилэтил-кетоном, этилацетатом и ацетонитрилом.
Подходящие углеводы включают адонит, арабинозу, арабит, аскорбиновую кислоту, хитин, D-целлюбиозу, 2-дезокси-D-рибозу, дульцит, (S)-(+)-эритрулозу, фруктозу, фукозу, галактозу, глюкозу, инозит, лактозу, лактулозу, ликсозу, мальтол, мальтозу, мальтотриозу, маннит, маннозу, мелецитозу, мелибиозу, микрокристаллическую целлюлозу, палатинозу, пентаэритритол, раффинозу, рамнозу, рибозу, сорбит, сорбозу, крахмал, сахарозу, трегалозу, ксилит, ксилозу и их гидраты. Подходящие углеводы включают также D и L энантиомеры, а также альфа и бета аномеры вышеперечисленных соединений. Предпочтительные углеводы представляют собой простые сахара (напр., моно- и дисахариды).
Соединение эхинокандина может быть включено в рецептурную смесь настоящего изобретения до лиофилизации в концентрациях, превышающих или равных 1 мг/мл. Обычно соединение эхинокандина присутствует в диапазоне от около 1 мг/мл до около 50 мг/мл, предпочтительно в диапазоне концентраций от около 1 мг/мл до около 40 мг/мл, более предпочтительно от около 1 мг/мл до около 30 мг/мл и наиболее предпочтительно от около 8 мг/мл до около 12 мг/мл.
Рецептурные смеси настоящего изобретения содержат мицеллообразующее поверхностно-активное вещество, которое представляет собой фармацевтически приемлемый амфифильный наполнитель, обладающий гидрофобными и гидрофильными элементами или группами, которые обладают способностью солюбилизировать в воде водонерастворимое лекарственное средство. В большинстве случаев значения HLB 10-18 наиболее благоприятны для солюбилизации соединений эхинокандина. Поверхностно-активное вещество представлено в рецептурной смеси в массовом соотношении эхинокандина и поверхностно-активного вещества от около 1:1,75 до около 1:25, более предпочтительно - в соотношении от около 1:2 до около 1:3. Верхний предел добавляемого к рецептурной смеси поверхностно-активного вещества может быть ограничен из-за его токсичности применительно к фармацевтическому лекарственному средству; поэтому верхний предел может варьировать в зависимости от конкретного выбранного поверхностно-активного вещества. Подходящие поверхностно-активные вещества включают полисорбаты (напр., полисорбат 80, полисорбат 40, полисорбат 20), производные полиоксиэтиленового касторового масла (напр., Chemophors™ (касторовое масло полиоксил 35, гидрогенизированное касторовое масло полиоксил 40 и гидрогенизированное касторовое масло полиоксил 60), доступные от BASF)), полиоксиэтиленстеараты (напр., Solutol™ HS 15 (макрогол-660-гидроксистеарат, доступный от BASF), сорбиттриолеат, соли желчных кислот (напр., холевые кислоты, дезоксихолевые кислоты и их соли) (напр., натрийдезоксихолат или натрийтауродезоксихолат)), лецитин, и им подобные. Предпочтительные поверхностно-активные вещества включают полисорбат 80, полисорбат 40, полисорбат 20, и полиоксиэтиленгидроксистеараты, обладающие восстанавливаемыми гистаминными эффектами (напр., Solutol™ HS 15). Поверхностно-активные вещества, которые солюбилизируют неудовлетворительно, включают полоксамеры, которые представляют собой группу сополимеров пропиленоксида и этиленоксида.
"Полисорбат" относится к веществам, обладающим нижеследующей общей формулой:
где x+y+w+z равно целому числу между 5 и 20.
Коммерческий продукт Твин™ 20, 40 и 80 (доступный от ICI Americas Inc., Wilmington, DL) представлен вышеприведенной структурой, когда x+y+w+z=20.
"Лецитин" относится к веществам, обладающим нижеследующей общей структурой:
R представляет собой типичный остаток стеариновой кислоты, пальмитиновой кислоты или олеиновой кислоты.
"Соли желчных кислот" относятся к веществам, обладающим нижеследующей общей структурой:
где R3, R7, и R12 представляют собой группы -ОН, Н или SО3, a R24 представляет собой -ОН или щелочную соль СО
| - |
| 2 |
| - |
| 3 |
| - |
| 2 |
Типичный раствор рецептурной смеси включает соединение эхинокандина и мицеллообразующее поверхностно-активное вещество. Заявители наблюдали, что включение мицеллообразующего поверхностно-активного вещества не только оптимизирует солюбилизацию соединения эхинокандина, но также повышает стабильность данного раствора. Рецептурная смесь может факультативно включать один или несколько компонентов в виде буфера, стабилизирующего агента, и/или тонизирующего агента. Если данная рецептурная смесь находится в виде раствора, то в нем присутствует также и растворитель. Растворители обычно выбирают с учетом их безопасного (GRAS) парентерального введения млекопитающему. Как правило, безопасные растворители представляют собой не