Лекарственное средство для подавления заражения и пролиферации вируса иммунодефицита человека
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и касается лекарственного средства для подавления заражения и пролиферации вируса иммунодефицита человека в макрофагах, которое содержит производные эритромицина. Данные макролидные соединения обладают высокой ингибирующей активностью в отношении белка тирозинкиназы, и эффективны для подавления заражения и пролиферации вируса иммунодефицита человека. 3 з.п. ф-лы, 25 ил.
Реферат
Предпосылки изобретения
1. Область изобретения
Настоящее изобретение относится к агенту для подавления заражения и пролиферации вируса иммунодефицита человека (ВИЧ-1), который заражает иммунокомпетентные клетки, такие как макрофаги или дендритные клетки, и приводит к повреждению иммунной системы. Конкретнее, настоящее изобретение относится к применению агента для подавления заражения и пролиферации вируса иммунодефицита человека, агенту, который подавляет инфицирование и пролиферацию вируса иммунодефицита человека в макрофагах типа М, производных человеческих моноцитов.
2. Описание предшествующего уровня техники
Более 40 миллионов людей заражено вирусом иммунодефицита человека (ВИЧ-1), и было установлено, что среди них у 5 миллионов людей развился синдром приобретенного иммунодефицита человека (СПИД). СПИД действительно является общемировым инфекционным заболеванием. Высокоэффективная антиретровирусная терапия (HAART) пациентов с ВИЧ-1 появилась в начале 90-х годов. В результате применения в клинике было получено значительное терапевтическое действие, такое как снижение количества вирусов в плазме крови пациентов со СПИДом и установленное выделение CD4.
Однако, с другой стороны, вызывает тревогу, что вирус, направленный к макрофагам (Мϕ), остается в ретикулоэндотелиальных тканях1),2), и у пациентов, получавших HAART, наблюдается появление резистентного штамма к HAART в течение периода времени примерно от полугода до нескольких лет после HAART. Кроме того, поскольку стоимость лечения с помощью HAART является высокой, лечение в основном назначается людям в развитых странах, и люди в развивающихся странах не могут получать подобную терапию вследствие неравенства в экономическом положении развитых стран и развивающихся стран, где как раз находится более 80% пациентов, зараженных ВИЧ в мире, и такое лечение не может способствовать прерыванию международного распространения вируса, в результате чего необходима множественная комбинированная терапия для того, чтобы подавить появление резистентных штаммов, и также сообщается о пациентах, которые не получают лечения за счет абдоминального симптома и повреждения гематопоэтической системы, следовательно, указывается на ограничения как в медицинском, так и социальном плане при применении HAART.
ВИЧ-1 представляет вирус, который заражает иммунокомпетентные клетки, такие как макрофаги и дендритные клетки, с последующим разрушением иммунной системы. В результате недавно проведенных исследований становится очевидным, что заражение и пролиферация ВИЧ-1 в макрофагах играют важную роль в поддержании инфекции и развитии патогенеза ВИЧ-13), следовательно, требуется разработка новых лекарственных препаратов, которые ингибируют заражение и пролиферацию ВИЧ-1 в макрофагах.
Несмотря на проведение многочисленных опытов по заражению макрофагов ВИЧ-1, многие исследования выполнялись с использованием клеточных штаммов макрофагов, но результаты экспериментов с использованием клеточных штаммов не всегда отражают функцию тканевых макрофагов in vivo. Akagawa et al. добились успеха в дифференциальной индукции двух типов макрофагов, способствующих пролиферации ВИЧ-1, и макрофагов, подавляющих пролиферацию ВИЧ-1, из моноцитов, кроме того, они дополнительно показали, что макрофаги, подавляющие пролиферацию, могут служить моделью человеческих альвеолярных макрофагов, в результате чего стало возможным проводить исследование заражения, пролиферации и механизма подавления пролиферации ВИЧ-1 в системе, подобной макрофагам in vivo4)-9).
Кроме того, известно, что макролиды эффективны при лечении панбронхиолита (DPB) и заболеваний в области оторинологии, и известен механизм их действия, в дополнении к антибиотическому действию, в отношении индукции противовоспалительного действия10). В частности, имеется сообщение, в результате исследования накопления макролидов в тканях, указывающее, что в макрофагах наблюдали в несколько сот-тысяч раз более высокое накопление по сравнению с периферическими лимфоцитами, следовательно, полагается, что действие макролидов на макрофаги является важным.
Основываясь на вышеуказанных предпосылках, авторы изобретения предположили, что является полезной разработка лекарственных препаратов, восполняющих недостатки HAART, подавляющих заражение и пролиферацию ВИЧ-1 в макрофагах, и нацеленных на удаление ВИЧ-1, направленного к макрофагам из лимфоидной ретикулоэндотелиальной системы, особенно разработка дешевых химиотерапевтических препаратов с точки зрения терапевтической стратегии против СПИДа во всем мире для лечения пациентов, зараженных ВИЧ-1.
Авторы изобретения исследовали, оказывают или нет известные макролидные производные действие в отношении подавления заражения и пролиферации ВИЧ-1 и неожиданно обнаружили, что они оказывают подавляющее действие на заражение и пролиферацию ВИЧ-1 в макрофагах, и показали, что подавляющее действие на пролиферацию проявляется подавлением экспрессии белка тирозинкиназы Hck в макрофагах, который является необходимым для роста вируса и подавлением активации Р38МАРК, и сделали настоящее изобретение.
Целью настоящего изобретения является обеспечение применения агента для подавления заражения и пролиферации вируса иммунодефицита человека, пригодного для лечения пациентов, зараженных ВИЧ-1, дешевым химиотерапевтическим препаратом, а также пригодного в качестве дополнительного препарата при проведении HAART.
Краткое описание изобретения
Настоящее изобретение относится к применению макролидных производных для подавления заражения и пролиферации вируса иммунодефицита человека в макрофагах, производных человеческих моноцитов. Макрофаги, производные человеческих моноцитов, являются макрофагами типа М. Подавление пролиферации вируса основано на ингибирующем действии макролидов на белок тирозинкиназа Hck и ингибировании активации Р38МАРК макрофагов, необходимых для пролиферации вируса. Известные макролидные производные, обладающие таким подавляющим действием в отношении пролиферации ВИЧ-1, включены в настоящее изобретение.
Предпочтительными примерами макролидных производных, использованных в настоящем изобретении, являются:
Оксациклотетрадекан-2,10-дион,4[(2,6-дидезокси-3-О-метил-α-L-рибо-гексопиранозил)окси]-14-этил-7,12,13-тригидрокси-3,5,7,9,11,13-гексаметил-6-[[3,4,6-тридезокси-3-(диметиламино)-β-D-ксило-гексопиранозил]окси]; 11-(1’-гидроксипропил)-3-[[2,6-дидезокси-3-С-метил-α-L-рибо-гексопиранозил]окси]-5-[(3,4,6-тридезокси-3-(диметиламино)-β-D-ксило-гексопиранозил)окси]-2,4,6,8,11,14-гексаметил-10,13,15-три-оксатрицикло[9.2.1.1.9.6]-пентадекан-1-он; 6,15,16-триоксатрицикло[10.2.1.11,4]гексадекан, производное эритромицина; 4,13-диоксабуцикло [8.2.1]тридек-12-ен-5-он,7-[(2,6-дидезокси-3-С-метил-α-L-рибо-гексопиранозил)окси]-3-(1,2-дигидрокси-1-метилбутил)-2,6,8,10,12-пентаметил-9-[[3,4,6-тридезокси-3-(диметиламино)-β-D-ксило-гексопиранозил]окси]; оксацикло-тетрадекан-2,10-дион,4-[(2,6-дидезокси-3-О-метил-α-L-рибо-гексопиранозил)окси]-14-этил-12,13-дигидрокси-7-метокси-3,5,7,9,11,13-гексаметил-6-[[3,4,6-тридезокси-3-(диметиламино)-β-D-ксило-гексопиранозил]окси]; де(3’-N-метил)-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; де (3’-N-метил)-3’-N-сульфонил-8,9-ангидропсевдоэритромицина
А 6,9-гемикеталь или его соль; де(3’-N-метил)-[3’-N-(3-гидрокси-1-пропил)]-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; де(3’-N-метил)-3’-N-(2-ацетоксиэтил)-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; де(3’-N-метил)-3’-N-цианометил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; де(3’-N-метил)-3’-N-(2-фторэтил)-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; бис-де(3’-N-метил)-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; бис-де(3’-N-метил)-3’-N-этил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; бис-де(3’-N-метил)-3’,3’-N,N-диэтил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; бис-де(3’-N-метил)-3’-N-аллил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; бис-де (3’-N-метил)-3’,3’-N,N-диаллил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; бис-де(3’-N-метил)-3’-N-пропаргил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; бис-де(3’-N-метил)-3’,3’-N,N-дипропаргил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; бис-де(3’-N-метил)-3’-N-пропил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; бис-де(3’-N-метил)-3’,3’-N,N-дипропил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; бис-де(3’-N-метил)-3’-N-гексил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; бис-де(3’-N-метил)-3’,3’-N,N-дигексил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; бис-де(3’-N-метил)-3’-N-бензил-8,9-ангидро-псевдоэритромицина А 6,9-
гемикеталь или его соль; бис-де(3’-N-метил)-3’,3’-N,N-дибензил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; бис-де(3’-N-метил)-3’-N-(2-пропил)-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; бис-де (3’-N-метил)-3’,3’-N,N-ди-(10-бром-1-деканил)-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; бис-де(3’-N-метил)-3’-N-ацетил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; де(3’-диметиламино)-3’-пиперидино-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; де(3’-диметиламино)-3’-пирролидино-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; де(3’-диметиламино)-3’-морфолино-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; де(3’-диметиламино)-3’-[гексагидро-1-(1Н)-азепинил]-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; де (12-гидрокси)-де[12-(1-гидроксипропил)]-12-гидроксиоксим-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; де[12-(1-гидроксипропил)]-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; де(12-гидрокси)-де[12-(1-гидроксипропил)]-12-амино-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; де(3’-N-метил)-де[12-(1-гидроксипропил)]-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль; де(3-O-кладинозил)-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль и де(3-O-кладинозил)-де(3’-N-метил)-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль.
Для того чтобы понять настоящее изобретение, поясняется
механизм подавления пролиферации ВИЧ-1, направленного на макрофаги, в макрофагах, производных моноцитов человека.
[I] Экспериментальные материалы и методы
(1-1) Получение макрофагов, производных человеческих моноцитов и альвеолярных макрофагов
Как сообщалось ранее11), человеческие одноядерные клетки из периферической крови (РМВС) выделяли из светлого слоя кровяного сгустка от здоровых людей-добровольцев с использованием микрогранул, нагруженных антителами CD14 (Miltenyi Biotec, Германия), магнитной системы для разделения клеток (MACS) (Miltenyi Biotec, Германия) и лифопрепарата (Nycome Inc., Норвегия), затем моноциты выделяли из РМВС положительным отбором.
Макрофаги, производные моноцитов, получали культивированием выделенных моноцитов в присутствии M-CSF (колониестимулирующего фактора макрофагов) (104 Е/мл, полученного от Morinaga Milk Co.), гранулоцитов и колониестимулирующего фактора гранулоцитов, GM-CSF (500 Е/мл, полученного от Japan, Scheling Plough Co., Osaka, или полученного от R & S Genzyme-TECHNE Inc.) в среде RPMI1640 с добавлением 10% фетальной телячьей сыворотки (Nissui Seiyaku Co., Токио) в течение 7-8 дней.
Макрофаги, полученные при дифференциальной индукции с помощью M-CSF из человеческих моноцитов, обозначали, как макрофаги типа М (Мϕ типа М или М-Мϕ) и макрофаги, полученные дифференциальной индукцией с помощью GM-CSF, из человеческих моноцитов, обозначали как макрофаги типа GM (Мϕ типа GM или GM-Mϕ). Кроме того, альвеолярные макрофаги (альвеолярные Мϕ или А-Мϕ) получали следующим образом. Извлекали клетки, полученные из альвеолярной промывной жидкости, при промывании альвеол у здоровых добровольцев их суспендировали и адгезировали к пластику, затем отмывали неадгезированные клетки и оставшиеся адгезированные клетки обозначали как альвеолярные Мϕ.
(1-2) Заражение макрофагов ВИЧ-1
Заражение макрофагов ВИЧ-1 проводили следующим образом. Вирусные штаммы, направленные на макрофаги, ВИЧ-1JR-FL и ВИЧ-1BAL, использовали для заражения в течение 2 ч при контактировании с клетками М-Мϕ, GM-Мϕ и А-Мϕ (доводили до 2,5×105/лунку, Flacon №3043: Becton Dickinson Labware, Inc., США) при низкой концентрации (титр антигена р24 50 нг/мл, TCID50=3000/мл вируса до конечной концентрации 100 пг/мл), и неадсорбированный к макрофагам вирус отмывали и культивировали при добавлении свежей среды. В случае среды с М-Мϕ добавляли M-CSF (104 Е/мл) и в случае среды с GM-Mϕ добавляли GM-CSF (500 Е/мл).
В настоящих опытах количество вируса, использованное при контактном заражении, доводили до уровня вируса у пациентов, имеющегося на стадии носительства, поскольку уровень вируса в легочной ткани у пациентов на стадии носительства ВИЧ-1 составляет несколько десятков пг/мл - несколько сотен пг/мл, а уровень вируса при заражении в альвеолярных Мϕ составляет несколько копий на 104 клеток12).
(1-3) Анализ заражения и пролиферации ВИЧ-1
Пролиферацию вируса исследовали по количеству выделенных в культуральный супернатант вирусных частиц после заражения, с использованием сэндвич-ELISA с двумя типами анти-р24-антител (Nu24 и 10В513)). В качестве LTR (длинного концевого повторного)-gag генного праймера использовали следующие JAM62 и JAM65. Для групповой ПЦР использовали следующие праймеры JAM63 и JAM64 в качестве внутреннего праймера.
JAM62:
5’-GCTTCAAGTAGTGTGTGCCCGTCTG-3’
JAM65:
5’-AATCGTTCTAGCTCCCTGCTTGCCC-3’
JAM63:
5’-GTGTGACTCTGGTAACTAGAGATCC-3’
JAM64:
5’-CCGCTTAATACTGACGCTCTCGCAC-3’.
(1-4) Анализ экспрессии белка тирозинкиназы Hck и белка фактора транскрипции С/ЕВРβ
Экспрессию белка тирозинкиназы Hck и белка фактора транскрипции С/ЕВРβ в макрофагах исследовали после солюбилизации макрофагов в буфере для образца для SDC-PAGE, проведением электрофореза в 10% SDS-полиакриламидном геле, переносом белка с геля на иммобилоновую мембрану Р (Millipore Inc., США) и анализом антител против данных белков вестерн-блоттингом. Антитела против белка тирозинкиназы Hck (N-30) и антитела против С/ЕВРβ (С-19) были получены от Santacluse Inc. (США). Результаты вестерн-блоттинга детектировали реагентом Amersham ELC (Amersham International plc, Buckinghamshire, Великобритания). Интенсивность полос выражали показателем PSL (фотостимулирующей люминесценции) (А/мм2).
(1-5) Обработка макрофагов антисмысловым белком тирозинкиназой Hck и белком фактором транскрипции С/ЕВРВ
Антисмысловой олигонуклеотидный зонд белка Hck и белка С/ЕВРβ (AS), соответствующий ему смысловой олигонуклеотидный зонд (S) и несмысловой олигонуклеотидный зонд, не относящийся к транскрипции и трансляции (NS), использовали следующим образом.
Фосфортиоат-модифицированный AS-Hck;
5’-TTCATCGACCCCATCCTGGC-3’
Фосфортиоат-модифицированный S-Hck;
5’-GCCAGGATGGGGTCGATGAA-3’
Фосфортиоат-модифицированный NS-Hck;
5’-CCATATTTCCCGCTCGCGTG-3’
Фосфортиоат-модифицированный AS-C/EBPβ;
5’-CAGGCGTTGCATGAACGCGG-3’
Фосфортиоат-модифицированный S-C/ЕВРβ;
5’-CCGCGTTCATGCAACGCCTG-3’
Фосфортиоат-модифицированный NS-C/EBPβ;
5’-CCAGAGAGGGCCCGTGTGGA-3’.
Данные зонды растворяли в сыворотке, не содержащей среду RPMI1640, в которой растворяли липофектин (Life Technology
Inc., США) в концентрации 5 мкМ, при комнатной температуре в течение 30 мин, добавляли со средой RPMI1640, которая содержала 10% FCS, к макрофагам (конечная концентрация 2 мкМ) и инкубировали при 37°С в течение 24 ч. После чего клетки промывали средой, добавляли среду RPMI1640, содержащую 10% FCS, без олигонуклеотидов, дополнительно культивировали в течение 24 ч, и затем заражали ВИЧ-1.
(1-6) Анализ активации Р38МАРК и ERK1/2
Активацию Р38МАРК и ERK1/2 определяли с использованием антител против Р38МАРК, анти-ЕРК1/2-антител, анти-фосфорилирования тирозина Р38МАРК-антител и анти-фосфорилирования тирозина ERK1/2-антител (New England Biolabs, Inc., США) и реакцию фосфорилирования данных молекул определяли вестерн-блоттингом.
[2] Результаты
(2-1) Пролиферативная ответная реакция штамма ВИЧ-1, направленного на макрофаги в М-Мϕ и GM-Mϕ
(2-1-1) Количество белка р24 в ВИЧ-1 зараженных М-Мϕ и GM-Мϕ в культуральном супернатанте
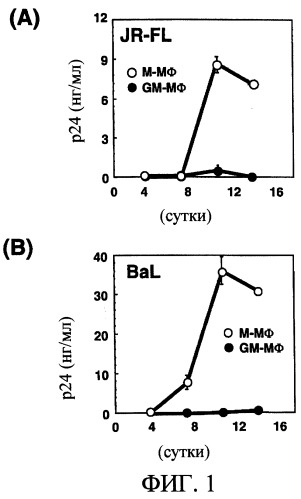
Клетки М-Мϕ и GM-Mϕ заражали штаммом ВИЧ-1JR-FL и штаммом ВИЧ-1BAL и инкубировали в течение 14 суток. Количество белка р24 в культуральном супернатанте макрофагов определяли в одинаковые периоды времени. При любом из штаммов ВИЧ-1 белок р24 обнаруживали в культуральном супернатанте М-Мϕ [смотри фиг.1(А) и (В)].
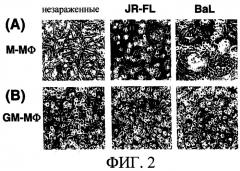
(2-1-2) Цитопатия в ВИЧ-1-зараженных М-Мϕ и GM-Мϕ
Морфологические изменения клеток М-Мϕ и GM-Mϕ, зараженных штаммом ВИЧ-1JR-FL и штаммом ВИЧ-1BAL, наблюдали в зависимости от времени. Образование кластеробразующих клеток и слитых клеток наблюдали на 2-ые сутки инкубации только в продуцирующих вирус М-Мϕ и на 4-7 сутки отмечали образование многоядерных гигантских клеток в культуре [смотри фиг.2(А)]. С другой стороны, морфологические изменения не наблюдали в GM-Мϕ, в которых отсутствовало размножение вируса [смотри фиг.2(В)]. Данные результаты указывают на то, что цитопатическое действие такое, как образование кластеров, слияние клеток и образование MGC в макрофагах, при заражении ВИЧ-1, направленного на макрофаги, можно использовать в качестве показателя для определения пролиферации вируса.
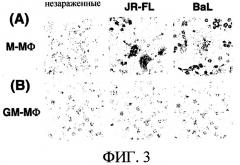
(2-1-3) Анализ распределения внутриклеточного белка р24 в ВИЧ-1-зараженных М-Мϕ и GM-Mϕ
Клетки М-Мϕ и GM-Mϕ заражали штаммом ВИЧ-1JR-FL и штаммом ВИЧ-1BAL и иммунологически окрашивали антителами к р24 на 8 сутки после заражения. В М-Мϕ наблюдали экспрессию белка р24 в MGC и сходным им клетках [смотри фиг.3(А)]. В GM-Mϕ не наблюдали экспрессии белка р24 [смотри фиг.3(В)]. Исходя из данных результатов, установлено, что механизм, подавляющий продукцию вируса в GM-Mϕ, может быть подавляющим механизмом перед стадиями внутриклеточного образования и активной репликации вирусных частиц.
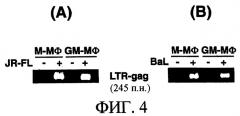
(2-1-4) Детектирование вирусной ДНК в ВИЧ-1-зараженных М-Мϕ и GM-Мϕ
Клетки М-Мϕ и GM-Mϕ заражали штаммом ВИЧ-1JR-FL и штаммом ВИЧ-1BAL и детектировали образование вирусной ДНК на 2 сутки после заражения групповой ПЦР с использованием праймера LTR-gаg. Образование вирусной ДНК детектировали как в М-Мϕ, в которых наблюдали пролиферацию вируса, так и GM-Мϕ, в которых не наблюдали образование вирусной ДНК [смотри фиг.4(А) и (В)]. Данные результаты указывали, что инфильтрация вируса в клетки и превращение РНК в ДНК происходило даже в GM-Мϕ без обнаружения пролиферации вируса, это показывает, что механизм подавления образования вирусов в GM-Мϕ имеет место после образования вирусной ДНК.
(2-1-5) Экспрессия белка тирозинкиназы Hck и белка С/ЕВРβ в М-Мϕ и GM-Мϕ и изменения экспрессии под действием заражения ВИЧ-1
Поскольку М-Мϕ, производные человеческих моноцитов, эффективно индуцируют пролиферацию ВИЧ-1, и GM-Mϕ ингибируют пролиферацию вируса, авторы изобретения изучали, зависят или нет различия в восприимчивости к заражению ВИЧ-1 от различий в экспрессии белка хозяина. В результате показано, что экспрессия белка тирозинкиназы Hck и фактора транскрипции С/ЕВРβ является различной в двух типах макрофагов.
Без заражения вирусом белок тирозинкиназа Hck экспрессировался в высокой степени в М-Мϕ и в меньшей степени экспрессировался в GM-Мϕ [смотри фиг.5]. Несмотря на то, что экспрессия белка тирозинкиназы Hck в М-Мϕ увеличивалась при заражении штаммом ВИЧ-1BAL на 2 сутки, напротив, экспрессия белка тирозинкиназы в GM-Mϕ была снижена [смотри фиг.5]. С другой стороны, в М-Мϕ при экспрессии белка С/ЕВРβ без заражения вирусом экспрессировался только высокомолекулярный тип (37 кД), но в GM-Mϕ была обнаружена экспрессия обоих белков высокомолекулярного типа и низкомолекулярного типа (23 кД) [смотри фиг.6]. Несмотря на то, что не было установлено изменений в экспрессии белка С/ЕВРβ в М-Мϕ на 2 сутки после заражения штаммом ВИЧ-1BAL, экспрессия низкомолекулярного белка С/ЕВРβ была значительно повышена в GM-Mϕ, и появились изменения в соотношении высокомолекулярного типа и низкомолекулярного типа (соотношение L/S) [смотри фиг.6].
(2-1-6) Изучение восприимчивости к заражению человеческих альвеолярных Мϕ к ВИЧ-1 и экспрессия белка тирозинкиназы и белка С/ЕВРβ
Было показано, что GM-Mϕ, полученные из человеческих моноцитов с помощью GM-CSF, аналогичны человеческим альвеолярным макрофагам по морфологии, экспрессии поверхностного маркера, продуктивности образования активного кислорода и экспрессии каталазы13),14). Авторы изобретения исследовали, сходна или нет восприимчивость к заражению GM-Мϕ, производных человеческих моноцитов, и человеческих альвеолярных Мϕ.
После заражения штаммом ВИЧ-1BAL альвеолярных Мϕ (А-Мϕ) определяли вирусную ДНК групповой ПЦР и анализировали пролиферацию вируса по количеству белка р24 в культуральном супернатанте с помощью ELISA. Вирусную ДНК обнаруживали во все периоды времени после заражения [смотри фиг.7(В)], но через 14 суток инкубации не был детектирован ни белок р24, ни продукция вируса [смотри фиг.7(А)].
В результате изучения экспрессии белка тирозинкиназы Hck и белка С/ЕВРβ в альвеолярных Мϕ вестерн-блоттингом было установлено снижение экспрессии белка тирозинкиназы Hck и изменение экспрессии изоформы белка С/ЕВРβ, а именно была значительно повышена экспрессия низкомолекулярного типа белка С/ЕВРβ (23 кД), и имело место снижение соотношения L/S [смотри фиг.8]. На основании данных результатов можно предположить, что механизм подавления пролиферации вируса в человеческих альвеолярных Мϕ и GM-Mϕ, производных человеческих моноцитов, может в значительной степени быть сходным.
(2-1-7) Снижение экспрессии белка тирозинкиназы Hck в обработанных антисмысловыми олигонуклеотидами М-Мϕ к белку тирозинкиназе Hck и подавление пролиферации ВИЧ-1
Клетки М-Мϕ обрабатывали антисмысловыми олигонуклеотидами (Hck-AS) к белку тирозинкиназе Hck в течение 24 ч, и М-Мϕ инкубировали еще в течение 24 ч и определяли экспрессию белка тирозинкиназы Hck. В результате было установлено, что экспрессия белка тирозинкиназы Hck была значительно снижена по сравнению с контрольной группой (L) [смотри фиг.9]. Однако в М-Мϕ, обработанных смысловым зондом (Hck-S) или не относящимся к нему зондом (Hck-NS), было установлено подавление экспрессии белка тирозинкиназы Hck [смотри фиг.9].
Данные клетки М-Мϕ, предварительно обработанные различными олигонуклеотидами, заражали штаммом ВИЧ-1BAL и оценивали экспрессию белка тирозинкиназы Hck через 2 суток после заражения, снижение экспрессии белка тирозинкиназы Hck было установлено только в группе с добавлением антисмыслового зонда (Hck-AS), и подавление экспрессии белка тирозинкиназы Hck не было детектировано в М-Мϕ, обработанных смысловым зондом (Hck-S) или не относящимся к нему зондом (Hck-NS) [смотри фиг.10]. Определяли содержание белка р24 в культуральном супернатанте через 4, 7 и 10 суток после заражения. В клетках М-Мϕ, обработанных антисмысловым зондом (Hck-AS), во все периоды времени было обнаружено значительное количество белка р24, но в М-Мϕ, обработанных смысловым зондом (Hck-S) и не относящимся к нему зондом (Hck-NS), было установлено зависимое от времени повышение уровня белка р24, сходное с контрольной группой, обработанной только липофектином (L) [смотри фиг.10]. Данные результаты указывают, что экспрессия белка тирозинкиназы в М-Мϕ необходима для пролиферации ВИЧ-1.
(2-1-8) Экспрессия С/ЕВРβ и ростовая ответная реакция ВИЧ-1 в GM-Мϕ, обработанных антисмысловыми олигонуклеотидами С/ЕВРβ
Клетки GM-Mϕ обрабатывали антисмысловым зондом к С/ЕВРβ (C/EBPβ-AS) в течение 24 ч и культивировали еще в течение 24 ч, и в GM-Мϕ через двое суток после заражения штаммом ВИЧ-1BAL в относительной степени сохранялась экспрессия высокомолекулярной изоформы (37 кД), но экспрессии низкомолекулярной изоформы (23 кД) была существенно снижена с повышением соотношения L/S [смотри фиг.11]. Кроме того, заражение ВИЧ-1 клеток GM-Мϕ, предварительно обработанных C/EBPβ-AS, индуцировало пролиферацию вируса, и в культуральном супернатанте был обнаружен белок р24 [смотри фиг.12]. Способствующее росту ВИЧ-1 действие и изменения экспрессии С/ЕВРβ не обнаруживали в группах с добавлением С/ЕВРβ-S и C/EBPβ-NS [смотри фиг.11 и фиг.12].
Вышеприведенные результаты опытов четко указывают, что клетки М-Мϕ и GM-Mϕ, производные человеческих моноцитов, обладают различной восприимчивостью к заражению ВИЧ-1, направленным к макрофагам, и в М-Мϕ значительно усиливается пролиферация вируса, в то время, как напротив, в GM-Mϕ пролиферация вируса подавляется. Кроме того, различие в характере пролиферации в М-Мϕ и GM-Mϕ совпадало с различием в экспрессии высокомолекулярной изоформы и низкомолекулярной формы белка тирозинкиназы Hck и белка фактора транскрипции С/ЕВРβ в данных клетках. В результате специфически регулируемой экспрессии изоформы белка тирозинкиназы Hck и белка С/ЕВРβ с использованием антисмысловых олигонуклеотидов, размножение вируса в клетках М-Мϕ полностью регулировалось и, напротив, размножение вируса можно было индуцировать в GM-Мϕ.
Исходя из данных результатов, четко следует, что тирозинкиназа является необходимой для пролиферации ВИЧ-1 в М-Мϕ, и низкомолекулярный тип изоформы С/ЕВРβ играет важную роль при подавлении пролиферации ВИЧ-2 в GM-Mϕ. Кроме того, поскольку результаты исследования восприимчивости к заражению ВИЧ-1 человеческих альвеолярных Мϕ и экспрессия белка тирозинкиназы Hck и С/ЕВРβ, и поскольку механизм подавления роста ВИЧ-1 в человеческих альвеолярных Мϕ и GM-Mϕ, производных человеческих моноцитов являются идентичными, анализ в GM-Mϕ может быть в высокой степени связан с анализом альвеолярных Мϕ in vivo. Результаты данных опытов указывают, что анализ механизма пролиферации ВИЧ-1 в М-Мϕ, производных человеческих моноцитов, пригоден в качестве основной экспериментальной системы для разработки лекарственных препаратов, обладающих подавляющим действием на рост ВИЧ-1.
Основываясь на вышеприведенных результатах, можно привести предпочтительные примеры макролидных производных, обладающих свойством ингибировать экспрессию белка тирозинкиназы в М-Мϕ, производных человеческих моноцитов, и ингибировать активацию Р38МАРК, который необходим для пролиферации вируса, в виде следующих соединений, и данные соединения являются промышленно доступными или их легко получить способами, описанными в литературных источниках.
Оксациклотетрадекан-2,10-дион,4[(2,6-дидезокси-3-О-метил-α-L-рибо-гексопиранозил)окси]-14-этил-7,12,13-тригидрокси-3,5,7,9,11,13-гексаметил-6-[[3,4,6-тридезокси-3-(диметиламино)-β-D-ксило-гексопиранозил]окси (Sigma Inc., США); в последующем обозначенный, как ЕМ.
11-(1’-Гидроксипропил)-3-[2,6-дидезокси-3-С-метил-α-L-рибо-гексопиранозил]окси]-5-[(3,4,6-тридезокси-3-(диметиламино)-β-D-ксило-гексопиранозил)окси]-2,4,6,8,11,14-гексаметил-10,13,15-три-оксатрицикло [9.2.1.1.9.6]-пентадекан-1-он (смотри P.Kurath et al. Exoperimentia, 27, 362, 1971); в последующем обозначенный как ЕМ201.
6,15,16-Триоксатрицикло[10.2.1.11,4]гександекан, производное эритромицина или 6,9,12-ангидроэритромицин А (смотри Р. Kurath et al. Exoperimentia, 27, 362, 1971); в последующем обозначенный как ЕМ202.
4,13-Диоксабуцикло [8.2.1] тридек-12-ен-5-он,7-[(2,6-дидезокси-3-С-метил-α-L-рибо-гексопиранозил)окси]-3-(1,2-дигидрокси-1-метилбутил)-2,6,8,10,12-пентаметил-9-[[3,4,6-тридезокси-3-(диметиламино)-β-3-D-ксило-гексопиранозил]окси] (смотри JP-A-7-247299); в последующем обозначенный как ЕМ703.
Оксациклотетрадекан-2,10-дион,4-[(2,6-дидезокси-3-О-метил-α-L-рибо-гексопиранозил)окси]-14-этил-12,13-дигидрокси-7-метокси-3,5,7,9,11,13-гексаметил-6-[[3,4,6-тридезокси-3-(диметиламино)-β-D-ксило-гексопиранозол]окси] (смотри S.Morimoto et al. J Antibiotics, 43, 286, 1990 или продукт Apin Chemicals Ltd., Великобритания и продукт Wako Pure Chemicals, Inc. Япония); в последующем обозначенный как САМ.
Примерами производных эритромицина являются:
де(3’-N-метил)-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ703; де(3’-N-метил)-3’-N-сульфонил-8,9-ангидро-псевдоэритромицина А G,9-гемикеталь или его соль, в последующем обозначенный как ЕМ727; де(3’-N-метил)-[3’-N-(3-гидрокси-1-пропил)]-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ744; де(3’-N-метил)-3’-N-(2-ацетоксиэтил)-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ745; де(3’-N-метил)-3’-N-цианометил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ742; де(3’-N-метил)-3’-N-(2-фторэтил)-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ740; бис-де(3’-N-метил)-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ721; бис-де(3’-N-метил)-3’-N-этил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ722; бис-де(3’-N-метил)-3’,3’-N,N-диэтил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ723; бис-де(3’-N-метил)-3’-N-аллил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ724; бис-де (3’-N-метил)-3’,3’-N,N-диаллил-8, 9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ725; бис-де(3’-N-метил)-3’-N-пропаргил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ728; бис-де(3’-N-метил)-3’,3’-N,N-ди-пропаргил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ729; бис-де(3’-N-метил)-3’-N-пропил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ730; бис-де(3’-N-метил)-3’,3’-N,N-дипропил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ731; бис-де (3’-N-метил)-3’-N-гексил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ738; бис-де(3’-N-метил)-3’,3’-N,N-дигексил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ739; бис-де(3’-N-метил)-3’-N-бензил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ732; бис-де (3’-N-метил)-3’,3’-N,N-дибензил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ733; бис-де(3’-N-метил)-3’-N-(2-пропил)-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ736; бис-де(3’-N-метил)-3’,3’-N,N-ди-(10-бром-1-деканил)-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ749; бис-де(3’-N-метил)-3’-N-ацетил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ726; де(3’-диметиламино)-3’-пиперидино-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ734; де(3’-диметиламино)-3’-пирролидино-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ735; де (3’-диметиламино)-3’-морфолино-8, 9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ747; де(3’-диметиламино)-3’-[гексагидро-1(1Н)-азепинил]-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ748; де(12-гидрокси)-де[12-1-(гидроксипропил)]-12-гидроксиоксим-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ743; де[12-(гидроксипропил)]-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ746; де(12-гидрокси)-де[12-(1-гидроксипропил)]-12-амино-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ750; де(3’-N-метил)-де[12-1-(гидроксипропил)]-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ751; де(3-O-кладинозил)-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ737 и де(3-O-кладинозил)-де(3’-N-метил)-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталь или его соль, в последующем обозначенный как ЕМ754.
Различные вышеуказанные производные эритромицина были установлены авторами настоящего изобретения Satoshi Omura et аl., и поданы в качестве международной патентной заявки, международная публикация WO 02/14338 А1, включая псевдоэритромицин, который, как полагается, является новым противовоспалительным агентом. В описании WO 02/14338 A1 подробно приводятся способы синтеза и химические структуры производных эритромицина, и описания способов синтеза каждого производного эритромицина поясняются ниже.
Синтез ЕМ701
Раствор эритромицина (12,4 г) в ледяной уксусной кислоте перемешивали при комнатной температуре в течение 2 ч, медленно добавляли водный раствор бикарбоната натрия и нейтрализовали. Реакционную смесь экстрагировали хлороформом, органический слой обезвоживали мирабилитом, отфильтровывали мирабилит и растворитель удаляли выпариванием с получением сырого твердого вещества. Сырое вещество очищали колоночной хроматографией на силикагеле (смесь хлороформ:метанол:водный аммиак = 10:0,5:0,01→10:1:0,05) с получением ЕМ201 (7,7 г). Затем к метанольному раствору ЕМ201 (7,6 г) добавляли карбонат калия (1,4 г) и кипятили с обратным холодильником в течение 2 ч. После отгонки растворителя остаток растворяли в водном растворе бикарбоната натрия и экстрагировали хлороформом. Смесь обезвоживали мирабилитом, фильтровали и удаляли мирабилит, затем полученное сырое твердое вещество очищали колоночной хроматографией на силикагеле (смесь хлороформ:метанол:водный аммиак = 10:0,5:0,01→10:1:0,5) с получением ЕМ701 (5,9 г, белый порошок).
Синтез де(3’-N-метил)-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталя (ЕМ703)
Ацетат натрия (3,9 г) и йод (2,5 г) добавляли в данном порядке к раствору ЕМ701 (6,9 г) в смеси метанол (52,0 мл) - вода (13,0 мл) при комнатной температуре и перемешивали при 50°С в течение 3 ч. Во время перемешивания добавляли 1 н. водный раствор гидроокиси натрия для постоянного поддержания при рН 8-9. После подтверждения окончания реакции по ТСХ реакционную смесь разбавляли смесью водный аммиак (7,5 мл) - вода (200 мл) и экстрагировали дихлорметаном. После обезвоживания органического слоя мирабилитом мирабилит удаляли фильтрованием и растворитель отгоняли с получением сырого вещества. Сырое вещество очищали колоночной хроматографией на силикагеле (смесь хлороформ:метанол:водный аммиак = 10:0,5:0,01→10:1:0,05) с получением ЕМ703 (4,8 г, белый порошок).
Синтез бис-де(3’-N-метил)-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталя (ЕМ721)
Натрий (4,5 г) добавляли к метанолу (15 мл) для получения метанольного раствора метилата натрия и добавляли ЕМ703 (195,4 мг) и йод (353,6 мг) в таком порядке при 0°С и перемешивали в течение 3 ч. После подтверждения окончания реакции по ТСХ добавляли тиосульфат натрия (0,8 г), водный аммиак (0,5 мл) и воду (80 мл) и экстрагировали дихлорметаном. Органический слой обезвоживали добавлением мирабилита, фильтровали для удаления мирабилита и растворитель отгоняли с получением сырого вещества. Сырое вещество очищали колоночной хроматографией на силикагеле (смесь хлороформ:метанол:водный аммиак = 10:0,5:0,01→10:1:0,05) с получением ЕМ721 (166,3 мг, белый порошок).
Синтез бис-де(3’-N-метил)-3’-N-этил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталя (ЕМ722)
N,N-диизопропилэтиламин (26,6 мкл) и этилйодид (12,2 мкл) добавляли к раствору ЕМ721 (21,0 мг) в диметилформамиде (1,0 мл) и перемешивали при комнатной температуре в течение 4 ч. После подтверждения окончания реакции по ТСХ реакционную смесь разбавляли водой и экстрагировали дихлорметаном. Органический слой обезвоживали добавлением мирабилита, фильтровали для удаления мирабилита и удаляли растворитель с получением сырого вещества. Сырое вещество очищали колоночной хроматографией на силикагеле (смесь хлороформ:метанол:водный аммиак = 10:0,5:0,01→10:1:0,05) с получением ЕМ722 (7,0 мг, белый порошок).
Синтез бис-де(3’-N-метил)-3’,3’-N,N-диэтил-8,9-ангидро-псевдоэритромицина А 6,9-гемикеталя (ЕМ723)
N,N-диизопропилэтиламин (26,6 мкл) и этилйодид (12,2 мкл) добавляли к раствору ЕМ721 (21,0 мг) в диметилформамиде (1,0 мл) и перемешивали при комнатной температуре в течение 4 ч. После подтверждения окончания реакции по ТСХ реакционную смесь разбавляли водой и экстрагировали дихлорметаном. Органический слой обезвоживали добавлением