Модуляторы а3 -рецепторов аденозина
Иллюстрации
Показать всеИзобретение относится к области органической химии и медицины и касается новых производных имидазола формулы I, используемых в качестве модуляторов А3-рецепторов аденозина, а также способа лечения рака и определения наличия опухолевых клеток с помощью указанных соединений. Соединения обладают повышенной активностью. 5 с и 8 з.п. ф-лы, 4 ил.
Реферат
Область изобретения
Настоящее изобретение относится к некоторым производным пиразоло-триазоло-пиримидина, триазоло-триазоло-пиримидина и имидазоло-триазоло-пиримидина и их применению в практике медицины в качестве модуляторов А3-рецепторов аденозина.
Предпосылки изобретения
Фармакологически охарактеризованы три основных класса рецепторов аденозина, классифицируемые как A1, A2 и А3. A1-рецепторы связаны с ингибированием аденилатциклазы через Gi белки, и также было показано, что связаны с другими системами вторичных переносчиков, включая ингибирование или стимуляцию обмена фосфоинозита и активацию ионных каналов. А2-рецепторы дополнительно подразделяются на два подтипа, А2A и А2B, на которых агонисты аденозина активируют аденилатциклазу с высокой и низкой аффинностью соответственно. Последовательность А3-рецепторов была впервые идентифицирована в опытах с крысиной библиотекой кДНК, и было показано, что эта последовательность, позднее клонированная гомологично по отношению к другим рецепторам, связанным с G-белком из библиотеки кДНК мозга крыс, соответствует новому функциональному рецептору аденозина.
Обнаружение А3-рецептора открыло новые лечебные перспективы в области пуринов. В частности, А3-рецепторы участвуют в процессах воспаления, гипотонии и дегрануляции тучных клеток. Вероятно, этот рецептор также играет роль в центральной нервной системе. Селективный А3-агонист IB-MECA индуцирует поведенческую депрессию и при долговременном введении защищает от церебральной ишемии. Было также установлено, что селективные А3-агонисты в высоких концентрациях индуцируют апоптоз в клетках лейкемии человека HL-60. Эти и другие обнаруженные факты делают А3-рецепторы обещающей терапевтической мишенью. Идет поиск селективных антагонистов для А3-рецепторов в качестве потенциальных противовоспалительных и, возможно, антиишемических агентов в головном мозге. В последнее время на стадии разработки находятся А3-антагонисты для применения в качестве препаратов против астмы, антидепрессантов, против аритмии, для защиты почек, против болезни Паркинсона и для усиления познавательной функции.
Следовательно, целью настоящего изобретения является обеспечение соединений и способов их получения и применения, которые являются агонистами, неполными агонистами и/или антагонистами А3-рецептора аденозина.
Краткое описание изобретения
Раскрываются соединения, полезные в качестве эффективных, к тому же селективных модуляторов А3-рецептора аденозина с активностью антагонистов для данного рецептора и способы их получения и применения.
Соединения имеют следующую общую формулу:
или
где:
А является имидазолом, пиразолом или триазолом;
R является -C(X)R1, -C(X)-N(R1)2, -C(X)OR1, -C(X)SR1, -SOnR1, -SOnOR1, -SOnSR1 или -SOn-N(R1)2;
R1 является водородом, алкилом, замещенным алкилом, алкенилом, замещенным алкенилом, алкинилом, замещенным алкинилом, арилом, гетероарилом, гетероциклом, низшим алкенилом, низшим алканоилом или, если связан с атомом азота, затем взятый вместе с атомом азота, образует азетидиновое кольцо или 5-6-членное гетероциклическое кольцо, содержащее один или более гетероатомов, таких как N, О, S;
R2 является водородом, алкилом, алкенилом, алкинилом, замещенным алкилом, замещенным алкенилом, замещенным алкинилом, аралкилом, замещенным аралкилом, гетероарилом, замещенным гетероарилом или арилом;
R3 является фураном, пирролом, тиофеном, бензофураном, бензопирролом, бензотиофеном, необязательно замещенными одним или более заместителями, как описано для замещенных гетероарильных колец;
Х является О, S или NR1;
n равно 1 или 2;
их меченные радиоактивным изотопом аналоги, их меченные флуоресцентной меткой аналоги и
их фармацевтически приемлемые соли.
Предпочтительно R1 является водородом, C1-C8алкилом; С2-С7алкенилом; С2-С7алкинилом; С3-С7циклоалкилом; C1-C5алкилом, замещенным одним или более атомами галогена, гидроксигруппами, C1-C4алкокси, С3-С7циклоалкилами или группами формулы -NR
| 1 |
| 2 |
| 1 |
| 2 |
Предпочтительными C1-C8алкильными группами являются метил, этил, пропил, бутил и изопентил. Примеры С3-С7циклоалкильных групп включают циклопропил, циклопентил и циклогексил. Примеры C1-C5алкильных групп, замещенных С3-С7циклоалкильными группами, включают циклогексилметил, циклопентилметил и 2-циклопентилэтил. Примеры замещенных C1-C5алкильных групп включают 2-гидроксиэтил, 2-метоксиэтил, трифторметил, 2-фторэтил, 2-хлорэтил, 3-аминопропил, 2-(4-метил-1-пиперазин)этил, 2-(4-морфолинил)этил, 2-аминокарбонилэтил, 2-диметиламиноэтил, 3-диметиламинопропил. Арил предпочтительно является фенилом, необязательно замещенным Cl, F, метокси, нитро, циано, метилом, трифторметилом, дифторметокси группами. Примеры 5-6-членных кольцевых гетероциклических групп, содержащих N, О и/или S, включают пиперазинил, морфолинил, тиазолил, пиразолил, пиридил, фурил, тиенил, пирролил, триазолил, тетразолил. Примеры С7-С10аралкильных групп включают бензил или фенетил, необязательно замещенные одним или более заместителями, выбранными из Cl, F, метокси, нитро, циано, метила, трифторметила и дифторметокси. Предпочтительно R1 является водородом, C1-C8алкилом, арилом или С7-С10аралкилом, необязательно замещенным предпочтительно атомами галогена. Предпочтительно Х является О, R2 является C2-С3алкилом или замещенным алкилом, и R3 является фураном.
Особенно предпочтительными соединениями являются те, в которых R представляет фенетильную группу, в которой фенильное кольцо замещается одним или более заместителями, выбранными из группы, состоящей из атомов хлора, фтора, метокси, нитро, циано, метила, трифторметила и дифторметокси.
Возможные значения А можно представить следующими структурными формулами:
Соединения можно применять в способе модуляции А3-рецепторов аденозина у млекопитающего, включая человека. Способы включают введение эффективного количества соединения формулы I, достаточного для модуляции А3-рецепторов аденозина у млекопитающего. Применения соединений включают:
- лечение гипертензии;
- лечение воспалительных заболеваний, таких как ревмато-идный артрит и псориаз;
- лечение аллергических заболеваний, таких как сенная лихорадка и аллергический ринит;
- дегрануляцию тучных клеток;
- противоопухолевые препараты;
- лечение кардиальной гипоксии и
- защиту от церебральной ишемии;
- диагностические применения, например, для определения наличия одного или более вышеуказанных заболеваний или для скринингового анализа при определении эффективности других соединений на связывание с А3-рецептором аденозина (т.е. посредством конкурентного ингибирования, как определяется различными тестами связывания), как описано в Jacobson and Van Rhee, Purinergic approaches to experimental therapy, Jacobson and Jarvis, ed., Wiley, New York, 1997, pp.101-128; Mathot et al., Brit. J. Pharmacol., 116:1957-1964 (1995); van der Wenden et al., J. Med. Chem., 38:4000-4006 (1995); и van Calenbergh, J. Med. Chem., 40:3765-3772 (1997), содержание которых включено здесь в качестве ссылки.
Соединения также можно использовать в способе полного или частичного ингибирования аденилатциклазы (А3) у млекопитающего, включая человека. Способы включают введения эффективного количества соединения формулы I, достаточного для полного или частичного ингибирования аденилатциклаэы у млекопитающего. Соединения также можно пометить и использовать для обнаружения наличия опухолевых клеток, содержащих А3-лиганды аденозина, у пациента или в пробе клеток путем контактирования клеток с меченым соединением, связывания соединения с А3-рецепторами и детектирования присутствия метки.
Соединения можно использовать в фармацевтической композиции, которая включает соединение формулы I и один или более эксципиентов. Различные химические промежуточные продукты можно использовать для получения данных соединений.
Краткое описание чертежей
Фиг.1 является графиком, показывающим насыщение связывания [125I]AB-MECA (фмоль/мг белка) с А3-рецепторами человека, экспрессированными в клетках НЕК 293 против молярной концентрации [125I]АВ-МЕСА.
Фиг.2 является графиком, показывающим насыщение связывания [125I]AB-MECA (фмоль/мг белка) с А3-рецепторами человека, экспрессированными в клеточной линии JURKAT против молярной концентрации [125I]AB-MECA. Как показано на фигуре, детектируемая плотность А3-рецептора равнялась примерно 300 фмоль/мг белка в мембранах клеток JURKAT при использовании [125I]AB-MECA.
Фиг.3 и 4 являются графиками, показывающими насыщение связывания меченного тритием аналога соединения 47-5-[[(4-метоксифенил)амино]карбонил]амино-8-пропил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидина (соединение 102) (фмоль/мг белка) с А3-рецепторами, экспрессированными в клеточной линии JURKAT против молярной концентрации соединения 102. Данные на этих фигурах показывают присутствие А3-рецепторов аденозина в опухолевых клетках человека в высокой плотности. Например, было обнаружено примерно 1300 фмоль/мг белка в клетках JURKAT и 650 фмоль/мг белка детектировано в клетках HL60. Следовательно, соединение 102 является значительно более чувствительным инструментом для обнаружения А3-рецепторов аденозина, чем [125I]AB-MECA. Эти обнаруженные факты облегчают определение присутствия А3-рецептора во многих опухолях человека.
Детальное описание изобретения
Настоящая заявка раскрывает соединения, полезные в качестве эффективных, к тому же селективных модуляторов рецепторов аденозина с активностью как А3-агонистов, так и в некоторых случаях А3-антагонистов, и способы их получения и применения.
Соединения можно использовать в способе модуляции А3-рецепторов аденозина у млекопитающего, включая человека. Способы включают введение эффективного количества соединения формулы I, достаточного для модуляции А3-рецепторов аденозина, млекопитающему.
Соединения можно использовать в фармацевтической композиции, которая включает соединение формулы I и один или более эксципиентов. Различные химические полупродукты можно использовать для получения данных соединений.
Определения
Как здесь использовано, соединение является агонистом А3-рецептора аденозина, если оно способно полностью ингибировать аденилатциклазу (А3) и способно вытеснять [125I]AB-MECA в тесте конкурентного связывания.
Как здесь использовано, соединение является неполным агонистом А3-рецептора аденозина, если оно способно частично ингибировать аденилатциклазу (А3) и способно вытеснять [125I]AB-MECA в тесте конкурентного связывания.
Как здесь использовано, соединение является антагонистом А3-рецептора аденозина, если оно способно предупредить ингибирование за счет агониста и способно вытеснять [125I]AB-MECA в тесте конкурентного связывания.
Как здесь использовано, соединение является селективным для А3-рецептора, если соотношение активности A1/А3 и A2/А3 выше, чем примерно 50, предпочтительно находится между 50 и 100 и наиболее предпочтительно выше, чем примерно 100.
Как здесь использовано, термин “алкил” относится к одновалентным прямым, разветвленным или циклическим алкильным группам, предпочтительно имеющим от 1 до 20 атомов углерода, более предпочтительно от 1 до 10 атомов углерода (“низший алкил”) и наиболее предпочтительно от 1 до 6 атомов углерода. Этот термин поясняется примерами групп, таких как метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, н-гексил и тому подобное. Термины “алкилен” и “низший алкилен” относится к двухвалентным радикалам соответствующего алкана. Кроме того, как здесь использовано, другие фрагменты, имеющие названия, производные от алканов, такие как алкоксил, алканоил, алкенил, циклоалкенил и т.д., когда модифицированы “низшими”, имеют углеродные цепи из 10 или менее атомов углерода. В этих случаях, когда минимальное число атомов углерода выше, чем один, например, алкенил (минимум из двух атомов углерода) и циклоалкил (минимум из трех атомов углерода), следует понимать, что “низший” означает по меньшей мере минимальное число атомов углерода.
Как здесь использовано, термин “замещенный алкил” относится к алкильной группе, предпочтительно из от 1 до 10 атомов углерода (“замещенный низший алкил”), имеющей от 1 до 5 заместителей и предпочтительно от 1 до 3 заместителей, выбранных из группы, состоящей из алкокси, замещенного алкокси, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, ацила, ациламино, ацилокси, амино, замещенного амино, аминоацила, аминоацилокси, оксиациламино, циано, галогена, гидроксила, кето, тиокето, карбоксила, карбоксилалкила, тиола, тиоалкокси, замещенного тиоалкокси, арила, арилокси, гетероарила, гетероарилокси, гетероцикла, гидроксиамино, алкоксиамино, нитро, -SO-алкила, -SO-замещенного алкила, -SO-арила, -SO-гетероарила, -SО2-алкила, -SO2-замещенного алкила, -SО2-арила, -SO2-гетероарила и моно и ди-алкиламино, моно- и ди-(замещенный алкил)амино, моно- и ди-ариламино, моно- и ди-гетероариламино, моно- и ди-гетероциклического амино и несимметричных дизамещенных аминов, имеющих различные заместители, выбранные из алкила, арила, гетероарила и гетероцикла. Как здесь использовано, другие фрагменты имеющие префикс “замещенный”, предназначены для включения одного или более заместителей, перечисленных выше.
Как здесь использовано, “алкарил” относится к алкилу с арильным заместителем. Связывание имеет место через алкильную группу. “Аралкил” относится к арильной группе с акильным заместителем, где связывание происходит через арильную группу.
Как здесь использовано, термин “алкокси” относится к группе “алкил-O-”, где алкил является таким, как определено выше. Предпочтительные алкокси группы включают в качестве примера метокси, этокси, н-пропокси, изо-пропокси, н-бутокси, трет-бутокси, втор-бутокси, н-пентокси, н-гексокси, 1,2-диметилбутокси и тому подобное.
Как здесь использовано, термин “алкенил” относится к алкенильным группам, предпочтительно имеющим от 2 до 10 атомов углерода и более предпочтительно от 2 до 6 атомов углерода и имеющим по меньшей мере 1 и предпочтительно 1-2 двойные ненасыщенные связи. Предпочтительные алкенильные группы включают этенил (-CH=CH2), н-пропенил (-CH2CH=CH2), изо-пропенил (-С(СН3)=CH2) и тому подобное.
Как здесь использовано, термин “алкинил” относится к алкинильным группам, предпочтительно имеющим от 2 до 10 атомов углерода и более предпочтительно от 2 до 6 атомов углерода и имеющим по меньшей мере одну и предпочтительно 1-2 тройных ненасыщенных связи.
Как здесь использовано, термин “ацил” относится к группам: алкил-С(О)-, замещенный алкил-С(О)-, циклоалкил-С(О)-, замещенный циклоалкил-С(О)-, арил-С(О)-, гетероарил-С(О)- и гетероцикл-С(О)-, где алкил, замещенный алкил, циклоалкил, замещенный циклоалкил, арил, гетероарил и гетероцикл являются такими, как здесь определено.
Как здесь использовано, термин “ациламино” относится к группе -C(O)NRR, где каждый R независимо является водородом, алкилом, замещенным алкилом, арилом, гетероарилом или гетероциклом, где алкил, замещенный алкил, арил, гетероарил и гетероцикл являются такими, как здесь определено.
Как здесь использовано, термин “арил” относится к ненасыщенной ароматической карбоциклической группе из 6-14 атомов углерода, имеющей одно кольцо (например, фенил) или несколько конденсированных (слитых) колец (например, нафтил или антрил). Предпочтительные арилы включают фенил, нафтил и тому подобное. Если нет иного ограничения определения арильного заместителя, такие арильные группы могут быть необязательно замещены 1-5 заместителями и предпочтительно 1-3 заместителями, выбранными из группы, состоящей из гидрокси, ацила, алкила, алкокси, алкенила, алкинила, замещенного алкила, замещенного алкокси, замещенного алкенила, замещенного алкинила, амино, замещенного амино, аминоацила, ацилокси, ациламино, алкарила, арила, арилокси, азидо, карбоксила, карбоксилалкила, циано, галогена, нитро, гетероарила, гетероарилокси, гетероцикла, гетероциклоокси, аминоацилокси, оксиациламино, тиоалкокси, замещенного тиоалкокси, тиоарилокси, тиогетероарилокси, -SO-алкила, -SO-замещенного алкила, -SO-арила, -SO-гетероарила, -SО2-алкила, -SО2-замещенного алкила, -SО2-арила, -SО2-гетероарила, тригалогенметила. Предпочтительные заместители включают алкил, алкокси, галоген, циано, нитро, тригалогенметил и тиоалкокси.
Как здесь использовано, термин “циклоалкил” относится к циклическим алкильным группам из 3-12 атомов углерода, имеющим одно циклическое кольцо или несколько конденсированных колец. Такие циклоалкильные группы включают в качестве примера единичные кольцевые структуры, такие как циклопропил, циклобутил, циклопентил, циклооктил и тому подобное, или множественные кольцевые структуры, такие как адамантил и тому подобное.
Как здесь использовано, термины “гало” или “галоген” относятся к фтору, хлору, брому и йоду и предпочтительно являются либо фтором, либо хлором.
Как здесь использовано, термин “гетероарил” относится к ароматической карбоциклической группе из 1-15 атомов углерода и 1-4 гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы, по меньшей мере, в одном кольце (если имеется больше, чем одно кольцо).
Если нет иного ограничения определения гетероарильного заместителя, такие гетероарильные группы могут быть необязательно замещены 1-5 заместителями и предпочтительно 1-3 заместителями, выбранными из группы, состоящей из гидрокси, ацила, алкила, алкокси, алкенила, алкинила, замещенного алкила, замещенного алкокси, замещенного алкенила, замещенного алкинила, амино, замещенного амино, аминоацила, ацилокси, ациламино, алкарила, арила, арилокси, азидо, карбоксила, карбоксилалкила, циано, галогена, нитро, гетероарила, гетероарилокси, гетероцикла, гетероциклоокси, аминоацилокси, оксиациламино, тиоалкокси, замещенного тиоалкокси, тиоарилокси, тиогетероарилокси, -SO-алкила, -SO-замещенного алкила, -SO-арила, -SO-гетероарила, -SО2-алкила, -SO2-замещенного алкила, -SО2-арила, -SО2-гетероарила и тригалогенметила. Предпочтительные заместители включают алкил, алкокси, галоген, циано, нитро, тригалогенметил и тиоалкокси. Такие гетероарильные группы могут иметь одно кольцо (например, пиридил или фурил) или несколько конденсированных колец (например, индолизинил или бензотиенил).
“Гетероцикл” или “гетероциклический” относится к одновалентной насыщенной или ненасыщенной группе, имеющей одно кольцо или несколько конденсированных колец из от 1 до 15 атомов углерода и от 1 до 4 гетероатомов, выбранных из группы, состоящей из азота, серы и кислорода в кольце.
Если нет иного ограничения определения гетероциклического заместителя, такие гетероциклические группы могут быть необязательно замещены 1-5 заместителями, выбранными из группы, состоящей из алкила, замещенного алкила, алкокси, замещенного алкокси, арила, арилокси, галогена, нитро, гетероарила, тиола, тиоалкокси, замещенного тиоалкокси, тиоарилокси, тригалогенметила и тому подобное. Такие гетероциклические группы могут иметь одно кольцо или несколько конденсированных колец.
В отношении любой из вышеуказанных групп, которая содержит 1 или более заместителей, конечно понятно, что такие группы не содержат замещение или образец замещения, которые стерически неосуществимы и/или синтетически невыполнимы.
Как здесь использовано, “производные карбоновой кислоты” и “производные сульфоновой кислоты” относятся к -C(X)R1, -С(Х)-N(R1)2, -C(X)OR1, -C(X)SR1, -SOnR1, -SOnOR1, -SOnSR1 или -SOn-N(R1)2, где Х является О, S или NR1, где R1 является водородом, алкилом, замещенным алкилом или арилом, и их активированные производные, такие как ангидриды, сложные эфиры и галогениды, такие как хлориды, бромиды и йодиды, которые можно использовать для сочетания производных карбоновой кислоты и сульфоновой кислоты с 5’-амином, используя обычную химию сочетания.
“Фармацевтически приемлемые соли” относятся к фармацевтически приемлемым солям соединения формул IA, IB или IC, которые являются производными различных органических и неорганических противоионов, хорошо известных в данной области, и включают, только в качестве примера, натрий, калий, кальций, магний, аммоний, тетраалкиламмоний и тому подобное; и когда молекула содержит основную функциональность, в качестве фармацевтически приемлемой соли можно использовать соли органических и неорганических кислот, такие как гидрохлорид, гидробромид, тартрат, мезилат, ацетат, малеат, оксалат и тому подобное.
Термин “защитная группа” или “блокирующая группа” относится к любой группе, которая когда присоединена к одной или более гидроксильным, амино или карбоксильным группам данных соединений (включая их промежуточные продукты, такие как аминолактамы, аминолактоны и т.д.) предотвращает реакции, имеющие место с этими группами, и которую можно удалить обычной химической или ферментативной стадиями для восстановления гидроксильной, амино или карбоксильной группы. Предпочтительные удаляемые блокирующие группы для аминогруппы включают обычные заместители, такие как трет-бутоксикарбонил (t-BOC), бензилоксикарбонил (CBZ) и тому подобное, которые можно удалить в обычных условиях, совместимых с природой продукта.
Здесь используются следующие сокращения: [125I]АВ-МЕСА - [125I]N6-(4-амино-3-йодбензил)аденозин-5’-N-метил-уронамид; (R)-PIA - (R)-N6-(фенилизопропил)аденозин; ДМСО - диметилсульфоксид; I-AB-MECA - N6-(4-амино-3-йодбензил)аденозин-5’-N-метилуронамид; IB-MECA - N6-(3-йодбензил) аденозин-5’-N-метилуронамид; Ki - равновесная константа ингибирования; NECA - 5’-N-этилкарбоксамидоаденозин; ТГФ - тетрагидрофуран; Трис - трис-(гидроксиметил)аминометан.
Получение соединений
Специалисты в области органической химии оценят, что реакционноспособные и лабильные функциональные группы часто должны быть защищены перед определенной реакцией или последовательностью реакций и затем восстановлены до их первоначальной формы после завершения последней реакции. Обычно группы защищаются при их превращении в относительно стабильное производное. Например, гидроксильную группу можно превратить в эфирную группу и аминогруппу можно превратить в амид или карбамат. Способы защиты и снятия защиты также известны как “блокирование” и “деблокирование”, хорошо известны и широко практикуются в данной области, например, смотри Т.Green, “Protective Groups in Organic Synthesis”, John Wiley, New York (1981) или “Protective Groups in Organic Chemistry”, Ed. J.F.W. McOmie, Plenum Press, Лондон (1973).
Соединения предпочтительно получают взаимодействием соединения формулы II, ниже, с подходящим производным карбоновой кислоты или сульфоновой кислоты, используя известную химию.
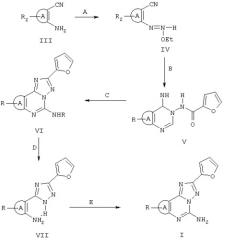
Соединения формулы II можно получить, используя следующие схемы I и II, проиллюстрированные для R3, являющегося фураном.
Схема I
Реагенты: А) триэтилортоформиат; В) гидразид 2-фуранкарбоновой кислоты, 2-метоксиэтанол; С) PhOPh, 260°C; D) 10% НСl, при кипячении с обратным холодильником; Е) цианамид, pTsOH, N-метилпирролидон.
Реагенты: F) гидразид 2-фуранкарбоновой кислоты, дифениловый эфир; Е) цианамид, рТsОН, N-метилпирролидон.
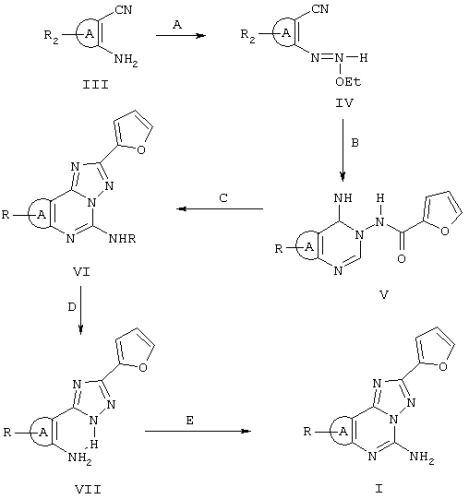
Соединения формулы II можно получить либо опосредованным путем, представленным на схеме I, либо прямым путем, представленным на схеме II. Пригодными исходными соединениями для обеих схем являются гетероциклические орто-аминонитрилы формулы III, обычно полученные синтетическими способами, известными в литературе, о которых сообщается в книге E.C.Taylor and A.McKillop (vol. 7 of the series “Advances in Organic Chemistry”, Ed. Interscience, 1970).
Орто-аминонитрилы III превращаются в соответствующие имидаты формулы IV при взаимодействии с избытком этилортоформиата при кипячении с обратным холодильником в течение от 8 до 10 ч. Реакция после выпаривания этилортоформиата приводит к по существу чистым соответствующим имидатам IV с высоким выходом по данным анализа ИК и 1Н ЯМР сырых продуктов реакции.
Затем имидаты формулы IV подвергаются последовательности двух реакций с получением трициклических структур формулы VI с высоким выходом.
Последовательность реакций включает: а) реакцию с гидразидом 2-фуранкарбоновой кислоты в растворе 2-метоксиэтанола при температуре кипения с обратным холодильником в течение 8-10 ч с получением промежуточных соединений формулы V; b) термическую циклизацию последних в соответствующие соединения формулы VI при нагревании в дифениловом эфире при температуре 260°С в течение 0,5-1 ч.
Трициклические соединения VI затем гидролизуют HCl при кипячении с обратным холодильником в течение 1-3 ч с получением триазолов VII, которые окончательно циклизуются в требуемые соединения II с цианамидом в N-метилпирролидоне при кипячении с обратным холодильником и в присутствии пара-толуолсульфоновой кислоты (схема I).
В некоторых случаях триазолы VII можно получить непосредственно нагреванием в дифениловом эфире орто-аминонитрила III с гидразидом 2-фуранкарбоновой кислоты. Триазолы VII затем циклизуются, как представлено выше на схеме II. На следующих схемах III, IV и V более детально представлен синтез соединений формулы II, в которых А является триазоловым кольцом.
Схема III
Синтез производных 5-амино-7-замещенный-2(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидина
Схема IV
Синтез производных 5-амино-8-замещенный-2(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидина
Реагенты: А) гидразид 2-фуранкарбоновой кислоты, PhOPh, 260°C; В) NH2CN, pTsOH, N-метилпирролидон.
Схема V
Синтез производных 5-амино-9-замещенный-2-(2-фурил)-1,2,3-триазоло[5,4-е]-1,2,4-триазоло[1,5-с]пиримидина
Реагенты: А) гидразид 2-фуранкарбоновой кислоты, PhOPh, 260°С; В) NH2CN, pTsOH, N-метилпирролидон.
Наконец, 5-амин-содержащие соединения II подвергают взаимодействию с карбоновыми кислотами, сульфоновыми кислотами, активированными карбоновыми кислотами, активированными сульфоновыми кислотами, тиокарбоновыми кислотами, активированными тиокарбоновыми кислотами и тому подобными с образованием требуемых соединений. Активированные карбоновые кислоты включают галогенангидриды, сложные эфиры, ангидриды и другие производные, известные как реагирующие с аминами с образованием амидов. Активированные сульфоновые кислоты включают сульфонилгалогениды, такие как сульфонилхлориды.
Нет необходимости во всех случаях использовать активированные производные карбоновой кислоты и сульфоновой кислоты. Кислоты сами по себе можно сочетать с аминами, используя стандартную реакцию сочетания, например, используя дициклогексилдиимид (DCI) и другие обычно используемые агенты для сочетания. Пригодные условия сочетания для образования амидных связей хорошо известны специалистам в области синтеза пептидов.
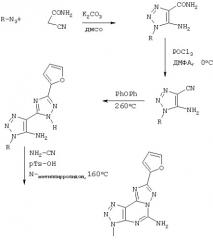
Обычно вышеуказанную реакцию можно использовать для получения 8-(Ар)алкил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло [1,5-с]пиримидинов, когда в качестве исходных веществ используют 3-циано-2-аминопиразолы. 3-Циано-2-аминопиразолы могут взаимодействовать с алкилгалогениды (RX) в полярном апротонном растворителе, таком как диметилформамид (ДМФА) для получения R-группы на одном из азотов кольца. Полученное соединение можно кипятить с обратным холодильником с триэтилортоформиатом для обеспечения иминэтилового эфира, который может взаимодействовать с фуранкарбоновым гидразидом, предпочтительно используя ловушку Дина-Старка для азеотропного удаления воды, образовавшейся в реакции, для получения 8-(Ар)алкил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидинов. Продукты можно очистить хроматографией, например, в смеси EtOAc/гексан (1:1) для использования в последующей реакции.
Продукт этой реакции может взаимодействовать с приемлемой кислотой, такой как HCl, при кипячении с обратным холодильником, с последующей реакцией с цианамидом в растворителе, таком как N-метилпирролидон, с катализатором пара-толуолсульфоновой кислотой при повышенной температуре для обеспечения 5-амино-8-(Ар)алкил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидинов.
Аминзамещенные соединения могут реагировать с соответствующими изоцианатами с образованием соединений мочевины, с активированными карбоновыми кислотами, такими как галогенангидриды, для получения амидов, с активированными сульфоновыми кислотами, такими как галогенангидриды сульфоновой кислоты с образованием сульфонамидов или с другими реакционноспособными производными карбоновой кислоты или сульфоновой кислоты с образованием других требуемых соединений.
Соединения триазоло-триазоло-пиримидина можно получить, используя аналогичную химию, но начиная с подходящего функционально-способного азида, и при взаимодействии азида с H2NC(O) CH2CN с образованием первоначального гетероциклического кольца с последующим взаимодействием амидной группы с дегидратирующим реагентом, таким как РОСl3, с образованием нитрила. Полученный цианоаминотриазол может реагировать таким же образом, как 3-циано-2-аминопиразолы, которые обсуждались выше, с получением триазоло-триазоло-пиримидинов.
Синтез меченных радиоактивным изотопом аналогов
Соединения можно пометить любым пригодным радиоактивным изотопом. Примеры пригодных радиоактивных меток включают 3H и 14С, но можно использовать любую в основном нетоксичную радиоактивную метку, обычно используемую в фармакокинетических исследованиях. Способы включения радиоактивных меток в органические соединения хорошо известны специалистам в данной области.
Когда соединения являются 5-[[замещенный фенил)амино]карбонил]амино-8-(ар)алкил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидинами или 5-амино-8-(ар)алкил-2-(2-фурил) пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидинами, то довольно легко включить тритиевую метку.
В одном воплощении пригодным исходным веществом является соединение, в котором (ар)алкильная группа в 8-положении включает двойную связь. Может иметь место реакция с тритием по двойной связи в присутствии пригодного катализатора, например палладия на угле или других известных катализаторов для гидрирования.
Например, 5-[[(4-метоксифенил)амино]карбонил]амино-8-(1,2-дитритиопропил)-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидин (соединение 102) можно получить добавлением трития по двойной связи 5-[[(4-метоксифенил)амино]карбонил]амино-8-1-пропенил-2-(2-фурил)пиразоло[4,3-е]-1,2,4-триазоло[1,5-с]пиримидина (соединение 101). Соединение 102 обсуждается ниже в отношении различных исследований по аффинности связывания на опухолевых клетках JURKAT.
Альтернативно тритиевая метка может присутствовать в соединениях, используемых для взаимодействия с 5-аминогруппой с образованием амидов, мочевин и других групп в 5-положении. Например, изоцианаты, используемые для получения 5-аминокарбониламино соединений, описанных здесь, могут включать тритий или другие радиоактивные изотопы и, следовательно, могут легко быть включены в конечный продукт.
В другом воплощении радиоактивный изотоп можно включить в молекулу во время образования кольцевой системы. Как обсуждалось выше в отношении синтеза соединений формулы II, различные трициклические соединения формулы VI гидролизуются HCl с получением триазолов формулы VII, которые циклизуются с цианамидом при кипячении с обратным холодильником в присутствии пара-толуолсульфоновой кислоты, как показано на схеме I. Относительно легко включить 14С-метку на этой стадии синтеза, используя 14С-меченый цианамид.
Йодированные соединения можно получить, например, при включении радиоактивного йода в ароматическое соединение, используемое для реакции с 5-аминогруппой. Включение йода в ароматические кольца хорошо известно специалистам в данной области. Легко включить атом йода в ароматические соединения, используемые для взаимодействия с 5-аминогруппой, с получением соединений, описанных здесь.
Следовательно, обычный специалист в данной области может легко получить пригодные меченные радиоактивным изотопом аналоги.
Синтез меченных флуоресцентной меткой аналогов
Как и в случае меченных радиоактивным изотопом соединений, синтез соединений с флуоресцентной меткой является относительно простым. Предпочтительно флуоресцентные группы находятся в R2-положении, хотя замещение в R3-положении также осуществимо. В одном воплощении флуоресцентная группа(ы) включают фурановое кольцо, которое может присоединяться в R3-положении. Альтернативно, можно использовать другие ароматические кольца. Флуоресцентные метки хорошо известны специалистам в данной области и могут легко присоединяться к соединениям, описанным здесь, с использованием известной химии.
Способы применения соединений
Соединения можно применять при всех показаниях для агонистов и антагонистов А3-рецептора, включая:
- лечение гипертензии;
- лечение воспалительных заболеваний, таких как ревматоидный артрит и псориаз;
- лечение аллергических заболеваний, таких как сенная лихорадка и аллергический ринит;
- дегрануляцию тучных клеток;
- противоопухолевые препараты;
- лечение кардиальной гипоксии и
- защиту от церебральной ишемии;
как описано, например, у Jacobson, TIPS May 1998, pp.185-191, содержание которой включено в качестве ссылки.
Предпочтительным применением данных соединений является таковое для обнаружения и/или лечения рака. Как обсуждается ниже, было показано, что опухолевые клетки экспрессируют А3-рецептор. Полагают, что А3-рецептор защищает клетки от ишемического повреждения, когда они не получают адекватной поставки крови. Действие нескольких имеющихся в продаже лекарственных препаратов, а также препаратов, находящихся в настоящее время на стадии разработки, направлено на ингибирование экспрессирования VEGF, что приводит к отключению поставки крови к опухолевым клеткам. Однако агонизм А3-рецепторов аденозина может привести к защитному эффекту, предупреждая гибель опухолевых клеток, когда клетки не получают адекватной поставки крови. При введении антагонистов указанных рецепторов вместе с соединениями с активностью против VEGF или другими антиангиогенными соединениями опухолевые клетки можно отключить от новой поставки крови, а также освободить от защиты от ишемического повреждения, которое обеспечивает агонизм А3-рецепторов.
Соединение можно вводить пациенту посредством любых приемлемых в медицине способов. Пригодные способ